光动力治疗(Photodynamic Therapy,简称PDT)是一种非侵袭性、有一定靶向性治疗肿瘤和非肿瘤疾病的有效方法[1],与传统的手术、化疗、放疗相比,具有基本上不损伤正常组织与器官,治疗过程无严重痛苦、副作用小等特点.酞菁金属配合物作为新一代用于光动力治疗光敏剂的研究是近20年来人们一直关注的热点之一.通常认为,在生物体系内光敏剂在与其匹配的光激发下引起生物分子的光敏氧化过程主要是通过Ⅱ型机制,即光敏剂受光照激发后,首先由基态跃迁到激发单重态,然后通过系间窜越,转变为激发三重态,并与生物体内基态(三重态)氧(3O2)作用生成单重态氧(1O2)或超氧阴离子(O2·-),进而氧化生物分子[2].而在生物体中存在的蛋白质生物大分子,被氧化时实际上只是少数几种氨基酸(如半胱氨酸、组氨酸、色氨酸及酪氨酸等)的残基被氧化[3,4].因此,人们通常在研究中选用组成生物大分子的片断作模型化合物,作为研究酞菁类金属配合物光敏化氧化能力的靶分子,进而了解其光生物效应.本文研究了3种不同喹啉氧基取代位置与数目的酞菁金属配合物的光敏化氧化色氨酸能力,并探讨了其构效关系. 1 实验部分 1.1 仪器与试剂
DF-101B集热式恒温磁力搅拌器,浙江省乐清县电器厂;医用激光器(670 nm),北京寿安山有限公司;Varian cary eclipse 荧光仪,美国varian仪器公司;氯化钠,分析纯,广东西陇化工厂;N,N-二甲基甲酰胺(DMF),1,2-丙二醇,磷酸氢二钠,磷酸二氢钠,均为分析纯,均购自中国医药集团上海化学试剂公司;CEL(蓖麻油衍生物,USP级),色氨酸(99%),均购自上海晶纯实业有限公司;3种喹啉氧基(4-QO、6-QO、8-QO)酞菁金属(Zn、Al、Cd、Cu、Co、Ni)配合物均由本课题组合成,并经表征鉴定①②,酞菁金属配合物母环及取代基团结构如图1所示.
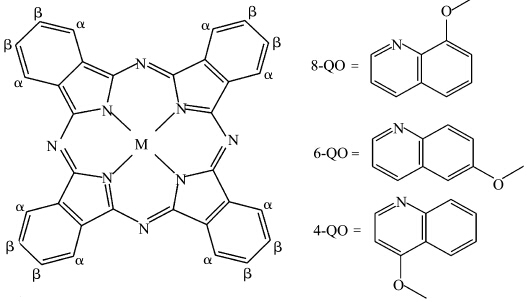 | M=Zn(Ⅱ),Cd(Ⅱ),AlCl(Ⅱ),Cu(Ⅱ),Ni(Ⅱ),Co(Ⅱ) 图1 酞菁金属配合物母环及取代基团结构示意图 The structure of metallophthalocyanines and substitutional groups |
首先,在避光条件下,分别配制欲测酞菁金属配合物及色氨酸的PBS溶液(酞菁金属配合物浓度约为5 μmol·mL-1,色氨酸浓度约为1 μmol·mL-1,pH值为7.4),然后往溶液中通氧至饱和,并在磁力搅拌下以波长为670 nm,功率密度为210 mW/cm2的激光照射6 min—10 min,最后取样用荧光法测色氨酸荧光强度及其变化,计算其被光敏化氧化的速率常数(色氨酸的激发波长为295 nm,测定范围300 nm—500 nm),每个样品均取样5次以上.由于酞菁类光敏剂在均相体系中光敏氧化氨基酸的机制早已有报道,主要是采用Ⅱ型机制[5],这种机制的光敏化氧化过程可以近似的看成是一级反应过程[6,7],符合一级反应速率方程 -dc/dt=kc,同时由于色氨酸的荧光强度F在本试验条件下正比于其浓度c,因此,可用下面的公式计算色氨酸氧化速率常数:ln(F0/F)=k×t(式中:F0为反应初始色氨酸的荧光强度,F为反应时间t时色氨酸的荧光强度,k为光敏化氧化速率常数).由此以ln(F0/F)为纵坐标,以t为横坐标作图,其斜率就是速率常数k的值. 2 结果与讨论 2.1 不同喹啉氧基结构在酞菁环周边取代位置及数目的影响
表1给出了8种喹啉氧基酞菁锌光敏化氧化色氨酸的速率常数.
| 表1 喹啉氧基取代酞菁锌光敏化氧化色氨酸速率常数 Rate constants of photosensitive oxidation on tryptophan for ZnPc substituted with quinolyloxy |
从表1数据可见:
(1)对于相同喹啉氧基(如4-QO和6-QO)的α位与β位四取代的酞菁锌,光敏化氧化色氨酸的速率常数比值分别约为7和24,表明α位取代比β位取代酞菁锌光敏化氧化能力更强,可能是由于在α位引入取代基比β位具有更大的空间位阻,减弱了酞菁大环之间的相互作用,这样既可以降低酞菁金属配合物分子间的聚集,又有利于色氨酸插入其中,由此增强酞菁金属配合物和色氨酸的作用,使光敏化氧化的效率明显提高.
(2)同为β位4-QO和6-QO取代的酞菁锌,β-(4-QO)8ZnPc的速率常数约是β-(4-QO)4ZnPc的13倍,β-(6-QO)8ZnPc的速率常数约是β-(6-QO)4ZnPc的10倍.这表明增加取代基数目,会导致光敏化氧化色氨酸的速率常数大大增加.这可能是由于随着取代基数目增加空间位阻效应增大,削弱了酞菁环之间的π-π相互作用,从而降低酞菁配合物分子间的聚集,使其主要以单体形式存在,因而提高了激发三重态量子产率,导致光敏化氧化能力增强.
(3)喹啉氧基均为α位取代并且取代数目均为4时,8-QO、6-QO、4-QO取代的酞菁锌光敏化氧化色氨酸的速率常数分别约为12.0、7.39和3.84,显示喹啉氧基中氮杂原子与氧原子的相对位置的不同即结构上的差异可导致其光敏化氧化色氨基酸能力的不同,具体的作用机理值得进一步研究. 2.2 中心金属的影响
表2列出的是不同中心金属的6-喹啉氧基四取代酞菁配合物光敏化氧化色氨酸的速率常数.
| 表2 不同中心金属喹啉氧基取代酞菁金属配合物光敏化氧化色氨酸的速率常数k Rate constants of photosensitive oxidation on tryptophan for MPc substituted with 6-quinolyloxy (M=Zn2+,Cd2+,Al3+,Cu2+,Ni2+,Co2+) |
由表2可知,同是α位6-QO四取代酞菁金属配合物,但不同中心金属的酞菁配合物其光敏化氧化色氨酸的速率常数是有差异的.其光敏化氧化色氨酸能力的顺序为:α-(6-QO)4ZnPc≈α-(6-QO)4AlClPc>α-(6-QO)4CdPc>>α-(6-QO)4CoPc≈α-(6-QO)4NiPc>α-(6-QO)4CuPc,由此可见,具有闭壳层电子结构的中心金属(如Zn2+、Al3+、Cd2+)酞菁配合物的光敏化氧化色氨酸的能力远大于具有开壳层电子结构的中心金属(如Co2+、Ni2+、Cu2+)酞菁配合物,这一结果与已有报道的其他类型取代酞菁金属配合物的结果是一致的[8,9,10,11].这可认为是由于具有闭壳层电子结构的中心金属酞菁配合物既具有较高的激发三重态量子产率又有较长的激发三重态寿命,因而光敏化氧化产生1O2量子产率较高,而具有开壳电子结构中心金属的酞菁配合物,通常因激发三重态寿命较短,单重态氧量子产率较低,导致光敏化氧化色氨酸能力下降. 3 结论
通过对一系列喹啉氧基酞菁金属配合物光敏化氧化色氨酸能力的研究,表明酞菁环内中心金属离子的电子构型、酞菁环周边取代基的结构以及取代基的位置与数目都对其光敏化氧化色氨酸的能力产生影响,中心金属离子为闭壳层电子结构,取代基位于α位以及提高取代基数目均有利于提高其光敏化氧化活性.同时显示,取代基的组成结构对靶分子有一定选择性,结果可为研发该类光敏剂提供依据.
| [1] | Serra A, Pineiro M, Pereira N, et al. A look at clinical applications and developments of photodynamic therapy[J]. Oncol.Rev., 2008, 2(4):235-249. |
| [2] | Rosenthal I, Kriahna C M, et al. The role of molecular oxygen in the photodynamic effect of phthalocyanines[J]. Radiat. Res., 1986, 107(1):136-142. |
| [3] | Tang N L, Peng J Y. Determination of proteins with tetracarboxy manganese(II) phthalocyanine by resonance light scattering technique[J]. Spectrochim Acta A, 2008, 71(4):1246-1249. |
| [4] | Zhong H, Wang K, Chen H Y. Protein analysis with tetra-substituted sulfonated cobalt phthalocyanine by the technique of rayleigh light scattering[J].Anal. Biochem., 2004, 330(1):37-42. |
| [5] | a. Langlots R, Ali H, van Lier J E, et al. Biological activities of phthalocyanines-IV. type II sensitized photooxidation of L-tryptophan and cholesterol by sulfonated metallo phthalocyanines[J]. Photochem. Photobiol.,1986, 44(2): 117-123. b. Wagner J R, Ali H, Langlois R, et al. Biological activities of phthalocyanines VI:photooxidation of L-tryptophan by selectively sulfonated gallium phthalocyanines:singlet oxygen yields and effect of aggregation[J]. Photochem. Photobiol., 1987,45(5): 587-594. |
| [6] | 董润安,邱 勇,宋心琦.磺化铝酞菁对甘氨酰-L-色氨酸的光敏化氧化[J].科学通报,1997,42(22):2402-2405. Dong R A, Qiu Y, Song X Q. Photosensitive oxidation of sulphonated aluminum phthalocyanine on glycyl -L- tryptophan [J].Chinese Science Bulletin, 1997, 42(22):2402-2405. |
| [7] | 魏 彦,陈 伟,王 玉,等. 两亲性酞菁锌对人体肝癌细胞的光灭活作用[J].影像科学与光化学,2010, 28(5): 362-367. Wei Y, Chen W, Wang Y, et al. Photoinhibition on liver cancer cell of amphiphilic phthalocyanine zinc[J]. Imaging Science and Photochemistry, 2010, 28(5): 362-367. |
| [8] | 吴世康,汪鹏飞. 有机-过渡金属配合物的三重态发光问题[J].影像科学与光化学,2011, 29(2): 81-98. Wu S K, Wang P F. The organic-transition metal complex and the emission of triplet states[J]. Imaging Science and Photochemistry, 2011, 29(2): 81-98. |
| [9] | 沈淑引,刘 恺,张先付,周庆复,许慧君.烷氧基取代金属酞菁的合成和在有机溶液中聚集性质的研究[J].感光科学与光化学,1993,11(4):366-370. Shen S Y, Liu K, Zhang X F, Zhou Q F, Xu H J. Aggregation of copper-phthalocyanines with different alkoxy chains in organic solution[J].Photographic Science and Photochemistry,1993,11(4):366-370. |
| [10] | 黄金陵,黄剑东,刘尔生,等.酞菁配合物的结构与其光动力抗癌活性[J]. 物理化学学报,2001,17(7):662-671. Huang J L, Huang J D, Liu E S, et al.Some relationships between structures and photodynamic anti-cancer activities of phthalocyanines[J]. Acta Phys.Chim.Sin., 2001, 17(7):662-671. |
| [11] | Ogunsipe A, Nyokong T. Effects of central metal on the photophysical and photochemical properties of non-transition metal sulfophthalocyanine[J].J. Porphyrins Phthalocyanines, 2005, 9(2):121-129. |




