2. 合肥乐凯科技产业有限公司, 安徽 合肥 230041
2. Hefei Lucky Science & Technology Industry Company Ltd., Hefei 230041, Anhui, P.R.China.
1 萘并吡喃的光致变色原理、结构特征及合成方法
光致变色(photochromism)是指化合物在受到一定波长的光照射下发生化学反应,由A构型转变为另一个不同颜色的B构型产物,而在另一波长的光照射下或热的作用下,又能恢复到原来的构型.比较具有实际应用意义的光致变色过程是:A构型只在近紫外光谱区(360—400 nm)有吸收,而在可见光谱区(400—750 nm)没有吸收,则称之为隐色体或无色体;而B构型在可见光谱区有明显吸收,则称之为显色体或呈色体(图1).光 致变色材料由于其在光能量转换、光学镜片、汽车挡风玻璃、光学防伪、装饰材料等方面的应用越来越普及,以及在光信息存储、光记录和光开关等领域显示出巨大的潜在应用前景而受到关注[1,2,3,4,5,6,7].本课题组20年来一直致力于光致变色理论和应用性能研究,先后对螺吡喃[8]、俘精酸酐[9]、螺噁嗪[10]、偶氮[11]、萘并吡喃[12,13,14]等不同种类的光致变色化合物进行了合成和性能表征,并在光信息记录材料、分子探针和树脂镜片等领域也取得了产业化成果.其中,相比较于其它类型的光致变色化合物,萘并吡喃类化合物具有较好的光响应性和较快的褪色速度以及较好的光稳定性而成为一类具有实际应用价值的变色材料[15,16].
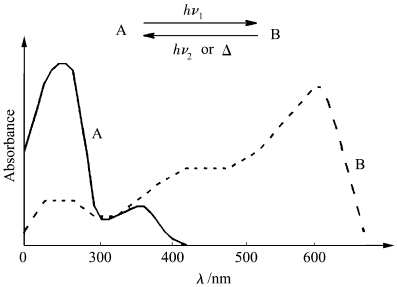 | 图1 光致变色原理及吸收光谱变化 The photochromism and the change of absorption spectrum |
萘并吡喃类化合物的可逆光致变色通过光照下吡喃环的可逆异裂而实现(图2),其 吸收光谱变化的变化规律如图1,并随着取代基、溶剂极性以及应用载体的变化而变化. Crano等通过低温核磁法证实了萘并吡喃类化合物的开环体为醌式结构[17],其中包括顺醌和反醌结构.潘桂兰等用稳态方法和纳秒时间分辨吸收光谱技术研究了萘并吡喃类化合物的光致变色过程和反应机理,研究了分子结构对光致变色行为的影响、氧对其的瞬态吸收光谱和衰减动力学的影响,发现开环过程以激发单重态为主,呈色体的寿命主要与杂环取代基与萘并吡喃相连结的位置以及所形成的呈色体的共轭程度直接相关[18].对于萘并吡喃类化合物的抗疲劳性能研究,有很多的因素可引起其不可逆的疲劳反应,需要从本质上去认识抗疲劳性能,特别是开环体激发态的电子结构、能态以及化学行为,这样才能通过有目的的设计合成新结构并从根本上解决抗疲劳性等问题.
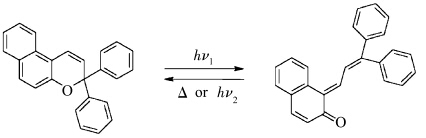 | 图2 萘并吡喃光照下的结构变化 Structural change of naphthopyran compound under UV irradiation |
我们近期对萘并吡喃化合物空间构型进行了研究,其晶体结构工作表明:萘环保持了较好的平面性,而吡喃环非芳香性,其中的螺碳原子键角为109.7°,为典型的sp3杂化,偏离萘环平面,且其与吡喃上氧相连的C—O键为较弱的共价键(图3),也证实了该键就是发生光致结构互变的断裂点[14].为保证开环显色体足够的共轭空间,螺碳原子上一般连接有两个体积较大的苯环,被相互排斥于萘并吡喃环所构成的平面两侧,这样可产生两个作用,一是使得这两个苯环无法与萘并吡喃环产生大π共轭关系,可以防止其吸收光谱进入可见光区域,保持其闭环体形式为无色状态;二是这两个苯环基团可以有效地阻止一般染料分子由于π-π作用所产生的紧密层状堆砌,保持较为疏松的分子堆砌形式,可使染料熔点降低,溶解性能得到改善,有助于该染料在树脂材料中的充分分散,具较透明性[13].
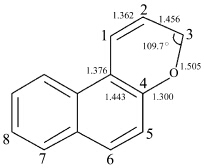 | 图3 萘并吡喃环的光致变色活性位点 The acitive position in naphthopyran |
萘并吡喃类化合物的合成一般是萘酚衍生物与二芳基炔丙醇化合物在催化条件下加热,先缩合得到炔丙基醚,然后发生一个Claisen重排反应,最后通过醌式化合物的氢 迁移和环化生成萘并吡喃类化合物(图4)[19].通过合成工艺中原料的选择实现萘并吡喃母体上取代基的改变,对其光学、热学和溶解性能等有较大的影响.因此,设计和合成不同结构的吡喃化合物,对进一步探索其结构与光致变色性能的关系,调节和改善该类化合物的光致变色性能,加速推广该类光致变色化合物的应用有重要的意义.
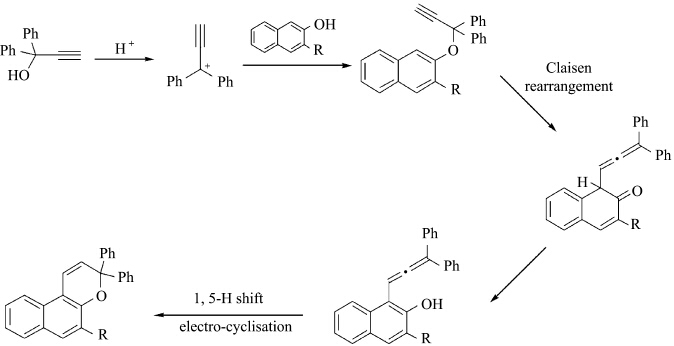 | 图4 萘并吡喃化合物的合成路线 The synthetic route of naphthopyran compounds |
我们采用氯气氧化萘酚,使其形成α,β-不饱和酮,通过亲核加成引入吗啉取代基,再Pd-C催化加氢除氯恢复萘环,得到含吗啉取代基的萘酚,进一步与炔醇反应,即得到6-位吗啉基取代的萘并吡喃化合物[13].虽然显色体的主吸收波长未见明显红移,但色深有近6倍的提高,该性能的提高得益于6-位吗啉基对共轭体系的深色效应(hyperchromism)(图5)[20],量子化学计算模拟的电子云分布也证实了这一结果[13].
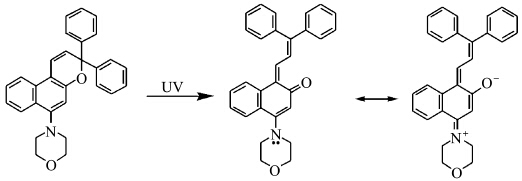 | 图5 吗啉基对共轭体系的深色效应 The hyperchromism induced by morpholine substitution |
我们通过使用含氮取代基的二芳基炔丙醇,尝试了在3位苯环对位上引入含氮推电子基团.含氮推电子基团可以和萘并吡喃的开环体产生很好的共轭(图6),有效地扩展了开环体的共轭体系,吸收光谱红移至600 nm附近,但深色效应并无明显改善[14].
 | 图6 在3位苯环上含氮推电子基团引起的共振效果 The resonance effect by N containing donating groups at 3-phenyl positions |
Jockusch等研究了通过芴结构连接稠合萘并吡喃的茚并稠合结构(图7),开环体吸收光谱红移至650 nm左右[21]. Kumar等提出了类似思路的氧芴并吡喃结构[22],即:采用氧芴结构稠合吡喃来拓展π共轭结构(图6),这样的化合物(图8)在吸收光谱上表现出特征双峰,即位置为400—500 nm的A带和500—700 nm的B带(图9).
 | 图7 茚并稠合萘并吡喃结构 The indeno fused naphthopyrans |
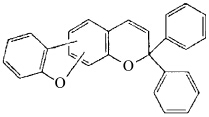 | 图8 氧芴并吡喃化合物 The dibenzofuran fused pyran compounds |
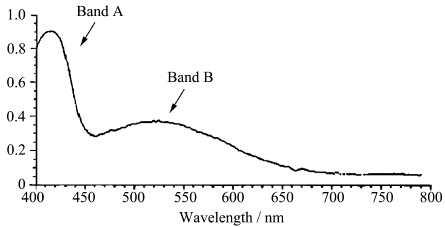 | 图9 氧芴并吡喃在吸收光谱上的特征双峰 The typical absorption peaks in the spectrum of dibenzofuran fused pyran compounds |
Rickwood等也提出了类似思路的咔唑并吡喃结构[23],即:采用咔唑结构稠合吡喃来拓展π共轭结构(图10).
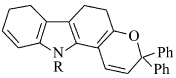 | 图10 咔唑并吡喃化合物 The carbazole fused pyran compounds |
Brun等通过使用含茂取代基的二芳基炔丙醇,在萘并吡喃结构中引入了金属茂结构(图11),发现金属茂的推电子作用可以很好地稳定开环体(图12),使其能级降低因而使吸收光谱红移至600 nm附近,金属原子的高电子密度有助于提高稳定化作用[24].
 | 图11 引入了金属茂的萘并吡喃结构 The naphthopyran compounds introducing metallocenyl groups |
 | 图12 金属茂对萘并吡喃开环体的稳定化作用 The naphthopyran′s open form stabilizated by metallocenyl groups |
3-位苯环的稠合可以通过C—C键相连的方式实现,两个苯环则以芴结构形式出现在3-位螺碳上,即得到螺[芴-萘并吡喃]化合物(图13).这样的化合物比起简单的萘并吡喃在吸收光谱上产生超过100 nm的红移,并且有色深效应[25].需要指出的是,芴核是12π电子结构,并不遵守Hückel芳香性.
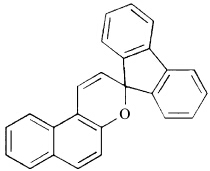 | 图13 螺[芴-萘并吡喃]化合物 Spiro[fluorene-naphthopyran] compounds |
3-位苯环的稠合也可以通过杂原子桥连的方式实现,两个苯环则以呫吨结构形式出现在3-位螺碳上.如采用氧原子桥连,则得到螺[呫吨-萘并吡喃]化合物;如采用硫原子桥连,即得到螺[硫呫吨-萘并吡喃]化合物(图14).在这里,两种结构均为14π电子结构,遵守Hückel芳香性[26].
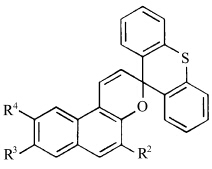 | 图14 螺[thioxanthene -萘并吡喃]化合物 Spiro[thioxanthene-naphthopyran] compounds |
在萘并吡喃化合物共轭体系而引入的取代基中,取代基与母体萘环平面的共面程度将大大影响萘并吡喃化合物π共轭体系的拓展效果.我们近期考察了在吡喃邻位引入甲酰苯胺基(图15),希望借助于酰胺中的N—H与吡喃环上的O形成分子内氢键,构成一个与母体萘环共面性较好的六元环,并在N上孤对电子的传导下,使萘并吡喃化合物获得更大的共轭空间.
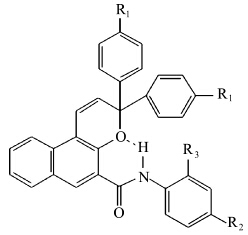 | 图15 引入甲酰苯胺基的萘并吡喃化合物 The naphthopyran compounds having formanilide groups |
在晶体结构研究中,我们还发现该类化合物甲酰苯胺基与相连的母体萘环保持着很好的共面性,这是一个很有趣的现象,因为在一般情况下,由于构象能量的原因,作为取代基的芳环与母体萘环之间往往都有一定的夹角[27];而在这里,一方面,酰胺中的N—H具有一定的酸性,与吡喃环上的O形成了分子内氢键,并构成一个与母体萘环共面性较好的六元环,另一方面,与N相连的苯环在N上孤对电子的传导下,可以与羰基形成一定的共振关系,也使得作为取代基的芳环与母体萘环之间形成较好的共面性(图16).
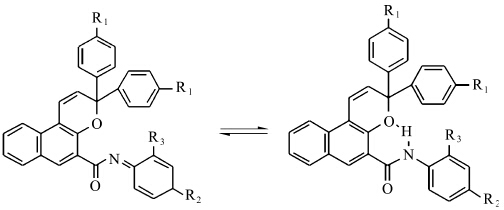 | 图16 N上孤对电子的传导形成的共振结构 The resonance induced by electrons in nitrogen |
本文简要介绍了萘并吡喃类化合物光致结构互变时的关键化学结构点,分别考察了在萘环上引入含氮推电子基团,在3位苯环上引入含氮推电子基团,在吡喃部位稠合引入金属茂结构,通过碳原子或杂桥连的3-位苯环的稠合来改善这类光致变色化合物的性能.此外,还考察了引入取代基的共面控制及对共轭体系的影响.
| [1] | Chaur M N, Collado D, Lehn J-M.Configurational and constitutional information storage: multiple dynamics in systems based on pyridyl and acyl hydrazones [J]. Chem. Eur. J., 2011, 17:248-258. |
| [2] | Wang S, Qi Q Z, Li C P, Ding G H, Kim S H. Photoswitching of bisthienylethene using D-π-A type pyran-based fluorescent dye for rewritable optical storage[J]. Dyes and Pigments, 2011, 89(2): 188-192. |
| [3] | Leydet Y, Gavara R, Cunha-Silva L, Parolal A J, Pinal F. Phase-dependent photochromism of a lactone-stabilized chromene from a flavylium reaction network[J]. Chem. Eur. J., 2011, 17: 3663-3671. |
| [4] | 刘环环,陈懿.新型二芳基乙烯光致变色化合物的制备及其应用基础研究[J]. 影像科学与光化学, 2011, 29(4): 315. Liu H H, Chen Y. The study of novel diaryl ethylene photochromic compounds[J]. Imaging Science and Photochemistry, 2011,29(4): 315. |
| [5] | 胡世荣, 方越, 黄成金, 张玉平, 杜金真, 陈伯勇.2-芳氧基-1,8-邻苯二甲酰基萘的合成及光致变色性[J]. 影像科学与光化学, 2009, 27(2): 135-140. Hu S R, Fang Y, Huang C J, Zhang Y P, Du J Z, Chen B Y.Synthesis and photochromism of the 2-Aryl-1,8-phthaloylnaphthalene[J]. Imaging Science and Photochemistry, 2009, 27(2): 135-140. |
| [6] | 王建营, 冯长根,胡文祥. 光致变色聚合物研究进展[J]. 化学进展,2006, 18(3): 298-307. Wang J Y, Feng C G, Hu W X.The study of photochromic polymers[J]. Progress in Chemistry, 2006, 18(3): 298-307. |
| [7] | 符定良,孟庆华,黄德音. 变色树脂镜片及光致变色染料的筛选[J]. 染料与染色, 2007, 44(4): 13-18. Fu D L, Meng Q H, Huang D Y.Photochromic plastic ophthalmic lens and photochromic dyes[J]. Dyestuffs and Coloration, 2007, 44(4): 13-18. |
| [8] | 卞保红,陆明湖.螺吡喃吲哚啉类光致变色化合物的合成与LB膜研究[J]. 华东化工学院学报, 1992, 18(6): 755-760. Bian B H, Lu M H.Synthesis of photochromic spiropyranindolines and study on their Langmuir-Blodgett films[J]. Journal of East China Institute of Chemical Technology, 1992, 18(6): 755-760. |
| [9] | 许武,黄德音.光致变色的吲哚类俘精酸酐[J]. 华东化工学院学报, 1991, 17(5): 531-535. Xu W, Huang D Y.The photochromic fulgide[J]. Journal of East China Institute of Chemical Technology, 1991, 17(5): 531-535. |
| [10] | 刘勤凤, 陆明湖, 黄德音.螺噁嗪化合物光致变色行为的研究[J]. 化学物理学报, 1996, 9(6): 507-510. Liu Q F, Lu M H, Huang D Y. The photochromic study of spirooxazine compounds[J]. Chinese Journal of Chemical Physics, 1996, 9(6): 507-510. |
| [11] | 孙志成, 孟庆华.溶胶-凝胶法制备含偶氮生色团的三阶非线性材料[J]. 合成化学, 2008, 16(4): 406-409. Sun Z C, Meng Q H. Preparation of third order nonlinear optical material containing azo-dyes by sol-gel method[J]. Chin. J. Synth. Chem., 2008, 16(4): 406-409. |
| [12] | 孟庆华, 符定良, 张海凤, 黄德音, 张万斌.光致变色萘并吡喃类化合物及其合成方法. 中国专利,CN101215282.2007. Meng Q H, Fu D L, Zhang H F, Huang D Y, Zhang W B. Synthesis of photochromic naphthopyran compounds. China patent, CN101215282.2007. |
| [13] | 王珍,符定良,孟庆华,黄德音.吗啉取代萘并吡喃化合物的结构性能关系研究[J]. 信息记录材料,2010, 11(2): 8-11. Wang Z, Fu D L, Meng Q H, Huang D Y.Structure-function relationship study of morpholine substituted naphthopyran compound[J]. Information Recording Materials, 2010, 11(2): 8-11. |
| [14] | Wang Z, Meng Q H, Zhang Z H, Fu D L, Zhang W B. Synthesis and photochromic properties of substituted naphthopyran compounds[J]. Tetrahedron, 2011, 67: 2246-2250. |
| [15] | Melzig M, Zinnert H. Photochromic spiropyran compounds. WO: 9500504,1995. |
| [16] | Irie M, Kobatake S, Horichi M. Reversible surface morphology changes of a photochromic diarylethene single crystal by photoirradiation[J]. Science, 2001, 291: 1769-1772. |
| [17] | Crano J C, Flood T, Knowles D, Kumar A, Gemert B V. Photochromic compounds: chemistry and application in ophthalmic lenses[J]. Pure & Appl. Chem., 1996, 68: 1395-1398. |
| [18] | 潘桂兰,魏景强,朱爱平,明阳福,樊美公,等.萘并吡喃类化合物的光致变色性质和反应机理[J]. 中国科学(B辑),2001, 31(3): 246-252. Pan G L, Wei J Q, Zhu A P, Ming Y F, Fan M G,et al. The photochromic properties and reaction mechanism of naphthopyran compounds[J]. Science in China (Series B), 2001, 31(3): 246-252. |
| [19] | Gabbutt C D, Heron B M, Instone A C, Thomas D A, Partington S M, Hursthouse M B, Gelbrich T. Observations on the synthesis of photochromic naphthopyrans[J]. Eur. J. Org. Chem., 2003,1220-1230. |
| [20] | Crano J C, Guglielmetti R.Organic Photochromic and Thermochromic Compounds – Photochromic[M]. New York :Plenum Publishers, 1999. |
| [21] | Jockusch S, Turro N J, Forrest R, Blackburn F R. Photochromism of 2H-Naphthopyrans: a spectroscopic investigation[J]. J. Phys. Chem. A, 2002, 106: 9236-9241. |
| [22] | Kumar A.Structure property relationship of heterofused benzopyran[J]. Mol. Crysr. Liq. Crysr., 1997, 297: 147-154. |
| [23] | Rickwood M, Hepworth J D, Gabbutt C D. Photochromic heterocyclochromenes. WO: 05382,1995. |
| [24] | Brun P, Guglielmetti R, Anguille S. Metallocenyl-naphthopyrans[J]. Appl. Organomet. Chem., 2002, 16: 271-276. |
| [25] | Aldoshin S, Chuev I, Filipenko O. Pozzo J L, Lokshin V,Pèpe G. Photochromic properties of spiro [J]. Acta Crystallogr. Sect.C: Cryst. Struct. Commun., 1998, 54: 1720-1722. |
| [26] | Coelho P J, Carvalho L M, Abrantes S, Oliveira M M, Oliveira-Campos A M F, Samat A, Guglielmetti R. Synthesis and spectrokinetic studies of spiro [J]. Tetrahedron, 2002, 58: 9505- 9511. |
| [27] | Smith M B, March J. Advanced Organic Chemistry[M]. New York:John Wiley & Sons, 2007. |




