2. 中国科学院 研究生院, 北京 100049
2. Graduate University of Chinese Academy of Sciences, Beijing 100049, P.R.China
随着经济和社会的发展,环境污染问题,尤其是水污染,已经成为全球面临的重要挑战.染料废水在目前水污染中占有很大比重,因其难降解、易在环境中积累,对生物和人类毒害作用大,严重威胁生态环境和人类健康.传统去除水中染料污染物的方法主要有微生物降解法、活性炭吸附法、氧化法、螯合法等,但这些方法操作成本高、效率低、处理条件苛刻、存在二次处理困难等,在实际应用中受到很大的限制.
当今,随着纳米科技的快速发展和应用,纳米材料和技术逐渐用于解决能源和环境问题[1,2,3,4],并取得了很好的效果.其中,纳米吸附剂、纳米催化剂等纳米材料被广泛用于水中污染物的处理,为水的净化提供了新的途径.TiO2、ZnO等[1,2]纳米半导体材料因具有较好的光催化活性而被广泛用于催化降解水中的污染物.例如,Wang等利用F掺杂的TiO2纳米颗粒作为光催化剂,在可见光下能高效的降解水中的有机染料[3];Lu等利用金字塔状的ZnO微纳结构,在紫外光照射下短时间内可将甲基橙完全除去[4].
三氧化钨(WO3)是一种典型的n型半导体材料[5],因其独特的物理和化学性质而在变色器件[6]、太阳能器件[7]、智能窗[8]、传感器[9,10]、光电化学器件[11,12]等方面有着广泛的应用.用于水中污染物治理的n型半导体光催化剂种类很多,如ZnO、Fe2O3 、CdS、WO3、CuO、CeO2等.其中,WO3的禁带宽度在2.8 eV左右,属窄禁带材料,其吸收光谱在可见光范围内,能有效提高太阳能利用率,成为继TiO2之后研究较多的半导体催化材料,在水中污染物处理方面[13,14,15,16]表现出较好的催化性能,具有诱人的实际应用前景.
我们知道,催化剂的晶型、形貌等物化性质对其催化性能有很大的影响.氧化钨的晶型较多,形貌也复杂多样,已报道的有纳米线、纳米棒、纳米树、纳米花、纳米球、纳米管、纳米纤维、纳米片、纳米盘等[17,18,19,20,21,22,23,24,25].制备WO3的方法有气相沉积法(CVD)、水热法及电化学法等[26,27,28].其中水热法因反应温度低、产物粒径和形貌可控、设备简单、制备成本低廉等优点而渐渐成为研究人员青睐的合成方法.目前,在WO3水热合成过程中所采用的结构调节剂大部分是硫酸盐,如Na2SO4、K2SO4等[29,30,31],以有机酸盐作为结构调节剂的研究报道较少.
本文以钨酸钠和盐酸为主要原料,采用水热合成法[29],选用甲酸钠(HCOONa·2H2O)和无水乙酸钠(CH3COONa)作为结构调节剂,通过调控反应原料组成、沉淀时间等反应参数,合成出了不同形貌和晶型的WO3纳米晶体,并以水中染料污染物亚甲基蓝为研究对象,考察了所制得WO3纳米材料的催化性能. 1 实验部分 1.1 试剂
钨酸钠(Na2WO4·2H2O)、浓盐酸(质量分数37 %)、双氧水(质量分数30 %)、草酸(H2C2O4·2H2O)、柠檬酸(C6H8O7·H2O)、甲酸钠(HCOONa·2H2O)和无水乙酸钠(CH3COONa)等试剂来自北京化工厂,皆为分析纯;去离子水: Millipore公司Mill-Q Plus 185 Academic型超纯水仪器自制. 1.2 催化剂的制备
制备过程如图1所示:将称量好的Na2WO4·2H2O溶解于32 mL去离子水中,磁力搅拌下快速滴入3 mol/L HCl水溶液,调节溶液pH=1.2,溶液颜色由无色透明变为浅黄色胶状物,搅拌15 h后,得到均一、稳定的浅黄色沉淀,加入2.016 g草酸并稀释至80 mL,搅拌溶液变为无色透明状,加入无水乙酸钠,继续搅拌至微透明溶胶状,将反应液转移到具有100 mL聚四氟乙烯内衬的反应釜中,在180 ℃下,水热反应8 h.反应结束后,自然冷却至室温,离心、洗涤数次,在60 ℃下干燥12 h得到产品.我们考察了原料组成对WO3产品形貌的影响,具体如表1所示,所获得的产品分别标记为S1、S2、S3、S4.
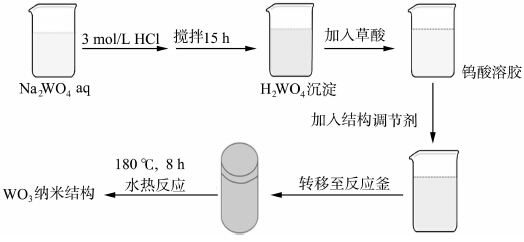 | 图1 制备WO3纳米结构的流程示意图 Schematic diagram of fabrication of tungsten oxide nanostructures |
| 表1 制备WO3纳米结构的原料组成 Compositions used for preparation of WO3 nanostructures |
X射线衍射仪(XRD): Bruker D8 Focus型 X射线粉末衍射仪(德国),利用CuKα线(λ=0.1542 nm),操作电压40 kV,电流40 mA;扫描电子显微镜(SEM):Hitachi S-4300扫描电子显微镜,加速电压为10 kV,附件安装有能量分散谱(EDS);透射电子显微镜(TEM)及高分辨透射电子显微镜 (HRTEM):JEOL 2100透射电子显微镜,加速电压为200 kV;比表面积及孔隙度分析仪:QuadraSorb SI全自动比表面和孔径分布分析仪(Quantachrome Instruments),采用氮吸附容量法测定样品的比表面积;傅里叶变换红外光谱仪(FT-IR):Excalibur 3100(美国,Varian),4000—400 cm-1扫描;紫外-可见分光光度计:TU-1901型紫外-可见分光光度计(Beijing Purkinje General Instrument Co.). 1.4 WO3的催化性能测试
将100 mL、浓度为10 mg/L的亚甲基蓝溶液移至250 mL的锥形瓶中,加入20 mg WO3样品后,立刻加入20 mL新鲜的双氧水(质量分数30 %)晃动,静止置于室温下反应.反应过程中,间隔一定时间取样离心,取其上层清液,用紫外-可见分光光度计检测亚甲基蓝的吸收光谱.根据朗伯-比尔定律,亚甲基蓝在λ=665 nm的吸光度A与其浓度成正比,因此可通过吸光度的测量得到亚甲基蓝的浓度.亚甲基蓝的降解率D按下式计算:
D=[(A0-A)/A0]×100%
式中,A0、A为催化降解前后亚甲基蓝溶液的吸光度. 2 结果与讨论 2.1 原料配比对WO3晶型的影响图2为采用不同原料组成所制备的WO3样品的XRD谱图.图中S1和S4各衍射峰位置与JCPDS No.33-1387相吻合,表明所得WO3为六方晶相.S2与S3的XRD谱图相同,各衍射峰位置与JCPDS No. 44-0363相吻合,为立方晶相的WO3·0.5H2O. 由此可知调节剂的用量和种类对WO3的晶型都有很大影响.减少调节剂的用量(S1和S2),或者调节剂由CH3COONa变为HCOONa·2H2O(S2和S4),都可以将产品由立方晶相的WO3·0.5H2O变为六方晶相的WO3.另外,与样品S2比较,S3的衍射峰强度明显增强,说明在同样的反应及处理条件下,增加原料中Na2WO4·2H2O 的含量可以提高产品的结晶度.
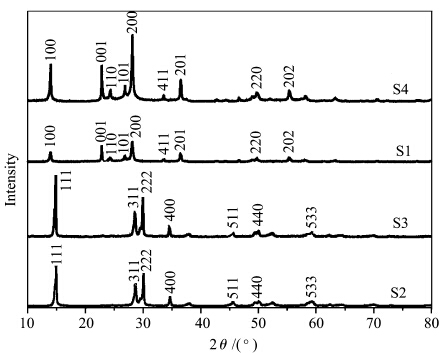 | 图2 不同原料组成合成WO3纳米结构的XRD谱图 XRD patterns of WO3 nanostructures prepared using varied compositions |
图3是不同原料组成所合成WO3的SEM图,可见样品S1(图3a)为纳米棒,平均长度约1 μm,直径为50 nm,由其TEM(图4a)和HRTEM(图4c)可以看到样品S1为单晶,晶格间距为0.37 nm,对应于六方相WO3的(110)晶面.一些纳米棒表面还存在平均尺寸为25 nm的纳米颗粒(如图3a箭头所示).S2是 由纳米棒(图3b虚线箭头所示)和纳米颗粒(图3b实线箭头所示)组成的混合形貌,纳米棒的平均长度为1 μm(图3b),平均直径为30 nm,其表面较S1光滑;纳米颗粒平均粒径为470 nm.样品S3为具有较好的对称性的八面体,边长约在200—800 nm之间(图3c),表面不光滑,均匀分布了一层粒径为30 nm的颗粒(图3c箭头所示).图3d为样品S4的SEM图,从图中可以看到,S4由长度在0.35—1.80 μm的长纳米棒组成,直径在35 nm左右,其表面也存在纳米颗粒(图3d箭头所示),粒径约为20 nm.图4b和4d分别为S4的透射电镜图(TEM)和高倍透射电镜图(HRTEM),由图4d可以看到清晰的晶格,晶格间距0.66 nm,与六方相WO3的(100)晶面相一致.
 | 图3 不同原料组成合成的WO3的SEM图 SEM images of WO3 prepared using varied starting compositions (a) S1,(b) S2,(c) S3,(d) S4 |
 | 图4 S1的TEM和HRTEM图(a,c);S4的TEM和HRTEM图(b,d) TEM and HRTEM images of S1(a,c) and S4 (b,d),respectively |
由上述讨论可以看出原料组成对WO3的形貌有很大影响.当增加结构调节剂用量时,其形貌由均一的纳米棒(图3a)转变为纳米棒和纳米颗粒组成的混合结构(图3b).这可能是因为,CH3COO-在WO3特定晶面进行选择性吸附,诱导纳米棒的生成;当其用量过多时,CH3COO-除在特定晶面吸附外,在非特定晶面也产生吸附,沿纳米棒取向生长的趋势减弱,产生不规则颗粒[29,30,31].S1与S2、S2与S4的比较表明,CH3COONa和HCOONa·2H2O都显示了调节产品形貌的作用.图3b和3d表明,在同样的条件下,以4 g的CH3COONa或4 g的HCOONa·2H2O为结构调节剂时,分别得到纳米棒和纳米颗粒混合形貌WO3和纳米棒单一形貌WO3,因此与CH3COO-相比较,HCOO-对WO3的导向作用更强.
此外,我们还探讨了原料中Na2WO4·2H2O的浓度对产品形貌的影响.如图3b和3c所示,当Na2WO4·2H2O的用量由2.608 g增加到5.216 g时,其形貌由纳米棒和纳米颗粒混合形貌转变为单一的八面体形貌,这是因为在水热条件下,原料的浓度对产物的形貌有极大的影响[15].当Na2WO4·2H2O浓度较低时,溶液的过饱和度也较低,而低过饱和度有利于纳米棒的形成;随着其浓度的增加,溶液的过饱和度增加,而高过饱和度会抑制纳米棒的生长方向,而生成八面体[32].XRD分析显示(图2中 S2和S3),其晶型并未发生变化,仍为立方相WO3·0.5H2O. 2.3 草酸对产品形貌的影响
草酸作为分散剂,在WO3的水热合成过程中起到了很重要的作用[20,21].研究表明,草酸在形成纳米线束、纳米棒的过程中起到决定性作用,它提供足够数量和合适尺寸的胶核作为晶核,以进行后续的水热成长,并诱导和改善结构调节剂的导向作用.在本实验中,我们发现改变S2制备过程中草酸的量对产品形貌有很大影响.如图5a所示,不加入草酸时,只形成不规则颗粒;保持其他条件不变,若将草酸的量增加到2.016 g,则得到纳米棒与纳米颗粒组成的混合形貌(图3b),而将草酸的量继续增加到4 g,则没有产物生成.用柠檬酸来替代草酸,则只有不规则的八面体颗粒生成(图5b).产生这种现象的原因可能是,若不加入草酸,不能有效的诱导有序结构的形成,故只生成不规则颗粒;当加入过量草酸时,晶核数量多,而尺寸很小,在高温高压的水热条件下很难长大,会渐渐溶解,以至于没有产物生成[20,21].
 | 图5 不加入草酸(a)和以柠檬酸为分散剂(b)得到WO3的扫描电镜图 SEM images of WO3 prepared without adding oxalic acid (a) and by adding citric acid (b),respectively |
保持其他条件不变,当沉淀时间少于或等于12 h时,水热反应后没有产物生成;沉淀时间为15 h时,产品为纳米颗粒和纳米棒组成的混合形貌(图3b);若延长沉淀时间至120 h,其形貌变得更加单一,不规则颗粒的含量很小(图6).由此可见,钨酸的沉淀过程对产物的形貌影响很大,增加沉淀时间有助于产物向一维方向生长,形成纳米棒.我们推测产生这种现象的主要原因是增加沉淀时间可以提高结构调节剂在产物一维方向生长时的导向作用,从而提高了纳米棒的产率.
 | 图6 沉淀时间为120 h合成的WO3的扫描电镜图 SEM image of WO3 using a precipitation time of 120 h |
图7a为所得WO3样品的FT-IR谱图.在600—900 cm-1范围内的宽吸收峰皆为 WO3中O—W—O的伸缩振动峰,位于960 cm-1的峰为终端WO的伸缩振动峰[16,33],在3200—3600 cm-1的宽峰对应于表面水分子和晶格水分子的伸缩振动峰.这4个样品在1600 cm-1处都出现了一个对应于H2O和OH-弯曲振动的吸收峰,说明所制得样品的表面都已羟基化.由图中可以看出,S2和S3的表面羟基的吸收峰更强,这归因于材料结构中带的结晶水.
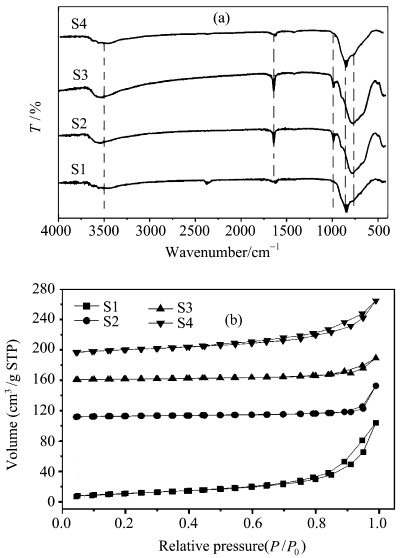 | 图7 所合成WO3的FT-IR图谱(a)和N2吸附-脱附等温线(b) FT-IR spectra (a) and N2 adsorption-desorption isotherms (b) of as-synthesized WO3 |
催化剂S1、S2、S3和S4的N2吸附-脱附曲线如图7b所示,所有的吸附-脱附曲线均表现为典型的Ⅱ型等温线,并且在P/P0>0.8处出了H3型滞后环,表明样品结构中存在有不均一的堆积孔[34],应主要是由WO3纳米颗粒堆积而成.按照BET法计算比表面积,得出S1、S2、S3和S4的比表面积分别为40.2 m2/g、8.1 m2/g、11.5 m2/g和44.1 m2/g.可以看到,S1、S4与 S2、S3的比表面积相差较大,S1、S4是S2、S3的4—5倍,这可能主要归因于其形貌的不同,由图3可以看到,S1和S4主要是由较短的纳米棒组成,而S2和S3样品中则分别出现了较大的颗粒和八面体. 2.6 不同WO3对亚甲基蓝的催化降解性能
本实验选取亚甲基蓝作为废水中的模拟有机污染物,评价WO3在室温下去除水中污染物的催化活性.
从图8可以看到,在仅有H2O2存在时,亚甲基蓝都只有少量降解(图8A-a、8B-a、8C-a和8D-a).对比S1、S2、S3和S4这4种WO3的MB+WO3和MB+H2O2+WO3变化曲线可以看出,不同的WO3在亚甲基蓝的去除中作用不同.图8A-b和图8A-c显示,在WO3单独存在时,亚甲基蓝在5 min内去除率达到96 %,因为没有H2O2,8A-b显示的应该是一个吸附过程;当加入H2O2后(8A-c),亚甲基蓝的去除率初始阶段没有明显的提高,只是当反应时间延长至20 min后,亚甲基蓝的去除率才略有进一步的增加,去除率接近100 %(图8A-c).这说明S1催化剂在亚甲基蓝的去除过程中主要发挥的是吸附作用,催化性能不显著.图8D显示了类似现象,说明S4催化剂在亚甲基蓝去除过程中同样发挥的是吸附作用.如图8D-c所示,当反应时间为30 min时,去除率达98 %.但图8B和8C显示,在WO3存在下,加入H2O2明显提高亚甲基蓝的去除率,说明S2和S3的吸附性能弱于其他两个催化剂,但其催化活性最强.当反应时间达6 h时,S2对亚甲基蓝的去除率达97 %(图8B-c);S3在8 h时,去除率接近99 %(图8C-c).
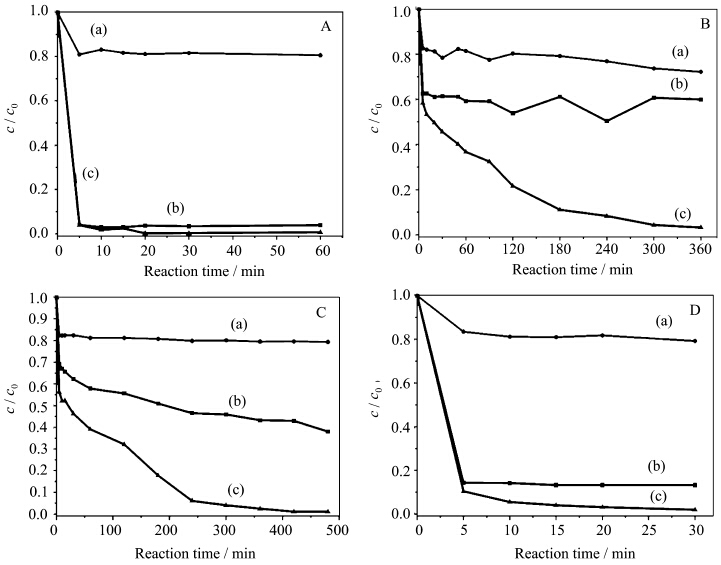 | 图8 (A)S1、(B)S2、(C)S3和(D)S4催化降解亚甲基蓝溶液浓度随时间的变化 Time profiles of MB degradation by (A) S1,(B) S2,(C) S3 and (D) S4 under different conditions (a)MB+H2O2,(b)MB+WO3,(c)MB+H2O2+WO3 |
在相同的条件下,我们对比了这4种WO3在MB+H2O2+WO3体系中对亚甲基蓝的整体脱色率,以考察不同WO3对水中亚甲基蓝去除的整体效率.如图9所示,S1在反应5 min时对亚甲基蓝的去除率达96 %,20 min达到平衡,去除率为99 %;S4在5 min时对亚甲基蓝的脱色率达90 %,30 min时为98%;而S2、S3在5 min时总去除率分别为42 %和44 %,30 min时皆达54 %,明显弱于S1和S4.但是,S2和S3的去除性能主要是催化降解作用,而S1和S4的去除性能主要来自于其吸附作用.反应时间3 h内,这4个样品对水中亚甲基蓝的去除能力为:S1>S4>S2>S3.其中,S1和S4具有很好的吸附能力,而S2具有最佳的催化活性.
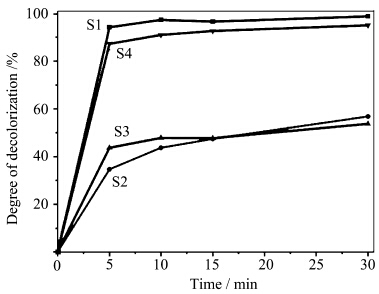 | 图9 不同WO3纳米结构上亚甲基蓝去除率随时间变化的曲线图 Removal curves of methylene blue using different WO3 nanostructures in 30 min |
由FT-IR谱图(图7a)可知,相比S2和S3,样品S1和S4拥有较少的表面羟基和较大的比表面积,联系其较好的吸附能力,我们认为制备的WO3的去除率和去除方式与其比表面积的大小有直接的关系,而受表面羟基的影响不大.S1、S4的比表面积是S2、S3的4—5倍,其去除率高于后者2—3倍(图9),且去除方式以吸附为主;S2和S3的比表面积较小,仅为8.1 m2/g和11.5 m2/g,其吸附效果较弱,故其催化降解能力突显. 2.7 催化降解机理
研究表明,以无机氧化物为催化剂、H2O2为氧化剂降解有机染料的过程,符合吸附-氧化-脱附机理.在氧化降解过程中,产生的具有较高氧化活性的HO·、HOO·及O2-·等活性自由基,将亚甲基蓝氧化降解[35].本实验的结果表明亚甲基蓝的去除机理与其相似.首先,亚甲基蓝染料分子与H2O2在WO3纳米结构表面进行吸附;然后,在WO3纳米催化剂存在下,H2O2分解成多种活性自由基,如HO·、HOO·及O2-·等,这些较高氧化活性的自由基将亚甲基蓝染料分子进行氧化,并将其降解成小分子;最后,降解的小分子从WO3表面脱附,使催化剂表面重新得到活化. 3 结论
本文采用水热法成功地合成了棒状、颗粒与棒的混合状、八面体状等形貌的WO3,探讨了沉淀时间、结构调节剂的种类和用量等反应参数对产物晶型和形貌的影响,并在室温下考察了所合成样品对水中染料污染物亚甲基蓝的去除性能.结果显示:沉淀时间增加有利于均一纳米棒的形成,通过添加CH3COONa和HCOONa·2H2O作为结构调节剂都可以有效地诱导纳米棒的生成.
亚甲基蓝去除结果表明,所合成的WO3对亚甲基蓝具有很好的去除性能,去除率均达97 %.本实验中,WO3纳米结构的去除亚甲基蓝的方式有吸附和催化降解两种,其去除方式与材料比表面积有直接的关系,而受表面羟基的影响不大.实验表明所制备的材料能有效地清除有机污染物,因此在水处理领域有潜在的应用前景.
| [1] | Wold A. Photocatalytic properties of TiO2[J]. Chem. Mater.,1993, 5(3): 280-230. |
| [2] | Gouvêa C A K, Wypycha F, Moraes S G, et al. Semiconductor-assisted photocatalytic degradation of reactive dyes in aqueous solution[J].Chemosphere, 2000, 40(4): 433-440. |
| [3] | Wang Q, Chen C C, Zhao D, et al. Change of adsorption modes of dyes on fluorinated TiO2 and its effect on photocatalytic degradation of dyes under visible irradiation[J].Langmuir, 2008, 24(14):7338-7345. |
| [4] | Lu F, Cai W P, Zhang Y G. ZnO hierarchical micro/nanoarchitectures: solvothermal synthesis and structurally enhanced photocatalytic performance[J]. Adv. Funct. Mater., 2008, 18(7): 1047-1056. |
| [5] | Santato C, Ulmann M, Augustynski J. Photoelectrochemical properties of nanostructured tungsten trioxide films[J]. J. Phys. Chem. B, 2001, 105(5): 936-940. |
| [6] | Naseri N, Azimirad R, Akhavan O, et al. Improved electrochromical properties of sol gel WO3 thin films by doping gold nanocrystals[J]. Thin Solid Films, 2010, 518(8): 2250-2257. |
| [7] | Zheng H D, Tachibana Y, Kalantar-zadeh K. Dye-sensitized solar cells based on WO3[J]. Langmuir, 2010, 26(24): 19148-19152. |
| [8] | Luo J Y, Deng S Z, Tao Y T, et al. Evidence of localized water molecules and their role in the gasochromic effect of WO3 nanowire films[J]. J. Phys. Chem. C, 2009, 113(36): 15877-15881. |
| [9] | Zhao Y Q, He J H, Yang M Q, et al. Single crystal WO3 nanoflakes as quartz crystal microbalance sensing layer for ultrafast detection of trace sarin simulant[J]. Anal. Chim. Acta, 2009, 654(2): 120-126. |
| [10] | Righettoni M, Tricoli A, Pratsinis S. Si∶WO3 sensors for highly selective detection of acetone for easy diagnosis of diabetes by Breath analysis[J]. Anal. Chem., 2010, 82(9): 3581-3587. |
| [11] | Zhang X H, Lu X H, Shen Y Q, et al. Three-dimensional WO3 nanostructures on carbon paper: photoelectrochemical property and visible light driven photocatalysis[J]. Chem. Commun., 2011, 47(20): 5804-5806. |
| [12] | Vemuri R S, Kamala Bharathi K, Gullapalli S K, et al. Effect of structure and size on the electrical properties of nanocrystalline WO3 films[J]. Appl. Mater. Interfaces, 2010, 2(9): 2623-2628. |
| [13] | Zhao Z G, Miyauchi M. Nanoporous-walled tungsten oxide nanotubes as highly active visible light-driven photocatalysts[J]. Angew. Chem. Int. Ed., 2008, 47(37): 7051-7055. |
| [14] | Kim J, Lee W C, Choi W. Platinized WO3 as an environmental photocatalyst that generates OH radicals under visible light[J]. Environ. Sci. Technol., 2010, 44(17): 6849-6854. |
| [15] | Jeon S, Yong K. Morphology-controlled synthesis of highly adsorptive tungsten oxide nanostructures and their application to water treatment[J]. J. Mater. Chem., 2010, 20(45): 10146-10151. |
| [16] | Zhao Z G, Liu Z F, Miyauchi M. Nature-inspired construction, characterization, and photocatalytic properties of single-crystalline tungsten oxide octahedra[J]. Chem. Commun., 2010, 46(19): 3321-3323. |
| [17] | Riegel G, Bolton J R. Photocatalytic efficiency variability in TiO2 particles[J]. J. Phys. Chem., 1995, 99(12): 4215-4224. |
| [18] | Lee K, Seo W S, Park J T. Synthesis and optical properties of colloidal tungsten oxide nanorods[J]. J. Am. Chem. Soc., 2003, 125(12): 3408-3409. |
| [19] | Shibuya M, Miyauchi M. Site-selective deposition of metal nanoparticles on aligned WO3 nanotrees for super-hydrophilic thin films[J]. Adv. Mater., 2009, 21(13): 1373-1376. |
| [20] | Zhao Y Q, Chen H M, Wang X Y, et al. Flower-like tungsten oxide particles: synthesis, characterization and dimethyl methylphosphonate sensing properties[J]. Anal. Chim. Acta, 2010, 675(1): 36-41. |
| [21] | Zhao X F, Cheung T L Y, Zhang X T, et al. Facile preparation of strontium tungstate and tungsten trioxide hollow spheres[J]. J. Am. Ceram. Soc., 2006, 89(9): 2960-2963. |
| [22] | Wang Z X, Zhou S X, Wu L M. Preparation of rectangular WO3·H2O nanotubes under mild conditions[J]. Adv. Funct. Mater., 2007, 17(11): 1790-1794. |
| [23] | Lu X F, Liu X C, Zhang W J, et al. Large-scale synthesis of tungsten oxide nanofibers by electrospinning[J]. J. Colloid Interface Sci., 2006, 298(2): 996-999. |
| [24] | Choi H G, Jung Y H, Kim D K. Solvothermal synthesis of tungsten oxide nanorod/nanowire/nanosheet[J]. J. Am. Ceram. Soc., 2005, 88(6): 1684-1686. |
| [25] | Zhou L, Zou J, Yu M M, et al. Green synthesis of hexagonal-shaped WO3·0.33H2O nanodiscs composed of nanosheets[J]. Cryst. Growth Des., 2008, 8(11): 3993-3998. |
| [26] | Fernando C, Carlos F, Enrique L, et al. Preparation of self-organized porous tungsten oxide using HFCVD technique[J]. Mater. Chem. Phys., 2010, 120(1):36-41. |
| [27] | Zhu J, Wang S L, Xie S H, et al. Hexagonal single crystal growth of WO3 nanorods along a[110] axis with enhanced adsorption capacity[J]. Chem. Commun., 2011, 47(15): 4403-4405. |
| [28] | Polleux J, Gurlo A, Barsan N, et al. Template-free synthesis and assembly of single-crystalline tungsten oxide nanowires and their gas-sensing properties[J]. Angew. Chem. Int. Ed., 2006, 45(2): 261-265. |
| [29] | Wang J M, Khoo E, Lee P S, et al. Synthesis, assembly, and electrochromic properties of uniform crystalline WO3 nanorods[J]. J. Phys. Chem. C., 2008, 112(37): 14306-14312. |
| [30] | Gu Z J, Zhai T Y, Gao B F, et al. Controllable assembly of WO3 nanorods/nanowires into hierarchical nanostructures[J]. J. Phys. Chem. B, 2006, 110(47): 23829-23836. |
| [31] | Lou X W, Zeng H C. An inorganic route for controlled synthesis of W18O49 nanorods and nanofibers in solution[J]. Inorg. Chem., 2003, 42(20): 6169-6171. |
| [32] | Qin Y X, Hu M, Zhang J. Microstructure characterization and NO2-sensing properties of tungsten oxide nanostructures[J]. Sens. Actuators B, 2010, 150(1): 339-345. |
| [33] | Salmaoui S, Sediri F, Gharbi N. Characterization of h-WO3 nanorods synthesized by hydrothermal process[J]. Polyhedron., 2010, 29(7): 1771-1775. |
| [34] | Han Y, Ying J Y. Generalized fluorocarbon-surfactant-mediated synthesis of nanoparticles with various mesoporous structures[J]. Angew. Chem. Int. Ed., 2005, 44(2): 288-292. |
| [35] | Zhang W X, Yang Z H, Wang X, et al. Large-scale synthesis of b-MnO2 nanorods and their rapid and efficient catalytic oxidation of methylene blue dye[J]. Catal. Commun., 2006, 7(6): 408-412. |




