菁染料由于具有摩尔吸收系数大、吸收和发射波长范围宽、与生物分子作用后荧光量子产率高等优点,近年来广泛应用于生物分子(如生物聚合物、蛋白质、抗体、核酸分子等[1,2,3])的标记.七甲川菁染料(亚甲基链上含有7个碳原子)的最大吸收和最大发射光谱位于700 nm—900 nm的近红外区,近红外光能够穿透生物组织并有效避免生物体的自荧光,因而较可见光具有更大的优势.一些荧光性能优良的近红外荧光染料的不断开 发[4,5],使近红外荧光成像技术灵敏度更高,有望在生物技术及生物制药领域发挥重要的作用[6,7,8,9].菁染料的光谱范围特征主要取决于连接端基芳环的亚甲基链的长度,亚甲基链越长,染料的光稳定性也不断下降.在强激光下,染料易发生光降解,因而限制了染料在一些要求高灵敏度、高检出限的分析技术方面的进一步应用,如激光诱导荧光成像技术和荧光分析技术等[10].因此,研究七甲川菁染料的光降解机理,提高染料的光稳定性成为研究的焦点.
早期进行的有关菁染料结构与光稳定性关系的研究结果表明,三甲川菁染料中芳环上取代基的改变会影响染料的光物理性能[11].在染料溶液中添加环糊精或在亚甲基链上共价引入环糊精可增强染料的光稳定性[12].其次,在菁染料的端基芳环上[13]以及染料骨架上[14]引入不同的取代基都会影响染料的光稳定性.Pantonay[15,16]研究组发现,将七甲川菁染料的中间亚甲基链进行环化,染料的光稳定性会大大增强,而在近红外(NIR)七甲川菁染料的3H吲哚环N位上引入苄基可以大大增强染料的光稳定性[17].NIR菁染料的吲哚环氮原子上引入4’位具有供电子基团的苄基,染料的光稳定性明显增强[18].在以上研究的基础上,本文合成了2种中位甲川链上具有不同取代基的NIR菁染料,结构如图1所示,未见文献报道过;采用电化学循环伏安法测试了染料的氧化电位,并考察了NIR菁染料中位取代基效应对染料光稳定性的影响,结果表明亚甲基链上吸电子基的引入使染料的光稳定性增强,供电子基使染料的光稳定性下降.
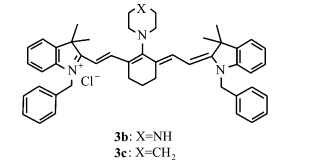 | 图1 染料的结构式 Structures of the dyes |
紫外-可见吸收光谱在双光束紫外-可见分光光度计(TU-1901)上测得(北京谱析通用仪器有限责任公司);荧光光谱在Cary Eclipse荧光分光光度计上测得(安捷伦科技有限公司);核磁(NMR)数据用AVANCE III 400MHz全数字化核磁共振谱仪(TMS为内标)测得.高分辨质谱仪在MICROMASS HPLC-Q-TOF质谱仪上测得.循环伏安曲线在上海辰华CHI660D电化学工作站上测得.实验用水为二次去离子水.其他试剂如未说明均为国产分析纯或化学纯试剂,如未加说明均直接应用而未经过任何处理. 1.2 光降解实验及循环伏安曲线
将1 cm厚的石英比色皿充满染料的乙醇溶液并保持密闭,在500 W的碘钨灯下照射.为消除短波长光的吸收及照射过程中产生的热量,在比色皿和碘钨灯之间设置一冷阱,其中充满2 L浓度为50 g/L的NaNO2水溶液,冷阱宽度为15 cm,碘钨灯与染料溶液间相距25 cm.照射过程中尽量保持避自然光以排除其它因素的影响.工作电极为玻碳电极,参比电极为饱和甘汞电极,对电极为铂丝电极,扫描速率是100 mV/s,染料浓度为10-4 mol/L乙腈溶液,电解质为氯化锂. 1.3 荧光量子产率的测量
用罗丹明B(Φ=0.56,乙醇)做标准物[9],计算荧光量子产率公式[19]为:
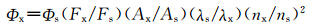
式中Φx、Φs分别为被测样品和标准物的荧光量子产率,Ax、As分别为被测样品和标准物在激发波长处的吸光度,nx、ns分别为被测样品和标准物所在溶液的折射率,Fx、Fs分别为被测样品和标准物的荧光发射峰的积分面积,λx、λs分别为被测样品的激发波长(560 nm)和标准物的激发波长(470 nm). 1.4 染料的合成
中间体2,3,3-三甲基-3H吲哚(1a)采用费歇尔法合成,通过苯肼与3-甲基-2-丁酮经缩合、环化制得[20],2-氯-1-甲酰基-3-羟亚甲基环己烯(2b)的合成参考相关的文献[21].染料3a的制备见参考文献[17].具体合成路线如式1所示.

式1 七甲川菁染料的合成路线
N-苄基-2,3,3-三甲基-3H-吲哚季铵盐(2a)的合成:7.02 g (44 mmol) 2,3,3-三甲基-3H吲哚(1a)和8.79 g (63 mmol)氯化苄加入到含10 mL乙醇、2.10 g高氯酸钾的50 mL单口烧瓶中,加热回流,反应6 h后停止,冷却后蒸馏除去部分溶剂,析出固体经过滤后收集,得到的固体粉末在醋酸中重结晶得到4.62 g纯净产物,收率为36%.
染料3a的合成:精确称量190 mg(0.65 mmol)中间体2a,50 mg(0.33 mmol)中间体2b和100 mg无水醋酸钠,依次加入到含有10 mL醋酸酐的25 mL圆底烧瓶中,加热到75 ℃,溶液变绿色,反应40 min后停止.冷却后将绿色溶液加入到饱和的氯化钠水溶液中,析出绿色染料固体,过滤后收集.粗品在乙醇中重结晶,过滤后干燥得到191 mg绿色粉末,收率86%. 1HNMR (d6-DMSO): δ 1.72 (s,14H,C(CH3)2,CH2),2.50 (m,4H,CH2),5.53 (s,4H,NCH2),6.43 (d,J=14 Hz,2H,CH),7.28 (m,16H,Ar-H),7.67 (d,2H,J=7.6 Hz,Ar-H),8.24 (d,2H,J=14 Hz,CH).MS (m/z):635.3[M]+.
染料3b的合成:精确称量134 mg (0.2 mmol)染料3a,六水合哌嗪194 mg(1 mmol),加入到20 mL无水乙醇和5 mL无水甲醇混合液中,加热回流反应约1 h,溶液中析出固体直接过滤收集得到120 mg纯品,收率82%.1HNMR(d6-DMSO): δ 1.58-1.60(m,2H,CH2),1.64(s,12H,CH3),2.31(t,4H,J=8 Hz,CH2),3.70(s,4H,CH2),3.83(s,4H,CH2),5.29(s,4H,CH2),5.86-5.89(d,2H,J=12 Hz,CH),7.10-7.54(m,20H,Ar-H,CH). HRMS,m/z: calc. 685.4270[M]+,found 685.4275[M]+.
染料3c的合成:精确称量67 mg(0.1 mmol)染料3a,哌啶26 mg(0.3 mmol),加入到50 mL圆底烧瓶中,再加入5 mL二氯甲烷,室温下搅拌2 h,反应液逐渐由绿色变为深蓝色,反应停止后,旋蒸除去二氯甲烷溶剂,所得粘稠固体用30 mL乙醚搅拌约5 h,重复三次,过滤得到粉末,用乙醇重结晶,得到深蓝色粉末68 mg,产率为94%.1HNMR(d6-CDCl3): δ1.56(s,2H,CH2),1.66(s,12H,CH3),1.74(s,4H,CH2),1.82(s,2H,CH2),2.26(s,4H,CH2),3.84(s,4H,CH2),5.04(s,4H,CH2),5.51-5.54(d,2H,J=12 Hz,CH),6.80-6.82(d,2H,J=8 Hz,CH),7.06-7.37(m,18H,Ar-H). HRMS,m/z: calc. 684.4318[M]+,found 684.4326[M]+. 2 结果与讨论 2.1 染料的合成
分别设计合成了中位亚甲基链哌嗪、哌啶取代的七甲川菁染料,合成反应收率高,采用溶剂重结晶的方法,避免了进一步的柱色谱分离,简化了纯化步骤,降低了分离提纯成本. 2.2 染料的吸收和荧光光谱
染料3a、3b的吸收光谱和荧光发射光谱如图2所示.染料3a在甲醇中最大吸收和荧光发射分别为785 nm和817 nm,斯托克斯位移为32 nm.3b在甲醇中的最大吸收波长为677 nm,较3a蓝移了108 nm,最大荧光发射波长在790 nm,其斯托克斯位移为113 nm,比3a增大了81 nm.3c在甲醇中的最大吸收和荧光发射波长分别在647 nm和786 nm,斯托克斯位移也增大到139 nm.主要是由于染料中位甲川链上氯原子取代在菁染料共轭体系上产生吸电子效应,而3b染料中位甲川链上的氮原子在菁染料共轭体系上产生供电子效应;由于中位氮原子改变了染料共轭体系的电子分布,使染料LUMO能级升高,相对于染料3a的最大吸收波长发生蓝移,符合库恩经典多甲川菁染料理论[22].另一方面,3a分子结构中氯原子与两侧双键上的氢原子可以形成弱的分子内氢键,使得分子的共平面性更好.而3b与3c分子中氮原子两侧的亚甲基上的氢原子与两侧双键上的氢原子产生了排斥作用,使两侧双键上的氢原子无法与氮原子形成稳定的分子内氢键,相反更可能会通过单键的部分旋转,使得整个分子偏离了共平面状态.表现为宏观上的吸收光谱的差异,即3a比3b与3c具有更长波长的吸收特征.表1中所示数据为染料3b、3c在不同溶剂中的最大吸收和荧光发射光谱.从表中可以看出,在醇类等极性质子溶剂中其吸收和荧光光谱最大值变化不大,在极性非质子溶剂中表现出较大的斯托克斯位移,在乙腈中的斯托克斯位移分别为158 nm和197 nm.染料在溶剂中的荧光量子产率在0.013—0.057.
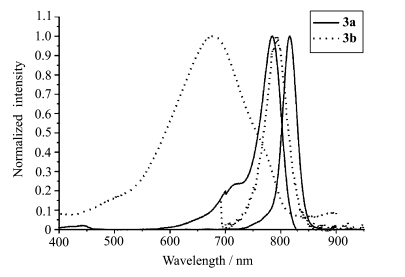 | 图2 染料3a、3b在甲醇中经归一化后的吸收和荧光发射光谱 Normalized absorption and emission spectra of dyes 3aand 3b in methanol |
| 表1 染料在不同溶剂中的光谱性质 Spectral property of the dyes in different solvents |
菁染料的光稳定性是近年来学者们研究的热点[15,16].陈萍、田禾等对菁染料的光氧化反应机理进行了较深入的研究[23,24].为了得到染料的光降解速率常数,本文研究了3种染料在乙醇中的光降解性质.光降解实验在1 cm宽的石英比色皿中进行,样品溶液用500 W的碘钨灯照射,实验在室温下密闭避自然光进行.实验结果见图3所示.实验初始,将染料的最大吸收值调至0.9—1.0之间,保持一致.光照5 h之后,3a、3b、3c分别降解了30%、42%和48%,可见染料的光稳定性顺序为3a>3b>3c.
 | 图3 染料在乙醇中的光降解实验对比 Comparisons on the photobleaching of the dyes |
对于低浓度染料,染料的浓度和最大波长处的吸收值之间具有线性关系,光降解反应方程如下:
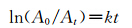
A0是光照前染料最大波长处的吸收值,At是光照中染料在最大波长处的吸收值,t是光照反应时间,k是光反应速率常数,因而光降解反应速率常数可以通过实验测到[25],如图4所示.经过计算可知:染料3a、3b、3c的光降解速率常数分别为1.21×10-3 mol/min、1.81×10-3 mol/min、2.14×10-3 mol/min.可能是由于染料3a的中位氯原子为吸电子基团,使共轭体系中电子密度下降,且3a的分子内氢键有利于分子的稳定性提高;而3b、3c中位取代为N原子,是供电子基团,使共轭体系中电子密度增大,因此染料3a比3b、3c更稳定.染料3b、3c中位分别为哌嗪、哌啶取代,氮的电负性大于碳,所以哌嗪、哌啶的供电子能力为哌啶>哌嗪,因此染料的光稳定性顺序为3a>3b>3c
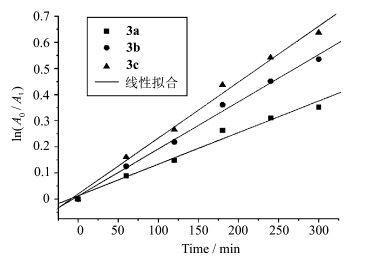 | 图4 染料的光降解速率常数 Rate constants of the photodegradation for the dyes |
菁染料的光降解主要是由于共轭链受到活性氧的进攻氧化造成的.染料光稳定性越高,分子越难被氧化,因此对染料进行循环伏安实验,可以测出其氧化反应的难易.染料在乙腈中的循环伏安曲线如图5所示,从图中可以看出,3a—3c的氧化峰电位分别为0.740 V、0.620 V和0.599 V,氧化峰电位的大小顺序为3a>3b>3c,氧化峰电位越大,染料越不容易被氧化,光稳定性越高,与光降解实验结果一致.
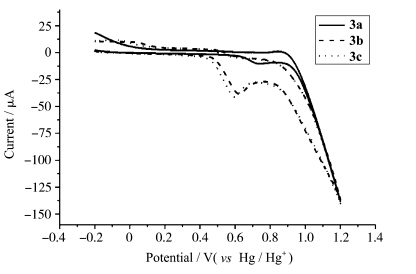 | 图5 染料在乙腈中的循环伏安曲线 Cyclic voltammetry curves of the dyes (10-4mol/L) with scan rate of 100 mV/s in acetonitrile |
本文合成了两种未见文献报道过的中位取代七甲川菁染料,并采用核磁1HNMR和质谱对染料结构进行了表征.3b、3c在甲醇中的最大吸收波长和最大荧光发射波长分别为677/790 nm和647/786 nm,染料在各种溶剂中的Stokes位移在113 nm—197 nm.染料的光降解实验表明:3a—3c在乙醇中的光降解速率常数分别为1.21×10-3mol/min、1.81×10-3mol/min和2.14×10-3mol/min,氧化电位依次分别在0.729 V、0.624 V和0.598 V.由于中位氯、哌嗪、哌啶取代基的供-吸电子能力差别及氢键作用相互影响,使菁染料的光稳定性不同.中位吸电基取代增强染料光稳定性,供电基取代减弱染料的光稳定性,这对于设计光稳定性更强的菁染料具有实际指导意义.
| [1] | Mishra A, Behera R K, Cyanines during the 1990s: a review[J]. Chem. Rev., 2000, 100: 1973-2011. |
| [2] | Wang M, Holmes-Davis R, Rafinski Z. Accelerated photobleaching of a cyanine dye in the presence of a ternary target DNA, PNA probe, dye catalytic complex: a molecular diagnostic[J]. Anal. Chem., 2009, 81(6): 2043-2052. |
| [3] | Eriksson M, Karlsson H J, Westman G. Groove-binding unsymmetrical cyanine dyes for staining of DNA: dissociation rates in free solution and electrophoresis gels[J]. Nucleic Acids Research, 2003,31: 6235-6242. |
| [4] | Peng X, Song F, Lu E, et al. Heptamethine cyanine eyes with a large stokes shift and strong fluorescence: a paradigm for excited-state intramolecular charge transfer[J]. J. Am. Chem. Soc., 2005, 127(12): 4170-4171. |
| [5] | Hilderbrand S A, Kelly K A, Weissleder R, Tung C-H. Monofunctional near-infrared fluorochromes for imaging applications[J]. Bioconjugate Chem., 2005, 16(5):1275-1281. |
| [6] | Tung C H. Fluorescent peptide probes for in vivo diagnostic imaging[J]. Biopolymers, 2004, 76(5): 391-403. |
| [7] | Oushiki D, Hirotatsu K, Takuya T,et al. Development and application of a near-infrared fluorescence probe for oxidative stress based on differential reactivity of linked cyanine dyes[J]. J. Am. Chem. Soc., 2010, 132: 2795-2801. |
| [8] | Takuya M, Kazuki K, Kenjiro H, et al. Rational design of ratiometric near-infrared fluorescent pH probes with various pKa values, based on aminocyanine[J]. J. Am. Chem. Soc., 2011, 133(10): 3401-3409. |
| [9] | Fei X, Gu Y. Progress in modifications and applications of fluorescent dye probe[J]. Progress in Natural Science Materials International, 2009, 19(1): 1-7. |
| [10] | Pawley J B. Handbook of Biological Confocal Microscopy[M]. New York: Plenum Press, 1995, 327-338. |
| [11] | Murphy S, Schuster G B, Series of cyanine dyes: evidence for electronic and steric control of the rotational rate[J]. J. Phys. Chem., 1995, 99: 8516-8518. |
| [12] | Guether R, Reddington M V. Photostable cyanine dye β-cyclodextrin conjugates[J]. Tethahedron Letter, 1997, 38: 6167-6170. |
| [13] | Renikuntla B R, Rose H C, Eldo J, Waggoner A S, Armitage B A. Improved photostability and fluorescence properties through polyfluorination of a cyanine dye[J]. Org. Lett., 2004, 6: 909-912. |
| [14] | Mader O, Reiner K, Egelhaaf H J, Fischer R, Brock R, Structure-property analysis of pentamethine indocyanine dyes -identification of a new dye for life-science applications[J]. Bioconjugate Chem., 2004, 15: 70-78. |
| [15] | Tarazi L, George A, Patonay G, Strekowski L. Spectral characterization of a novel near-infrared cyanine dye: a study of its complexation with metal ions[J]. Talanta, 1998, 46: 1413-1424. |
| [16] | Gorecki T, Patonay G, Strekowski L, Chin R, Salazar N. Synthesis of novel near-infrared cyanine dyes for metal ion determination[J]. J.Heterocycl. Chem., 1996, 33: 1871-1876. |
| [17] | 陈 欣,姚祖光. N-苄基吲哚三碳菁染料的合成及性能[J]. 高等学校化学学报, 1996, 17(10): 1613-1616. Chen X, Yao Z G. Synthesis and properties of N-benzylindotricarbocyanine dyes[J]. Chemical Journal of Chinese Universities, 1996, 17: 1613-1616. |
| [18] | Chen X Y, Peng X J. Photostabilities of novel heptamethine 3H-indolenine cyanine dyes with different N-substituents[J]. J. Photochem. Photobiol. A: Chem., 2006, 181: 79-85. |
| [19] | Velapoldi R A, Tonnesen H H. Corrected emission spectra and quantum yields for a series of fluorescent compounds in the visible spectral region[J]. Journal of Fluorsecence, 2004, 14(4): 465-472. |
| [20] | Illy H, Funderbruk L. Fischerindole synthesis direction of cyclization of isopropyl methyl ketone phenylhydrazone[J]. J. Org. Chem., 1968, 33: 4283-4285. |
| [21] | Gallaher D L, Johnson J M, Johnson E. Development of near-infrared fluorophoric labels for the determination of fatty acids separated by capillary electrophoresis with diode laser induced fluorescence detection[J]. Analyst, 1999, 124: 1541. |
| [22] | Descalzo A B, Rurack K. On the signaling pathways and CuII mediated anion indication of N-meso-substituted heptamethine cyanine dyes[J]. Chem. Eur. J, 2009,15: 3173-3185. |
| [23] | 李 军, 陈 萍, 赵 江, 等. 近红外吸收菁染料分子结构对其光氧化稳定性能的影响[J]. 感光科学与光化学, 1997, 15(4): 343. Li J, Chen P, Zhao J. The influence of molecular chain structure on stability againstphotooxidation of near-infrared absorbing cyanine dyes[J]. Photographic Science and Photochemistry, 1997,15(4): 343. |
| [24] | 杨松杰, 孟凡顺, 田 禾, 姚思德. 菁染料光稳定性及氧猝灭剂对其光稳定性的影响[J]. 感光科学与光化学, 2001, 19(3): 169-176. Yang S J, Meng F S, Tian H, Yao S D. Photodegradation mechanism of cyanine dyes and merocyanine dyes solution[J]. Photographic Science and Photochemistry, 2001, 19(3): 169-176. |
| [25] | Chen P, Sun S Q, Hu Y F, Qian Z G, Zheng D S. Structure and solvent effect on the photostability of indolenine cyanine dyes[J]. Dyes Pigments, 1999, 41: 227-231. |




