2. 中国科学院 研究生院,北京 100049
2. Graduate University of Chinese Academy of Sciences, Beijing 100049, P. R. China
光化学反应研究的是激发态分子的反应.一般情况下分子激发态的寿命都很短,反应的活化能低,过渡态的构型难以控制,因此,光化学反应的手性传递效率比较低[1].化学家们已经提出了许多提高光化学反应立体选择性的方法,利用受限介质来控制光化学反应的立体选择性是其中较为成功的策略.
环糊精(Cyclodextrin,简称CD)[2]是C1椅式构象α-D-吡喃葡萄糖单元通过α-1,4-苷键连接起来形成的主体分子.它的手性疏水空腔可以提供一个尺寸和形状相对固定的手性环境,在控制光化学反应的选择性方面显示出独特魅力.2003年,Inoue等[3]报道了水溶液中γ-CD诱导2-蒽甲酸(2-AC)光二聚反应的对映体选择性.他们发现,γ-CD不仅能有效控制2-AC光二聚反应的区域选择性,还能诱导顺式-头尾(syn-head-to-tail)光二聚体的立体选择性,e.e.值达到41%(0 ℃).
在特定位置上带有特定取代基的萘衍生物能够发生光二聚反应,生成类立方烷刚性骨架结构的光二聚体.研究至今,这类光二聚反应的化学选择性和区域选择性都得以改善[4].2006年,我们研究组首次揭示了萘衍生物类立方烷光二聚体的手性[5].之后,在萘衍生物分子间的不对称光二聚反应方面进行了深入研究[6].前期的研究发现葫芦[8]脲(CB[8])能够加速双-2-萘甲酸三缩四乙二醇酯(N-P4-N)的分子内光二聚反应,高效、高选择性地得到反式-头头类立方烷光二聚体,而在不包含主体的水溶液中没有得到光二聚体[4].本工作利用与CB[8]大小类似的γ-CD手性空腔作为手性主体,研究水溶液中γ-CD对N-P4-N分子内光二聚反应立体选择性的影响. 1 实验部分 1.1 试剂和仪器
试剂:文中合成所用试剂均为分析纯,高效液相色谱分离所用试剂为色谱纯试剂(HPLC级).2-萘甲酸为常州市武进化学试剂有限公司生产的分析纯试剂;γ-环糊精为TCI公司产品;三缩四乙二醇为Aldrich公司产品.
仪器:JASCO-PU-1580高效液相色谱仪;Perkin Elmer-200高效液相色谱仪;Bruker公司Advance Brucker-400 M核磁共振波谱仪;Waters公司GCT Premier高分辨飞行时间质谱;Shimadzu-1601 PC紫外可见光谱仪;F-4500 Fluorescence Spectrophotometer荧光光谱仪;JASCO J-815 Spectropolarimeter圆二色谱仪. 1.2 双-2-萘甲酸三缩四乙二醇酯(N-P4-N)的合成
称取2-萘甲酸(3 g,17.5 mmol)与10 mL新蒸二氯亚砜混合,加热回流4 h,除去未反应的二氯亚砜,将剩余的2-萘甲酰氯溶解于10 mL无水甲苯中得浅黄色溶液,待用.将三缩四乙二醇(1.54 g,7.9 mmol)与14 mL吡啶混合溶解于80 mL的无水甲苯中,冰浴冷却下边搅拌边滴加2-萘甲酰氯的甲苯溶液.滴加完毕后,常温常压下搅拌过夜,然后在80 ℃反应3 h.冷却后,加入80 mL甲苯对反应液进行稀释,然后加入80 mL 2 mol/L的盐酸,分出有机层,水层使用甲苯萃取(20 mL×3).合并有机层相,依次使用2 mol/L的盐酸、1 mol/L的碳酸钠水溶液和水洗涤,洗至中性后使用无水Na2SO4干燥.滤掉干燥剂,浓缩得到黄色油状粗产物,使用硅胶柱分离(石油醚∶乙酸乙酯=50∶1—2∶1).分离得到的纯净产物为透明油状液体,产率为98%.
N-P4-N: 1HNMR (400 MHz,CDCl3) δ:8.62 (s,2H),8.08—8.05 (m,2H),7.94 (d,J=8.0 Hz,2H),7.86 (d,J=8.7 Hz,4H),7.59—7.50 (m,4H),4.52 (t,J=4.8 Hz,4H),3.86 (t,J=4.9 Hz,4H),3.73—3.69 (m,8H); 13CNMR (100 MHz,CDCl3) δ:165.7,134.8,131.8,130.4,128.6,127.6,127.4,127.1,126.8,126.0,124.6,70.0,68.5,63.5; EI-MS [M]+ 502.2. 1.3双-2-萘甲酸三缩四乙二醇酯外消旋光二聚体(anti-N-P4-N-photodimer)的合成
氮气保护下,1×10-5—1×10-4 mol/L的双-2-萘甲酸三缩四乙二醇酯的环己烷溶液,置于Pyrex玻璃制成的光反应器中,使用500 W的高压汞灯光照6 h,真空下除去环己烷,粗产物使用高效液相色谱(HPLC)进行分离,得到纯的类立方烷光二聚体,产率为98%.高效液相色谱分离条件:Intersil ODS-3半制备柱250 mm×10 mm,220 nm检测波长,流动相乙腈/水 = 80/20,流速2.0 mL/min.
anti-N-P4-N-photodimer: 1HNMR (400 MHz,CDCl3) δ:7.00—6.92 (m,8H),4.53—4.49 (d,J=11.7 Hz,2H),4.42—4.36 (m,2H),4.33—4.30 (m,4H),3.90—3.87 (d,J=7.9 Hz,2H),3.83—3.73 (m,4H),3.70 (s,8H); 13CNMR (100 MHz,CDCl3) δ:173.6,136.2,135.8,128.7,128.6,127.2,127.0,71.0,70.9,69.2,64.4,47.4,43.1,42.9,39.8; EI-MS [M]+ 502.3. 1.4 N-P4-N@γ-CD包结物水溶液的制备
称取N-P4-N(141 mg,0.281 mmol)与γ-CD(401 mg,0.309 mmol)溶解于1 L的超纯水中,再加入1 mL甲醇,50 ℃下超声振荡4 h后静置过夜,使用0.22 μm的有机相微孔滤膜过滤,滤液即为包结物水溶液. 1.5 N-P4-N@γ-CD包结物水溶液的光照实验
将60 mL的N-P4-N@γ-CD包结物水溶液装入Pyrex玻璃制成的光反应试管中,在持续通入氮气的条件下,用500 W的高压汞灯照射11 h.Pyrex玻璃作为滤光片只允许波长大于280 nm的光透过.光照后的溶液使用氯仿萃取5次,减压除去氯仿后,就得到光反应的粗产物,为淡黄色固体. 2 结果与讨论 2.1 水溶液中γ-CD与N-P4-N的包结作用
首先,采用光谱的方法测定了N-P4-N@γ-CD包结物水溶液的包结情况.从N-P4-N@γ-CD包结物水溶液与N-P4-N水溶液紫外吸收光谱和荧光发射光谱的对比,显示出包结物水溶液中N-P4-N与γ-环糊精之间发生了有效的包结.N-P4-N@γ-CD包结物水溶液的吸收光谱相对于纯水中的吸收光谱发生了明显的红移(图1),表明基态下N-P4-N与γ-CD之间存在相互作用.
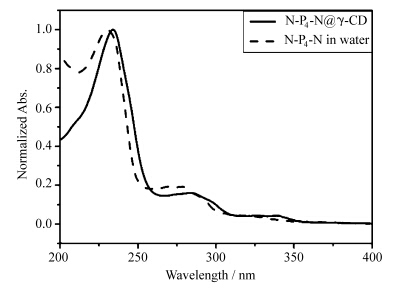 | 图1 N-P4-N@γ-CD包结物水溶液和N-P4-N水溶液的紫外光谱图 The absorption spectra of N-P4-N@γ-CD inclusion complex in aqueous solution and N-P4-N in aqueous solution |
与N-P4-N水溶液的360 nm附近单体荧光发射峰不同,N-P4-N@γ-CD包结物水溶液在420 nm附近显示强的激基缔合物的发光(图2a).我们也测试了两者的荧光激发光谱,如图2b所示,可以看到包结物水溶液中410 nm处的荧光发射与N-P4-N水溶液356 nm处的荧光发射来源不同,吸收发生了红移.表明包结物水溶液中N-P4-N的存在形式与水溶液中不同.因为γ-CD的空腔能够容纳两个芳香环一同进入,因此可以认为在包结物的水溶液中N-P4-N分子的两个萘环被包结在同一个γ-CD分子中,两个萘环非常靠近.这个推测进一步由N-P4-N和γ-CD的光谱滴定实验证实.
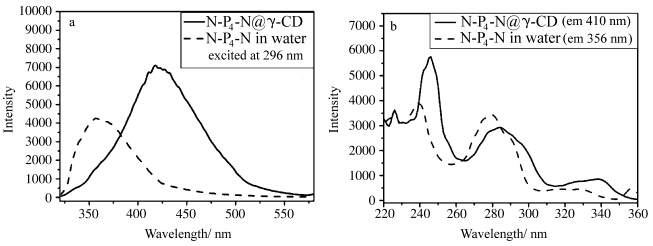 | 图2 N-P4-N@γ-CD包结物水溶液和N-P4-N水溶液的荧光发射(a,λex=296 nm)和激发光谱图(b) (a) The fluorescence spectra of N-P4-N@γ-CD inclusion complex in aqueous solution and N-P4-N in aqueous solution; (λex=296 nm); (b) The excitation spectra of N-P4-N@γ-CD inclusion complex in aqueous solution (λem=410 nm) and N-P4-N in aqueous solution (λem=356 nm) |
由于溶解度的限制,光谱滴定实验是在含10%乙二醇的水溶液中完成的.向2×10-5mol/L的N-P4-N乙二醇水溶液中加入不同浓度的γ-CD,超声振荡1 h后静置过夜.吸收光谱如图3a所示,随着γ-CD浓度的增加N-P4-N的吸光度逐渐增大,表明γ-CD与N-P4-N有相互作用,提高了N-P4-N在水溶液中的溶解度.与此同时,荧光发射光谱(图3b)在421 nm处激基缔合物的发光逐渐增强,以1/ΔFi对[γ-CD]-1作图得到一条直线符合Benisi-Hildebrand方程1(图3b插图)[7],表明γ-CD和N-P4-N以1∶1的方式络合,即N-P4-N分子的两个萘环被包结在同一个γ-CD分子中,根据方程1计算得到络合常数K1为964 mol-1·L.
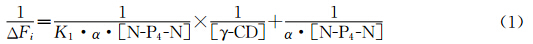
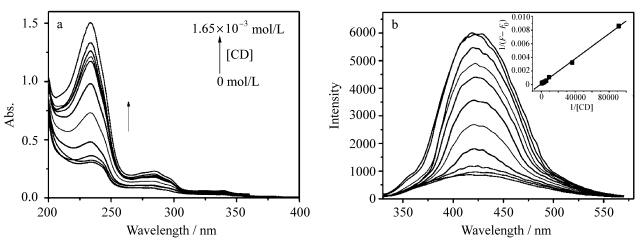 | 图3 不同浓度的γ-CD(0—1.65×10-3 mol/L)滴加到N-P4-N(2×10-5 mol/L) 的10%乙二醇水溶液中引起的吸收(a)和发射光谱(b,λex=296 nm)的变化 插图为1/ΔFi对1/[γ-CD]作图所得到的直线 UV-vis absorption spectra (a) and fluorescence spectra (b,λex=296 nm) of 2×10-5 mol/L of N-P4-N in aqueous solution at various concentration of γ-CD (0—1.65×10-3 mol/L) insert: plot of the 1/ΔFi vs. 1/[γ-CD] |
N-P4-N@γ-CD包结物水溶液的光照实验在室温条件下进行,光照时间11 h,光反应的转化率高达93%.从HPLC上收集光二聚产物,核磁和质谱测试的结果表明N-P4-N@γ-CD包结物水溶液光照后只生成反式-头头结构的光二聚体(anti-N-P4-N-photodimer).
anti-N-P4-N-photodimer类立方烷光二聚体是一种带有C2轴的手性化合物,它的外消旋体包含等量的一对对映异构体(图4).外消旋anti-N-P4-N-photodimer类立方烷光二聚体在高效液相色谱仪上被成功地拆分成了一对对映异构体,在手性拆分谱图上呈现面积相等的两个峰(图5a).我们直接从手性HPLC上收集流出的第一组份(命名为a)和第二组份(命名为b),真空条件下除去溶剂,进行光谱测定.
 | 图4 反式-头头N-P4-N光二聚体的镜像对称关系 Enantiomers of anti-N-P4-N-photodimer |
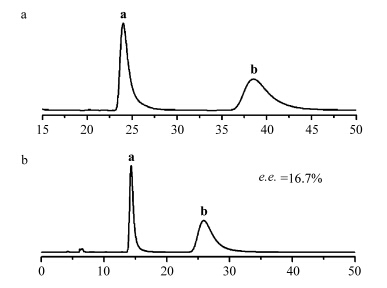 | 图5 (a)外消旋anti-N-P4-N-photodimer和(b)N-P4-N@γ-CD包结物水溶液 光照产物anti-N-P4-N-photodimer的高效液相色谱手性拆分图 (分离条件:Chiralcel OJ-H 分析柱0.46 cm I.D.×25 cm L,220 nm检测波长,流动相55/45正己烷/乙醇,流速0.5 mL / min) Typical HPLC chromatograms of (a) racemic anti-N-P4-N-photodimer and (b) anti-N-P4-N-photodimer generated from photochemical transformation of N-P4-N@γ-CD inclusion complex in aqueous solution on Chiralcel OJ-H analytical column (25 cm×0.46 cm) (UV detection at 220 nm; eluent: 55/45 n-hexane/ethanol; flow rate: 0.5 mL/min) |
组份a和组份b具有完全相同的紫外吸收光谱,它们的圆二色谱(circular dichroism)呈典型的镜像对称关系(图6).使用相同的手性HPLC条件,我们分析了N-P4-N@γ-CD包结物水溶液光照后得到的anti-N-P4-N-photodimer类立方烷光二聚体的立体选择性,发现组份b的积分面积大于组份a的积分面积,e.e.值为16.7%(图5b).
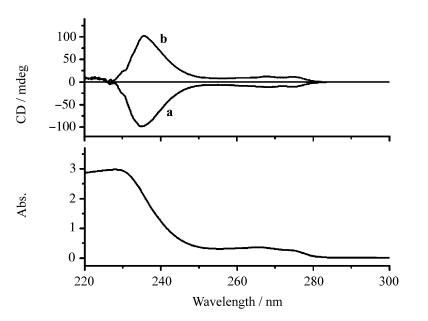 | 图6 anti-N-P4-N-photodimer一对对映异构体的圆二色谱和紫外吸收光谱(溶剂:乙腈) The circular dichroism and absorption spectra of anti-N-P4-N-photodimer enantiomers (solvent: acetonitrile) |
我们选择了0.5—30 ℃区间的六个温度(0.5、5 、10 、15、20、30 ℃)分别进行N-P4-N@γ-CD包结物水溶液的光照实验,光照6 h后的处理方法同常温下的光照实验.六个温度下都只得到分子内的光二聚体,且全为反式-头头结构,不同温度下所得光二聚体的对映体选择性,结果列于表1中.30 ℃与0.5 ℃的温差为29.5 ℃,温度变化引起的e.e.值的绝对差值为5.1%,光二聚产物的e.e.值随着温度的降低呈现单调上升的趋势(图7a).温度对N-P4-N@γ-CD包结物水溶液光二聚反应对映体选择性产生的这种影响,可以从热力学的角度来进行分析[8].ln[(100+%ee)/(100-%ee)]对绝对温度的倒数(T-1)作图,线性拟合得到一条直线(图7b).
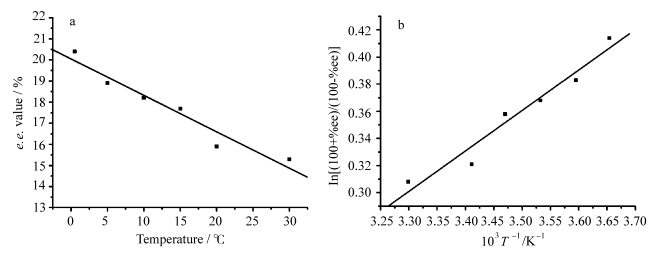 | 图7 (a)N-P4-N@γ-CD包结物水溶液不同温度下光二聚产物的e.e.值与温度的关系, (b)N-P4-N@γ-CD包结物水溶液光二聚产物两种对映异构体组份相关产率与温度倒数的关系 (a) Plot of e.e. values vs. temperature and (b) Plot of ln[(100+%ee)/(100-%ee)] vs. T-1 |
| 表1 不同温度下N-P4-N@γ-CD包结物水溶液光照11 h的结果 The photodimerization of N-P4-N@γ-CDinclusion complex in aqueous solution under different temperature |
从图7b中直线的截距和斜率,可以计算得出微分活化焓ΔΔHb-a++= -2.48 kJ·mol-1,熵变的微分ΔΔSb-a++= -5.69 J·mol-1·K-1.ΔΔHb-a++表示生成两种对映异构体相应的焓变之差,ΔΔSb-a++表示相应的熵变之差(将手性HPLC分离图中先流出的组份命名为a,后流出的组份命名为b,则ΔΔHb-a++=ΔΔHb++-ΔΔHa++,ΔΔSb-a++=ΔΔSb++ -ΔΔSa++).因为ΔΔHb-a++与ΔΔSb-a++的符号相同,因此存在一个平衡温度T0,使得生成的组份a和组份b的量相等,此时光反应没有对映体选择性.在平衡温度T0时,有ΔΔG++=ΔΔHb-a++ -TΔΔSb-a++= 0,则T0=ΔΔHb-a++/ΔΔSb-a++=435.85 K.结果表明,N-P4-N@γ-CD包结物水溶液光二聚反应的对映体选择性在实验的温度区间内主要受焓变控制,表现出强的温度依赖性.只要实验的温度小于162.7 ℃,就有ΔΔG++=ΔΔHb-a++ -TΔΔSb-a++ <0,即生成的组份b的量大于组份a的量.光化学反应的立体化学几乎专一地由相关基态复合物(假设这些复合物进行光二聚反应的效率是具有可比较性的)的稳定性决定. 3 结论
γ-CD与双-2-萘甲酸三缩四乙二醇酯(N-P4-N)能够形成稳定的1∶1包结复合物.光照N-P4-N@γ-CD包结物水溶液,在实验的温度范围内只得到反式-头头类立方烷结构的分子内光二聚体.γ-CD的手性空腔,能够诱导N-P4-N光二聚反应的立体选择性,最高对映选择性达到20.4% e.e..
| [1] | a) Inoue Y, Ramamurthy V, et al. Chiral Photochemistry[M]. Marcel Dekker: New York, 2004. b) Ramamurthy V, Schanze K S, et al. Molecular and Supramolecular Photochemistry[M]. Marcel Dekker: New York, 2001. c) Peter J P. In: Neckers D C, Volman D H, Von Bünau G, eds. Advances in Photochemistry[M]. Vol. 21, John Wiley & Sons: New York, 1996. 135. |
| [2] | 童林荟. 环糊精化学—基础与应用[M]. 北京:科学出版社,2001. Tong L H. Chemistry of Cyclodextrin - Base and Application[M]. Beijing: Science Press, 2001. |
| [3] | a) Nakamura A, Inoue Y. Supramolecular catalysis of the enantiodifferentiating photocyclodimerization of 2-anthracenecarboxylate by γ-cyclodextrin[J]. J. Am. Chem. Soc., 2003, 123(4): 966-972. b) Nakamura A, Inoue Y. Electrostatic manipulation of enantiodifferentiating photocyclodimerization of 2-anthracenecarboxylate within γ-cyclodextrin cavity through chemical modification. Inverted product distribution and enhanced enantioselectivity[J]. J. Am. Chem. Soc., 2005, 127(15): 5338-5339. c) Yang C, Mori T, Origane Y, et al. Highly stereoselective photocyclodimerization of α-cyclodextrin-appended anthracene mediated by γ-cyclodextrin and cucurbit |
| [4] | a) Wu X L, Luo L, Lei L, et al. Highly efficient cucurbit[8]uril-templated intramolecular photocycloaddition of 2-naphthalene-labeled poly(ethylene glycol) in aqueous solution[J]. J. Org. Chem., 2008, 73(2): 491-494.b) Lei L, Luo L, Wu X L, et al. Cucurbit[8]uril-mediated photodimerization of alkyl 2-naphthoate in aqueous solution[J]. Tetrahedron Lett., 2008, 49(9): 1502-1505.c) Chen B, Cheng S F, Liao G H, et al. Efficient and selective photodimerization of 2-naphthalenecarbonitrile mediated by cucurbit[8]uril in an aqueous solution[J]. Photochem. Photobiol. Sci., 2011, 10(9): 1441-1444. |
| [5] | Lei L, Wu L Z, Wu X L, et al. Stereochemistry of a cubane-like photodimer of methyl 2-naphthoate[J]. Tetrahedron Lett., 2006, 47(27): 4725-4727. |
| [6] | a) Wu X L, Lei L, Wu L Z, et al. Synthesis, structure, and chirality of hydroxyl- and carboxyl-functionalized cubane-like photodimers of 2-naphthalene[J]. Tetrahedron, 2007, 63(15): 3133-3137. b) Liao G H, Luo L, Xu H X, et al. Formation of cubane-like photodimers from 2-naphthalenecarbonitrile[J]. J. Org. Chem., 2008, 73(18): 7345-7348. c) Luo L, Liao G H, Wu X L, et al. γ-Cyclodextrin-directed enantioselective photocyclodimerization of methyl 3-methoxyl-2-naphthoate[J]. J. Org. Chem., 2009, 74(9): 3506-3515. d) Luo L, Cheng S F, Chen B, et al. Stepwise photochemical-chiral delivery in γ-cyclodextrin-directed enantioselective photocyclodimerization of methyl 3-methoxyl-2-naphthoate in aqueous solution[J]. Langmuir, 2010, 26(2): 782-785. e) Xu H X, Chen B, Zhang L P, et al. Diastereodifferentiating photodimerization of alkyl 2-naphthoates with chiral auxiliaries[J]. Tetrahedron Lett., 2009, 50(35): 4965-4968. f) Xu H X, Chen B, Zhang L P, et al. Stereoselective photodimerization of alkyl 3-alkoxyl-2-naphthoates[J]. Tetrahedron Lett., 2011, 52(23): 2946-2949. g) 罗 林,王 锋,陈 彬,等. γ-环糊精诱导的2-萘甲酸酯光二聚反应[J]. 影像科学与光化学,2009, 27(6): 442-451. Luo L, Wang F, Chen B, et al. γ-Cyclodextrin-induced photocyclodimerization of alkyl 2-naphthoate[J]. Imaging Science and Photochemistry, 2009, 27(6): 442-451. |
| [7] | Conners K A. Binding Constants: The Measurement of Molecular Complex Stability[M]. New York: John Wiley & Sons. 1987. |
| [8] | a) Inoue Y, Yamasaki N, Yokoyama T, et al. Enantiodifferentiating Z-E photoisomerization of cyclooctene sensitized by chiral polyalkyl benzenepolycarboxylates[J]. J. Org. Chem., 1992, 57(5): 1332-1345. b) Inoue Y, Matsushima E, Wada T. Pressure and temperature control of product chirality in asymmetric photochemistry. Enantiodifferentiating photoisomerization of cyclooctene sensitized by chiral benzenepolycarboxylates[J]. J. Am. Chem. Soc., 1998, 120(41): 10687-10696. c) Asaoka S, Horiguchi H, Wada T, et al. Enantiodifferentiating photocyclodimerization of cyclohexene sensitized by chiral benzenecarboxylates[J]. J. Chem. Soc., Perkin Trans. 2, 2000, 4: 737-747. |




