近年来有机光功能材料研究飞速发展,大量具有特殊结构和功能的化合物被设计合成出来.六苯并蔻(Hexa-peri-hexabenzocoronene,HBC)是近年来被广泛关注的一类大平面盘状结构的化合物,分子含有42个碳原子,具有D6h对称性及大π共轭体系,被称为“超级苯”和最小的“石墨烯片段”. HBC分子的大共轭结构使分子间具有很强的π-π相互作用,导致该类分子在溶液、中间相态(液晶态)或固体中均容易形成柱状组装体[1,2],并具有较高的电荷迁移率,使其在光电功能材料中有潜在的应用前景[3,4,5,6,7].但HBC分子间的强相互作用导致化合物溶解性较差,因此在HBC外围修饰各种功能基团,不仅能够调节HBC的溶解性,有利于物化性质研究,而且还能扩展其功能[8,9,10,11,12].
树枝形聚合物是一类不同于传统聚合物的大分子,具有高度几何对称性、精确的分 子结构、外围链段和官能团随代数增加呈指数增长、分子量精确可控等特点,被广泛应用于多个研究领域[13,14]. 利用树枝形聚合物修饰六苯并蔻分子,了解其衍生物结构与性质之间的关系,同时为进一步的功能化提供末端修饰位点,将为发展功能化六苯并蔻衍生物提供实验基础,探索新的途径.
本工作设计合成了一系列外围修饰不同代数聚酰胺-胺树枝形聚合物(PAMAM)的六苯并蔻衍生物HBC-C6-PAMAM-Dm,化合物结构经过了1HNMR、13CNMR、IR和MALDI-TOF表征,利用吸收和荧光光谱研究了各化合物在溶液中的光谱性质. 1 实验部分 1.1 仪器及主要试剂
核磁共振谱图在Bruker AvanceΠ-400谱仪上测得,质谱测试采用Bruker Microflex (MALDI TOF),红外光谱由Varian Excalibur 3100光谱仪测得,吸收光谱用日本岛津公司UV-1601PC紫外-可见吸收光谱仪测定,荧光发射光谱由日本日立公司F-4500荧光光谱仪测定.
炔丙胺、乙二胺、丙烯酸甲酯、甲醇、二氯甲烷(CH2Cl2)、石油醚、正己烷、1,4-二氧六环和四氢呋喃(THF)、二甲基甲酰胺(DMF)、CH3NO2、Na2SO4、K2CO3、Na2S2O3、FeCl3、NaN3等试剂为国药集团北京化学试剂公司的分析纯或化学纯产品,其中反应用二氯甲烷使用前经CaH2干燥处理后蒸馏使用,乙二胺和丙烯酸甲酯使用前经过减压蒸馏提纯,1,4-二氧六环和四氢呋喃(THF)在金属钠存在下回流干燥后蒸馏. 1,2-二苯基乙炔、八羰基二钴、双(三氟乙酰氧基)碘苯、9-BBN、6-氯-1-己烯、PdCl2(dppf)为Alfa Aesar公司试剂.再生纤维素透析袋为北京瑞达恒辉科技发展有限公司产品. 1.2 HBC-C6-PAMAM-Dm的合成 1.2.1 HBC-C6-N3的合成
HBC-C6-N3按文献方法合成[15,①]. 具体合成路线如图1所示.
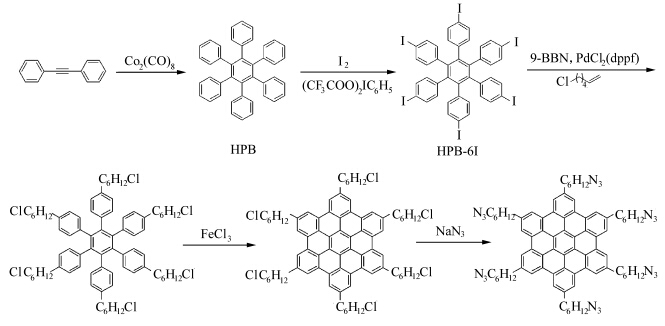 | 图1 HBC-C6-N3的合成路线图 Synthesis of HBC-C6-N3 |
六苯基苯(HPB): 在50 mL Schlenk反应瓶中加入3.5 g (19.7 mmol) 1,2-二苯基乙炔和50 mg (0.145mmol)八羰基二钴,重复冷冻抽真空-通氮气操作3次,在氮气氛围下加入30 mL新蒸1,4-二氧六环,搅拌回流反应24 h.停止搅拌后将反应液倒入水中,用二氯甲烷多次萃取,合并有机相,再用饱和食盐水和蒸馏水各洗涤3次. 有机相用无水Na2SO4干燥,浓缩后以石油醚/二氯甲烷(5/1)为洗脱剂柱层析(200—300目硅胶)分离,得到白色固体3.2 g,产率91.4%,m.p.:>350 ℃.
六(4-碘苯基)苯(HPB-6I): 避光条件下往50 mL二口瓶中加入262 mg (0.491 mmol)六苯基苯、707 mg (1.644 mmol)双(三氟乙酰氧基)碘苯、0.411 g(1.619 mmol)碘和20 mL新蒸二氯甲烷,通氮气15 min除氧,氮气保护下室温搅拌反应24 h.然后向 ①胡志国,朱新玲. 水溶性咪唑环类HBC衍生物的合成及性质研究(硕士论文). 新乡:河南师范大学,2006. 反应体系中加入20 mL正己烷,过滤得白色固体. 将固体溶于200 mL氯仿,分别用饱和硫代硫酸钠、饱和食盐水、水各洗涤三次. 有机相用无水Na2SO4干燥,浓缩后用乙醇重结晶得0.52 g白色固体,产率82.1%.m.p.: >350 ℃. 1HNMR (400 MHz,CDCl3): 7.26 (d,12H,J=8.4 Hz),6.48 (d,12H,J=8.4 Hz).
1,2,3,4,5,6-六[4-(氯己基)苯基]苯(HPB-C6-Cl): 在氮气保护下向200 mL干燥的Schlenk反应器加入50 mL (0.5 mol/L) 9-BBN的THF溶液和2.85 g (24 mmol)6-氯-1-己烯,重复冷冻抽真空-通氮气操作3次,室温搅拌反应12 h.然后用注射器向反应体系中加入12 ml (3 mol/L) K2CO3水溶液,搅拌30 min,再加入1.29 g (1 mmol) 六(4-碘苯基)苯(HPB-6I),0.22 g (0.3 mmol) PdCl2(dppf),在氮气保护下室温搅拌反应48 h.停止反应后用二氯甲烷萃取,用饱和食盐水、水各洗涤3次,无水Na2SO4干燥,过滤,浓缩后经硅胶(200—300目)柱层析分离提纯(石油醚/CH2Cl2=5/1),得淡黄色油状产品1.3 g,产率78%. 1HNMR (400 MHz,CDCl3):6.67 (d,J=8.1 Hz,12H),6.61 (d,J=8.1 Hz,12H),3.49 (t,J= 6.8 Hz,12H),2.35 (t,J=7.4 Hz,12H),1.78—1.65 (m,12H),1.48—1.31 (m,24H),1.18—1.10(m,12H).
2,5,8,11,14,17-六(氯己基)六-邻-苯并寇(HBC-C6-Cl):在250 mL三口瓶中加入500 mg (0.4 mmol) 1,2,3,4,5,6-六[4-(氯己基)苯基]苯和150 mL干燥二氯甲烷,通氮气15 min.滴加5 mL含有3.12 g (19.2 mmol) FeCl3的硝基甲烷溶液,室温搅拌反应12 h,在整个反应过程中保持通入氮气.加入150 mL甲醇猝灭反应,收集黄色沉淀,用甲醇洗涤固体多次,烘干固体得产物390 mg,产率79.3%. m.p.: >350 ℃. 1HNMR (400 MHz,CDCl3):8.48 (s,12H),3.62 (br s,12H),3.04 (br s,12H),2.09—1.58 (m,48H).
2,5,8,11,14,17-六(叠氮己基)六-邻-苯并寇(HBC-C6-N3): 在100 mL三口瓶中加入400 mg (0.32 mmol) HBC-C6-Cl和0.62 g (9.6 mmol) NaN3及50 mL二甲基甲酰胺,120 ℃下反应48 h. 用二氯甲烷萃取,水洗3次,无水MgSO4干燥,过滤后浓缩至大约10 mL,加入50 mL甲醇,析出黄色沉淀,过滤后烘干固体得黄色产物0.38 g,产率93%. m.p.: >350 ℃. 1HNMR (400 MHz,CDCl3):8.38 (s,12H),3.36 (br s,12H),3.00 (br s,12H),1.96—1.61 (m,48H). 1.2.2 PAMAM-Dm的合成
半代聚酰胺-胺树枝形聚合物根据文献方法合成[16],以炔丙胺为起始核心,通过Michael加成和酰胺化合成得到0.5、1.5和2.5代数PAMAM树枝形聚合物. 1.2.3 HBC-C6-PAMAM-Dm的合成
HBC-C6-PAMAM-Dm合成路线如图2所示. 通用合成操作如下: 将0.1 mmol HBC-C6-N3,1.8 mmol PAMAM-Dm,0.03 mmol Cu(PPh3)3Br,1.8 mmol N,N-二异丙基乙胺(DIPEA)和15 mL CHCl3置于50 mL Schlenk反应器中,重复冷冻抽真空-通氮气3次,反应液在50 ℃条件下无水无氧反应48 h.停止反应后浓缩至大约5 mL,加入10 mL甲醇,析出沉淀Cu(PPh3)3Br,将收集的滤液在甲醇中透析以除去过量的PAMAM-Dm和DIPEA,透析时间为2 d,每12 h换一次透析液. 提纯0.5、1.5、2.5代HBC-C6-PAMAM-Dm所用透析袋的截留分子量分别为1000、2000和7000,将透析后袋中残留物旋干得到产物HBC-C6-PAMAM-Dm[17,18].
 | 图2 HBC-C6-PAMAM-Dm合成路线 Synthesis of HBC-C6-PAMAM-Dm |
HBC-C6-PAMAM-D0.5: 产率93%. 1HNMR (400 MHz,CDCl3):8.65 (s,12H),7.48 (s,6H),4.40 (br s,12H),3.78 (br s,12H),3.60 (s,36H),3.12 (br s,12H),2.77 (br s,24H),2.46 (br s,24H),1.99 (br s,24H),1.64 (br s,12H),1.53 (br s,12H). 13CNMR (100 MHz,CDCl3) δ: 172.83,144.76,139.83,129.67,123.19,122.60,121.15,119.46,51.51,50.29,48.93,48.67,37.17,32.60,32.31,30.47,29.31,26.68. IR (KBr,cm-1) ν: 3448,2927,2852,1735,1620,1459,1438,1373,1261,1200,1050. MS (MALDI-TOF): calc. m/z 2635.4,found [M+Na]+:2658.3.
HBC-C6-PAMAM-D1.5: 产率90%. 1HNMR (400 MHz,CDCl3):8.99 (s,12H),7.58 (s,6H),7.09 (s,12H),4.39 (br s,12H),3.83 (br s,12H),3.61 (s,72H),3.59 (br s,12H),3.24 (br s,24H),2.79 (br s,24H),2.68 (br s,48H),2.55—2.27 (m,96H),2.01 (br s,24H),1.67 (br s,12H),1.55 (br s,12H). 13CNMR (100 MHz,CDCl3) δ: 173.07,172.17,144.04,139.76,130.43,129.66,122.71,122.
06,121.14,53.52,52.99,51.67,50.34,49.32,48.63,47.83,37.20,33.78,32.74,32.45,30.54,29.34,26.77; IR (KBr,cm-1) ν: 3446,2928,2853,1739,1644,1458,1436,1374,1262,1200,1050. MS (MALDI-TOF): calc. m/z 5036.8,found [M+H]+: 5037.7.
HBC-C6-PAMAM-D2.5: 产率91%. 1HNMR (400 MHz,CDCl3):9.04 (s,12H),7.73 (s,12H),7.64 (s,6H),7.05 (s,24H),4.41 (br s,12H),3.85 (br s,12H),3.68 (s,144H),3.47 (br s,12H),3.28 (br s,72H),2.86—2.65 (m,168H),2.55 (br s,72H),2.41 (br s,168H),2.00 (br s,24H),1.68 (br s,12H),1.57 (br s,12H). 13CNMR (100 MHz,CDCl3) δ: 172.50,171.78,171.72,143.20,140.70,130.09,129.03,123.57,122.35,121.79,52.94,52.42,52.02,51.09,49.79,49.42,
48.74,46.99,36.97,36.67,33.37,33.14,32.19,31.89,30.00,29.05,28.85,26.25; IR (KBr,cm-1) ν: 3427,2938,2843,1734,1651,1546,1438,1362,1257,1204,1045. MS (MALDI-TOF): calc. m/z 9839.5,found [M+H]+: 9840.5.
2 结果与讨论
2.1 HBC-C6-PAMAM-Dm的合成
HBC-C6-N3的合成如图1所示,首先在八羰基二钴催化剂的作用下,1,2-二苯基乙炔衍生物环三聚化反应生成六苯基苯(HPB),然后经过碘化反应,得到六(4-碘苯基)苯(HPB-6I). HPB-6I在钯试剂催化作用下和9-BBN活化的6-氯-1-己烯通过Suzuki偶联反应得到1,2,3,4,5,6-六[4-(氯己基)苯基]苯(HPB-C6-Cl). 反应中所用9-BBN及6-氯-1-己烯需大大过量,反应时间足够长以保证HPB-6I外围的6个碘反应完全. HPB-C6-Cl在三氯化铁的作用下发生氧化环化脱氢反应得到2,5,8,11,14,17-六(氯己基)六-邻-苯并蔻(HBC-C6-Cl),最后用NaN3将烷基链末端的氯原子取代得到HBC-C6-N3.
不同代数的单支PAMAM-Dm树枝形聚合物外围分别含2、4、8个酯基,外围酯基可以通过皂化、氨解等反应进一步官能化,而核心的炔基可以用于进一步的修饰反应. 树枝形聚合物溶于甲醇、二氯甲烷、四氢呋喃等有机溶剂,微溶于甲苯,不溶于水.
HBC-C6-N3在Cu+的催化作用下与PAMAM-Dm核心的炔基通过高效、方便的“点击”化学(Click Chemistry)反应得到HBC-C6-PAMAM-Dm.产物外围的PAMAM结构中的大量酰胺基团使产物具有很高的极性,使用柱层析会降低产物收率.考虑到反应产物与原料的分子量差别较大,我们在实验中利用透析的方法纯化产物,产物核磁图谱中没有观察到属于原料的峰,表明透析可以很好地纯化该系列化合物. 2.2 HBC-C6-PAMAM-Dm光物理性质研究
HBC-C6-PAMAM-Dm外围树枝形聚合物基团易溶于甲醇,但由于HBC结构不溶于甲醇并且分子间的相互作用很强,树枝形聚合物HBC-C6-PAMAM-Dm不溶于甲醇. 在甲苯中,只有0.5代HBC-C6-PAMAM-Dm有一定的溶解度,1.5和2.5代HBC-C6-PAMAM-Dm溶解度均很低. 不同代数的HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5)在四氢呋喃、乙腈和二氯甲烷中有较好的溶解度,因此,本工作中我们只讨论HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5)在四氢呋喃、乙腈和二氯甲烷中的光谱行为.
HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5)在四氢呋喃中的吸收光谱如图3a所示,各代化合物均在360 nm处呈现最大吸收,其中HBC-C6-PAMAM-D0.5的吸收光谱有较明显的精细结构,随代数增加,吸收光谱的精细结构逐渐消失,峰形变宽,HBC-C6-PAMAM-D2.5的吸收光谱已基本为无结构吸收峰.以360 nm的光激发在相同条件下测得化合物的荧光发射光谱,图3b为各代化合物在四氢呋喃中对激发波长归一化处理后的荧光光谱. HBC-C6-PAMAM-D0.5的荧光发射光谱有清晰的精细结构,其最大发射峰位置在487 nm处,随着分子内外围树枝形聚合物取代基代数的增加,化合物的荧光发射光谱明显变宽,精细结构清晰度程度降低,短波长区域发光减弱,而长波长区域的发光明显增加,HBC-C6-PAMAM-D0.5中为次强的495 nm处发射峰在HBC-C6-PAMAM-D2.5荧光光谱中成为最大发射峰.对比文献报道的HBC吸收和荧光发射光谱[19,20],可以判断测得的HBC-C6-PAMAM-Dm吸收和发光光谱均为HBC基团聚集态典型的吸收和荧光,浓度稀释实验表明,在1.6×10-6—5.3 ×10-8mol/L浓度范围内各代数化合物在四氢呋喃中均呈现聚集态光谱行为,更低浓度下仪器已无法得到可解析的信号.分析在很稀浓度下化合物仍呈现聚集态的原因应该是HBC基团之间有很强的相互作用,外围修饰的大量树枝形聚合物基团不能抑制分子间HBC基团的聚集,在测试浓度下化合物HBC-C6-PAMAM-Dm在四氢呋喃中达不到单分子分散的形式. HBC-C6-PAMAM-D0.5的吸收和荧光发射光谱相比更高代数化合物具有明显的精细结构,表明HBC基团在低代数化合物的聚集体中振动态更有序,能级分布更清晰,而高代数化合物外围树枝形聚合物的链段较多,在聚集体中围绕在HBC核心的周围,导致发色团振动能级不均匀化,发射峰精细结构减少,且长波长发光增加[20];此外,随着代数增加树枝形聚合物骨架在四氢呋喃中的溶解程度降低,使高代数化合物聚集体中外围聚酰胺-胺骨架紧密地围绕在核心HBC发色团的外围,导致树枝形聚合物骨架的振动与发色团的振动耦合增强,吸收和发射光谱呈无结构化展宽.相同条件下,我们测试了化合物在乙腈中的光谱性质,其光谱特征和变化趋势与四氢呋喃中相同,推测也是因为树枝形聚合物骨架在乙腈中的溶解能力随着代数增加逐渐降低,高代数化合物聚集体中树枝形聚合物骨架与发色团相互作用更强。
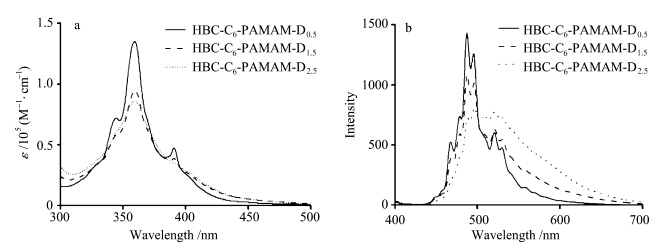 | 图3 HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5)在四氢呋喃中的吸收光谱(a)和 对激发波长处吸收归一化后的荧光光谱(b) Absorption spectra of HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5)(a)and emission spectra of HBC-C6-PAMAM-Dm (m=0.5,1.5,2.5) normalized to the absorbance at the excitation wavelength(b) in THF [HBC-C6-PAMAM-Dm] = 1.6×10-6 mol/L,λex=360 nm |
二氯甲烷对树枝形聚合物骨架的溶解能力比四氢呋喃和乙腈强,进一步测定了化合物HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5)在二氯甲烷中吸收和荧光发射光谱.图4为化合物对激发波长处吸收归一化后的荧光光谱,虽然不同代数的化合物均呈现HBC聚集态的发光,但发光光谱随外围树枝形取代基代数变化趋势与四氢呋喃和乙腈中略有不同,0.5代、1.5代和2.5代化合物的发光光谱均呈现明显精细结构,最大发射峰位置都在487 nm处,随着化合物代数增加,短波长区域发光只略微减弱,长波长区域发光逐渐增强,但增强幅度比在四氢呋喃和乙腈中要小.推测是因为二氯甲烷对发色团外围树枝形骨架的溶剂化作用较强,外围树枝形聚合物骨架振动弛豫对发色团影响较小.这也从另一角度验证了前面对四氢呋喃和乙腈中光谱的分析结果.
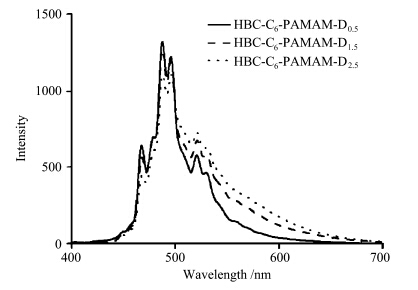 | 图4 HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5)在二氯甲烷中对激发波长处吸收归一化后的荧光光谱 Emission spectrum of HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5) normalized to the absorbance at the excitation wavelength in CH2Cl2 [HBC-C6-PAMAM-Dm] = 1.6×10-6mol/L,λex=360 nm |
合成了一系列聚酰胺-胺树枝形聚合物修饰的六苯并蔻化合物HBC-C6-PAMAM-Dm(m=0.5,1.5,2.5),研究了化合物在不同溶剂中的光谱性质.研究结果表明,HBC基团间强相互作用导致化合物HBC-C6-PAMAM-Dm在四氢呋喃、乙腈和二氯甲烷中均以聚集体形式存在.在四氢呋喃和乙腈中,随着树枝形聚合物代数增加化合物的光谱逐渐失去精细结构,短波长区域发光减弱,长波长区域发光增强,这是由于树枝形聚合物链段的增加导致发色团振动能级不均匀化,导致吸收和荧光光谱展宽和无结构化.二氯甲烷中,树枝形聚合物骨架的溶剂化作用较强,在聚集体中骨架与发色团振动耦合相对减弱,光谱变化幅度较四氢呋喃和乙腈中小.外围树枝形聚合物结构的修饰不仅可以改善六苯并蔻化合物在有机溶剂中的溶解度,还可以调整其聚集态的发光,为功能化六苯并蔻衍生物的发展提供了实验基础和新的途径.
| [1] | Fechtenkötter A, Saalwächter K, Harbison M A, Müllen K, Spiess H W. Highly ordered columnar structures from hexa-peri-hexabenzocoronenes—synthesis, X-ray diffraction, and solid-state heteronuclear multiple-quantum NMR investigations[J]. Angew. Chem. Int. Ed., 1999, 38(20):3039-3042. |
| [2] | Ito S, Wehmeier M, Brand J D, Kübel C, Epsch R, Rabe J P, M llen K. Synthesis and self-assembly of functionalized hexa-peri-hexabenzocoronenes[J]. Chem. Eur. J., 2000, 6(23):4327-4342. |
| [3] | van de Craats A M, Warman J M, Müllen K, Geerts Y, Brand J D. Rapid charge transport along self-assembling graphitic nanowires[J]. Adv. Mater., 1998, 10(1):36-38. |
| [4] | Bao Z, Lovinger A J, Dodabalapur A. Highly ordered vacuum-deposited thin films of metallophthalocyanines and their applications in field-effect transistors[J]. Adv. Mater., 1997, 9(1):42-44. |
| [5] | Adam D, Schuhmacher P, Simmerer J, Haussling L, Siemensmeyer K, Etzbachi K H, Ringsdorf H, Haarer D. Fast photoconduction in the highly ordered columnar phase of a discotic liquid crystal[J]. Nature, 1994, 371(6493):141-143. |
| [6] | Bushby R J, Lozman O R. Photoconducting liquid crystals[J]. Curr. Opin. Solid State Mater. Sci., 2002, 6(6):569-578. |
| [7] | Katz H E, Lovinger A J, Johnson J, Kloc C, Siegrist T, Li W, Lin Y Y, Dodabalapur A. A soluble and air-stable organic semiconductor with high electron mobility[J]. Nature, 2000, 404(6777):478-481. |
| [8] | Tang B Y, Ge J J, Zhang A, Calhoun B, Chu P, Wang H, Shen Z, Harris F W, Cheng S Z D. Liquid crystalline and monotropic phase behaviors of 2,3,6,7,10,11-hexa(4 -octyloxybenzoyloxy) triphenylene discotic molecules[J]. Chem. Mater,. 2000, 13(1):78-86. |
| [9] | Serrette A G, Swager T M. Controlling intermolecular associations with molecular superstructure: polar discotic linear chain phases[J]. J. Am. Chem. Soc., 1993, 115(19):8879-8880. |
| [10] | Lee M, Kim J-W, Peleshanko S, Larson K, Yoo Y-S, Vaknin D, Markutsya S, Tsukruk V V. Amphiphilic hairy disks with branched hydrophilic tails and a hexa-peri-hexabenzocoronene core[J]. J. Am. Chem. Soc., 2002, 124(31):9121-9128. |
| [11] | Wu J, Watson M D, Zhang L, Wang Z, Müllen K. Hexakis(4-iodophenyl)-peri-hexabenzocoronene- a versatile building block for highly ordered discotic liquid crystalline materials[J]. J. Am. Chem. Soc., 2003, 126(1):177-186. |
| [12] | Kastler M, Pisula W, Wasserfallen D, Pakula T, Müllen K. Influence of alkyl substituents on the solution and surface-organization of hexa-peri-hexabenzocoronenes[J]. J.Am.Chem.Soc., 2005, 127(12):4286-4296. |
| [13] | Grayson S M, Fréchet J M J. Convergent dendrons and dendrimers: from synthesis to applications[J]. Chem. Rev., 2001, 101(12):3819-3868. |
| [14] | 李 嫕, 张小辉, 曾 毅, 陈金平, 李迎迎. 光捕获树枝形聚合物体系能量传递和电子转移研究进展[J].影像科学与光化学, 2011, 29(4) : 246-269. LI Y, Zhang X H, Zeng Y, Chen J P, Li Y Y. Photoinduced electron/energy transfer within light-harvesting dendrimers[J]. Imaging Science and Photochemistry, 2011, 29(4):246-269. |
| [15] | Kenji Kobayashi, Norifumi Kobayashi, Masahiro Ikuta, Bruno Therrien, Shigeru Sakamoto, Kentaro Yamaguchi. Syntheses of hexakis(4-functionalized-phenyl)benzenes and hexakis benzenes directed to host molecules for guest-inclusion networks[J]. J. Org. Chem., 2005, 70(2): 749-752. |
| [16] | Tomalia D A, Baker H, Dewald J, Hall M E, Kallos G, Martin S, Roeck J, Ryder J, Smith P. A new class of polymers: starburst-dendritic macromolecules[J]. Polym. J., 1985, 17(1):117-132. |
| [17] | Lee J W,Kim H J,Han S C,Kim J H,Jin S H.Designing poly(amido amine) dendrimers containing core diversities by click chemistry of the propargyl focal point poly(amido amine) dendrons[J]. Journal of Polymer Science Part A: Polymer Chemistry, 2008, 46(3): 1083-1097. |
| [18] | Lee J W,Kim J H,Kim H J,Han S C,Kim J H,Shin W S,Jin S H. Synthesis of symmetrical and unsymmetrical PAMAM dendrimers by fusion between azide- and alkyne-functionalized PAMAM dendrons[J]. Bioconjugate Chemistry, 2007, 18(2): 579-584. |
| [19] | Fleming A J, Coleman J N, Dalton A B, Fechtenkotter A, Watson M D, Mullen K, Byrne H J, Blau W J. Optical spectroscopy of isolated and aggregate hexabenzocoronene derivatives: astudy of self-assembling molecular nanowires[J]. J. Phys. Chem. B, 2003, 107(1):37-43. |
| [20] | Feng X, Pisula W, Zhi L, Takase M, Müllen K. Controlling the columnar orientation of C3-symmetric "superbenzenes" through alternating polar/apolar substitutents[J]. Angew. Chem. Int. Ed., 2008, 47(9):1703-1706. |




