2. 中国科学院 研究生院, 北京 100049
2. Graduated University of Chinese Academy of Sciences, Beijing 100049, P. R. China
1,8-萘啶及其衍生物展现出了丰富的光物理性质、多样的配位能力、独特的生理活性,它们在众多领域有着广泛的应用.1,8-萘啶的发光波长在蓝光波段,其实用价值不大.近年来,人们对1,8-萘啶衍生物与配合物发光的研究逐渐增多,从而揭示了其丰富的光物理和光化学性质[1,2,3].另一方面,氟硼(BODIPY)染料是一类新型的高发射量子效率的荧光染料,由于其具有较高的荧光量子产率、摩尔消光系数、很好的光稳定性,因而氟硼类荧光分子探针的研究受到关注.目前,人们已经研究了基于吡咯甲基烯、酮类、吡啶甲基烯、亚酞菁、卟啉、偶氮苯以及其它大量的BODIPY类似物[4,5,6,7,8,9,10,11,12,13,14].但基于1,8-萘啶配体的BF2-化合物的研究却是出奇的少.我们实验室合成了第一个基于1,8-萘啶的双硼核BODIPY化合物[15],这为我们以后的工作提供了参考.本文中我们合成了萘啶上有氯原子的1,8-萘啶的双硼核BODIPY化合物,两个氯原子的存在为我们以后对化合物的修饰工作提供了可用的合成位点. 1实验部分
基于1,8-萘啶的双氟硼核化合物的合成路线如Scheme 1所示,在文献报道的基础上[16,17],我们对 H2L合成方法做了改进 [3,18].以氯仿为溶剂,与过量的三氟化硼/乙醚在有机碱2,6-二甲基吡啶的存在下加热反应.
依据参考文献[19,20,21,22]我们制备了化合物2-氨基-7-羟基-1,8-萘啶和2-氨基-7-氯-1,8-萘啶.
1,8-萘啶偶氮化合物(D)的合成[16,23]:将2-氨基-7-氯-1,8-萘啶(1.79 g,0.01 mol)的50 mL水溶液冰浴冷却至0—5 ℃后,缓慢滴加10%的NaClO水溶液80 mL,滴加完毕后混合物继续在冰浴条件下搅拌4 h.过滤,滤饼反复用蒸馏水淋洗,以除去多余的NaClO.干燥滤饼,硅胶柱分离,洗脱剂为二氯甲烷/甲醇(体积比为80:1),得到砖红色粉末1.06 g.产率:60%.m.p.: 294 ℃. 1HNMR (400 MHz,DMSO-d6): δ=8.52 (d,J=8 Hz,2H),8.21 (d,J=8 Hz,2H),7.83(d,J=4 Hz,2H),7.42 (d,J=4 Hz,2H). 13CNMR (DMSO-d6): 159.3,147.2,141.2,139.5,132.2,123.2,120.7. ESI-MS: m/z 355[M+1]+,377[M+Na]+.

Scheme 1
1,8-萘啶偶氮还原衍生物( H2L)的合成[15]:氮气条件下,将1,8-萘啶偶氮化合物D(3.54 g,0.01 mol)溶于90 mL冰醋酸中,加热至70 ℃搅拌2 d,冷却至室温,冰浴条件下用浓氨水调节pH至弱碱性,二氯甲烷萃取,合并有机相.无水Na2SO4干燥后,硅胶柱分离,洗脱剂:氯仿/甲醇(体积比为50∶1),得到亮红色粉末2.31 g.产率:65%. m.p.: 312 ℃. 1HNMR (400 MHz,DMSO-d6): 9.78 (s,2H),8.21 (d,J=8 Hz,2H),8.15 (d,J=8 Hz,2H),7.15 (d,J=8 Hz,2H),7.30 (d,J=8 Hz,2H). 13CNMR (DMSO-d6): 164.7,148.9,147.2,137.8,133.2,127.9,116.7,113,9. ESI-MS: m/z 357[M+1]+,379[M+Na]+.
双硼核化合物( C1)的合成[16]:氮气条件下,将 H2L (0.36 g,0.001 mol) 溶于30 mL除水氯仿中,室温缓慢滴加BF3·Et2O (4 mL),滴加完毕后升温至回流,快速一次加入4 mL 2,6-二甲基吡啶,继续反应3 h,用氯仿萃取.合并有机相,旋干,硅胶柱层析分离,洗脱剂二氯甲烷,得到黄色油状粗产品.二氯甲烷/正己烷重结晶后得亮黄色粉末0.09 g,产率:20%.用自然挥发的方法培养晶体,在二氯甲烷中长出黄色块状晶体.m.p.: 346 ℃. 1HNMR (400 MHz,DMSO-d6): 8.53 (d,J=4 Hz,2H),8.50 (d,J=4 Hz,2H),7.88 (d,J=8 Hz,2H),7.35 (d,J=8 Hz,2H).13CNMR (DMSO-d6): 166.2,161.9,148.2,139.3,127.9,117.7,114,5. MALDI-TOF-MS,CCA: m/z 453[M+1]+,475[M+Na]+.
X-ray单晶测试及晶体结构分析:衍射数据室温条件下以Mo Kα(λ=0.071073 nm)为单色器在Rigaku R-AXIS RAPID IP X-ray单晶衍射仪和Bruke SMART CCD X-ray单晶衍射仪上收集.吸收校正通过ABSCOR程序[24],或通过半经验法校正.结构解析直接通过SHELXS 97程序[25],结构精修用SHELXL 97程序[26],非氢原子通过各向异性精修,而氢原子由理论计算加入.通过deposit@ccdc.cam.ac.uk申请了单晶 C1的CCDC号为880562.
电子吸收光谱和发射光谱的测量:电子吸收光谱及发射光谱分别在Hitachi U-3010分光光度计及Hitachi F-4500荧光光谱仪上测量.液体样品用1×1 cm2石英比色皿,而固体样品用石英管. 2 结果与讨论 2.1 晶体结构研究
图1 在实验中用自然挥发的方法得到 C1的浅黄色晶体.在 C1的分子结构中,硼核的引入使得整个分子中心形成两个新的CN3B五元杂环(图 1).在 C1的晶胞中有两个完整的分子,这两个分子通过C6-H6…F1氢键连接在一起,并且沿着b轴在同一平面中(图 2).化合物 C1的晶胞参数和选择的键长键角分别列在表1和表2.
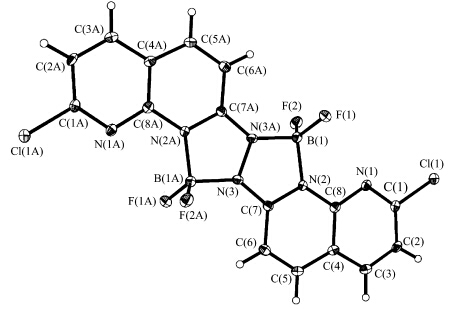 | 图1 化合物 C1的晶体结构 Crystal structure of complex C1 |
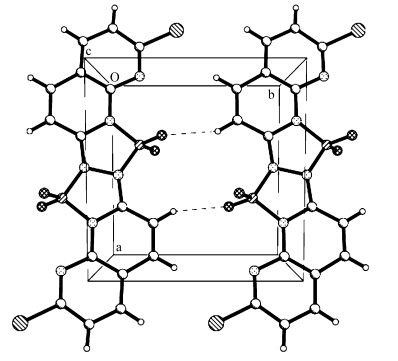 | 图2 化合物 C1的晶胞 The cell of C1 |
| 表1 化合物 C1的X-射线衍射参数 X-ray crystallographic data for C1 |
| 表2 化合物 C1的键长键角 Selected bond lengths (Å) and angles (°) for C1 |
在 C1的分子结构(图 1)中,以B核为中心的键F—B(0.1370 nm)和N—B(0.1570—0.1577 nm)在键长范围内[24,25,26,27,28].N3—N3A,N3—C7和N2—C7的平均键长分别为0.1405,0.1330和0.1362 nm,没有明显的单、双键区分,这表明分子内的π电子离域于中心两个五元环及周围两个1,8-萘啶环之间.由于BF2核替换了原 H2L中的分子内氢键,使得分子的刚性增加.BF3·Et2O配位后生成的新键B—N,一个是共价键B(1)—N(3) 0.157(4) nm,一个是配位键N(2)—B(1) 0.1577(4) nm,但由于整个分子处于共轭状态,π电子离域于整个分子,使得两个B—N键均匀化.F(2)—B(1)—F(1)、F(2)—B(1)—N(3)、F(1)—B(1)—N(3)、F(2)—B(1)—N(2)、F(1)—B(1)—N(2)及N(3)—B(1)—N(2)的键角分别为111.6(3)°、111.8(3)°、111.8(2)°、112.3(3)°、113.7(3)°和94.7(2)°, 这些数据表明B的配位构型为畸变的四面体.相邻两分子间通过双重C6-H6…F1氢键连接(见图3),沿着b轴一维链生长,并且所有的分子都在一个平面上,这些链之间又通过C3-H3…F1和C3-H3…F2氢键形成成三维网格(见图 4).
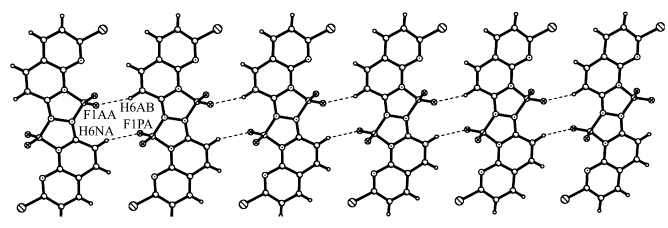 | 图3 化合物 C1通过C6-H6…F1氢键形成沿b轴的一维链 1D chain of C1along b axis formed by double C6-H6…F1 hydrogen bonds |
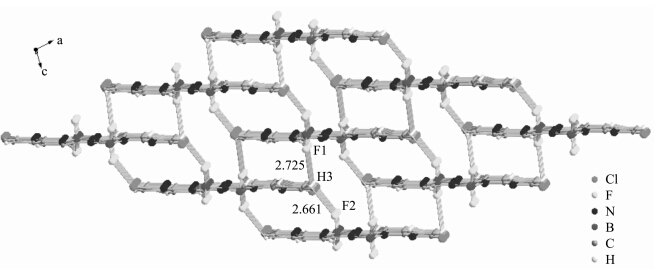 | 图4 C1的一维链通过氢键连接形成三维网状结构 3D network structure of C1 through C3-H3…F1 and C3-H3…F2 hydrogen bonds |
化合物 H2L在二氯甲烷中的特征吸收峰在402 nm、426 nm、452 nm、482 nm、518 nm,当引入硼核后,吸收蓝移约60 nm(图 5).这是由于 H2L与BF2配合之后HOMO和LUMO轨道能差增大,导致了配合物 C1的紫外吸收光谱较 H2L的产生了蓝移[25].
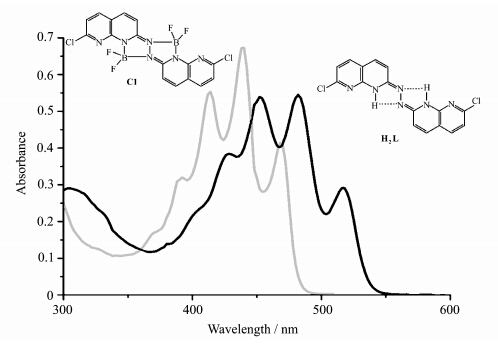 | 图5 化合物 H2L和 C1在二氯甲烷中的紫外光谱 UV-Vis absorption spectra of complex H2Land C1in CH2Cl2 |
在二氯甲烷中,H2L在350 nm处的吸收随着甲醇量的增加逐渐增强,同时在402 nm、426 nm、452 nm、482 nm、518 nm吸收强度逐渐降低.这是由于在强极性的质子性溶剂中,分子内氢键被破坏而与甲醇形成分子间氢键,破坏了分子的共平面[29].
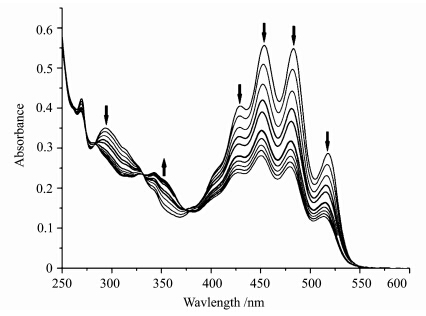 | 图6 化合物 H2L在二氯甲烷中随甲醇加入吸收光谱的变化 UV-Vis spectra change of H2L in CH2Cl2(2×10-5 mol/L) with the addition of MeOH |
我们测试了Hg2+、Fe2+、Na+、Fe3+、Cu2+、Ca2+、Mn2+、Mg2+、Cd2+、Zn2+金属离子的高氯酸盐对化合物 H2L吸收光谱的影响(图7).以 H2L在甲醇中的最大特征吸收峰(λmax=500 nm)的强度(0.038)为基准,用加入金属离子后吸收峰强度的增加值与0.038的比值(表 3)作图.结果表明Hg2+或Zn2+对 H2L吸收的恢复效果最明显,其光谱变化如图8所示,这可能是由于Hg2+或Zn2+更易于与 H2L配位[15].
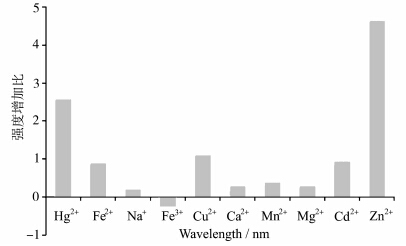 | 图7 金属离子对化合物 H2L吸收光谱的影响 Influence of metal ions on the absorption spectra of H2L |
氟硼化合物 C1在甲醇中的吸收和发射光谱如图9所示,从图中可以看出 C1的吸收峰特征在350 nm—600 nm,其最大吸收峰出现在440 nm;而相应的发射峰出现在478 nm和512 nm处,550 nm和600 nm有小肩峰,其总的荧光量子产率达到92%.相比之下,配体 H2L在二氯甲烷溶液中的最大发射波长位于571 nm处,荧光量子产率仅为0.008.BF2核配位后,由于B—N的作用,固定了分子的共轭体系,阻止H2L内N—N单键的自由旋转,从而减小能量损失.因此,配体 H2L和BF2核配位后,激发态的能量极大程度地以光的形式释放出来,回到基态,所以配体与BF2配位后荧光量子产率增长了100多倍.
| 表3 加入金属离子后吸收峰强度的增加值 After adding metal ions,added value of the absorption peak intensity |
 | 图8 金属离子(Hg2+,Zn2+)对 H2L紫外光谱的影响 The influence of metal ions on the the H2LUV spectrum |
我们采用稀溶液比较法测量荧光量子产率,具体方法如下:配合物在溶液中量子产率和发光寿命在测定前均经过通氮除气.发光量子产率的测定是根据Crosby方法[5],方程如下:
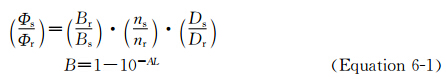
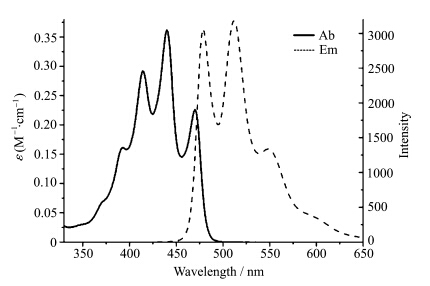 | 图9 化合物 C1在甲醇中的吸收和发射光谱 Absorbance and emission of C1in CH3OH |
我们合成了一个配体( H2L)和一个双硼核的化合物( C1),并对 C1晶体结构进行表征.研究结果表明 H2L主要通过分子内的氢键构成五元环来稳定分子结构,极性溶剂及金属离子对 H2L的光谱影响较大.而 C1通过 H2L和BF2的配位形成稳定的刚性构架,极大地提高了发光量子产率.
| [1] | Matveeva A G, Lemport P S, Pasechnik M P, Aysin R R, Leites L A, Nifantev E E. Coordination of 2-phosphorylalkyl-substituted 1, 8-naphthyridines in complexes with lanthanide nitrates[J]. Russ. Chem. B., In. Ed., 2009, 58(7): 1416-1422. |
| [2] | Chen Y, Zhao X J, Gan X, Fu W F. Zinc(Ⅱ) complexes with 1,8-naphthyridine-based ligand: crystal structures and luminescent properties[J].Inorg. Chim. Acta, 2008, 361: 2335-2342. |
| [3] | Boens N, Leen V, Dehaen W. Fluorescent indicators based on BODIPY[J]. Chem. Soc. Rev., 2012, 41: 1130-1172. |
| [4] | Loudet A, Burgess K. BODIPY dyes and their derivatives: syntheses and spectroscopic properties[J]. Chem. Rev., 2007, 107: 4891-4932. |
| [5] | Ulrich G, Ziessel R, Harriman A. The chemistry of fluorescent bodipy dyes: versatility unsurpassed[J]. Angew. Chem., Int. Ed., 2008, 47(7):1184-1201. |
| [6] | Nagai A, Kokado K, Nagata Y, Arita M, Chujo Y. Highly intense fluorescent diarylboron diketonate[J]. J. Org. Chem., 2008, 73(21): 8605-8607. |
| [7] | Maeda H, Mihashi Y, Haketa Y. Heteroaryl-substituted C3-bridged oligopyrroles: potential building subunits of anion-responsive π-conjugated oligomers[J]. Org. Lett., 2008, 10(15): 3179-3182. |
| [8] | Zhang G, Lu J, Sabat M, Fraser C L. Polymorphism and reversible mechanochromic luminescence for solid-state difluoroboron avobenzone[J]. J. Am. Chem. Soc., 2010, 132(7): 2160-2162. |
| [9] | Poon C T, Lam W H, Wong H L, Yam V W W. A versatile photochromic dithienylethene-containing β-diketonate ligand: near-infrared photochromic behavior and photoswitchable luminescence properties upon incorporation of a boron(III) center[J]. J. Am. Chem. Soc., 2010, 132(40): 13992-13993. |
| [10] | Stefane B. Selective addition of organolithium reagents to BF2-chelates of β-ketoesters[J]. Org. Lett., 2010, 12(13): 2900-2903. |
| [11] | Kubota Y, Tsuzuki T, Funabiki K, Ebihara M, Matsui M. Synthesis and fluorescence properties of a pyridomethene- BF2 complex[J]. Org. Lett., 2010, 12(18): 4010-4013. |
| [12] | Hayashi S, Inokuma Y, Osuka A. Meso-tris(oligo-2,5-thienylene)-substituted subporphyrins[J]. Org. Lett., 2010, 12(18): 4148-4151. |
| [13] | Yoshino J, Kano N, Kawashima T. Synthesis of the most intensely fluorescent azobenzene by utilizing the B—N interaction[J]. Chem. Commun., 2007: 559-561. |
| [14] | Job A, Wakamiya A, Kehr G, Erker G, Yamaguchi S. Electronic tuning of thiazolyl-capped π-conjugated compounds via a coordination/cyclization protocol with B(C6F5)3[J]. Org. Lett., 2010, 12(23): 5470-5473. |
| [15] | Fu W F, Li H F J, Wang D H. A novel Kolbe reaction pathway for a selective one- and two-electron reduction of azo compounds[J]. Chem. Commun., 2009, 5524-5526. |
| [16] | Bröring M, Krüger R, Link S. Bis(BF2)-2, 2'-bidipyrrins (BisBODIPYs): highly fluorescent BODIPY dimers with large stokes shifts[J]. Chem. Eur. J., 2008, 14(10): 2976-2983. |
| [17] | Ono K, Hashizume J, Yamaguchi H, Tomura M, Nishida J, Yamashita Y. Synthesis, crystal structure, and electron-accepting property of the BF2 complex of a dihydroxydione with a perfluorotetracene skeleton[J]. Org. Lett., 2009, 11(19): 4326-4329. |
| [18] | Launary J P, Tourrel-Pagis M, Lipskier J F. Control of intramolecular electron transfer by a chemical reaction. The 4,4'-azopyridine/1,2-bis(4-pyridyl)hydrazine system[J]. Inorg. Chem., 1991, 30(5):1033-1038. |
| [19] | Chen Y, Fu W F, Li J L, Zhao X J, Ou X M. Conformation impact on spectral properties of bis(5,7-dimethyl-1,8-naphthyridin-2-yl)amine and its Zn-II complex[J]. New J. Chem., 2007, 31(10): 1785-1788. |
| [20] | Chen Y, Chen J S, Gan X, Fu W F. Dinuclear copper(Ⅰ) complexes containing diimine and phosphine ligands: synthesis, copper-copper separation and photophysical properties[J]. Inorg. Chim. Acta, 2009, 362(7): 2492-2498. |
| [21] | Zuo J L, Fu W F, Che C M, Cheung K K. Synthesis, crystal structure, and photoluminescent properties of a tetracarbonyl(naphthyridylearbamoyl) rhenium(I) complex and a highly emissive tetracarbonyl (naphthyridylamido) rhenium(I) complex[J]. Eur. J. Inorg. Chem., 2003, 2: 255-262. |
| [22] | Sadhukhan N, Bera J K. Mixed-metal assemblies involving ferrocene -naphthyridine hybrids[J]. Inorg. Chem., 2009, 48(3): 978-990. |
| [23] | Brown E V, Granneman G R. Cis-trans isomerism in the pyridyl analogs of azobenzene.A kinetic and molecular orbital analysis[J]. J. Am. Chem. Soc., 1975, 97(3): 621-627. |
| [24] | Yang Y, Su X, Carroll C N, Aprahamian I. Aggregation-induced emission in BF2-hydrazone (BODIHY) complexes[J]. Chem. Sci., 2012, 3: 610-613. |
| [25] | Li H F J, Fu W F, Li L, Gan X, Mu W H, Chen W Q, Duan X M, Song H B. Intense one- and two-photon excited fluorescent bis(BF2) core complex containing a 1,8-naphthyridine derivative[J]. Org. Lett., 2010, 12(13): 2924-2927. |
| [26] | McDonnell S O, OShea D F. Near-infrared sensing properties of dimethlyamino-substituted BF2-azadipyrromethenes[J]. Org. Lett., 2006, 8(16): 3493-3496. |
| [27] | Yamaguchi S, Akiyama S. Kohei Tamao. Tri-9-anthrylborane and its derivatives: new boron-containing π-electron systems with divergently extended π-conjugation through boron [J]. J. Am. Chem. Soc., 2000, 122(26): 6335-6336. |
| [28] | Camerel F, Bonardi L, Schmutz M, Ziessel R. Highly luminescent gels and mesogens based on elaborated borondipyrromethenes[J]. J. Am. Chem. Soc., 2006, 128(14): 4548-4549. |
| [29] | Chen Y, Fu W F, Li J L, Zhao X J, Ou X M. Conformation impact on spectral properties of bis(5,7-dimethyl-1,8-naphthyridin-2-yl)amine and its ZnⅡ complex [J]. New J. Chem., 2007, 31: 1785-1788. |




