2. 东华大学 化学化工与生物工程学院, 上海 201620
2. College of Chemistry, Chemical Engineering and Biotechnology, Donghua University, Shanghai 201620, P. R. China
纳米技术作为一门高新技术,近年来在医学、药学、化学、材料学、生命科学等相关领域,尤其是在癌症的早期诊断和治疗方面引起了人们广泛的重视和极大的兴趣.目前,纳米技术已经被成功用于药物传递、癌症的靶向诊断和治疗、分子手术和医学成像等生物医学领域的诸多方面.同时,由于纳米技术在疾病的监测、控制、预防、诊断和治疗等方面得到广泛应用而逐渐形成了一个新兴的研究领域——纳米医学(Nanomedicine)[1,2] .作为纳米医学的一个分支,基于树状大分子(Dendrimers)的分子影像学成为一个新型的纳米医学材料研究方向,引起了科研人员的广泛关注,近年来获得了较大的发展.
树状大分子(Dendrimer)由希腊语“dendra”和“mer”衍生而来(dendra=tree,mer=part),也有用“arborls”或“cascade”来表示树状大分子的[3].1978年Flory等人首次提出由多官能度单体(ABn,n>1,A、B为可反应基团)通过不连续的聚合来制备超支化聚合物的可能性[4,5] .这一发现促使研究者尝试合成具有类似结构或者更加复杂结构的超支化聚合物分子,并希望这种结构更加复杂的物质能够产生精确的分子识别功能.直到20世纪70—80年代,人们才开始深入研究具有树枝状结构的物质.树状大分子是通过支化单元(如多功能基单体)逐步重复反应得到的具有树状高度支化结构的大分子.它具有非常规整、精致的结构,分子的体积、形状及功能基团都可以精确控制,因而是单分散性的.典型的高代数树状大分子为球状,其分子尺寸突破了传统有机小分子的界限,由于球形结构具有丰富的空腔,为搭载一些活性分子提供了可能.因此,在生物医学领域为了充分利用树状大分子这一独特的结构特点,使用的一般是高代数(n ≥ 4)的树状大分子.
分子影像学是20世纪末由分子生物学和医学影像技术、化学、物理学、放射医学、核医学以及计算机科学相结合而逐渐发展成的一门新兴学科.1999年,Weissleder[6]最早提出分子影像学(molecular imaging,MI)的概念,即应用影像学的方法对活体状态下的生物过程在细胞和分子水平进行定性和定量研究,主要是以体内特定分子作为成像对比度源,以体内特异性细胞或分子作为成像及治疗的作用位点,利用现有的一些医学影像技术在不干扰机体生理条件下对机体内部生理或病理过程在分子水平上进行无损伤的、实时的成像.分子影像学是分子生物学技术和现代医学影像学相结合的产物,由精密的成像技术检测机体的生理和病理变化过程,再通过一系列的图像后处理技术,达到显示活体组织在分子和细胞水平上的生物学过程的目的.
CT成像是利用不同的组织或器官由于自身不同的密度与厚度,对X-射线产生不同程度的衰减作用,从而形成不同组织或器官的灰阶影像对比分布图,进而以病灶的相对位置、形状和大小等的改变来判断病情的医学成像方法.CT成像技术具有空间分辨率高、图像采集时间短、可整体成像的优点,同时,所需费用较磁共振成像(MRI)低廉,在临床检测中发挥着非常重要的作用.但是,CT成像技术也存在一些不足之处亟需解决[7,8] ,如对软组织分辨率差、检测过程中存在放射性辐射等问题.而Micro-CT的出现,极大地克服了软组织分辨率差的缺陷.同时,利用CT成像自身的优点,配合使用相应的检测设备,研发多功能化的CT成像技术具有广阔的应用前景.
目前临床上应用的CT造影剂主要为含碘的小分子化合物,包括有机碘和无机碘小分子化合物(如泛影酸Diatrizoic acid (DTA)、碘海醇Omnipaque等,如图1)[9].然而,由于肾脏对含碘小分子造影剂的快速清除效应,含碘化合物只有非常短的成像时间,并且它对肾脏具有一定的毒副作用[10].因此纳米材料的发展为解决这一问题提供了新的思路和方法.
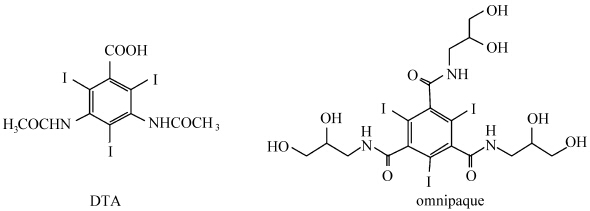 | 图1 泛影酸和碘海醇的分子结构式 The molecular structures of diatrizoic acid (DTA) and omnipaque |
近年来的研究也证实,基于纳米颗粒的CT造影剂能够有效地延长成像时间,减弱对肾脏的毒副作用,并具备较好的造影效果,如纳米金颗粒和纳米银颗粒等CT造影剂等已引起了科研工作者广泛的关注.树状大分子作为纳米平台既可修饰小分子含碘造影剂[11 ,12,13],又可作为模板包裹和稳定不同的无机纳米颗粒,提高造影剂的血液循环时间,使其更好地用于CT成像[14,15,16,17,18]. 1 基于树状大分子的碘造影剂的研究进展
2002年,Yordanov等[11]报道了将一种小分子碘化合物(3-N-[(N′,N′-dimethylaminoacetyl)amino]-α-ethyl-2,4,6-triiodobenzenepropanoic acid,DMAA-IPA)共价偶联到末端为氨基的第四代聚酰胺-胺树状大分子(G4 PAMAM)上形成树状G4-(DMAA-IPA)37 碘造影剂,并首次将该种造影剂用于CT成像研究.G4-(DMAA-IPA)37纳米尺寸半径为2.4 nm,其中碘的质量分数高达33.06%,且水溶性好,具有良好的CT成像效果.2005年,Yordanov等[12] 深入研究了上述G-4-(DMAA-IPA)37造影剂的X-射线衰减特性,结果显示随着碘浓度的增加,其X-射线衰减系数呈线性增加,表明G4-(DMAA-IPA)37能够作为优良的造影剂用于CT成像.
2006年,Fu等[13]将聚乙二醇(Polyethylene Glycol,简称PEG)为核心形成的聚赖氨酸树状大分子作为CT造影剂的载体,末端再共价偶联碘分子化合物,形成基于聚赖氨酸树状大分子的含碘造影剂PEG12000-Gen4-IOB.这种聚赖氨酸树状大分子螯合碘的数量随着其代数的增加而呈倍数的增加,使其可作为血池造影剂用于血池造影成像.该种方法制备的造影剂经小鼠尾静脉注射后,通过CT扫描表明,基于聚赖氨酸树状大分子的含碘造影剂PEG12000-Gen4-IOB在增强血管CT信号的同时,有效地延长了造影剂的血液代谢时间,是一种很有潜力的CT造影剂. 2 基于树状大分子的金属纳米颗粒CT造影剂的研究进展
目前有许多文献报道用树状大分子作为模板或稳定剂来包裹稳定纳米金属颗粒形成树状大分子包裹的纳米颗粒(Dendrimer-entrapped nanoparticles,简称DENPs) [14,15,16,17,18,19,20,21,22,23,24,25,26,27,28]和树状大分子稳定的纳米颗粒(Dendrimer-stabilized nanoparticles,简称DSNPs)[29,30,31,32,33,34,35,36,37,38,39],但将其作为造影剂用于CT成像的文献报道相对较少[14,15,16,17,18,19,20,21,22,23,24,25,26,27,28].用树状大分子包裹纳米金属颗粒,其优点主要有:(1)在包裹前后,树状大分子的表面通过多功能化修饰(如可以修饰荧光试剂、靶向试剂和小分子造影剂),可以提高纳米复合材料的生物相容性;(2)纳米粒子的尺寸和形貌可以通过改变还原剂的强弱和树状大分子与金属的摩尔比而得到控制;(3)树状大分子在肿瘤细胞的微酸环境下很稳定,不会因发生降解而影响纳米颗粒的稳定性[19-23, 34-36].因此,此类课题的研究具有广阔的发展前景.
2010年,Guo等[15]首次利用末端为氨基的第五代PAMAM(G5 PAMAM)树状大分子为模板,G5 PAMAM与HAuCl4以不同的摩尔比(1∶25, 1∶50, 1∶75, 1∶100, 1∶125, 1∶150, 1∶175和1∶200),通过硼氢化钠NaBH4原位还原氯金酸HAuCl4的方法制备了直径为2—4 nm的树状大分子包裹的金纳米颗粒(Au DENPs),并成功地将制备的Au DENPs用于生物体的CT成像研究.相关测试表明,在Au DENPs中Au和Omnipaque中的碘在相同浓度时,前者具有更高的X射线衰减系数、更好的血池造影效果和更长的血池造影时间(见图2[15]).
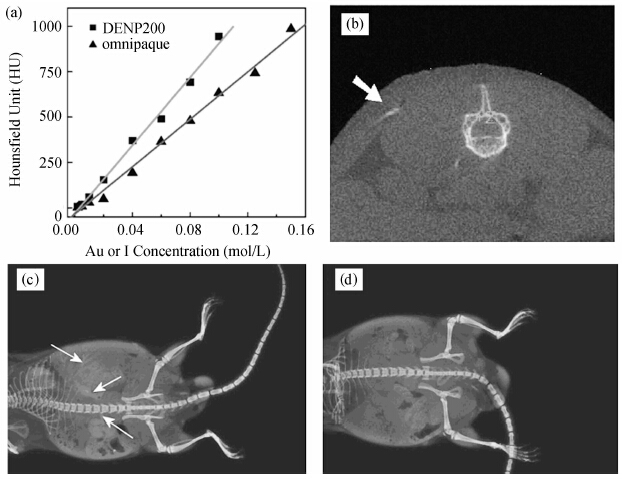 | 图2 (a) Au DENPs和omnipaque的X射线衰减系数对比图;(b) Au DENPs在小鼠皮下注射后的CT成像图; (c) Au DENPs经小鼠尾静脉注射后的CT成像图;(d) omnipaque(I的摩尔浓度与c图中Au相同) 经小鼠尾静脉注射后的CT成像图[15] (a) X-ray attenuation (HU) of Au DENPs and omnipaque as a function of the molar concentration of active element (Au or iodine), (b) CT image of a mouse with 10 μL of Au DENPs (0.02 mol/L) subcutaneously injected into its back, (c) X-ray CT image of a mouse 2 min post tail vein injection of acetylated Au DENPs, (d) X-ray CT image of a mouse 2 min post tail vein injection of omnipaque with an iodine concentration equal to Au[15] |
为了克服树状大分子表面氨基的毒性和非特异性,2011年,Peng等[16]将上述合成的Au DENPs末端氨基乙酰化后形成[(Au0)n-G5.NHAc]DENPs,并研究了所制备材料的X-射线衰减特性,考察了乙酰化的Au DENPs在小鼠体内的CT成像效果.实验结果表明,分别在两只小鼠尾静脉注射乙酰化的[(Au0)50-G5.NHAc] DENPs (图3a[16])和omnipaque造影剂(图3b[16]) 2 min之后,前者能够清楚地观察到小鼠的肺静脉 (图3a所示箭头和圆环区域)和下腔静脉(图3a所示白色平行直线显示区域) CT信号明显增强,而后者由于已经被肾脏代谢掉,其小鼠在相同位置处没有CT信号(图3b).这些结果表明,乙酰化的Au DENPs显示了更强的X-射线衰减特性和更长的成像时间,是一种很有潜力的CT造影剂.2011年,Wang等[18]将上述乙酰化的Au DENPs进一步用于SPC-A1肺癌肿瘤模型的CT成像诊断,结果表明,腹腔静脉注射的乙酰化的Au DENPs在注射后6 h时,在肿瘤组织内由于肿瘤部位的高通透性和滞留效应(Enhanced Permeability and Retention Effect,简称EPR效应)出现了局部的富集,实现了对肿瘤组织的CT成像诊断的初步目标.
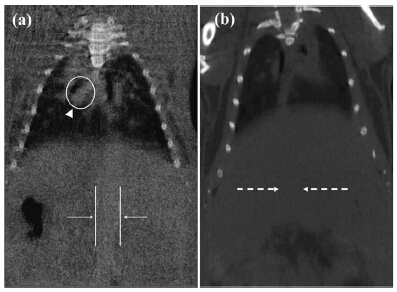 |
图3 (a) 静脉注射[(Au0)50-G5.NHAc] DENPs (500 μL,[Au]=0.1 mol/L) 2 min 之后小鼠体内X-射线CT 图片;
(b) 静脉注射omnipaque ([I] =Au DENPs 的[Au]) 2 min之后的小鼠体内CT图片[16] a中箭头和圆环区域指向肺静脉,白色平行直线显示下腔静脉;b中虚线箭头指向CT无法探测出来的下腔静脉[16] CT image of a mouse intravenously injected with 500 μL of (a) [(Au0)50-G5.NHAc] DENPs ([Au]=0.1 mol/L) and (b) omnipaque ([I] =0.1 mol/L) through tail vein[16] In part a, the white arrowhead and the white circle indicate the mouse’s pulmonary veins,and the white arrows and white lines point to the inferior vena cava of the mouse.In part b, the white dotted arrows point to the inferior vena cava of the mouse, which was undetectable in the CT image[16] |
2010年,Kojima等[40]将金离子螯合在聚乙二醇(PEG)修饰的G5 PAMAM树状大分子溶液中,利用形成的聚乙二醇化的G5 PAMAM树状大分子包裹的金纳米颗粒作为金种子,再进一步螯合更多的Au离子,加入抗坏血酸还原长成更大的金纳米颗粒.体外实验表明,随着金纳米颗粒变大,其X-射线吸收系数也变大.当树状大分子包裹的纳米金粒子长到最大(8 nm)时,金纳米颗粒的X射线吸收系数与商业化的碘帕醇(iopamidol)的X-射线吸收系数相近.将上述金纳米颗粒和碘帕醇分别注射到不同小鼠体内,并在不同时间进行CT扫描.结果表明, PEG化的G5 PAMAM树状大分子包裹的金纳米颗粒可作为血池造影剂用于血池成像,相对于传统小分子碘帕醇,其CT信号更清晰,血液循环时间更长,由于主要聚集在肝脏可用于肝脏CT成像.2012年,Peng等[17]以PEG修饰G5 PAMAM树状大分子,并以此化合物作为模板包裹金纳米颗粒,同时将PAMAM末端剩余氨基全部乙酰化以消除其表面的正电荷.实验结果表明,聚乙二醇的修饰较先前的报道极大地提高了Au DENPs中Au的上载量和稳定性,降低了Au DENPs的毒性,且此类材料被成功地用于SPC-A1肺癌肿瘤模型的CT成像诊断——尾静脉注射的PEG和乙酰化双重修饰的Au DENPs在注射后6 h时,在肿瘤组织内由于EPR效应出现了局部的富集,实现了对肿瘤组织的CT成像识别的目标(见图4)[17].
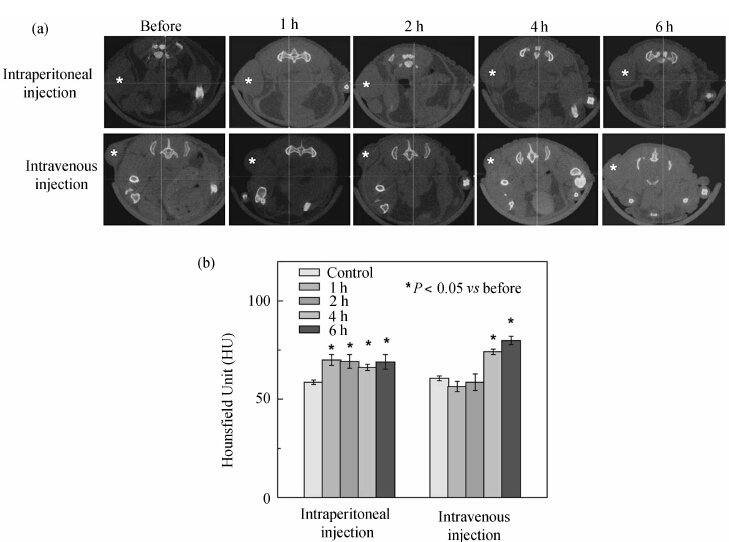 | 图4 SPC-A1裸鼠移植瘤micro-CT平扫及不同途径应用[(Au0)300-G5.NHAc-mPEG] DENPs之前 和之后1、2、4和6小时的动态扫描图(a.“ *”指示肿瘤部位)及其肿瘤部位的CT值(b)[17] Representative transectional micro-CT images (a) and CT values (b) of the xenografts SPC-A1 tumor in nude mice before and after injected with [(Au0)300-G5.NHAc-mPEG] DENPs by different injection routes for 1, 2, 4, and 6 h. The star “ *” in (a) indicates the location of the tumor[17] |
2011年,Guo等[14]以G5 PAMAM为模板,将金属元素Au和小分子的碘造影剂有效地结合起来,在Au DENPs的基础上,将含碘造影剂泛影酸通过化学键连接在G5 PAMAM表面,制备了新型的同时含有两种造影元素(Au和碘)的CT成像造影剂,并系统地研究了Au和碘的协同成像效果.实验结果表明,相对于先前报道的单纯的Au DENPs[16]和omnipaque,此类新型的纳米材料,在Au或者碘浓度相同时,均具有更高的X-射线衰减系数,说明此类同时具有两种造影元素的纳米材料,在提高CT成像效果的同时,克服了传统小分子造影剂代谢快、毒性大的缺点,有望作为一类新型的造影剂用于CT成像.
与纳米金颗粒相比,银颗粒具有相近的晶体结构,且Ag比Au更廉价易得.2010年,Liu等[41]以G5 PAMAM树状大分子为模板,通过调节Ag+和G5 PAMAM的摩尔比螯合Ag+,并利用硼氢化钠原位还原进一步制备得到了末端氨基乙酰化树状大分子稳定的银纳米颗粒(Ag DSNPs).实验结果表明,乙酰化的Ag DSNPs具有良好的稳定性和较高的X-射线衰减系数.不同小鼠皮下分别注射[(Ag0)75-G5.NHAc] DSNPs和碘海醇CT造影剂,注射[(Ag0)75-G5.NHAc] DSNPs的小鼠注射部位软组织具有明显增强的CT信号,而注射碘海醇的小鼠注射部位则无任何CT信号.结果表明,相对于传统小分子含碘造影剂,[(Ag0)75-G5.NHAc] DSNPs有着更长的成像时间,可以作为理想的造影剂用于CT成像.
2012年,Liu等[42]以G5 PAMAM树状大分子为模板和稳定剂,硼氢化钠为还原剂,制备了树状大分子稳定的金/银纳米复合颗粒,研究了不同摩尔配比的金/银合金的形貌及所制备材料的X-射线衰减系数.结果表明, G5 PAMAM末端氨基乙酰化后的材料较乙酰化前具有更高的X-射线衰减系数.同年,Liu等[43]用G5 PAMAM树状大分子作为模板和稳定剂,在不添加还原剂的条件下,利用自还原的方法制备了树状大分子稳定的金/银纳米复合颗粒,并研究了不同摩尔配比的金/银纳米合金的X-射线衰减系数.结果与先前的报道一致,对G5 PAMAM末端氨基进行乙酰化后的材料较乙酰化前具有更高的X-射线衰减系数.这些均为后续的活体CT成像研究奠定了良好的基础.
除此之外,基于树状大分子的双模态成像材料也相继被报道.2008年,Regino等[44]将DTPA和1B4M-DTPA修饰在G8 PAMAM表面,以此为模板螯合造影剂Gd,制备了新型的纳米复合造影剂(Gd-G8 dendrimer),该造影剂既能用于CT成像,也可以用于磁共振的T1成像.体外实验结果表明,Gd-G8 dendrimer (—6.0 HU mM-1)相对于含碘造影剂,在Gd和碘摩尔浓度相同时,前者的CT信号强度是后者的1.6倍.体内实验结果表明,使用此类造影剂能够通过CT和MRI两种检测技术对脑部实现快速便捷的诊断.2012年,Cai等[45]以共沉淀法制备的Fe4O3为核,通过层层自组装的方式,将树状大分子包裹的金纳米颗粒通过化学键修饰在Fe4O3的表面,制备了同时具有CT和MR(磁共振)双模态造影功能的多功能造影剂,并对所制备的Fe/Au核壳结构的纳米材料进行了系统的表征.结果表明,所制备的Fe/Au核壳结构纳米材料在体外和体内均具有良好的CT和MR成像效果. 3 总结与展望
本文系统地阐述了基于树状大分子的纳米CT成像造影剂的制备及其在生物医学领域的应用,尤其是作为优良的CT成像造影剂用于检测血管、肿瘤等方面的应用.本文综述的几种基于树状大分子的CT造影剂,主要包括修饰碘化合物的树状大分子、树状大分子包裹或稳定的金属纳米颗粒以及同时包含碘和金属的树状大分子纳米颗粒.这些纳米CT造影剂都可以通过树状大分子纳米技术制备出来.它们的共同优势是都能够延长在血液循环中的时间从而延长成像时间、可以通过修饰减少对肾脏的毒性.含纳米金属颗粒的树状大分子还具有较高的X-射线吸收系数,可以提高CT成像的灵敏度,同时含纳米金属和碘元素的树状大分子可以更大程度提高成像的灵敏度.
近些年,将功能化的纳米输送体系作为新型CT造影剂的研究取得了较大的发展.而此类纳米材料的制备方法也是灵活多样的.树状大分子灵活可控的尺寸、规整的结构和易于多功能化修饰的特点赋予了此类基于树状大分子的纳米材料广阔的应用空间.树状大分子不仅能化学键合小分子含碘造影剂,而且能够作为模板或稳定剂与金属纳米粒子结合,从而制备新型的基于树状大分子的有机-无机纳米复合材料.树状大分子包裹或者稳定的金属纳米粒子有望可以进一步修饰靶向试剂、荧光试剂、药物分子、小分子含碘造影剂或多种金属离子的螯合剂,制备多功能化的金属纳米颗粒[22,46] ,用于肿瘤的靶向成像、多模态成像诊断或诊断与治疗一体化纳米平台.除此之外,通过对树状大分子进行适当的修饰,可以更好地控制以此为模板或稳定剂所制备的金属纳米粒子的尺寸、形貌和X-射线衰减系数.值得注意的是,含金属纳米颗粒的基于树状大分子的CT造影剂的不足之处是通常需要选择合适的反应条件以改善纳米颗粒的胶体稳定性.另外,和其它CT造影剂相比,基于树状大分子的纳米CT成像造影剂的另一不足是所用的树状大分子目前价格较贵.相信随着人们技术水平的提高和个别商业公司垄断权的打破,将树状大分子纳米器件转化为医用产品的时代很快就会到来.
致谢:国家自然科学基金面上项目(21273032);教育部新世纪人才支持计划;上海市科委纳米专项(11nm0506400).
| [1] | Peer D, Karp J M, Hong S, et al. Nanocarriers as an emerging platform for cancer therapy[J]. Nat. Nanotechnol., 2007, 2(12): 751-760. |
| [2] | Moghimi S M, Hunter A C, Murray J C. Nanomedicine: current status and future prospects[J]. Faseb J., 2005, 19(3): 311-330. |
| [3] | Tomalia D A, Baker H, Dewald J, et al. A new class of polymers: starburst-dendritic macromolecules[J]. Polym. J., 1985, 17(1): 117-132. |
| [4] | Flory P J. Molecular size distribution in three dimensional polymers. I. gelation1 [J]. J. Am. Chem. Soc., 1941, 63(11): 3083-3090. |
| [5] | Boas U, Christensen J B, Heegaard P M H. Dendrimers in Medicine and Biotechnology: New Molecular Tools[M]. Royal Society of Chemistry: 2006. |
| [6] | Weissleder R. Molecular imaging: exploring the next frontier1 [J]. Radiology, 1999, 212(3): 609-614. |
| [7] | Debbage P, Werner J. Molecular imaging with nanoparticles: giant roles for dwarf actors[J]. Histochem. Cell Biol., 2008, 130(5): 845-875. |
| [8] | Deshpande N, Needles A, Willmann J K. Molecular ultrasound imaging: current status and future directions [J]. Clin. Radiol., 2010, 65(7): 567-581. |
| [9] | Krause W. Delivery of diagnostic agents in computed tomography[J]. Adv. Drug Deliv. Rev.,1999, 37(1-3): 159-173. |
| [10] | Haller C, Hizoh I. The cytotoxicity of iodinated radiocontrast agents on renal cells in vitro[J]. Invest. Radiol., 2004, 39(3): 149-154. |
| [11] | Yordanov A T, Lodder A L, Woller E K, et al. Novel iodinated dendritic nanoparticles for computed tomography (CT) imaging[J]. Nano Lett., 2002, 2(6): 595-599. |
| [12] | Yordanov A T, Mollov N, Lodder A L, et al. A water-soluble triiodo amino acid and its dendrimer conjugate for computerized tomography (CT) imaging[J]. J. Serb. Chem. Soc., 2005, 70(2): 163-170. |
| [13] | Fu Y, Nitecki D E, Maltby D, et al. Dendritic iodinated contrast agents with PEG-cores for CT imaging: synthesis and preliminary characterization[J]. Bioconjugate Chem., 2006, 17(4): 1043-1056. |
| [14] | Guo R, Wang H, Peng C, et al. Enhanced X-ray attenuation property of dendrimer-entrapped gold nanoparticles complexed with diatrizoic acid[J]. J. Mater. Chem., 2011, 18(13): 5120-5127. |
| [15] | Guo R, Wang H, Peng C, et al. X-ray attenuation property of dendrimer-entrapped gold nanoparticles[J]. J. Phys. Chem. C, 2010, 114(1): 50-56. |
| [16] | Peng C, Wang H, Guo R, et al. Acetylation of dendrimer-entrapped gold nanoparticles: synthesis, stability, and X-ray attenuation properties[J]. J. Appl. Polym. Sci., 2011, 119(3): 1673-1682. |
| [17] | Peng C, Zheng L F, Chen Q, et al. PEGylated dendrimer-entrapped gold nanoparticles for in vivo blood pool and tumor imaging by computed tomography[J]. Biomaterials, 2012, 33(4): 1107-1119. |
| [18] | Wang H, Zheng L F, Peng C, et al. Computed tomography imaging of cancer cells using acetylated dendrimer-entrapped gold nanoparticles[J]. Biomaterials, 2011, 32(11): 2979-2988. |
| [19] | Knecht M R, Garcia-Martinez J C, Crooks R M. Hydrophobic dendrimers as templates for Au nanoparticles[J]. Langmuir, 2005, 21(25): 11981-11986. |
| [20] | Oh S K, Kim Y G, Ye H C, et al. Synthesis, characterization, and surface immobilization of metal nanoparticles encapsulated within bifunctionalized dendrimers[J]. Langmuir, 2003, 19(24): 10420-10425. |
| [21] | Shi X Y, Lee I, Baker J R Jr. Acetylation of dendrimer-entrapped gold and silver nanoparticles[J]. J. Mater. Chem., 2008, 18(5): 586-593. |
| [22] | Shi X Y, Wang S H, Meshinchi S, et al. Dendrimer-entrapped gold nanoparticles as a platform for cancer-cell targeting and imaging[J]. Small, 2007, 3: 1245-1252. |
| [23] | Shi X Y, Wang S H, Sun H P, et al. Improved biocompatibility of surface functionalized dendrimer entrapped gold nanoparticles[J]. Soft Matter, 2007, 3(1): 71-74. |
| [24] | Crooks R M, Zhao M Q, Sun L, et al. Dendrimer-encapsulated metal nanoparticles: synthesis, characterization, and applications to catalysis[J]. Accounts Chem. Res., 2001, 34(3): 181-190. |
| [25] | Balogh L, Tomalia D A. Poly(amidoamine) dendrimer-templated nanocomposites. 1. synthesis of zerovalent copper nanoclusters[J]. J. Am. Chem. Soc., 1998, 120(29): 7355-7356. |
| [26] | Balogh L, Valluzzi R, Laverdure K S, et al. Formation of silver and gold dendrimer nanocomposites[J]. J. Nanoparticle Res., 1999, 1: 353-368. |
| [27] | Lemon B I, Crooks R M. Preparation and characterization of dendrimer-encapsulated CdS semiconductor quantum dots[J]. J. Am. Chem. Soc., 2000, 122(51): 12886-12887. |
| [28] | Wilson O M, Scott R W J, Garcia-Martinez J C, et al. Synthesis, characterization, and structure-selective extraction of 1-3-nm diameter AuAg dendrimer-encapsulated bimetallic nanoparticles[J]. J. Am. Chem. Soc., 2005, 127(3): 1015-1024. |
| [29] | Esumi K. Dendrimers for nanoparticle synthesis and dispersion stabilization[J]. Colloid Chemistry II, 2003, 227: 31-52. |
| [30] | Nalwa H S. Encyclopedia Nanoscience and Nanotechnology[M]. American Scientific Publisher, 2004. 2. 317-326. |
| [31] | Esumi K, Suzuki A, Aihara N, et al. Preparation of gold colloids with UV irradiation using dendrimers as stabilizer[J]. Langmuir, 1998, 14(12): 3157-3159. |
| [32] | Esumi K, Suzuki A, Yamahira A, et al. Role of poly(amidoamine) dendrimers for preparing nanoparticles of gold, platinum, and silver[J]. Langmuir., 2000, 16(6): 2604-2608. |
| [33] | Fahmi A, Pietsch T, Appelhans D, et al. Water-soluble CdSe nanoparticles stabilised by dense-shell glycodendrimers[J]. New J. Chem., 2009, 33(4): 703-706. |
| [34] | Shi X Y, Ganser T R, Sun K, et al. Characterization of crystalline dendrimer-stabilized gold nanoparticles[J]. Nanotechnology, 2006, 17(4): 1072-1078. |
| [35] | Shi X Y, Sun K, Baker J R Jr. Spontaneous formation of functionalized dendrimer-stabilized gold nanoparticles[J]. J. Phys. Chem. C, 2008, 112(22): 8251-8258. |
| [36] | Shi X Y, Sun K, Balogh L P, et al. Synthesis, characterization, and manipulation of dendrimer-stabilized iron sulfide nanoparticles[J]. Nanotechnology, 2006, 17(18): 4554-4560. |
| [37] | Satoh N, Nakashima T, Kamikura K, et al. Quantum size effect in TiO2 nanoparticles prepared by finely controlled metal assembly on dendrimer templates[J]. Nat. Nanotechnol., 2008, 3(2): 106-111. |
| [38] | Goodson T, Varnavski O, Wang Y. Optical properties and applications of dendrimer-metal nanocomposites[J]. Int. Rev. Phys. Chem., 2004, 23(1): 109-150. |
| [39] | Wu X C, Bittner A M, Kern K. Synthesis, photoluminescence, and adsorption of CdS/dendrimer nanocomposites[J]. J. Phys. Chem. B, 2005, 109(1): 230-239. |
| [40] | Kojima C, Umeda Y, Ogawa M, et al. X-ray computed tomography contrast agents prepared by seeded growth of gold nanoparticles in PEGylated dendrimer[J]. Nanotechnology, 2010, 21(24): 245104. |
| [41] | Liu H, Wang H, Guo R, et al. Size-controlled synthesis of dendrimer-stabilized silver nanoparticles for X-ray computed tomography imaging applications[J]. Polym. Chem., 2010, 1(10): 1677-1683. |
| [42] | Liu H, Shen M W, Zhao J, et al. Tunable synthesis and acetylation of dendrimer-entrapped or dendrimer-stabilized gold-silver alloy nanoparticles[J]. Colloid Surf. B-Biointerfaces, 2012, 94: 58-67. |
| [43] | Liu H, Sun K, Zhao J L, et al. Dendrimer-mediated synthesis and shape evolution of gold-silver alloy nanoparticles[J]. Colloid Surf. A-Physicochem. Eng. Asp., 2012, 405: 22-29. |
| [44] | Regino C A S, Walbridge S, Bernardo M, et al. A dual CT-MR dendrimer contrast agent as a surrogate marker for convection-enhanced delivery of intracerebral macromolecular therapeutic agents[J]. Contrast Media Mol. Imaging, 2008, 3(1): 2-8. |
| [45] | Cai H, Li K, Shen M, et al. Facile assembly of Fe3O4@ Au nanocomposite particles for dual mode magnetic resonance and computed tomography imaging applications[J]. |




