2. 常州大学 材料科学与工程学院, 江苏 常州 213164
2. School of Material Science and Engineering, Changzhou University, Changzhou 213164, Jiangsu, P.R. China
在当代工业技术中,光固化技术由于本身具有高效、经济、节能、环保及适应性广的天然优势,符合当今世界绿色发展、低碳发展及可持续发展的趋势,已经被广泛应用于各个生产领域中,如:涂料、粘合剂、油墨、印刷、光纤传导、微电子、牙齿填充材料、骨骼和组织修复工程等[1,2,3,4,5].
光引发剂是光固化体系中的一个重要组成部分,它关系到配方体系在光照射时低聚物及稀释剂能否迅速由液态转变成固态,直接影响着光固化的速度.目前在商业化紫外光固化材料和可见光齿科修复领域比较常见的光引发体系主要是二苯甲酮(BP)/胺体系和樟脑醌(CQ)/胺体系,而胺类助引发剂则是夺氢型光引发体系中必不可少的组成部分[1,2,3],但是固化后体系中游离出的小分子胺类化合物可能会引起产品表面的黄变[6]、可能具有毒性[7]和致癌性[8, 9].尽管通过分子定向设计出的大分子胺类化合物或可聚合的胺类化合物在某种程度上可以改善整个固化体系的生物相容性[10,11,12,13,14,15],但寻找一种合适的胺类助引发剂的替代物仍然是当前一项重大的任务. 缩醛化合物是一类常见的化合物,其含有的缩醛基团化学活性较高.从1963年Elad与Youssefyeh[16]发现1,3-二氧戊烷具有紫外光敏感性开始,人们开始对环缩醛类化合物进行了一系列的相关研究,本文着重介绍了将环缩醛类化合物在光聚合体系中的进展,期望能够在某种程度上改善固化体系的生物相容性,寻找一种合适的胺类助引发剂替代物. 1 1,3-二氧戊烷类化合物作为光引发剂的研究
在含有环缩醛结构的化合物中,由于两个氧原子间的亚甲基非常活泼,Walling[17]和Ikeda [18]报道了1,3-二氧戊烷(DO)能在空气中自动氧化;利用光照或者自由基引发剂均可以使它们重排生成相应的酯.Elad与Youssefyeh[16]也提出了1,3-二氧戊烷类化合物在紫外光照下重排生成酯的机理.
 | 图1 1,3-二氧戊烷在紫外光照下重排的机理 The photochemical rearrangement mechanism of 1,3-dioxolane |
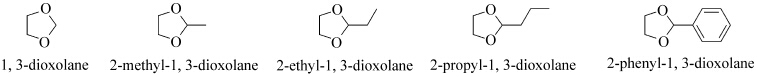
Ouchi等[19]通过研究发现:1,3-二氧戊烷类化合物在紫外光照射下可以分别引发苯乙烯及甲基丙烯酸甲酯光聚合;通过对其反应动力学的进一步研究,发现在环缩醛结构上的2位取代基对聚合反应的速率具有很大的影响,其引发苯乙烯、甲基丙烯酸甲酯的聚合效率大小顺序为:1,3-二氧戊烷<2-甲基-1,3-二氧戊烷<2-乙基-1,3,-二氧戊烷<2-正丙基-1,3-二氧戊烷<2-苯基-1,3-二氧戊烷.
 | 图2 1,3-二氧戊烷在紫外光照下重排的机理 The photochemical rearrangement mechanism of 1,3-dioxolane |
此外,他们还发现在氧气含量很小的情况下,苯乙烯的最终转化率基本保持不变,而当氧气含量逐渐增大时,苯乙烯的转化率却有显著增加,这可能是1,3-二氧戊烷类化合物在紫外光照射下,产生的环缩醛自由基被氧化重排能产生更多的活性自由基所引起的.
对于碳原子数对环缩醛化合物活性的影响,Ouchi等[20]也进行了相关的研究,通过对1,3-二氧杂环己烷、1,3-二氧杂环庚烷、1,3,5-三氧杂环己烷及1,2,4,5-四氧杂环己烷在紫外光照射下引发苯乙烯聚合的动力学过程研究发现:虽然环缩醛化合物分解速率的顺序是:1,3-二氧杂环庚烷>1,3-二氧杂环己烷>1,3,5-三氧杂环己烷>1,2,4,5-四氧杂环己烷,但其引发苯乙烯聚合速率的顺序是却是1,3-二氧杂环庚烷<1,3-二氧杂环己烷<1,3,5-三氧杂环己烷<1,2,4,5-四氧杂环己烷,这可能是由于1,3-二氧杂环庚烷及1,3-二氧杂环己烷经紫外光辐照裂解产生的单酯基自由基经过分子内重排产生的自由基活性更低的原因,从而降低了苯乙烯单体的聚合速率.
 | 图3 碳原子数不同的环缩醛化合物 The structures of cyclic acetals with different carbon atoms |
通过对1,3-二氧戊烷和偶氮二异丁腈分别引发苯乙烯光聚合的动力学研究,Ouchi等[21]还发现:1,3-二氧戊烷引发苯乙烯的光聚合能力与偶氮二异丁腈相当.
在对2,4,8,10-四氧杂螺[5,5]十一烷引发苯乙烯光聚合的研究中发现:含有两个环缩醛结构的化合物,其引发苯乙烯聚合的速率约是单个环缩醛引发聚合速率的两倍;并且亚甲基上的取代基对单体的聚合速率有很大影响,按照取代物引发单体聚合速率的大小,分别是:甲基取代物(R=Me)<未取代物(R=H)<乙基取代物(R=Et)<正丙基取代物(R=n-Pr)<苯基取代物(R=Ph)[22].
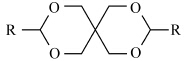 | 图4 2,4,8,10-四氧杂螺[5,5]十一烷的结构 The structure of 2,4,8,10-tetroxaspiro[5,5]undecane |
对于2-乙烯基-1,3-二氧戊烷在没有加入光引发剂的情况下,经紫外光辐照后本体也可以进行光聚合的现象,Ouchi等[23]提出了如下的机理:2-乙烯基-1,3-二氧戊烷经紫外光辐照后,产生环缩醛自由基,然后碳-氧键断裂生成酯单基自由基,乙烯基化合物被单酯基自由基引发聚合.
在更进一步的研究中发现,虽然2-乙烯-4-羟甲基-1,3-二氧戊烷和2-乙烯-1,3-二氧 戊烷的引发速率和产物的分子量都比较小,但是由于2-乙烯-4-羟甲基-1,3-二氧戊烷比2-乙烯-1,3-二氧戊烷在反应过程中的聚合速率更大,因此2-乙烯-4-羟甲基-1,3-二氧戊烷聚合得到产物的分子量要比2-乙烯-1,3-二氧戊烷得到的低[24].
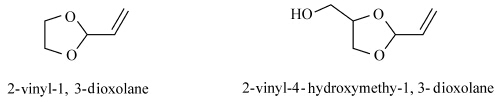 | 图5 2-乙烯基-1,3-二氧戊烷与2-乙烯基-4-羟甲基-1,3-二氧戊烷的结构 The structures of 2-vinyl-1,3-dioxolane and 2-vinyl-4-hydroxymethyl-1,3-dioxolane |
此外,除了含有环缩醛结构的小分子化合物外,含有环缩醛结构的低聚物也可以作为紫外光引发剂引发苯乙烯和甲基丙烯酸甲酯的聚合,其引发单体聚合的速率大小顺序分别是:聚乙烯醇缩甲醛< 聚(2-乙烯基-4-羟甲基-1,3-二氧戊烷) < 聚(2-乙烯-1,3-二氧戊烷) [25].而通过对1,3-二氧戊烷及2,4,8,10-四氧杂螺[5,5]十一烷(TU)引发马来酸酐进行光聚合的研究表明:马来酸酐的聚合物是以1,3-二氧戊烷或者TU封端的[26, 27]. 2 1,3-苯并二氧戊烷类化合物作为供氢体的研究
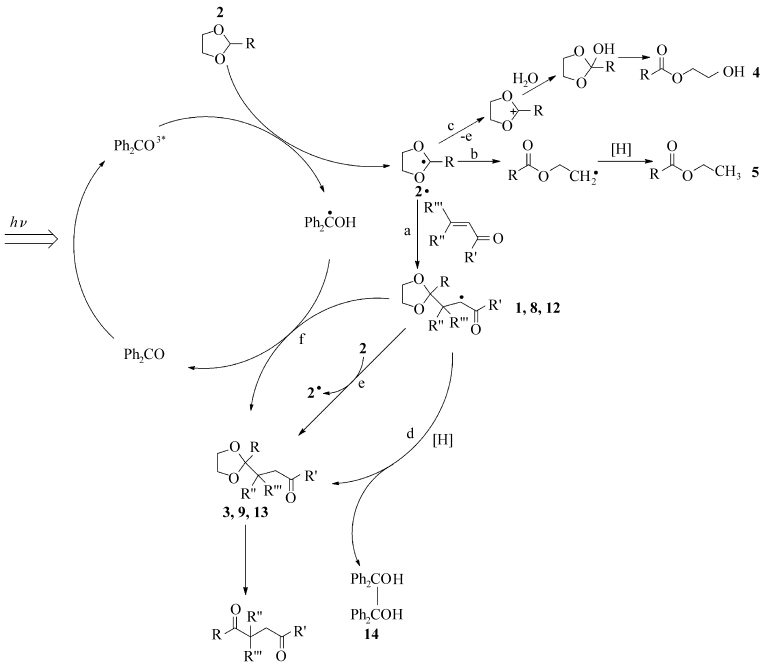
最近,Mosca等[28]发现:利用二苯甲酮、2-烷基-1,3-二氧戊烷及烯酮化合物,通过简单的光化学反应,就可以在较为温和的条件下反应制备1,4-二酮,并且产率较高.该反应历程如下:BP在紫外光的辐照下,从基态跃迁至激发态,夺取化合物2中的氢,产生相应 的烷氧基自由基2·;烯酮化合物通过途径a捕获烷氧基自由基2·,然后生成的加成自由基(化合物1,8,12)通过氢提取反应得到最终的单保护羰基的1,4二酮衍生物,再进一步脱 除保护基,得到最终的1,4-二酮化合物.在后半个过程中,中间产物加成自由基(化合物1,8,12)可以通过途径d、e、f分别从溶剂、2-烷基-1,3-二氧戊环或半频哪醇上夺取氢,另外,途径d会产生频哪醇副产物14,途径e和f会使反应所需的二苯甲酮的量小于理论的化学计量数.此外,竞争反应(途径b和c)也是影响烷基化反应的最终产率的因素之一,在整个烷基化反应中,最为关键的是烯酮类化合物对自由基2的捕获效率,该步反应速率主要由烯酮的化学结构所决定.通过对该反应的进一步研究后,发现2-烷基-1,3-二氧戊烷中2-C上的取代基对该过程的影响不大,但是与母体1,3-二氧戊环相比,取代基产生的电子效应还是会对氢的抽提速率略有影响[29]
 | 图6 光诱导烷基自由基的机理 The mechanism of photoinduced radical alkylation |
史素青等[30]报道了具有不同结构的环缩醛类化合物可作为夺氢型双分子光引发体系的助引发剂,并且环缩醛化学结构对于聚合体系的聚合速率和双键转化率等动力学参数有较大的影响[31].
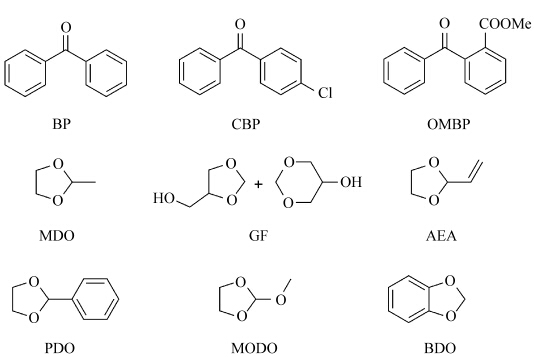 | 图7 不同环缩醛类化合物的化学结构 Chemical structures of cyclic acetals |
在通过对不同结构的环缩醛化合物进行研究筛选时,史素青等[32]发现了一类广泛存在于胡椒、芝麻等天然可食用植物中化学成分的模型化合物——胡椒环(1,3-苯并二氧戊烷,BDO)具有较高的化学活性.在紫外光辐照下,BP/BDO体系引发1,6-己二醇双丙烯酸酯(HDDA)聚合的聚合速率以及双键转化率与BP/EDAB(N,N-二甲氨基苯甲酸乙酯)体系相近.同时利用红外(IR)和气相色谱-质谱联用(GC-MS)对BP/BDO光解产物进行分析,得到如下反应机理:二苯甲酮在紫外光照射后由基态跃迁到激发态,然后通过直接夺氢和电子/质子转移两种方式与BDO发生相互作用,分别生成引发聚合的自由基活性种B1·和B2·.B1·和B2·进一步反应分别得到化合物1和4,根据化合物1和4占光反应产物的百分比,可以推断出,BP/BDO光引发体系在光引发过程中通过直接夺氢和电子/质子转移两种方式产生自由基活性种,其中电子/质子转移占主导地位(图8).该作用机理与BP/胺的引发机理类似.
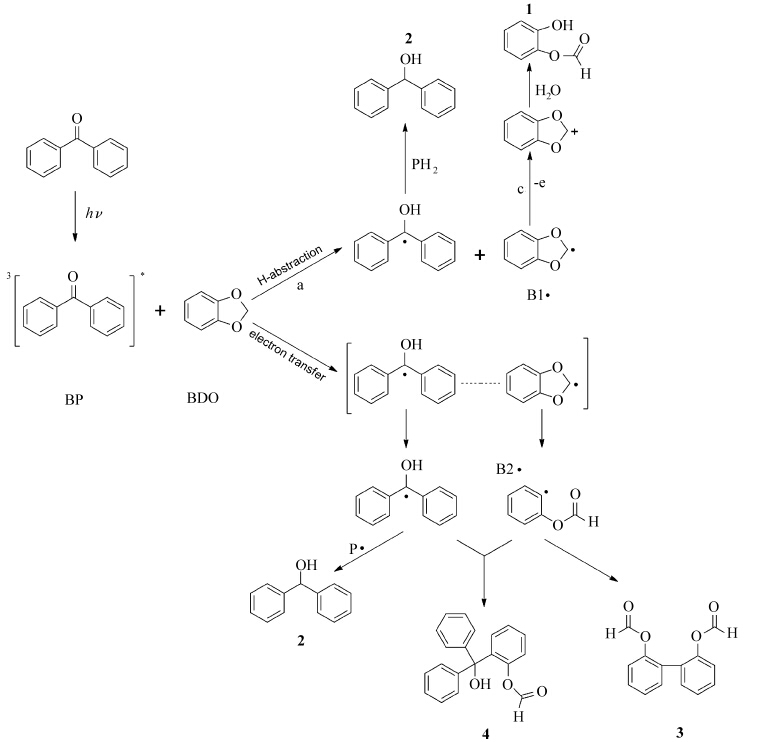 | 图8 BP/BDO光解机理 The initiating process of BP/BDO initiating system |
BDO作为牙科树脂材料光聚合体系的助引发剂,在对它进行进一步研究时发现:樟脑醌(CQ)和BDO浓度、低聚物结构、低聚物/活性稀释剂配比以及活性稀释剂化学结构对聚合时的动力学和引发活性均有影响,特别是单体种类对 CQ/BDO引发体系的引发活性影响很大,另外,单体的化学结构和物理性质也是影响固化后材料机械物理性能的主要因素[33].
通过研究CQ/1,3-苯并二氧戊烷类化合物光引发体系和商业用CQ/胺(N,N-二甲氨基苯甲酸乙酯,EDAB或甲基丙烯酸-2-二甲基胺基乙酯,DMEM)光引发体系聚合动力学及机械性能发现:虽然CQ/1,3-苯并二氧戊烷类化合物的聚合速率较低,但是其固化膜的机械物理性能与商业用光引发体系的相近,并且在人体温度(37 ℃)附近具有相对较高的储能模量[34].此外,1,3-苯并二氧戊烷类化合物具有抗氧化、抗致癌等生理活性,特别是对哺乳动物表现出较低的毒性[35,36,37,38,39],因此具有替代传统叔胺助引发剂用于齿科修复的潜在用途.
王克敏等[40]对于2位上含有不同取代基的1,3-苯并二氧戊烷衍生物作为光引发剂和助引发剂也进行了相关的研究.结果表明:该类环缩醛化合物可作为紫外光引发剂,但引发效果并不理想,而将不同结构的环缩醛化合物作为紫外光聚合助引发剂时,对BP有助引发效果,并且以无取代基的1,3-苯并二氧戊烷的效果最好,但该类化合物对于2-异丙基硫杂蒽酮(ITX)没有助引发剂效果.另外,还发现不同结构的环缩醛对CQ光还原的量子产率与对CQ引发聚合的影响并没有直接的联系,其可能的原因是环缩醛对CQ引发聚合的影响可以由两个相对的过程控制,即:形成相对活性的引发聚合的自由基可以加速聚合与通过链转移反应干扰有效的聚合.
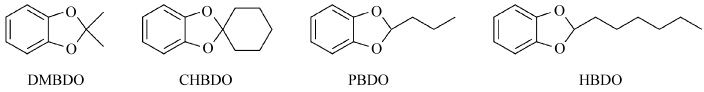 | 图9 不同结构的1,3-苯并二氧戊环的化学结构 The structure of 1,3-benzodioxole derivatives |
杨金梁等[41]合成了5位上含有不同取代基的芝麻酚类衍生物,并对其作为助引发剂与二苯甲酮配合使用,引发HDDA进行光聚合的动力学进行了相应研究.研究发现:当5位上的取代基为推电子效应基团时,该衍生物的活性较高,而5位取代基为吸电子效应的基团时,其活性较低,特别是当5位为甲氧基取代基时,该化合物的活性最高.另外,整个固化配方体系的粘度、单体的化学结构对反应的动力学参数也有很大影响,并且通过相应的计算分析,发现HDDA的聚合速率分别与5-甲氧基-1,3-苯并二氧戊烷在配方体系中的浓度、固化时光强的二分之一次方成正比.
 | 图10 不同结构的1,3-苯并二氧戊环的化学结构 The structure of 1,3-benzodioxole derivatives |
王克敏等[42]还报道了天然产物芝麻素(SA)可以作为CQ的助引发剂用于齿科修复体系中,以代替传统的胺助引发剂.利用CQ/SA在可见光照射下引发双酚A缩水甘油双甲基丙烯酸酯(Bis-GMA)/二缩三乙二醇双甲基丙烯酸酯(TEGDMA)聚合后,测试了聚合物的机械性能(储能模量和玻璃化温度)、吸水性、溶解性、黄变系数和间接细胞毒性,同时也将商业用的胺助引发剂EDAB作为对比进行了研究.结果表明:在CQ可见光引发体系中,加入助引发剂SA可以显著提高聚合速率和最终双键转化率.虽然CQ/SA引发聚合后的最终双键转化率比传统的胺助引发剂EDAB稍低,但是其固化膜的机械性能很相近,并且玻璃化转变温度更高,黄变系数和细胞毒性更低,吸水性和溶解性均在ISO-4049范围之内.因此,SA作为一种天然产物,可以作为传统的胺助引发剂的潜在替代物应用于齿科修复中.
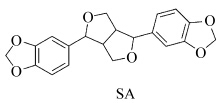 | 图11 芝麻素的化学结构 The structure of sesamin |
另外,也可以将SA作为紫外光引发剂的助引发剂使用.王克敏等通过实时红外(RT-IR)技术,研究了BP/SA体系引发丙烯酸酯类单体聚合的动力学过程,其结果表明:SA的浓度、辐照的光强以及不同的单体均对聚合的单体转化率、聚合速率有较大的影响[43].
环缩醛也可以作为第二助引发剂应用在三元复合光引发体系中.Janina Kabatc[44]将环缩醛化合物加入到菁染料/硼酸盐体系中,在可见光的照射下可以有效地引发三羟甲基丙烷三丙烯酸酯(TMPTA)的聚合(图12).通过DSC对其聚合的动力学过程进行研究,发现环缩醛类化合物的加入可以有效地提高TMPTA的聚合速率,这是因为在该三元复合光引发体系中,环缩醛类化合物在与终止自由基反应时,还可以产生新的活性自由基.环缩醛化合物的活性越高,其消除终止自由基及产生活性自由基的能力就越强,而环缩醛化合物的结构对其活性起着重要的作用,因此,环缩醛化合物的结构对该三元体系的光引发效率影响很大.
 | 图12 吸收可见光后菁染料/硼酸盐/环缩醛三元体系引发聚合机理 The processes occurring in the three-component photoinitiating system: cyanine dye/borate slat/cyclic acetal after absorption of the visible light |
肖浦等[45]对环缩醛类化合物作为紫外光引发剂做了相关研究.首先通过实时红外实验,对单独使用BDM,即benzo(1,3)dioxol-5-yl-(4-methyl-benzo(1,3)dioxol-5-yl)-methanone作为引发剂引发TMPAT聚合的现象进行了研究,发现其引发速率及最终转化率远大于单独使用BP;其次通过激光闪光光解实验(LFP),得到了BDM在乙腈溶液中的三重态寿命是4.6 μs,与BP的三重态寿命(4.1 μs)很接近,这是由于BDM浓度较低,没有发生明显的分子间相互夺氢作用;在激光闪光光解实验中还发现,随着BDO类助引发剂的加入,3BDM被处于基态的BDO类化合物猝灭,BDM的三重态寿命迅速下降,通过Stern-Volmer方程可以计算出其三重态猝灭速率常数为1.2×10-6 mol-1·L·S-1,作为对比,3BDM被EDAB猝灭的速率常数为1.4×10-8 mol-1·L·S-1,这说明当BDO达到一定浓度后,可以与BDM相互作用. 最后作者利用PBN(N-t-butyl-α-phenylnitrone)作为自由基捕获剂,通过电子自旋共振(ESR)实验,发现BDM产生自由基的机理与BP/EDAB类似.基于以上实验,作者提出了在紫外光照射下BDM引发单体聚合可能的机理,并且指出:在不需要聚合速度很快的情况下,BDM可以作为一种单组分的夺氢型光引发剂使用。
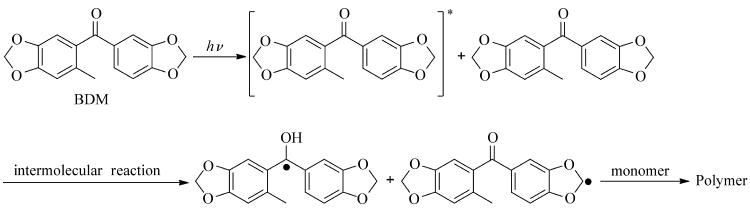 | 图13 BDM引发单体聚合可能的机理 Proposed mechanism of the radical formation with BDM |
王克敏等[46]报道了一种单组分夺氢型光引发剂5-苯酰基-1,3-二氧苯并环戊烷(BBDO).通过研究BBDO在溶液中引发MMA聚合的过程,发现MMA聚合的转化率随引发剂浓度的增加而增加,而与溶剂极性的关系不大.通过RT-IR研究了BBDO/EDAB引发丙烯酸树脂的光聚合动力学,并与添加了传统的胺助引发剂的引发体系进行了对比,发现BBDO/EDAB引发树脂聚合的聚合速率和最终双键转化率明显高于BP/EDAB,这表明BBDO/EDAB的引发效率要明显高于BP/EDAB,因此BBDO作为光引发剂用于光聚合树脂体系中,可以有效地降低胺助引发剂的使用.另外,还通过核磁和红外研究了BBDO的引发聚合的机理.结果表明,BBDO的引发过程是自身夺氢-供氢产生自由基引发双键聚合,引发活性比传统的BP引发体系更高.
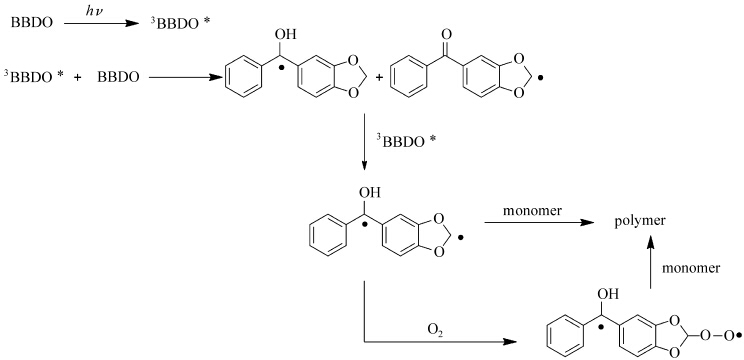 | 图14 5-苯酰基-1,3-二氧苯并环戊烷(BBDO)引发单体聚合的机理 Possible photoreaction mechanism of 6-benzoyl-l,3-benzodioxolane |
杨金梁等[47]利用1,2-二氯乙烷将芝麻酚与对羟基二苯甲酮偶联成单组分的光引发剂4-(1′,3′-苯并二氧戊烷-5′-氧乙氧基)二苯甲酮(BPC2BDO),通过元素分析、核磁及质谱等手段对其结构进行了确定.利用光漂白实验研究了其在乙腈中光降解的动力学过程,发现该引发剂光降解速率与入射光的光强成正比.通过ESR实验研究了其引发聚合的机理,发现其产生自由基的历程与BP/BDO体系类似,经历了引发剂夺取氢产生自由基的历程.在通过BPC2BDO引发单体聚合的过程中发现,BPC2BDO体系中的聚合速率远大于BP/BDO体系,这可能是单组分引发剂经光照后,同时发生分子内及分子间的光化学反应,产生的活性自由基均可以有效引发单体聚合.
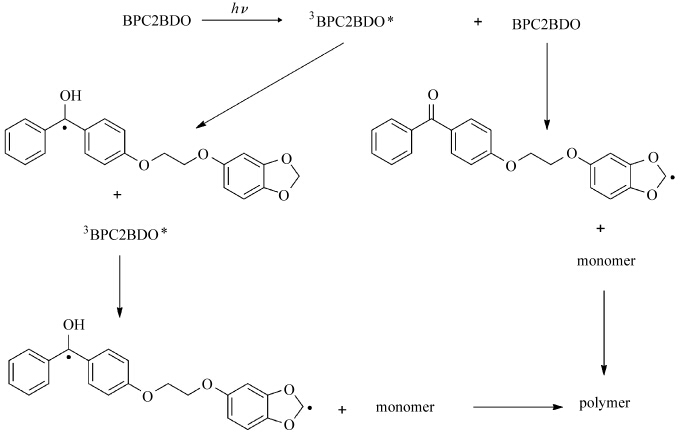 | 图15 BPC2BDO引发单体聚合的机理 Proposed mechanism of the radical formation with BPC2BDO |
此外,王克敏等[48]还合成了一种新的光引发剂:二苯甲酮并-1,3-二氧己噁烷(BP-DO),这种光引发剂在没有添加任何助引发剂的情况下就可以产生自由基引发(甲基)丙烯酸酯类单体聚合,引发效率与传统的BP/EDAB引发体系相当,并且该引发剂引发单体聚合后,固化膜中引发剂的萃取量远低于BP/EDAB引发体系.
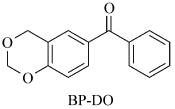 | 图16 二苯甲酮并-1,3-二氧己噁烷(BP-DO)的结构 The structure of Benzonphenone-1,3-Dioxane (BP-DO) |
不论在工业技术还是学术研究方面,光聚合技术都是当代聚合物科学的一个重要研究领域,而作为光聚合体系的一个重要组成部分的光引发剂,则是该领域研究的重中之重.将广泛存在于植物提取物中的环缩醛化合物应用在光聚合技术中,对改善固化体系的生物相容性具有重要意义,在未来会有更广阔的应用前景.
为了继续深入研究不同结构的环缩醛化合物在光反应中的动力学和机理,利用现代的实时红外(RT-IR)、激光闪光光解(LFP)及电子自旋共振(ESR)等技术是十分必要的.此外,通过分子模拟技术来设计或计算环缩醛化合物的物理化学性质,并以实验结果对其进行验证,这些都将会促进和提供其研究应用水平.
| [1] | Fouassier J P. Photoinitiation, Photopolymerization and Photocuring[M]. Munich:Hanser Verlag, 1995. |
| [2] | Rabek J F. Mechanisms of Photophysical Processes and Photochemical Reactions in Polymers, Theory and Applications[M].New York:Wiley,1987. |
| [3] | Davidson R S. Exploring the Science, Technology and Applications of UVand EB Curing[M].London: SITA Technology Ltd., 1999. |
| [4] | Dietliker K. Chemistry and Technology of UV and EB Formulations for Coatings, Inks and Paints[M]. London:SITA Technology Ltd, 1991. |
| [5] | Pappas S P. UV Curing Science and Technology[M]. Norwalk: Technology Marketing Corp., 1978. |
| [6] | Arsu N, Davidson R S, Holman R. Factors affecting the photoyellowing which occurs during the photoinitiated polymerization of acrylates[J]. J. Photochem. Photobiol. A: Chem., 1995, 87: 169-175. |
| [7] | Weisburger E K, Russfield A B, Hamburger F, et al. Testing of twenty-one environmental aromatic amine or derivatives for long-term toxicity or carcinogenicity[J]. Environ. Pathol. Toxicol., 1978, 2: 325-356. |
| [8] | Albrecht W N, Stephenson R L. Health hazards of tertiary amine catalysts[J]. Scand J. Work Environ. Health, 1988, 14: 209-219. |
| [9] | Nagao M, Wakabayashi K, Ushijima T, et al. Human exposure to carcinogenic heterocyclic amines and their mutational fingerprints in experimental animals[J]. Environ. Health Persp. (Suppl), 1996, 104: 497-501. |
| [10] | Bowen R L, Argentar H. Amine accelerators for methacrylate resin systems[J]. J. Dent. Res., 1971, 50: 923. |
| [11] | Bowen R L, Argentar H. Tertiary aromatic amine accelerators with molecular weights above 400[J]. J. Dent. Res., 1972, 51:473. |
| [12] | Nie J, Bowman C N. Synthesis and photopolymerization of N,N'-dimethyl,-N,N'-di(methacryloxy ethyl)-1,6-hexanediamine as a polymerizable amine coinitiator for dental restorations[J]. Biomaterials, 2002, 23(4): 1221-1226. |
| [13] | Ahn K D, Han D K, Lee S H, et al. New aromatic tert-amines for application as photoinitiator components in photocurable dental materials[J]. Macromol. Chem. Phys., 2003, 204: 1628-1635. |
| [14] | 吴刚强, 肖 浦,史素青,等. 樟脑醌/乙二醇-3-吗啡啉基丙酸酯甲基丙烯酸酯引发牙科复合树脂的光聚合动力学研究[J]. 感光科学与光化学, 2007, 25(2): 130-135. Wu G Q, Xiao P, Shi S Q,et al. Kinetics Study of dental composite initiated by camphorquinone/ethylene glycol 3-morpholine-propionate methacrylate[J]. Photographic Science and Photochemistry, 2007, 25(2): 130-135. |
| [15] | 孙梦洲,何勇,吴刚强,等. 二芳酮-可聚合胺紫外光引发1,6-己二醇二丙烯酸酯聚合的动力学研究[J]. 感光科学与光化学, 2007, 25(1): 41-49. Sun M Z, He Y,Wu G Q, et al. Photopolymerization of 1,6-Hexanediol Diacrylate Initiated by Diarylketone/Polymerizable Amine[J]. Photographic Science and Photochemistry, 2007, 25(1): 41-49. |
| [16] | Elad D, Youssefyeh D R. The photochemical conversion of acetals to carboxylic esters [J]. Tetrahedron Lett., 1963, 30: 2189. |
| [17] | Walling C. Free Radicals in Solution[M], Wiley: New York, 1957. |
| [18] | Ikeda K C, Braun A B, Sorenson E B. Autoxidation of 2-alkenyldioxolanes and 2-alkenyl-1,3-dioxanes [J]. J. Org. Chem.,1964, 29: 286. |
| [19] | Ouchi T, Nakamura S, Hamada M. Cyclic acetal -photosensitized polymerization. I. photopolymerization of styrene in the presence of 1, 3-dioxolanes [J]. J. Polym. Sci. Polym. Chem.,1975, 13: 455-466. |
| [20] | Ouchi T, Hamada M. cyclic acetal-photosensitized polymerization. II. photopolymerization of styrene in the presence of various monocyclic acetals[J]. J. Polym. Sci. Polym. Chem., 1976, 14: 2527-2533. |
| [21] | Ouchi T, Nagaya K, Oiwa M. Cyclic acetal-photosensitized polymerization. III. photopolymerization of styrene in the presence of 2,4,8,10-tetraoxaspiro undecane compounds [J]. J. Polym. Sci.: Polym. Chem. Ed. ,1976, 14: 2836. |
| [22] | Ouchi T, Komatsu Y.Cyclic acetal-photosensitized polymerization. V. photopolymerization of styrene sensitized by the system of 1, 3-dioxolane and α-azo bisisobutyronitrile [J]. J. Macromolecular Sci. Chem., 1977, A11(3): 483-9. |
| [23] | Ouchi T, Sato C, Yamamoto T. Cyclic acetal-photosensitized polymerization. XI. photoirradiations onto polycyclic acetals [J]. J. Macromol. Sci. Chem.,1980, 14(3): 265-275. |
| [24] | Ouchi T, Azuma T. Acetal-photosensitized polymerization. 15 photoirradiations of maleic anhydride in the presence of 2,4,8,10-tetraoxaspiro undecane compounds[J]. Eur. Polym. J., 1982, 18: 809- 812. |
| [25] | Ouchi T, Nakamura T, Oiwa M. Cyclic acetal-photosensitized polymerization. VI. photopolymerization of 2 -vinyl-1,3-dioxolane [J]. J. Macromol. Sci. Chem.,1977, 9: 1651-1662. |
| [26] | Ouchi T, Nakamura T, Komatsu Y. Cyclic acetal-photosensitized polymerization. VII. photopolymerization of 2-vinyl-4- hydroxymethyl- 1,3-dioxolane [J]. J. Polym. Sci. Polym. Chem.,1979, 17: 147-154. |
| [27] | Ouchi T, Nanki S, Komatsu Y.Cyclic acetal-photosensitized polymerization. XII. photopolymerizations of styrene methyl methacrylate in the presence of polycyclic acetals [J]. J. Macromolecular Sc. Chem.,1980, A14(3): 277-85. |
| [28] | Mosca R, Fagnoni M, Mella M, Albini A. Synthesis of monoprotected 1,4-diketones by photoinduced alkylation of enones with 2-substituted-1,3-dioxolanes [J]. Tetrahedron, 2001, 57: 10319-10328. |
| [29] | Malatesta V, Ingold K U. Stereoelectronic effects in hydrogen atom abstraction from ethers [J]. J. Am. Chem. Soc., 1981, 103: 609-614. |
| [30] | Shi S Q, Gao H, Wu G Q, et al. Cyclic acetal as coinitiator for bimolecular photoinitiating systems [J]. Polymer, 2007, 48(10): 2860-2865. |
| [31] | Shi S Q, Gao H, Xiao P, et al. Influence of chemical structure of benzophenones and cyclic acetals on the kinetics of diacrylates [J]. Polymer Preprints, 2006, 47(2): 333. |
| [32] | Shi S Q, Gao H, Nie J. 1,3-Benzodioxole as initiator for photopolymerization of 1,6-hexanedioldiacrylate[J]. Chinese Chemical Letters, 2007, 18(6):750-753. |
| [33] | 史素青, 张琴, 高娜, 等. 单体性质对樟脑醌/胡椒环光引发活性的影响[J]. 高分子学报,2012,43(8):812-817. Shi S Q, Zhang Q, Gao N, et al. Effect of monomer characteristics on photoinitiating activity of camphorquinone/1,3-benzodioxole system[J]. Acta Polymerica Sinica, 2012, 43(8):812-817. |
| [34] | Shi S Q, Nie J. Investigation of 3,4-methylenedioxybenzene methoxyl methacrylate as coinitiator and comonomer for dental application[J]. Journal of Biomedical Materials Research Part B:Applied Biomaterials, 2007,82B:487-493. |
| [35] | Tagashira M, Ohtake Y. A new antioxidative 1,3-benzodioxole from melissa officinalis[J]. Planta Med., 1998, 64:555-558. |
| [36] | Lu Q, Xu J, Chen S, Yang F. Antioxidant activity of extracts of black sesame seed (sesamum indicum L.) by supercritical carbon dioxide extraction[J]. J. Agric. Food Chem., 2004, 52: 943-947. |
| [37] | Jurd L, Narayana V L, Pauli K D. In vivo antitumor activity of 6-benzyl-1,3-benzodioxole derivatives against the P388, L1210, B16, and M5076 murine models[J]. J. Med. Chem., 1987, 30: 1752-1756. |
| [38] | Joshi R, Kumar M S, Satyamoorthy K, et al. Free radical reactions and antioxidant activities of sesamol: pulse radiolytic and biochemical studies[J]. J Agri. Food Chem., 2005, 53: 2696-2703. |
| [39] | Hodgson E, Philpot R M. Interaction of methylenedioxyphenyl (1,3-benzodioxle) compounds with enzymes and their effect on mammals[J]. Drug. Metab. Rev., 1974, 3:231-301. |
| [40] | Wang K M,Han J, Shi S Q, et al. Effect of cyclic acetals structure on efficiency of photoinitiation[J]. Polymers for Advanced Technologies, 2010, 21(6): 430-434. |
| [41] | Yang J L, Xu F, Shi S Q, et al. Influence of structure of benzodioxole derivatives on photoinitiation efficiency of benzophenone[J]. Photochemical and Photobiological Sciences, 2012, 11(8): 1377-1382. |
| [42] | Wang K M, Yang D Z, Xiao M, et al. Sesamin as a co-initiator for unfilled dental restorations[J]. Acta Biomaterialia, 2009, 5(7): 2508-2517. |
| [43] | Wang K M, Ma G P, Xiao M, et al. Cyclic acetals as coinitiators in CQ-induced photopolymerizations[J]. Polymer Journal, 2010, 42(6):450-455. |
| [44] | Janina Kabatc. |




