2. 河南大学 化学化工学院, 河南 开封 475004
2. College of Chemistry and Chemical Engineering, Henan University, Kaifeng 475004, Henan, P. R. China
三联吡啶是一种具有较大平面共轭结构及较强配位能力的氮杂环化合物, 与过渡金属离子有较强的亲和力, 可与多种过渡金属离子如: Fe(Ⅱ)、Pt(Ⅱ)、Ru(Ⅱ)、Au(Ⅲ)等作用形成八面体构型[1]或平面四边型构型[2]的配合物. 形成的配合物往往具有良好的电学[3]、光学[4]及催化性能[2], 使其在太阳能转换[1]、传感器[2, 4]、光电材料[5, 6]等领域受到日益广泛的关注. 如: Ru(Ⅱ)-三联吡啶配合物可用作吸光及发光材料的敏化剂[7]. 三联吡啶与多数的过渡金属离子间存在金属-配体反馈键(dπ-pπ*)[1],所形成的六配位八面体结构的配位化合物具有多种用途, 如: Pt(II)-三联吡啶配合物因具有独特的发光性质使其在分子识别[2, 8]、光催化及生物活性等方面存在潜在应用[2, 9], Au(III)-三联吡 啶配合物具有抗肿瘤活性等[10]. 而具有两个三联吡啶单元的化合物与单三联吡啶化合物相比, 其通过配位作用可以形成金属离子核间距既定的链状配位聚合物, 用于灵活构建传统方法难以制备的具有优越性能的超分子化合物[11]. 通过改变配位端的数量、桥接基、金属离子,还可以得到线型、环形及树枝状等具有不同用途的配合物[1,12,13]. 如:手性基团联接的双三联吡啶化合物与Fe(II)作用可形成手性链状配位聚合物[14].
本文设计合成了联噻吩桥接的双三联吡啶化合物 (BTTPY, 图1), 并通过紫外吸收光谱、荧光光谱及核磁共振氢谱, 研究了其在酸性介质中的质子化作用.借助紫外吸收滴定法研究了其与过渡金属的配位作用, 希望通过配位方式制备出线型配位聚合物, 并使其能进一步用作分子导线.
 | 图1 化合物BTTPY的合成路线 Synthetic route to BTTPY |
试剂:无水四氢呋喃是经金属钠处理后蒸馏得到;2,5-二溴噻吩购自PacificChem;n-BuLi (Alfa Aesar, ACROS)浓度参照文献[15]标定.其它试剂:DMF (Acros)、2-乙酰吡啶 (Alfa Aesar)、 PdCl2(PPh3)2 (Aldrich)、联硼酸频那醇酯(山东潍坊奥瑞化工有限公司)、Ni(OAc)2·4H2O (科密欧)、Cd(OAc)2·2H2O (科密欧)、环己烷(CH)(Alfa, HPLC)、二氯甲烷(DCM) (Acros, 光谱纯)、甲醇(MeOH) (Aldrich, HPLC)、乙腈 (MeCN) (Scharlau, 光谱纯)、三氟乙酸 (TFA) (阿拉丁试剂, 分析纯)、乙酸 (HOAc) (开封东大化工试剂厂, 分析纯试剂).
仪器:显微熔点测定仪(TX4-100)(未经校准);AVANCE 400 M (Bruker)核磁共振谱仪; Trace DSQⅡ(Finnigan)气质联用仪(电子轰击能量70 eV);电喷雾离子源-高分辨质谱仪(Waters Micromass Q-Tof MicroTMSystem);AVATAR 360 (Nicolet)傅立叶变换红外光谱仪;Lambda35 (Perkin Elmer)紫外-可见光谱仪;Fluoro SENS-9000荧光光谱仪;日本精工SPA400原子力显微镜. 1.2联噻吩桥联双三联吡啶(BTTPY)的合成
通过图1给出的合成路线制备BTTPY,合成步骤包括2,5-二溴噻吩的单溴锂交换、DMF醛基化制备5-溴-噻吩-2-甲醛;其后经Krhnke吡啶化反应制备BrTTPY,最后经Suzuki反应制备目标化合物BTTPY. 1.2.1 化合物5-溴噻吩-2-甲醛的合成
2,5-二溴噻吩 (5.15 g, 21.3 mmol) 溶于50 mL无水THF中,调温至-78℃, 加入n-BuLi ( 7.80 mL, 21.3 mmol, 1.0 equiv ), 在-78 ℃反应2 h之后升温到0 ℃, 继续反应2 h, 降温到-78℃, 加入DMF(2.28 g, 31.2 mmol, 1.46 equiv), 自然升温至室温过夜.反应体系中加入少量水终止反应, 用氯仿 (3×30 mL) 萃取,合并有机相,有机相经无水MgSO4干燥,除去溶剂经柱层析(300—400目硅胶,洗脱液: 石油醚/氯仿=3/1),得到淡黄色的液体3.82 g, 产率 94%. 1HNMR (400 MHz ,CDCl3) :9.78 (s, 1H), 7.52 (d, J= 4.0 Hz, 1H), 7.19 (d, J= 4.0 Hz, 1H). 13CNMR (100 MHz, CDCl3) :181.71, 145.20, 136.46, 131.43, 124.98. 1.2.2 化合物 BrTTPY的合成
5-溴噻吩-2-甲醛(1.05 g, 5.48 mmol)溶于120 mL乙醇中, 加入2-乙酰吡啶(1.17 mL,10.96 mmol)、氢氧化钠(220 mg, 5.48 mmol)和氨水(25%—29%, 30 mL), 回流24h, 得到黑色的浊液, 抽滤, 收集得到的灰白色固体, 20 mL水、30 mL甲醇洗涤, 得到部分纯品; 母液使用氯仿(3×40 mL)萃取,合并有机相,有机相经无水MgSO4干燥,除去溶剂, 柱层析(中性氧化铝,洗脱液: 石油醚/氯仿 =4/1)得到另一部分纯品.合并纯品共0.71 g, 产率33 %.熔点: 209—212℃ (文献值[16] 215℃). 1HNMR (400 MHz, CDCl3) :8.72 (d, J= 4.6 Hz, 2H), 8.62 (d, J= 8.0 Hz, 2H), 8.59 (s, 2H), 7.86 (td, J1= 7.8, J2 = 1.7 Hz, 2H), 7.51 (d, J= 3.9 Hz, 1H), 7.35 (dd, J 1 = 6.8, J2 = 5.0 Hz, 2H), 7.12 (d, J= 3.9 Hz, 1H). 13CNMR (100 MHz, CDCl3) :156.23, 155.83, 149.16, 143.29, 142.52, 136.91, 131.20, 125.99, 124.02, 121.33, 116.67, 114.27. MS(EI, 70 eV): m/z= 392.93[M+]. 1.2.3 化合物BTTPY的合成
将化合物 BrTTPY (202 mg, 0.51 mmol)、醋酸钾(245 mg, 2.5 mmol)、双频那醇硼酸酯(68.3 mg, 0.27 mmol)、Pd(PPh3)2Cl2 (17.8 mg, 0.025 mmol)在氩气保护下于DMSO中回流反应, TLC检测底物消失时停止反应, 过滤, 滤饼使用氯仿洗涤, 滤液使用水洗, 无水硫酸钠干燥, 减压蒸除溶剂, 经柱层析(中性Al2O3, 淋洗液:氯仿), 得淡黄色的固体65 mg. 产率41%. 熔点>300 ℃. 1HNMR (400 MHz, CDCl3):8.77 (d, J=3.8 Hz, 4H), 8.72 (s, 4H), 8.67 (d, J=7.8 Hz, 4H), 7.90 (td, J1= 7.8, J2=1.4 Hz, 4H), 7.77 (d, J=3.8 Hz, 2H), 7.42—7.37 (m, 4H),7.35 (d, J=3.8 Hz,2H). 1HNMR(d-TFA, 400 MHz): 9.03 (d, J=5.6 Hz, 4H), 8.85 (d, J=8.1 Hz, 4H), 8.76 (t, J=7.8 Hz, 4H), 8.64 (s, 4H), 8.14 (t, J=6.6 Hz, 4H), 7.87 (d, J=3.8 Hz, 2H), 7.46 (d, J=3.8 Hz, 2H). 13CNMR (100 MHz, CDCl3) :149.95, 149.18, 148.94, 148.30, 143.87, 142.94, 138.84, 131.65, 129.72, 128.55, 126.35, 122.09. HRMS (TOF MS EI+) m/z: Calculated for [C38H24N6S2] 628.1504, found 628.1508. IR (KBr): 1599, 1583, 1565, 1470, 1309, 785 cm-1. 1.3 BTTPY与金属离子作用制备配合物
将BTTPY (22.2 mg, 0.04 mmol) 和Ni(OAC)2·4H2O(10.0 mg, 0.04 mmol) 在20 mL甲醇中回流24 h, 过滤, 收集得到的滤液, 自然挥发除去部分溶剂, 收集固体, 于80℃烘干得到棕色固体Ni-BTTPY, 27.0 mg,产率: 96%.以相同的方法制备了暗红色固体Zn-BTTPY (91%)和深绿色固体Cd-BTTPY (90%). 2 结果与讨论 2.1 BTTPY溶剂效应的研究
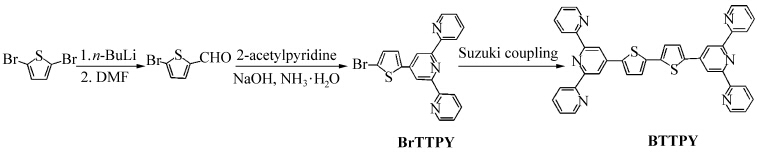
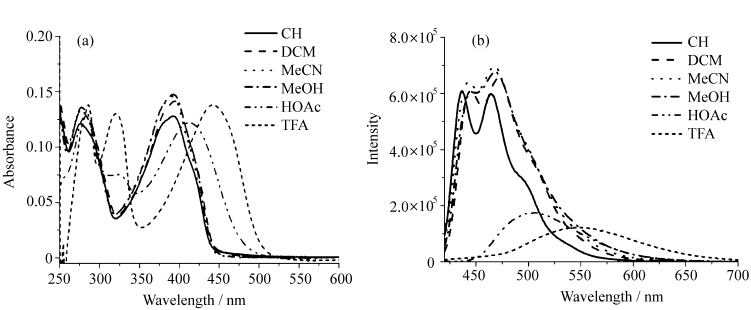
图2给出了BTTPY在不同极性溶剂中的紫外吸收(图2-a)和荧光光谱(图2-b). BTTPY具有较好的分子对称性,自身固有极性较小,吸收光谱表现为在不同极性溶剂,如:环己烷(CH)、二氯甲烷(DCM)、乙腈(MeCN)和甲醇(MeOH)中表现出类似的光谱行为,峰位没有明显移动.但在质子性溶剂乙酸(HOAc)和三氟乙酸(TFA)中其吸收光谱发生明显的红移,非质子性溶剂中277 nm处的吸收峰,分别红移至283和286 nm处, 393 nm处的吸收峰分别红移至412和444 nm处,并且在318 nm处有新的吸收峰产生. 主要是由于酸性溶剂中三联吡啶由trans-trans到cis-cis构型转变所致.在固态以及溶液状态下未配位或者未被质子化的三联吡啶,由于相邻吡啶环上α质子间存在弱的静电斥力以及相邻吡啶环上α质子与吡啶环上的N原子间存在弱的氢键吸引力,使得三联吡啶多以trans-trans的构型(图3-a)存在,当其与金属配位或者被质子化时会转变为cis-cis构型(图3-b)[17].其在酸性溶剂中,中心吡啶环上N被质子化,两侧的吡啶环发生反转, N原子与质子形成氢键,发生了如图(3-b)所示的构型转变,形成一平面性与共轭性均较好的体系,在吸收光谱上表现为强烈的红移现象并产生了由于构型转变而形成的新的吸收峰.如图2-a当使用酸性强的三氟乙酸时,最大吸收峰红移至444 nm,并且由于构型trans-trans到cis-cis的转变在318 nm处产生了新的较强吸收峰.
 | 图2 BTTPY在不同极性溶剂中的紫外吸收和荧光光谱图 The absorption and fluorescencespectra of BTTPY in different solvents [C] = 5.1 μmol/L, λex= 400 nm, slit: 2/2 |
 | 图3 三联吡啶分子的构型转变 The transformation of the two kinds of conformation for terpyridine |
同样由于分子自身的极性较小,在非质子性溶剂中BTTPY的发射光谱随溶剂的极性增加变化不大,无明显的红移(图2-b).在质子性溶剂乙酸和三氟乙酸中,由于三联吡啶部分被质子化,分子平面性与共轭范围变大,荧光发射由分子内的电荷转移态产生,从而在长波长方向上出现无精细结构的发射峰.其在乙酸中最大发射峰位在505 nm,而在三氟乙酸中的最大发射峰大幅度红移,峰位出现在550 nm,表现为强烈的质子化效应. 核磁共振光谱的变化进一步验证了这种质子化作用. BTTPY经氘代三氟乙酸质子化后, 由于氢键形成,其1HNMR谱(TFA-d)所表现出的化学位移均发生了向低场的明显漂移(表 1).由于分子内氢原子之间存在强烈的耦合作用以及质子化后中心吡啶环的影响,核磁谱图表现为不规整的三重峰和双峰[16].
| 表1 BTTPY在CDCl3及CF3COOD中氢的化学位移(400 MHz) Chemical shifts of BTTPY in CDCl3 and CF3COOD (400 MHz, ppm) |
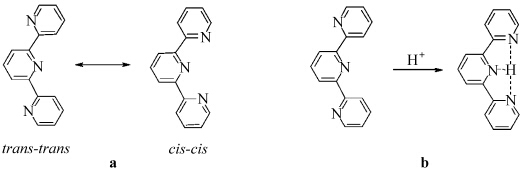
BTTPY具有两个可以与金属离子配位的三联吡啶单元, 本文通过紫外吸收滴定法研究了Ni2+、Zn2+、Cd2+、Cu2+与BTTPY的配位作用.图4-a是向BTTPY的甲醇溶液([C] = 6.3 μmol/L)中加入0—0.5当量镍离子时的吸收光谱图.随着镍离子的加入,金属-配体电荷转移(MLCT)态的吸收峰产生并逐渐增强[18, 19],表现为393 nm处吸收逐渐减弱并有微弱红移且在长波方向有新峰产生,在330 nm处也出现一随着镍离子增加逐渐增强的新吸收峰. 304、342、407 nm处出现了等吸收点,等吸收点407 nm右侧的吸收峰逐渐增强并红移至430 nm.吸收光谱的改变表明了配体BTTPY和金属离子的确发生了配位作用.等吸收点的出现,说明此时溶液中主要存在两种组分,即BTTPY和BTTPY-Ni2+形成的配合物ML2.但是当加入大于 0.5当量的镍离子时,体系中已经生成的ML2与镍离子继续配位,形成MnLn+1型低聚物,最大吸收峰 (430 nm)不再发生红移.当加入大于1当量镍离子时,配合物已无多余的配位能力,吸收光谱几乎不再变化(图4-b).从图4-b可以看出,当0≤[Ni2+]/[L]≤0.5时,约为430 nm处的吸收峰呈规律性增强;当0.5<[Ni2+]/[L]≤1时,吸收强度呈缓慢增加;当[Ni2+]/[L]>1时,吸收强度基本不再改变.由此说明BTTPY与镍离子的饱和配位比为1∶1.以相同的方法研究了BTTPY与Zn2+、Cd2+、Cu2+的配位作用, 结果见表2.由表2可以看出,通过配位作用BTTPY可与过渡金属离子(M2+)形成饱和配位比为1:1的配合物(图5).
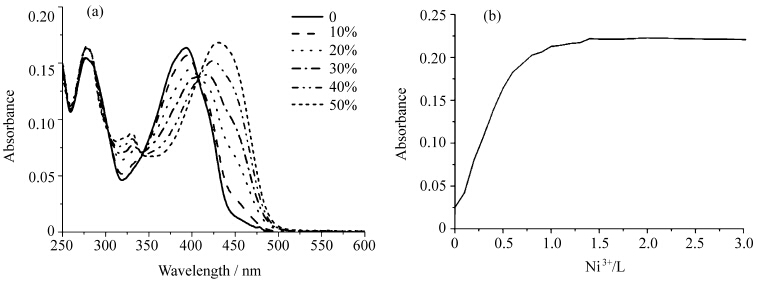 | 图4 Ni2+滴定BTTPY (6.3 μmol/L甲醇溶液)的吸收光谱图(a) 与430 nm处的吸收随[Ni2+]/[L]的变化图(b) UV-Vis titration of BTTPY(6.3 μmol/Lin menthanol) with Ni2+(a) and the absorption change at 430 nm with the ratios of [Ni2+]/[L](b) |
 | 图5 BTTPY和M2+离子形成配合物的示意图 Complexes formation from M2+and BTTPY |
| 表2 不同金属离子的饱和配位比及对应配合物的最大吸收峰位 Saturated coordinationratio and the maximum absorption peaks of M2+-BTTPY |
通过滴涂方式制备了厚度约为2 nm的Cd2+-BTTPY配合物薄膜, 原子力显微镜表征显示配合物膜中有粒径约为10 nm, 最长约100 nm棒状结构(图6),该结构的形成可能是配位化合物分子链间存在较强的π-π相互作用所致.配位聚合物作为分子导线方面的应用研究正在进行中.
 | 图6 配合物Cd2+-BTTPY的AFM图像 AFM images for complexes of Cd2+-BTTPY |
以2,5-二溴噻吩为原料,通过单醛基化、Krhnke吡啶合成反应、Suzuki偶联三步反应制备了联噻吩桥联双三联吡啶 (BTTPY),总产率为13%,并通过核磁共振氢谱、碳谱、高分辨质谱及红外光谱对其结构进行了表征.在酸性介质乙酸和三氟乙酸中BTTPY发生强烈的质子化效应,其紫外吸收光谱和荧光光谱均发生强烈红移,对应氢在核磁共振氢谱上表现出明显的低场方向漂移. BTTPY可与过渡金属离子 (Ni2+、Zn2+、Cd2+、Cu2+)形成1∶1的配合物,原子力显微镜 (AFM)表征显示, Cd2+-BTTPY配合物可生成配位聚合物, 有望应用于电致变色材料与分子导线等.
| [1] | 苑嗣纯,陈海波,王惠川. 联三吡啶配体组装及其金属配合物性能[J]. 化学进展, 2009, 21(10): 2132-2152. Yuan S C, Chen H B, Wang H C. Assembly and metal complex properties of terpyridine ligands[J]. Progress in Chemistry, 2009, 21(10): 2132-2152. |
| [2] | Eryazici I, Moorefield C N, Newkome G R. Square-planar Pd(II), Pt(II), and Au(III) terpyridine complexes: their syntheses, physical properties, supramolecular constructs, and biomedical activities[J]. Chem. Rev., 2008, 108: 1834-1895. |
| [3] | Hobara D, Kondo S, Choi M, et al. Construction of a two-dimensional molecule-nanoparticle network using iron(II) bis(terpyridine) complex formation for molecular-device applications[J]. Phys. Stat. Sol. (a), 2007, 204: 1706-1711. |
| [4] | Padilla-Tosta M, Manuel J, Martinez-Manez R, et al. Fluorescent chemosensors for heavy metal ions based on bis(terpyridyl) ruthenium(II) complexes containing aza-oxa and polyaza macrocycles[J]. Eur. J. Inorg. Chem., 2001, 6: 1475-1482. |
| [5] | Heinze K, Hempel K, Beckmann M. Multielectron storage and photo-induced olectron oransfer in oligonuclear complexes containing ruthenium(II) terpyridine and ferrocene building blocks[J]. Eur. J. Inorg. Chem., 2006, 10: 2040-2050. |
| [6] | Han F, Higuchi M, Kurth D. Metallosupramolecular polyelectrolytes self-assembled from various pyridine ring-substituted bisterpyridines and metal ions: photophysical, electrochemical, and electrochromic properties[J]. J. Am. Chem. Soc., 2008, 130: 2073-2081. |
| [7] | Vaduvescu S, Potvin P. G. Synthesis and characterization of a novel linear trinuclear ruthenium(II) complex: variation of photosensitization ability with chain length in a homologous series[J]. Inorg. Chem., 2002, 41: 4081-4083. |
| [8] | Crowley J D, Bosnich B. Molecular recognition: use of metal-containing molecular clefts for supramolecular self-assembly and host-guest formation[J]. Eur. J. Inorg. Chem., 2005, 11: 2015-2025. |
| [9] | Ma D L, Shum T Y T, Zhang F, Che C M, Yang M. Water soluble luminescent platinum terpyridine complexes with glycosylated acetylide and arylacetylide ligands: photoluminescent properties and cytotoxicities[J].Chem. Commun., 2005, 4675-4677. |
| [10] | Messori L, Abbate F, Marcon G, et al. Gold(III) complexes as potential antitumor agents: solution chemistry and cytotoxic properties of some selected Gold(III) compounds[J]. J. Med. Chem., 2000, 43, 3541-3548. |
| [11] | Kurth D, Higuchi M. Transition metal ions: weak links for strong polymers[J]. Soft Matter., 2006, 2: 915-927. |
| [12] | Constable E. Expanded ligands-an assembly principle for supramolecular chemistry[J]. Coor. Chem. Rev., 2008, 252: 842-855. |
| [13] | Constable E. 2,2':6,2″-Terpyridines: from chemical obscurity to common supramolecular motifs[J]. Chem. Soc. Rev., 2007, 36: 246-253. |
| [14] | Kimura M, Sano M, Muto T, et al. Self-assembly of twisted bridging ligands to helical coordination polymers[J]. Macromolecules, 1999, 32: 7951-7953. |
| [15] | Suffert J. Simple direct titration of organolithium reagents using N-pivaloyl-o-toluidine and/or N-pivaloyl-o-benzylaniline[J]. J. Org. Chem., 1989, 54: 509-510. |
| [16] | López R, Villagra D, Ferraudi G, et al. Preparation and photophysical properties of precursors of inorganic macromolecules. Mono and binuclear complexes of Ru(II) and terpyridine derivatized with thiophene and 4'-(5-bromothiophene) groups[J]. Inorg. Chim. Acta., 2004, 357: 3525-3531. |
| [17] | Dobrawa R, Ballester P, Chantu R, et al. Metal-containing and Metallosupramolecular Polymers and Materials[M].Washington: ACS Publications, 2006. |
| [18] | 吴世康,汪鹏飞. 有机-过渡金属配合物的三重态发光问题[J]. 影像科学与光化学, 2011, 29(2): 81-98. Wu S K, Wang P F. The organic-transition metal complex and the emission of triplet states[J]. Imaging Science and Photochemistry, 2011, 29(2): 81-98. |
| [19] | 李 立,吕小军,迟绍明,傅文甫.三联吡啶铂(II)配合物光谱性质的密度泛函研究[J].影像科学与光化学, 2010, 28(6): 433-441. Li L, LU X J, Chi S M, Fu W F. DFT studies on the spectroscopic properties of terpyridine Pt(II) complexes[J]. Imaging Science and Photochemistry, 2010, 28(6): 433-441. |




