自1972年Fujishima和Honda等发现TiO2能光解水以来,全世界掀起了TiO2应用的研究热潮[1].TiO2可作为添加材料广泛应用于涂料、油漆、塑料等领域;也可以作为光催化材料应用于环境治理、有机合成、光解水等领域.目前制备纳米TiO2的方法主要有气相氢氧焰水解法、醇盐水解法、溶胶-凝胶法、水热法、化学与电化学氧化法等[2,3,4,5,6],其中水热法由于能直接制得结晶良好且高纯的粉体,可应用于各种晶型TiO2的制备[7,8,9].在水热 合成中,不同的元素对TiO2晶体形状有较大的影响.自从2008年Yang等[10]制备获得具有{001}面的TiO2晶体以来,很多研究者利用各种合成方法和工艺等制备了形貌各异的{001}面主导的TiO2晶体材料.这些研究显示,主要是由于F元素存在,使得高能活性{001}面存在,其主要为锐钛矿型TiO2[11].其他研究表明,在SO2-4存在下,水热法制备的TiO2也主要为锐钛矿晶型[12];在Cl-存在时,水热法制备的TiO2主要为金红石晶型[13].然而,系统研究阴离子对水热制备TiO2晶体的影响却未见文献报道.
本文系统地研究了不同阴离子对水热制备TiO2晶形及光催化性能的影响。利用钛酸四丁酯在不同酸性介质中通过水热法制备纳米TiO2材料,采用X射线衍射(XRD)、扫描电子显微镜(SEM)、和紫外-可见漫反射光谱对TiO2的晶体结构及形貌进行表征,利用XPS考察阴离子掺杂状况,并利用所制备的纳米TiO2材料对罗丹明B染料进行光催化降解实验,考察其光催化性能. 1实验部分 1.1实验材料
钛酸四丁酯(化学纯)由北京益利精细化学品有限公司提供.HF、HCl、H2SO4及H3PO4等均为分析纯,购自北京北化精细化学品有限责任公司.罗丹明B为分析纯,购自Alfa Aesar公司. 1.2实验设备与分析仪器
100 mL水热反应釜(上海岩征实验仪器有限公司),JEM2010HT场发射电子显微镜(日本JEOL 公司),XRD-2000型X射线衍射仪(日本理学株式会社),UV-Vis分光光度计(UV-2450,日本岛津),微波无极紫外(主波长365 nm)灯装置为自制定做装置. 1.3纳米TiO2制备与表征
配置含有5 mol/L H+的酸性溶液(H2SO4、HCl、HF、H3PO4)60 mL,取一定量的钛酸四丁酯,边搅拌边缓慢加入上述60 mL酸性溶液中,继续搅拌30 min,将溶液转移至内层衬有聚四氟乙烯的高压釜中,在恒温烘箱中加热,控制反应温度150—180 ℃,反应24 h后取出,进行离心分离,用去离子水洗涤至中性.获得的TiO2晶体首先在105 ℃下烘2 h,再在马弗炉内450 ℃下灼烧2 h,得到具有光催化活性的TiO2纳米晶体.
本文将在H2SO4、HCl、HF和H3PO4溶液中获得的TiO2样品分别标记为TiO2-S、TiO2-Cl、TiO2-F和TiO2-P.获得的样品TiO2晶相由X射线衍射仪测定(Cu靶,Kα射线,石墨滤波,λ=0.1542 nm),采用JSM-6700F型扫描电镜观察制备样品的形貌.紫外-可见漫反射光谱在V-550 UV-Vis型带积分球紫外可见分光光度计上测量,以BaSO4为参比,狭缝宽度为2 nm,扫描速度设为200 nm/min,获取200—600 nm的漫反射光谱. XPS由K-Alpha型X射线光电子能谱仪(美国)测定,扫描步长为1 eV. 1.4光催化实验
配置一定浓度的罗丹明B溶液,取20 mL置于反应器中,加入一定量的水热合成TiO2作为催化剂,用0.1 mol/L NaOH或HCl调节溶液pH值.将配好的溶液置于微波激发紫外无极灯反应装置中进行光催化降解实验,为了保证催化剂充分发挥催化作用,本试验通过向反应器通入定量的空气进行搅拌,使催化剂处于悬浮状态.反应后的溶液通过离心分离去除TiO2,利用紫外-可见分光光度计在554nm波长处测定上清液中罗丹明B的浓度. 2结果与讨论 2.1材料表征
为了获得不同阴离子对水热反应制备TiO2形貌和晶型的影响,本实验利用SEM和XRD分别对所制备的样品进行了分析.图1显示了4种样品的SEM图片.由图1可见,由H2SO4所制备的纳米TiO2-S具有较小的粒径,其粒径在20 nm左右,所以由H2SO4所制备的纳米TiO2-S应该具有较高的比表面积,对染料具有较高的吸附性,从后续吸附试验可以得到证明.由HF所制备的纳米TiO2-F为十面体结构,其粒径在3 μm左右,大量文献显示较大的面为001面[10, 11, 14, 15, 16],该面具有很高的催化活性.由HCl所制备的纳米TiO2-Cl为刺球型结构,其球径为7 μm左右,刺棒的截面为500 nm矩形结构.由H3PO4所制备的纳米TiO2-P为大小不一的纳米粒子和块状结构组成.
 | 图1 不同阴离子条件下水热合成纳米TiO2的SEM图片 SEM photo of TiO2 prepared with hydrothermal synthesis under different anions a.TiO2-S,b.TiO2-F,c.TiO2-Cl,d.TiO2-P |
图2为4种样品的XRD图谱.由图2可见,TiO2-S和TiO2-F的XRD图谱均出现了25.4°、37.0°、37.9°、38.6°、48.1°、54.0°、55.1°处的衍射峰,与TiO2的PDF标准卡片(卡片号: 21-1272)对照可知,这些峰值均为锐钛矿所对应的峰值.因此,由H2SO4及HF所制备的纳米TiO2材料均为锐钛矿型相.TiO2-Cl的XRD图谱出现了27.5°、36.1°、41.3°、54.4°、56.7°处的衍射峰,与TiO2的PDF标准卡片(卡片号: 21-1276)对照可知,这些峰值均为金红石所对应的峰值,因此,由HCl所制备的纳米TiO2材料为金红石型相.TiO2-P的XRD图谱出现了24.2°、27.5°、38.6°、48.1°处的衍射峰,这些峰值分别是锐钛矿、金红石、板钛矿所对应的峰值,因此,由H3PO4所制备的纳米TiO2材料为锐钛矿、金红石、板钛矿的3种混合相.
 | 图2 不同阴离子条件下水热合成纳米TiO2的XRD图谱 XRD patterns of TiO2 prepared with hydrothermal synthesis under different anions a.TiO2-S,b.TiO2-F,c.TiO2-Cl,d.TiO2-P |
图3显示了4种样品的紫外-可见漫反射光谱.TiO2-F和TiO2-S的漫反射光谱基本相似,其吸收边带在386 nm左右,其对应的禁带宽度E=3.2 eV,这是典型的锐钛矿的吸收边带和禁带宽度[17],这进一步证实了在HF和H2SO4溶液中制备的TiO2为锐钛型.TiO2-Cl的漫反射光谱的吸收边带为410 nm左右,其对应的禁带宽度E=3.02 eV,这是典型的金红石晶相的吸收边带和禁带宽度[17],表明在HCl溶液中制备的TiO2为金红石型.TiO2-P的漫反射光谱的吸收边带表现为多个,这表明在H3PO4溶液中制备的TiO2为混合晶相.紫外-可见漫反射光谱进一步证实了XRD的试验结果。
 | 图3 纳米TiO2的紫外-可见漫反射光谱 UV-visible diffuse reflection spectra of TiO2 prepared with hydrothermal synthesis under different anions a.TiO2-S,b.TiO2-F,c.TiO2-Cl,d.TiO2-P |
图4为样品的XPS谱.从图4可见,4种样品都出现了Ti2s、Ti2p、 Ti3s、Ti3p、O1s的峰,这证实了它们均含有Ti和O这两种元素,形成了Ti-O键[18].但也都出现了各自特有的电子能谱峰,TiO2-S、TiO2-F、TiO2-Cl和TiO2-P分别出现了S2p、F1s、Cl2p和P2p的电子能谱峰.这表明在不同阴离子溶液中,水热制备的TiO2样品都掺杂了各自的元素.这些元素的掺杂对TiO2的晶形和光催化活性都可能有一定的影响[18]①.
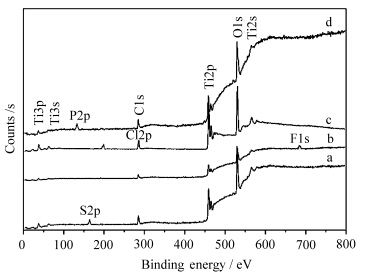 | 图4 纳米TiO2的XPS谱 XPS spectra of TiO2 prepared with hydrothermal synthesis under different anions a.TiO2-S,b.TiO2-F,c.TiO2-Cl,d.TiO2-P |
本实验采用罗丹明B染料光催化目标物,利用在上述4种条件下制备的TiO2进行光催化性能实验研究.分别考察了pH值、微波功率、催化剂用量、反应时间对光催化氧化反应的影响. 2.2.1 pH值
pH值对光催化氧化起着双重作用.对TiO2的影响,当pH低于TiO2的等电点时,TiO2表面带正电荷,有利于光生电子与吸附的O2结合而形成H2O2进而生成HO·,抑制了电子与空穴的复合,提高了反应速率;当pH较高时,TiO2表面带负电荷,有利于空穴向表面迁移,与吸附于表面的H2O、OH-等反应生成HO·,易于光催化降解反应的发生[19, 20].同时,pH对目标物也有相似的影响,罗丹明B在酸性条件下带正电荷,在碱性条件下带负电荷.因此,光催化反应应该有一最佳pH值.
下页图5为4种TiO2样品在不同pH值下的光催化降解罗丹明B的实验结果.由图5可见,在降解罗丹明B时,pH变化使TiO2-S和TiO2-P对罗丹明B的光催化降解率有一峰值,TiO2-S和TiO2-P对应的峰值分别在4—5和5.5—6.5之间.这表明在H2SO4溶液中制备的纳米TiO2-S的等电点比在H3PO4溶液中制备的纳米TiO2-P的等电点要低.而在所考察的pH值范围内,在TiO2-Cl和TiO2-F对罗丹明B的光催化降解率随着pH值的增加而降低.这表明不同酸性条件下,制备的TiO2材料的等电点有所不同.
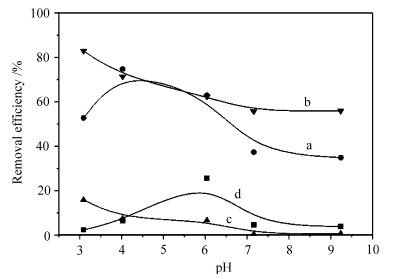 | 图5 pH值对光催化降解罗丹明B的影响 Effect of pH on the photocatalytic degradation of Rhodamine B a.TiO2-S,b.TiO2-F,c.TiO2-Cl,d.TiO2-P |
在微波无极紫外灯系统中,微波功率直接影响到紫外光的强度.因此,微波功率的大小将影响光催化降解效果.图6显示了微波功率对4种样品光催化降解罗丹明B的影响.由图6可见,随着微波功率的增大,在相同时间内,TiO2-P、TiO2-S、TiO2-Cl和TiO2-F对罗丹明B的降解率随着微波功率的增大而增大.这是由于微波功率的增加,导致紫外光光强增大,从而使得光催化产生的光生电子和空穴对增多,进一步使得罗丹明B的 降解率提高.在相同微波功率条件下,TiO2-S和TiO2-F的降解效率要远远高于TiO2-Cl和TiO2-P的降解效率.从XRD的分析可知,TiO2-S和TiO2-F同为锐钛矿晶型,而TiO2-Cl为金红石晶型,TiO2-P为锐钛矿、金红石和板钛矿的混合晶型.因此,表明锐钛矿的光催化活性要强于金红石和板钛矿的光催化活性.
 | 图6 微波功率对光催化降解罗丹明B的影响 Effect of microwave power on the photocatalytic degradation of Rhodamine B a.TiO2-S,b.TiO2-F,c.TiO2-Cl,d.TiO2-P |
目前,已有许多关于TiO2浓度对常规光催化氧化有机物的影响研究,这些研究均明确了优化这一因素的重要性.催化剂的用量均存在一个最佳值,如果催化剂用量过小,则催化效果不大,影响有机物的降解;如果催化剂用量过大,将会阻碍光在体系中的透射.图7显示了本实验所制备的4种催化剂的用量对微波激发无极紫外灯光催化效果的影响.
 | 图7 催化剂用量对光催化降解罗丹明B的影响 Effect of catalyst dosage on the photocatalytic degradation of Rhodamine B a.TiO2-S,b.TiO2-F,c.TiO2-Cl,d.TiO2-P |
从图7可见,随着催化剂用量的增大,罗丹明B的降解率也随之增加.这主要是由于随着纳米TiO2催化剂投入量增大,其表面形成的活性空穴和氢氧自由基·OH就增多,降解率也就越高.但在催化剂达到一定值(10 mg)以后,继续增加催化剂量则对罗丹明B的降解率略有降低,主要原因是催化剂量过大时,高浓度的悬浮液使得体系的透光性降低,从而导致罗丹明B的降解率略显下降.
下页图8显示的是催化剂用量为10 mg/L时,罗丹明B溶液降解后的颜色,从图8可以直观地看出,TiO2-F光催化降解后的溶液颜色最浅,而TiO2-P光催化降解后的溶液颜色最深.这表明TiO2-F光催化活性在4种样品中最高.
 | 图8 光催化降解后罗丹明B溶液的颜色 Final color of Rhodamine B solution with photocatalytic degradation |
下页图9给出了反应时间对罗丹明B光催化降解的影响.由于本实验反应体积仅为 20 mL,为了防止取样对浓度的影响,因此,采用每个时间一个样品的实验法测定时间对光催化效果的影响.由图9可见,当光催化降解时间低于30 min时,TiO2-S和TiO2-F对 罗丹明B的光催化降解效率随着反应时间的延长而急剧增加,当反应时间达到30 min时,光催化降解效率达到最大.然而,TiO2-P和TiO2-Cl对罗丹明B的光催化降解效率随着反应时间的延长而缓慢增加,在该实验条件下,几乎看不出最大值.这可能是由于TiO2-P和TiO2-Cl在微波无极紫外灯下的光催化能力较弱,使得罗丹明B的降解速率非常缓慢所至.这进一步证实了锐钛矿的光催化活性要强于金红石和板钛矿的光催化活性.
 | 图9 反应时间对光催化降解罗丹明B的影响 Effect of reaction time on the photocatalytic degradation of Rhodamine B a.TiO2-S,b.TiO2-F,c.TiO2-Cl,d.TiO2-P |
从前面的SEM测试,我们可以看出不同条件下制备的TiO2粒子大小有很大差别,因而比表面积会有较大的差异,进而影响其吸附能力.因此,为了探索该过程的罗丹明B的去除机理,我们首先研究了TiO2-P、TiO2-S、TiO2-Cl和TiO2-F的吸附能力.分别将TiO2-P、TiO2-S、TiO2-Cl和TiO2-F这4种催化剂各10 mg加入到15 mL 浓度为10 mg/L的罗丹明B染料溶液中.试验过程中不加微波和无极紫外灯,其他条件与光催化实验相同,试验所得吸附数据如表1所示.
| 表1 Ti2O-P、Ti2O-S、Ti2O-Cl和Ti2O-F对罗丹明B的吸附量 The adsorption amount of Rhodamine B on Ti2O-P,Ti2O-S,Ti2O-Cl,and Ti2O-F |
由表1可以看出,其吸附量大小顺序为TiO2-S>TiO2-P>TiO2-F>TiO2-Cl.从光催化过程来看,在实验条件都相同的情况下,被降解物质的光催化快慢取决于其在催化剂表面的吸附.因此,4种催化剂的降解效果应该与吸附大小的顺序相同.然而,光催化实验结果却显示出了较大差异.这表明罗丹明B在催化剂TiO2-P、TiO2-S、TiO2-Cl和TiO2-F上的降解过程有较大的差异.TiO2-F的光催化活性在这4种催化剂中是最高的,这应该归功于TiO2-F有较大面积的{001}面,而TiO2-P的光催化活性是最低的,虽然其吸附量比TiO2-Cl和TiO2-F要高,但由于TiO2-P中含有大量光催化活性很低的板钛矿.因此,TiO2的3种晶型的光催化活性应该为:锐钛矿>金红石>板钛矿.在锐钛矿中,{001}面的光催化活性又是最高的.另外,可能由于阴离子的掺杂使得制备的TiO2光催化活性也有一定的影响,F的掺杂能迅速夺取光催化产生的电子,从而实现光生电子/空穴对的有效快速分离,达到较好的光催化效果[18].
有机碳(TOC)的测定能很好地反映有机物矿化情况,因此本实验测定了罗丹明B溶液被所制备的4种TiO2样品降解3 h后的TOC,被TiO2-S、TiO2-F、TiO2-Cl和TiO2-P光催化降解的罗丹明B溶液TOC分别为3.11 mg/L、2.98 mg/L、4.02 mg/L、5.13 mg/L.这表明虽然被TiO2-F降解后的溶液颜色几乎完全去除,但是罗丹明B并没有被完全矿化.因此,本实验中的光催化仅将大分子罗丹明B降解为了小分子,大部分小分子有机物未被进一步矿化. 3 结论
本文通过水热法在4种不同酸性介质中合成了不同晶型和不同形貌的TiO2纳米材料,并将其应用于光催化降解罗丹明B染料.从SEM、XRD、紫外-可见漫反射、XPS以及染料光催化降解实验可以看出,由H2SO4所制备的纳米TiO2-S由较小纳米粒子构成、其晶型为具有高光催化活性的锐钛矿相,因此,对罗丹明B染料具有很高的降解率.由HF所制备的纳米TiO2-F是十面体结构,其晶型也为锐钛矿,由于粒子较大吸附性能较差,但具有催化活性很强的{001}晶面,因此,其对罗丹明B染料也具有很高的降解率,但在本实验条件下,罗丹明B仍没有被完全矿化.由HCl所制备的纳米TiO2-Cl材料具有最低的吸附性能,以及光催化性能较低的金红石相晶型,因此,其对罗丹明B染料的降解率较低.由H3PO4所制备的纳米TiO2-P为锐钛矿、金红石、板钛矿混合晶型,虽然吸附性能较高,但是对罗丹明B染料的降解率最低.综上可知,阴离子对水热合成TiO2的晶型、形貌和光催化活性都有较大的影响,其光催化活性除了受晶形、高能活性面影响外,还可能受到阴离子掺杂的影响.
| [1] | Fijishima A, Honda K. Electrochemical photolysis of water at a semiconductor electrode [J]. Nature, 1972, 238(5358): 37-38. |
| [2] | 陈晓慧, 柳丽芬, 杨凤林,等.CdS/TiO2光催化去除水体中氨氮的研究[J].感光科学与光化学 2007. 25(2): 89-101. Chen X H, Liu L H,Yang F L, et al. Removing ammonia nitrogen from water using CdS/TiO2photocatalyst[J]. Photographic Science and Photochemistry, 2007, 25(2): 89-101. |
| [3] | 吴孟强, 张其翼,陈艾,等.凝胶水热法制备纺锤形TiO2粉体 [J].硅酸盐学报, 2002, 30(1): 108-111. Wu M Q, Zhang Q Y, Chen A. et al. Synthesis of spindle type titania particles by the gel-hydrothermal process [J]. Journal of the Chinese Ceramic Society, 2002, 30(1): 108-111. |
| [4] | 李雪飞, 矫庆泽,赵 芸.水热法制备TiO2一维纳米材料研究进展 [J].化工进展, 2011, 30(2): 332-338. Li X F, Jiao Q Z, Zhao Y. et al. Hydrothermal synthesis of one-dimensional TiO2 nanomaterials [J]. Chemical Industry and Engineering Progress, 2011, 30(2): 332-338. |
| [5] | Huang J Q, Cao Y G, Huang Q F, et al. High-temperature formation of titanate nanotubes and the transformation mechanism of nanotubes into nanowires [J]. Cryst.Growth Design, 2009, 9(8): 3632-3637. |
| [6] | 王东波, 吴季怀, 郝三存, 等. 纳米二氧化钛的水热法制备及在染料敏化太阳能电池中的应用[J]. 感光科学与光化学, 2006, 24(3): 173-179. Wang D B, Wu J H, Hao S C, et al. Preparation nano-TiO2 by hydrothermal method and its application in dye sensitized solar cell[J]. Photographic Science and Photochemistry, 2006, 24(3): 173-179. |
| [7] | Kasuga T, Hiramatsu M, Hoson A, et al. Titania nanotubes prepared by chemical processing[J]. Adv. Mater., 1999, 11(15): 1307-1311. |
| [8] | 黄 涛, 张国亮, 蒋华兵,等.高性能纳米二氧化钛制备技术研究进展[J].化工进展, 2010, 29(3): 498 -504. Huang T, Zhang G L, Zhang H B, et al. Progress in preparation of TiO2 nanoparticles with high performance[J]. Chemical Industry and Engineering Progress, 2010, 29(3): 498 -504. |
| [9] | 黄 晖, 罗宏杰, 杨 明,等.水热沉淀法制备TiO2纳米粉体的研究[J].硅酸盐通报, 2000, 19(4): 8-12. Huang H, Luo H J, Yang M, et al. Preparation of nanocrystalline titania powders by hydrothermal precipitation [J]. Bulletin of Thechinese Ceramic Society, 2000, 19(4): 8-12. |
| [10] | Yang H G, Sun C H, Qiao S Z, et al. Anatase TiO2 single crystals with a large percentage of reactive facets[J]. Nature, 2008, 453(7195): 638-641. |
| [11] | Pan J, Liu G, Lu G Q, et al. On the true photo-reactivity order of {001}, {010}, and {101} facets of anatase TiO2: crystals[J]. Angew. Chem., Int. Ed., 2011, 50(9): 2133-2137. |
| [12] | 朱 地, 刘冉冉,李海龙,等. 水热法制备不同晶粒尺寸的纳米二氧化钛[J].北京大学学报(自然科学版), 2010, 46(4): 525-530. Zhu D, Liu R R, Li H L, et al. Hydrothermal synthesis of titania powder with different particle sizes[J]. Acta Scientiarum Naturalium Universitatis Pekinensis, 2010, 46(4): 525-530. |
| [13] | Liu B, Eray S A. Growth of oriented single-crystalline rutile TiO2 nanorods on transparent conducting substrates for dye-sensitized solar cells[J]. J. Am. Chem. Soc., 2009,131 (11): 3985-3990. |
| [14] | Sofianou M, Trapalis C, Psycharis V, et al. Study of TiO2 anatase nano and microstructures with dominant {001} facets for NO oxidation[J]. Environ. Sci. Pollut. Res., 2012, 19(9): 3719-3726. |
| [15] | Zhao Z, Sun Z, Zhao H, et al. Phase control of hierarchically structured mesoporous anatase TiO2 microspheres covered with {001} facets[J]. J. Mater. Chem., 2012, 22(41): 21965-21971. |
| [16] | Chen Q, Ma W, Chen C, et al. Anatase TiO2 mesocrystals enclosed by (001) and (101) facets: synergistic effects between Ti3+ and facets for their photocatalytic performance[J]. Chem.-Eur. J., 2012, 18(40): 12584-12589. |
| [17] | Haidry A A, Puskelova J, Plecenik T, et al. Characterization and hydrogen gas sensing properties of TiO2 thin films prepared by sol-gel method[J]. Appl. Surf. Sci., 2012, 259(15): 270-275. |
| [18] | Zhang H, Liu P, Li F, et al. Facile fabrication of anatase TiO2 microspheres on solid substrates and surface crystal facet transformation from {001} to {101}[J]. Chem.-Eur. J.,2011, 17(21): 5949-5957. |
| [19] | 艾智慧,姜军清,杨鹏,等.微波辅助光催化降解4-氯酚的研究 [J].工业水处理. 2004, 24(3): 41-44. Ai Z H, Jiang J Q, Yang P, et al. Microwave assisted UV electrodeless discharge lamp photocatalysis degradation of 4-chlorophenol in titanium dioxide suspensions [J]. Industrial Water Treatment, 2004, 24(3): 41-44. |
| [20] | Horihoshi S, Hidaka H, Serpone N. Effects of microwave, UV, and O3 on propylene gas degradation via photocatalytic reaction with CVD TiO2 films[J]. J. Photochem. Photobiol. A: Chem.,2003,159(6): 289-296. |




