2. 上海交通大学 化学化工学院,上海200240
2. School of Chemistry and Chemical Technology, Shanghai Jiao Tong University, Shanghai 200240, P.R.China
相对于传统无机材料,有机光电材料具有更好的可设计性与可控性[1,2,3],因此人们对有机化合物的光电性质产生了越来越多的兴趣.尤其在近二、三十年来,有机光电材料由于其在有机场效应晶体管(OFETs)、有机光伏材料(OPVs)、有机发光二极管(OLEDs)等方面的广泛应用前景,已经成为新型功能材料的研究热点之一[4].设计、合成光电性质优异的有机共轭分子,是开发新型有机半导体材料的关键所在[5].
在有机分子的共轭骨架中引入杂原子是获得有机半导体材料的有效途径之一,如Bunz和Miao的课题组在氮杂环分子方面的研究结果[6,7,8,9].在富氮杂环类化合物中,哒嗪(1,2-二嗪)、嘧啶(1,3二嗪)、吡嗪(1,4二嗪)受到了广泛关注[10].其中哒嗪衍生物具有缺电子特性,是构筑有机功能性分子的重要片段.比较典型的是与供电子单元构成推-拉共轭体系(D-A,其中D:Donor,代表电子供体;A:Acceptor,代表电子受体),可用于发展非线性光学材料以及窄能隙半导体材料等[11],如Tobin J Marks等人合成了一系列由噻 吩和哒嗪作为主要功能构筑片段的共轭小分子[12].
本文基于以上思路,设计并合成了有机共轭小分子1,4-二(2-噻吩基)苯并[c]哒嗪(5a)、1,4-二[2-(3-己基噻吩基)]苯并[c]哒嗪(5b)和1,4-二[2-(5-己基噻吩基)]苯并[c]哒嗪(5c):在共轭主链上引入哒嗪分子,并将哒嗪单元稠环化,在引入氮原子的同时,扩大共轭平面,以调节光电性质;引入电子供体噻吩分子,形成推-拉结构,此外已有相关报道,含氮硫的分子存在分子内的S…N相互作用[13],这种相互作用使得分子内S、N的距离小于范德华力,不仅增强了分子的共轭性,而且对形成分子间的堆积有重要影响;在噻吩结构单元的不同位置引入烷基链可以增加溶解性,同时,利用其位阻效应可以调控分子的共轭平面,利用其电子效应来影响分子的电子结构,进而对化合物的光电性能产生影响.通过光谱分析对这类分子的结构-性能关系进行了较为系统的研究. 1 实验部分 1.1实验药品与仪器
试剂:三乙胺,分析纯,上海阿拉丁;2-巯基吡啶,分析纯,上海达瑞;邻苯二甲酰氯, 分析纯,上海阿拉丁;2-溴噻吩,分析纯,上海阿拉丁;3-溴-2-己基噻吩,分析纯,上海阿拉丁;5-溴-2-己基噻吩,分析纯,上海阿拉丁;镁条,化学纯,国药;水合肼,分析纯,上海阿拉丁.
 | 图1 5a—c的合成路线 The synthetic scheme of 5a—c |
仪器:紫外-可见吸收光谱由紫外光谱仪HITACHI Spectrophotometer U-4100测定;荧光光谱由HORIBA Scientific Fluoromax-4 Spectrofluorometer测定;熔点由JingSong X-4A 熔点仪测定;核磁由Mercury Plus 400 (400 MHz for proton) 测定;质谱由超高效液相色谱-四级杆飞行时间质谱联用仪(沃特斯公司,Q-Tof Premier)测定. 1.2中间体以及目标化合物的合成
本文主要合成了以苯并哒嗪为核心、噻吩衍生物作为共轭延长链的新型化合物.化合物5a—c均是以邻苯二甲酰氯为起始原料,由于酰氯与格式试剂反应过于剧烈,不利于控制,所以采用间接的方式引入噻吩基团.即酰氯与2-巯基吡啶反应,引入巯基吡啶基团,作为离去基团,与噻吩格式试剂反应,引入噻吩基团.最后采用强还原剂水合肼对化合物4a—c还原关环,同时引入氮原子. 1.2.1 化合物2 [14]
0 ℃氮气氛围下,将15 mL 三乙胺与2-巯基吡啶(10.7 g,0.10 mol)溶于150 mL 精制四氢呋喃中搅拌,并将邻苯二甲酰氯(9.1 g,0.045 mol)溶于50 mL精制四氢呋喃中,迅速加入其中.反应溶液搅拌10 min后迅速加入盐酸溶液(1%,100 mL)淬灭反应,二氯甲烷萃取,合并有机相,分别用氢氧化钠溶液(10%,100 mL)、 碳酸氢钠溶液(1 mol/L,100 mL)、水洗涤,二氯甲烷萃取,无水硫酸镁干燥,旋蒸除去溶剂.使用二氯甲烷/乙醚重结晶纯化,得到白色固体13.3 g,收率84%.m.p.109—110 ℃.1HNMR (400 MHz,CDCl3):8.64 (d,J=4.4 Hz,2H),7.89(dd,J=5.6,3.2 Hz,2H),7.79(d,J=1.6 Hz,2H),7.77(d,J=2.0 Hz,2H),7.66(dd,J=5.6,3.2 Hz,2H),7.34—7.30(m,2H). 1.2.2 化合物4a
氮气氛围下,将2-溴噻吩(2.45 g,14.89 mmol)溶于50 mL精制四氢呋喃中,缓慢滴加到碘掺入的镁屑(0.38 g,15.60 mmol)中,从而形成格式试剂,保持35—40 ℃反应3 h.0 ℃氮气氛围下,将格式试剂缓慢滴加进化合物2 (2.5 g,7.09 mmol) 的40 mL四氢呋喃中搅拌,自然升温并反应过夜.加入盐酸溶液(10%,100 mL)淬灭反应,乙醚萃取,合并有机相.分别用氢氧化钠溶液(10%,100 mL)、 碳酸氢钠溶液(1 mol/L,100 mL)、水洗涤,乙醚萃取,硫酸镁干燥,旋蒸除去溶剂.使用二氯甲烷/正己烷重结晶纯化,得到浅黄色固体1.37 g,收率66%.m.p.145—146 ℃. 1HNMR (400 MHz,CDCl3):7.73 (dd,J=5.6,3.2 Hz,2H),7.66 (dd,J=5.2,1.2 Hz,2H),7.63(dd,J=5.6,3.2 Hz,2H),7.47(dd,J=4.0,1.2 Hz,2H),7.06(dd,J=4.8,3.6 Hz,2H). 13CNMR (100 Hz,CDCl3): 188.52,144.29,139.58,135.36,130.85,129.45,129.45,128.25. 1.2.3 化合物4b
氮气氛围下,将3-溴-2-己基噻吩(5 g,0.02 mol)溶于25 mL精制四氢呋喃中,缓慢滴加到碘掺入的镁屑(0.59 g,0.024 mol)中,保持35—40 ℃反应3 h.0 ℃氮气氛围下,将格式试剂缓慢滴加进2(2.38 g,6.7 mol)的30 mL四氢呋喃中搅拌,自然升温并反应过夜.加入盐酸溶液(10%,100 mL)淬灭反应,二氯甲烷萃取,合并有机相.分别用氢氧化钠溶液(10%,100 mL)、 碳酸氢钠溶液 (1 mol/L,100 mL)、水洗涤,二氯甲烷萃取,硫酸镁干燥,旋蒸除去溶剂.使用层析柱(二氯甲烷/石油醚=1/1)纯化,得到桔黄色油状物2.22 g,收率71%. 1HNMR (400 MHz,CDCl3):7.64(dd,J=5.6,3.2 Hz,2H),7.51(dd,J=5.6,3.2 Hz,2H),7.38(d,J=4.8 Hz,2H),6.95(d,J=5.2 Hz,2H),2.80(t,J=8.0 Hz,4H),1.58—1.50(m,4H),1.30—1.21(m,12H),0.85(t,J=7.2 Hz,6H). 13CNMR (100 Hz,CDCl3):189.14,151.89,141.40,135.73,131.82,131.21,130.33,129.24,31.87,30.49,30.27,29.47,22.84,14.34. 1.2.4 化合物4c
氮气氛围下,将5-溴-2-己基噻吩(1 g,4.05 mmol)溶于5 mL精制四氢呋喃中,缓慢滴加到碘掺入的镁屑(0.12 g,4.85 mmol)中,保持35—40 ℃反应3 h,反应溶液呈棕灰色.0 ℃氮气氛围下,将格式试剂缓慢滴加进化合物2(0.47 g,1.35 mmol)的30 mL四氢呋喃中搅拌,自然升温并反应过夜.加入盐酸溶液(10%,100 mL)淬灭反应,二氯甲烷萃取,合并有机相.分别用氢氧化钠溶液(10%,100 mL)、 碳酸氢钠溶液 (1 mol/L,100 mL)、水洗涤,二氯甲烷萃取,硫酸镁干燥,旋蒸除去溶剂.使用层析柱(二氯甲烷/石油醚=1/1)纯化,得到桔黄色油状物0.42 g,收率67%. 1HNMR (400 MHz,CDCl3):7.69 (dd,J=5.6,3.2 Hz,2H),7.59(dd,J=5.6,3.2 Hz,2H),7.25(d,J=4.0 Hz,2H),6.74(d,J=4.0 Hz,2H),2.80(t,J=7.6 Hz,4H),1.70—1.62(m,4H),1.39—1.27(m,12H),0.89(t,J=6.8 Hz,6H). 13CNMR (100 Hz,CDCl3): 179.84,157.56,141.84,139.61,136.02,130.60,129.31,125.82,31.72,31.53,30.95,28.92,22.77,14.30. 1.2.5 化合物5a
将4a (1.4 g,4.7 mmol)与水合肼(0.47 g,9.38 mmol)溶于125 mL乙醇中室温下搅拌过夜.旋蒸除去溶剂,重结晶(二氯甲烷)纯化,得到0.92 g浅黄色固体,收率67%. m.p.140—141 ℃. 1HNMR (400 MHz,CDCl3): 8.57(dd,J=3.2,6.0 Hz,2H),7.95(dd,J=3.6,6.4 Hz,2H),7.73(d,J=3.6 Hz,2H),7.61(d,J=5.2 Hz,2H),7.27—7.26(m,2H). 13CNMR (100 Hz,CDCl3):152.58,139.25,132.71,129.98,129.37,127.90,126.25,125.40. HRMS-ESI: m/z: calcd for C16H10N2S2: 295.0364[M+H+]; found: 295.0367. 1.2.6 化合物5b
在常温氮气氛围下,将4b (2.07 g,4.43 mmol)与水合肼(0.24 g,4.74 mmol)溶于20 mL乙醇中室温下搅拌过夜.通空气后,反应溶液加热至80 ℃,加热回流一天.旋蒸除去溶剂,层析柱(二氯甲烷/石油醚=1/2)纯化,得到2.05 g浅黄色油状物,收率98%. 1HNMR (400 MHz,CDCl3):8.05(dd,J=6.27,3.32 Hz,2H),7.86(dd,J=6.35,3.26 Hz,2H),7.51(d,J=5.11 Hz,2H),7.14(d,J=5.12 Hz,2H),2.58(t,J=8.0 Hz,4H),1.55(td,J=15.2,7.6 Hz,4H),1.18—1.09(m,12H),0.76(t,J=7.2 Hz,6H). 13CNMR (100 Hz,CDCl3):154.63,143.98,132.54,130.92,129.25,127.00,126.77,31.69,30.74,29.45,29.15 22.68,14.25. HRMS-ESI m/z: calcd for C28H34N2S2: 463.2242[M+H+]; found: 463.2244. 1.2.7 化合物5c
在常温氮气氛围下,将4c (0.4 g,0.86 mmol)与水合肼(0.057 g,1.03 mmol)溶于20 mL乙醇中室温下搅拌过夜.通空气后,反应溶液加热至80 ℃,加热回流一天.旋蒸除去溶剂,层析柱(二氯甲烷/石油醚=1/2)纯化,得到0.83 g浅黄色固体,收率95%.m.p.63—65 ℃.1HNMR (400 MHz,CDCl3):8.57(dd,J=6.4,3.6 Hz,2H),7.92(dd,J=6.4,3.2 Hz,2H),7.54(d,J=3.6 Hz,2H),6.93(d,J=3.6 Hz,2H),2.92(t,J=8.0 Hz,4H),1.81—1.73(m,4H),1.48—1.40(m,4H),1.38—1.31(m,8H),0.91(t,J=7.2Hz,6H). 13CNMR (100 Hz,CDCl3):152.2,150.47,136.70,132.37,130.06,126.26,125.19,31.85,30.57,29.95,29.10,22.86,14.37. HRMS-ESI m/z: calcd for C28H34N2S2: 463.2242[M+H+]; found: 463.2239. 2结果与讨论 2.1 5a—c的紫外吸收光谱
图2是室温下,化合物5a—c二氯甲烷溶液(2.0×10-5 mol/L)的紫外吸收光谱图,所得的吸收峰数据列于表1中.从化合物5a—c的紫外-可见吸收光谱可以看出,目标分子的吸收的吸收峰集中在300—500 nm区域,最大吸收峰波长呈现5c > 5a > 5b的规律.
 | 图2 5a—c的紫外吸收光谱图 The UV spectrum of 5a—c |
| 表1 化合物5a—c在二氯甲烷中的光谱数据 Optoelectronic data of compounds 5a—c in CH2Cl2 |
根据化合物的紫外吸收光谱,目标分子中烷基链的不同位置对这些苯并哒嗪类小分子的溶解性和光学性质有明显的影响.对比于没有烷基链取代的化合物5a,烷基链取代的化合物5b的吸收峰蓝移了22 nm,这是因为5b的烷基取代基位于噻吩基团的β位上,临近苯并哒嗪片段,有较大的位阻效应,所以共轭性降低.与此相反,烷基链取代在噻吩α位上的化合物5c的吸收峰红移了21 nm,在这种情况下,烷基链起到了推电子的作用.
有机半导体材料的能带间隙(Eg)是指有机分子的HOMO(最高占据分子轨道)与LUMO(最低未占据分子轨道)的能量差,可由紫外-可见吸收光谱的低能吸收边来确定.化合物5a—c的Eg大小呈现5c<5a<5b的规律,说明化合物的烷基链取代位置会影响其光电性质. 2.2 5a—c的荧光光谱
图3是室温下,化合物5a—c二氯甲烷溶液(2.0×10-6 mol/L)分别在345 nm、323 nm、366 nm激发波长,狭缝为4 nm的条件下的荧光光谱图,且最大峰波长呈现5c>5a>5b的规律.其中,5b(λmax=386 nm)与5a(λmax=359 nm)相比,发光峰有明显的蓝移,这表明具有较大空间位阻的5b共平面性差,因而其电子离域的共轭体系相对小,能隙变宽,发光向短波方向移动.与此相反,烷基链取代在噻吩α位上的化合物5c,发光峰红移了21 nm,这是因为烷基链起到了推电子的作用,能隙变窄,这与紫外得到的结论是一致的.
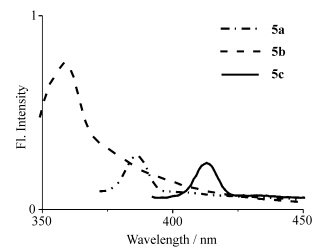 | 图3 5a—c的荧光光谱图 The FL spectrum of 5a—c |
本工作利用引入易离去基团2-巯基吡啶,高产率地实现了由苯并哒嗪和噻吩衍生物构成的新型有机共轭小分子化合物5a—c,所有目标产物均通过核磁共振和高分辨质谱确定了分子结构.通过对目标化合物5a—c的紫外-可见和荧光光谱分析,发现最大吸收峰波长和最大荧光波长均呈现5c>5a>5b的规律,证明可以通过在共轭体系中的不同位置引入烷基链,产生位阻和电子效应,来有效影响化合物的能隙,调节化合物的光电性质.
| [1] | Mishra A, Ma C Q, Bäuerle P, et al. Functional oligothiophenes: molecular design for multidimensional nanoarchitectures and their application[J]. Chem. Rev., 2009, 109(3): 1141-1276. |
| [2] | Murphy A R, and Frechet J M J. Organic semiconducting oligomers for use in thin film transistors[J]. Chem. Rev., 2007, 107(4): 1066-1096. |
| [3] | Zaumseil J, Sirringhaus H. Electron and ambiolar transport in organic field-effect transistor[J]. Chem. Rev., 2007, 107(4): 1296-1323. |
| [4] | Toby L N, Tomasz M Y, Jun Y L, et al. Transistor paint: high mobilities in small bandgap polymer semiconductor based on the strong acceptor, diketopyrrolopyrrole and strong donor, dithienopyrrole[J]. Adv. Mater., 2010, 22: 4617-4621. |
| [5] | Shinji A, Jun-ichi N, Eiichi F, et al. Novel p- and n-type organic semiconductors with an anthracene unit[J]. Chem. Mater., 2005, 17(6): 1261-1264. |
| [6] | Tverskoy F R, Peters A, Himmel H J, and Bunz U H F. An efficient synthesis of tetraazapentacenes[J]. Angew. Che, Int. Ed., 2011, 50: 557-3560. |
| [7] | Miao S, Appleton A L, Berger N, et al. 6,13-Diethynyl-5,7,12,14-tetraazapentacene[J].Chem. Eur. J., 2009, 15: 4990-4993. |
| [8] | Miao S B, Smith M D, and Bunz U H F. Synthesis of a peralkynylated pyrazinoquinoxaline[J]. Org. Lettv., 2006, 8(4): 757-760. |
| [9] | Liang Z, Tang Q, Mao R, et al. The position of nitrogen in N-heteropentacenes matters[J]. Adv. Mater., 2011, 23: 5514-5518. |
| [10] | Achelle S, Plé N, Turck A. Thiophene diazine molecular semiconductors: incorporation of pyridazine rings in the structure of functionalizedp-conjugated materials; implementation in organic field-effect transistors[J]. Rsc. Adv., 2011, 1: 364-388. |
| [11] | Gregory L G, Theresa M M, and Dwight S S. Atomistic band gap engineering in donor?acceptor polymers[J]. J. Am. Chem.Soc., 2012, 134: 539-547. |
| [12] | Ortiz R P, Casado J, Hernandez V, et al. Thiophene–diazine molecular semiconductors: synthesis, structural, electrochemical, optical, and electronic structural properties; implementation in organic field-effect transistors[J]. Chem. Eur. J., 2009, 15: 5023-5039. |
| [13] | Liu Y, Zhang F, He C, Wu D, et al. Efficient synthesis and physical properties of novel H-shaped 2,3,7,8-tetraazaanthracene-based conjugated molecules[J]. Chem. Commun., 2012, 48: 4166-4168. |
| [14] | Rafael H L K, Peter J A A, Dirk J M V, Jan M J V G. Grignard reactions on ortho dicarboxylic arene derivatives synthesis of 1,3-dithienylisothianaphthene compounds [J].J. Org. Chem., 1997, 62(5): 1473-1480. |




