2. 许昌一方建筑设计有限公司, 河南 许昌 461000
2. Xuchang Party Architectural Design Co. Ltd, Xuchang 461000, Henan, P.R.China
光催化氧化作为一门新兴的环保技术,从20世纪70年代兴起并逐步发展起来[1].光催化技术具有效率高、能耗低、操作简便、反应条件温和、适用范围广等突出特点,在有机废水处理中备受关注.但是光催化技术存在催化剂活性低、难分离回收和激发波长短的问题[2].针对这些问题研究者主要通过贵金属沉积、半导体复合、表面光敏化、磁载等手段对其进行改性,其中可磁分离的催化剂既具有悬浮相催化剂的高效性,又能利用外加磁场进行分离回收[3],是目前研究的热点.
研究者通过将催化剂和磁性物质结合,制备磁性核壳结构的催化剂.磁载催化剂目前分为直接包覆和非直接包覆型两种.直接包覆型是指在磁载体上直接包覆具有光催化作用的活性组分.Beydoun等[4]将TiO2颗粒负载到Fe2O3纳米磁铁矿颗粒上合成了磁性光催化剂,实现水处理中光催化剂的简单磁回收,效果显著.喻黎明等[5]在100℃低 温下利用溶胶-凝胶制备合成了Fe3O4/TiO2磁性光催化剂,对罗丹明B具有很高的降解效率,且回收率能达到90%.非直接包覆型是指在磁载体上包覆结合层,再将催化活性组分 包覆于结合层之上,以此来保护磁性材料.Yu等[6]制备了新颖的多功能γ-Fe2O3@SiO2@TiO2复合微球,可以有效地降解有机污染物,且很容易被磁铁回收利用,利用至少5次光催化效率没有任何明显的降低.
目前使用较多的磁基体为 Fe3O4和γ-Fe2O3两种,虽然γ-Fe2O3的磁性强于Fe3O4且γ-Fe2O3与 Fe3O4相比有很好的热稳定性,但当γ-Fe2O3与TiO2结合时,组成核壳式结构.由于六配位的Ti4+半径(74.5 nm)与六配位Fe3+半径( 69 nm)相近,而且Fe3+为d轨道未充满的易变价离子,当γ-Fe2O3和TiO2相接触煅烧时,Fe3+将进入TiO2晶体中,这种d轨道未充满的易变价离子既可以成为电子陷阱,也可成为空穴陷阱,从而成为电子-空穴的复合中心,当Fe3+进入TiO2晶体中的量较大时,复合几率增大,TiO2实际的光电转换效率降低,光催化能力下降[7].
本文采用溶胶-凝胶法,选用Fe3O4为磁核将催化剂中TiO2直接包覆在磁核的表面,经过陈化、干燥、煅烧制备磁功能性光催化剂,通过降解甲基橙溶解实验,比较了磁功能性光催化剂中Fe的掺杂比例、催化剂煅烧温度以及煅烧时间对催化剂活性的影响,得出最佳制备条件,使催化剂不仅具备一定磁性,而且光催化活性达到最高.此外,通过TG-DTA、XRD、UV-Vis、TEM对最佳制备条件下制备的光催化剂进行了表征.研究中还发现:铁掺杂能够引起催化剂在可见光的吸收边缘的范围缩小,催化剂光响应波长红移,提高可见光下的光催化活性,且能利用外加磁场对催化剂进行磁回收[8,9],磁载催化剂具有广阔的应用前景. 1 实验部分 1.1 试剂与仪器
主要试剂:钛酸丁酯、无水乙醇、盐酸、硫酸亚铁、硫酸铁,以上试剂均为分析纯;甲基橙为工业纯;实验所用去离子水为实验室自制.
主要仪器:日本精工TG/DTA6300型分析仪,日本理学RigakuD/max2500/pc型X射线衍射仪,UV-2550紫外-可见光谱仪(日本岛津公司),H-7650型透射电镜(日本日立公司). 1.2 磁功能性TiO2光催化剂的制备方法 1.2.1 Fe3O4的制备
称取3.475 g FeSO4·7H2O和5.62 g Fe2(SO4)3·9H2O溶解于250 mL去离子水中,机械搅拌,将温度保持在55 ℃,滴加2 mol/L的NaOH溶液得到黑色沉淀物,将混合液的pH值调至11,将混合液再升温至60 ℃,继续恒温搅拌时间为6 h,利用永磁体对沉淀物进行磁力沉降,将得到的沉淀物多次水洗,烘干待用. 1.2.2磁功能性TiO2光催化剂的制备
采用溶胶-凝胶法制备磁功能性TiO2光催化剂的核壳结构颗粒,具体步骤:以钛酸丁酯为TiO2光催化剂的前驱体,无水乙醇为共溶剂,冰醋酸为抑制剂,钛酸丁酯、无水乙醇、冰醋酸、蒸馏水的体积比为10∶25∶5∶4.首先将钛酸四丁酯溶于2/3的乙醇中,置于分液漏斗中,记为A组分;其次将剩余1/3的乙醇、冰醋酸、去离子水和一定量的Fe3O4置于烧杯中,记为B组分.将A组分摇匀后以1—2滴/秒的速度滴加至B组分,继续机械搅拌,得到凝胶,陈化12 h以上后,在110 ℃温度下烘12 h以上,分别在300 ℃、400 ℃、450 ℃、500 ℃、550 ℃、600 ℃下煅烧2 h,然后研磨,过300目筛后即得到磁功能性TiO2光催化剂粉体. 2 结果与讨论 2.1 磁功能性TiO2光催化剂的制备条件优化 2.1.1 Fe掺杂比例对催化剂活性的影响
采用不同的Fe/Ti摩尔比制备了不同Fe掺杂比例(1%、3%、5%、7%、10%)的磁功能性TiO2光催化剂.在250 W紫外高压汞灯下,分别以其为催化剂,对初始浓度为10 mg/L的甲基橙溶液进行光催化剂降解实验,催化剂投加量为2 g/L,结果如图1所示.
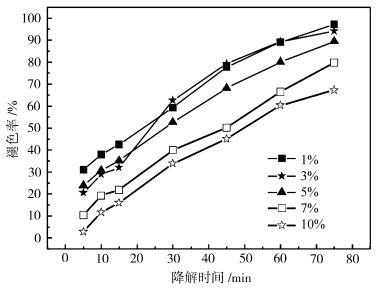 | 图1 Fe掺杂比例对甲基橙水溶液褪色率的影响 Effect of Fe-doped proportionon the rate of methyl orange aqueous solution fade |
由图1可知,当Fe掺杂比不高于5%时,催化剂对甲基橙溶液的降解效果较好,75 min后,溶液褪色率均能达到85%以上.当Fe掺杂比高于5%时,甲基橙溶液的褪色率下降,催化剂催化活性降低.这是由于磁核中的Fe3+是d轨道未充满的易变价离子,容易进入TiO2晶格中成为电子-空穴的复合中心,Fe掺杂比的增加会加剧这种复合反应[7];磁核含量的增加,使同等催化剂投加量条件下,催化剂的活性组分TiO2含量减少,催化效果降低.此外,制备的催化剂的磁性与Fe掺杂比直接相关,综合考察催化剂的催化活性和磁回收问题,选取Fe掺杂比为5%. 2.1.2 煅烧温度对催化剂活性的影响
催化剂的煅烧温度对催化剂的活性有着显著的影响.实验考察不同煅烧温度对催化剂活性的影响,将Fe掺杂量5%的磁功能性TiO2光催化剂分别在300 ℃、400 ℃、450 ℃、500 ℃、550 ℃、600 ℃下煅烧2 h,制成不同煅烧温度系列催化剂.在250 W紫外高压汞灯下,分别以其为催化剂,对初始浓度为10 mg/L的甲基橙溶液进行光催化剂降解实验,催化剂投加量为2 g/L,结果如下页的图2所示.
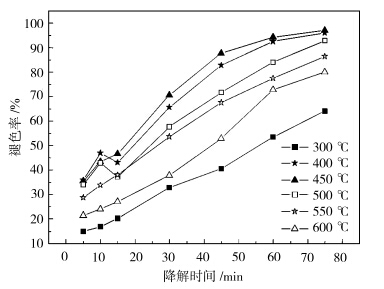 | 图2 煅烧温度对甲基橙水溶液褪色率的影响 Effect of calcination temperature on the rate of methyl orange aqueous solution fade |
由图2可知,催化剂的降解效率随煅烧温度的递增呈现先增加后降低的趋势,煅烧温度为450 ℃,催化剂的催化活性最高,甲基橙溶液的褪色率最高,达到97%.这是因为适当温度的煅烧可以使催化剂保持一定的颗粒大小,又可以使催化剂以一定的具有光催化活性的锐钛矿和金红石两种晶型存在.温度太低影响晶型的转变,而过高的温度下二氧化钛会转化为金红石晶型,也会使催化剂的活性降低.温度过高会导致催化剂粒径的增大以及比表面积的下降,且金红石型TiO2比例会升高,催化剂活性会受到影响.因此,选择催化剂的最佳煅烧温度为450 ℃. 2.1.3 煅烧时间对催化剂活性的影响
将最佳Fe含量为5%的磁功能性TiO2光催化剂在450 ℃的温度下分别煅烧0.5 h、1 h、1.5 h、2 h、3 h,制成不同煅烧时间系列的催化剂.在250 W紫外高压汞灯下,分别以其为催化剂,对初始浓度为10 mg/L的甲基橙溶液进行光催化剂降解实验,催化剂投加量为2 g/L,结果如图3所示.
 | 图3 煅烧时间对甲基橙水溶液褪色率的影响 Effect of calcination time on the rate of methyl orange aqueous solution fade |
从图3中可以看出,煅烧2 h的催化剂催化效果最高达到90%.催化剂的煅烧过程是其晶型调整过程,相应的催化活性也有较大差异.煅烧时间不同,催化剂的催化性能也会有所不同.煅烧温度一定,TiO2纳米颗粒会随着煅烧时间的增加发生团聚,催化剂的粒径将变大,导致比表面积的下降,催化剂的表面吸附能力下降,进而导致光催化剂活性下降.当煅烧时间较短时,催化剂晶型转化不完全,催化活性不能充分发挥.因此,催化剂的最佳煅烧时间为2 h. 2.2磁功能性TiO2光催化剂的表征
在掺杂Fe含量为5%,煅烧温度为450 ℃,煅烧时间为2 h的条件下,制备磁功能性TiO2光催化剂.对制备的磁功能性TiO2光催化剂进行磁性、TG-DTA、XRD、UV-Vis、TEM表征. 2.2.1 催化剂的磁性
本试验制备的旨在通过外磁场作用回收的磁功能性TiO2光催化剂,它的磁性性能是通过磁铁提供外磁场进行检验的,通过照片直观地展示其磁性,其磁性情况如图4所示.
 | 图4 磁功能性TiO2光催化剂的磁性表征 The Magnetic of magnetic TiO2 photocatalysts |
由图4中纯Fe3O4和磁功能性TiO2光催化剂的磁性照片对比可知,纯Fe3O4在磁铁提供的外磁场下,明显表现出有较强的磁性,而复合催化剂的磁性减弱,但仍有磁性,因此用于光催化降解实验后可以达到通过磁场进行回收的目的. 2.2.2 磁功能性TiO2光催化剂的TG-DTA表征
热重分析可以用来测定催化剂的热稳定性,TiO2粒子的晶型会随煅烧温度而发生变化,光催化活性也发生变化.
磁功能性TiO2光催化剂的TG如图5所示,曲线在0—450 ℃一直存在失重过程,20—150 ℃存在大约10%的质量损失过程并且伴随着吸热效应,这是由于少量水的脱除和乙醇等有机物的挥发;150—400 ℃存在严重的失重,并伴随两次明显的放热过程,这主要是样品中的乙醇的氧化分解,以及脱去结构中的—OH基团引起的;在464 ℃存在一处弱的放热峰,这是TiO2从无定形向锐钛相转变造成的;随后670 ℃存在一个放热峰,并伴随失重现象,这是锐钛矿向金红石相的转变的放热峰,与文献的610—915 ℃[10]的温度范围相一致.在整个过程中未出现重量增加的现象,说明在催化剂煅烧的过程中,磁核中的Fe3O4受热氧化,由磁性表征中该催化剂有一定的磁性可以说明Fe3O4可能受热氧化成γ-Fe2O3.
 | 图5 磁功能性TiO2光催化剂的TG-DTA表征 The TG-DTA graph of magnetic TiO2 photocatalysts |
磁功能性Fe3O4/TiO2催化剂和纯的TiO2(锐钛矿型)两种催化剂的XRD图谱如图6所示.由图6可知,对于纯的TiO2(锐钛矿型),在2θ=25.24 °、37.82 °、48.08 °、53.94 °、54.20 °和62.82 °处均存在明显的尖锐的衍射峰,其所对应的衍射峰的特征谱线正是锐钛矿型TiO2的特征谱线,且没有其他杂乱的衍射峰,说明该TiO2中没有其他的杂质物质.实验所制得的磁功能性TiO2光催化剂同样在2θ=25.24 °、37.82 °、48.08 °、53.94 °、54.20 °和62.82 °处出现衍射峰,证明所制的磁功能性TiO2光催化剂的晶型为锐钛矿型.由图谱可见,在2θ=37.12 °、56.6 °、75.2 °处均出现了微弱的吸收峰,说明实验所制的TiO2存在杂质物质,这是由于引入磁核的缘故,但磁核中是Fe3O4还是γ-Fe2O3,还需要从UV-Vis、TEM的表征手段进行分析.
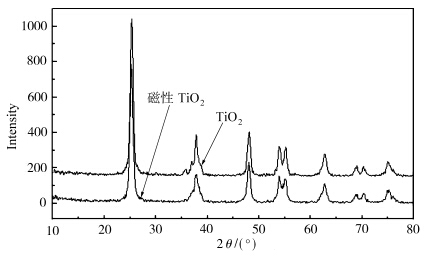 | 图6 磁功能性TiO2光催化剂的XRD图谱表征 The XRD graph of magnetic TiO2 photocatalysts |
磁功能性TiO2光催化剂和纯的TiO2两种催化剂的UV-Vis漫反射光谱图如图7所示.由图7可以看出,引入磁核的催化剂在200—800 nm的吸收峰均比纯TiO2催化剂要高,纯TiO2催化剂只在200—400 nm范围内有较高的吸收峰.光生空穴能使H2O分子氧化,生成氧化能力很强的·OH自由基;光生电子能使吸附在TiO2上的 O2还原生成 ·O-2,最终也可形成·OH自由基.使水溶液中的有机物被氧化分解,达到消除污染物的目的[11].磁性核心的引入,使磁载纳米TiO2光催化剂的光吸收的带发生了较大幅度的红移,同时吸收光强度也明显增大.
 | 图7 磁功能性TiO2光催化剂的UV-Vis光谱图 The UV-Vis spectra graph of magnetic TiO2 photocatalysts |
图8是制备的磁功能性TiO2光催化剂在乙醇中超声分散30 min后,由铜网挂很薄的薄膜干燥后拍摄的TEM图.从图8可以看出,制备的磁性催化剂颗粒磁核的平均直径在10 nm左右,磁核与包覆与磁核表面的TiO2形成的颗粒直径大约为20 nm.磁性核表面被TiO2颗粒包覆,形成了核壳结构.
 | 图8 磁功能性TiO2光催化剂的TEM图 The TEM graph of magnetic TiO2 photocatalysts |
本实验通过对磁性催化剂制备条件的优化研究,成功制备了磁功能性TiO2光催化剂,对催化剂进行磁性、TG-DTA、XRD、UV-Vis、TEM表征,结果表明:该催化剂具备一定的磁性,催化剂颗粒比较一致,平均粒径在20 nm左右;具有明显的核壳结构;该磁性催化剂的吸收带边发生红移,在可见光区的吸收强度也有所增强.
| [1] | Herrmann J M. Heterogeneous photocatalysis, fundamentals and applications to the removal of various types of aqueous pollutants[J]. Catalysis Today, 1999, 53(1): 115-129. |
| [2] | 姜安玺,徐桂芹,相会强.光催化剂纳米TiO2的固定化技术研究进展[J].哈尔滨建筑大学学报,2002,35(4):43-46. Jiang A X,Xu G Q,Xiang H Q.Immobilization technology of nanosized TiO2[J].Journal of Harbin University of Civil Engineering and Architecture,2002,35(4):43-46. |
| [3] | 包淑娟. 磁载光催化剂TiO2/SiO2/γ- Fe2O3的制备及其催化氧化性能[J].功能材料,2004,(1):108-113. Bao S J.Study on preparation and photocatalytic activity of titania-coated magnetite photocatalysts[J]. Journal of Functional Materials,2004,(1):108-113. |
| [4] | Beydoun D, Amal R. Implications of heat treatment on the properties of a magnetic iron oxide-titanium dioxide photocatalyst[J]. Materials Science and Engineering B-Solid State Materials for Advanced Technology, 2002, 94(1): 71-81. |
| [5] | 喻黎明,刘建军,于迎春,等.低温合成TiO2/Fe3O4磁载光催化剂的光催化性能研究[J].北京化工大学学报(自然科学版),2011,38(02):63-68. Yu L M, Liu J J, Yu Y C,et al. Photocatalytic activities of TiO2/Fe3O4 magnetic photocatalysts [J].Journal of Beijing University of Chemical Technology(Natural Science Edition),2011,38(02):63-68. |
| [6] | Yu X X,Liu S W,Yu J G.Superparamagnetic γ-Fe2O3@SiO2@TiO2 composite microspheres with superior photocatalytic properties[J].Applied Catalysis B:Environmental,2011,104 :12-20. |
| [7] | 金华峰,李文戈,向纪明,唐吉玉.Fe3+/TiO2/SiO2复合纳米微粒的合成及光催化降解NO2-[J].应用化学, 2001, 18( 8) : 636-639. Jin H F,Li W G,Xiang J M,Tang J Y.Nanometer particles of Fe3+/TiO2/SiO2 complex:synthesis and usefulness in photocatalytic degradation of nitrite[J].Chinese Journal of Applied Chemistry,2001,18(8):636-639. |
| [8] | 王 拯,张风宝.磁载光催化剂TiO2/Al2O3/γ-Fe2O3的制备与降解染料的优化模型[J].环境化学,2008,27(3):283-287. Wang Z,Zhang F B.TiO2/Al2O3/γ-Fe2O3photocatalyst synthesis and its application on 4bs dye wastewater treatment viaoptim ization model [J].Environmental Chemistry,2008,27(3):283-287. |
| [9] | Yu J G,Xiang Q J,Zhou M H. Preparation, characterization and visible-light-driven photocatalytic activity of Fe-doped titania nanorods and first-principles study for electronic structures[J]. Applied Catalysis B: Environmental,2009,90:595-602. |
| [10] | 周芝骏,宁崇德.钛的性质及其应用[M].北京:高等教育出版社.1993. Zhou Z J,Ning C D. The Properties and Applications of Titanium[M].Beijing:Higher Education Press.1993. |
| [11] | 菅盘铭,夏亚穆,李德宏,王晓燕.掺杂TiO2纳米粉的合成、表征及催化性能研究[J].催化学报,2001,22(2):161-164. Jian P M,Xia Y M,Li D H,Wang X Y. Preparation, characterization and photocatalytic activity of doped TiO2 nanopowders[J]. Chinese Journal of Catalysis, 2001, 22(2):161-164. |




