对于ESIPT化合物的研究最早开始于上个世纪60年代,Cohen等[ 6 ]在水杨酰苯胺的光谱中发现了较大的Stokes位移,并将其归结为质子转移异构行为的作用.进一步的研究发现,酮式互变异构体还存在着顺式酮式(cis-Keto)和反式酮式(trans-Keto)两种不同的构型.随后,在非质子溶剂中观察到3-羟基黄酮(3-HF)明显的黄绿色发光,同样将其归结为质子转移异构体的发光[ 7 ].文献中已报道的ESIPT化合物很多,比较典型的包 括:β-羟基丙烯醛(Malonaldehyde,MA),邻羟基苯甲醛(o-hydroxybenzaldehyde ,OHBA),水杨酸(salicylic acid,SA),7-羟基茚酮(7-hydroxy-1-indanone,7HIN),10-羟基苯并喹啉(10- Hydroxybenzo[h]quinolone,10-HBO)以及2-(2′-羟苯基)苯并唑类(2-(2′-hydroxyphenyl)benzoxales,HBX(X=NH、O或S)).本文将对近年来已报道的ESIPT分子的理论研究及其作为荧光探针分子的应用研究进展做简要综述. 1 激发态分子内质子转移过程的理论研究
在目前已知的ESIPT化合物中,2-(2′-羟苯基)苯并唑类HBX(X=NH、O或S)是一类重要的化合物,对此类分子的构型及微观动力学过程已有很多研究.1970年,Adam Heller等[ 8 ]就发表了对2-(2′-羟基苯基)苯并噻唑(HBS)晶体及其衍生物中的ESIPT过程的研究,并给出了ESIPT过程示意图(见图1.1).
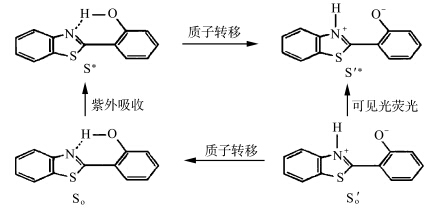 | 图1.1 HBS化合物的ESIPT过程示意图 The ESIPT process of HBS |
此后,研究人员利用超快光谱分析及量子化学计算等方法,对它们在溶液中的激发态质子转移过程已经有了相对清晰的认识[ 9,10,11,12 ](见图1.2).
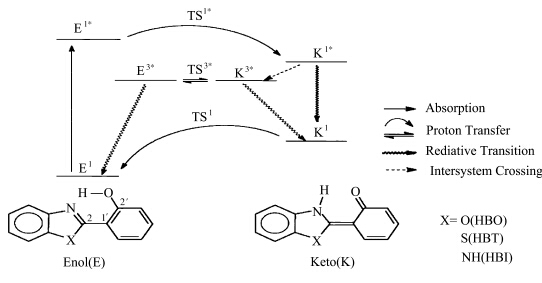 | 图1.2 HBX化合物进行ESIPT的光物理过程 The photophysics process of HBX-type ESIPT compounds(TS stands for transition state) |
研究者们也对其他的ESIPT化合物的光物理过程、反应动力学过程进行了相应的研究.Steve Scheiner等[ 13 ]研究了丙二醛的阴离子类似物的ESIPT过程(见图1.3).他们运用ab initio法将丙二醛分子与一种类似的系统对比,得出了丙二醛五元环质子转移系统中质子转移势垒与氢键强度几何学、能量学特征间的关系.
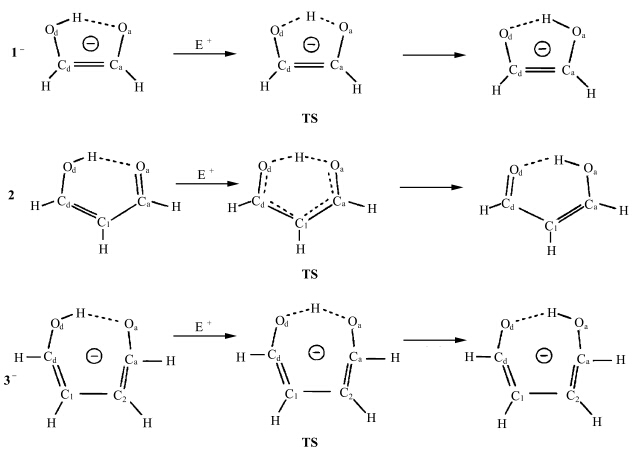 | 图1.3 丙二醛分子中质子转移示意图 The proton transferprogressesin anionic analogues of malonaldehyde |
2代表丙二醛中性分子五元环,1-和3-分别代表带有全局负电荷的四元环和六元环结构 角标d代表给体原子,a代表受体原子,TS代表质子转移中间构型 Swadeshmukul Santra等[ 14 ]研究了2-(2′-乙酰胺基)苯并咪唑(图1.4a)在不同溶液中的ESIPT过程.他们利用静态及时间分辨荧光光谱,辅助半经验量子力学计算,得出了不同极性溶剂中参与发光的构象异构体结构(图1.4b),并给出了激发波长与各种构象异构体间稳定性的关系.
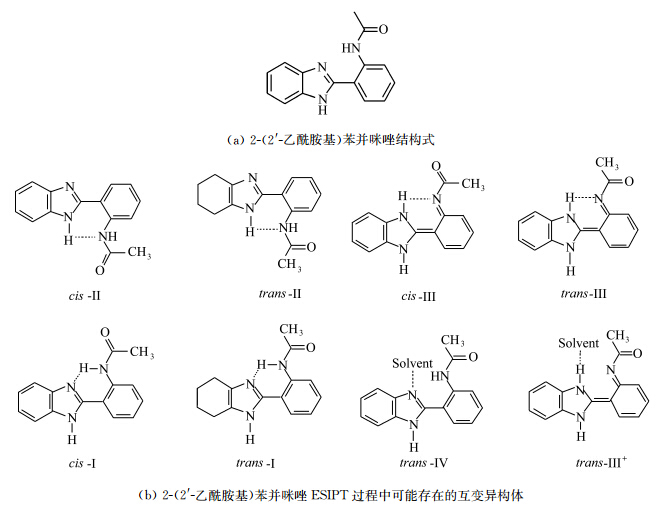 | 图1.4 2-(2′-乙酰胺基)苯并咪唑及其可能的构型 Geometrical isomers of 2-(2′-acetamidophenyl) benzimidazole |
Pi-Tai Chou等[ 15 ]通过非极性溶剂中稳态吸收及荧光光谱、飞秒时间分辨荧光结合瞬态吸收实验,研究了10-羟基苯并喹啉(HBQ)(图1.5)及其氘代同类物(DBQ)的激发态分子内醇式-酮式结构质子转移互变异构动力学.
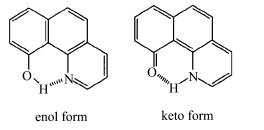 | 图1.5 10-羟基苯并喹啉的及其相应的酮式结构 Structures of 10-hydroxybenzoquinoline (HBQ) and its corresponding keto-tautomer |
我们课题组[ 16 ]利用瞬态吸收光谱捕捉到了HBT分子在聚集态的反式-酮式基态物种信号,辅助理论计算解释了该类ESIPT分子表现出聚集荧光增强(AIEE)性质的主要原因(图1.6).
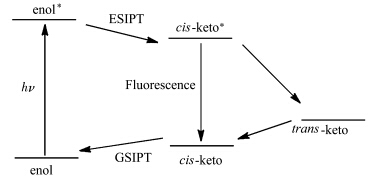 | 图1.6 HBT分子的光物理过程 Mechanism of a photoinduced process for HBT-type ESIPT compounds |
Papia Chowdhury等[ 17 ]利用密度泛函及含时的密度泛函理论研究了吲哚-7-甲醛的分子内质子转移现象.自然键轨道(Natural Bond Orbital,NBO)和Mullike分析方法表明该分子在基态时存在强烈的偶极-偶极相互作用,同时证实了激发态时分子内氢键的存在,并具有从氢键给体向受体部分转移形成两性离子的可能性.
Brandi M Baughman等[ 18 ]研究了几种二苯甲酮分子的光物理特性(图1.7).他们通过光谱研究和理论计算,利用ESIPT原理解释了二苯甲酮吸收紫外线的溶剂化效应.
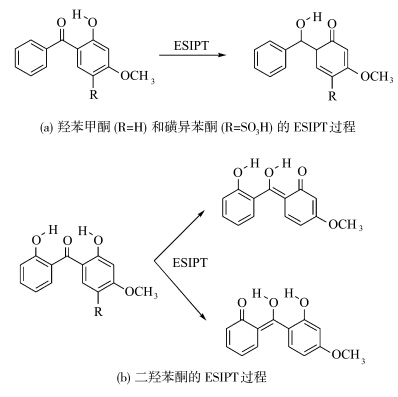 | 图1.7 二苯甲酮类化合物的ESIPT过程 Schematic of the excited state intramolecular proton transfer in benzophenone derivatives |
Douhal等[ 19 ]研究了吡罗昔康的飞秒动力学性质(图1.8).吡罗昔康是一种非类固醇镇定剂.该文献给出了其在两种质子溶剂中三个pH值下的飞秒光谱、瞬态吸收、荧光寿命等物理参数,并对吡罗昔康在上述条件下的反应动力学做出了解释.该结果对研究此种药物在不同环境下的短期反应有重要意义.
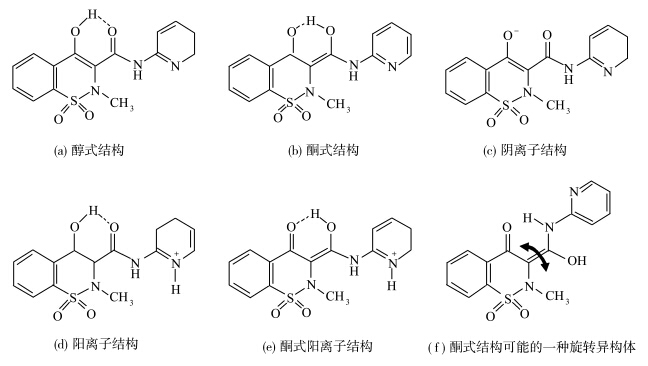 | 图1.8 吡罗昔康在ESIPT过程中可能的构型 Structures of piroxicam |
由于ESIPT过程很容易受到所处环境(温度,压力,极性、粘度、酸碱等因素)的影响,因而在荧光传感器领域的应用引起了人们的广泛关注.ESIPT分子及其衍生物作为荧光探针的原理是:外援物质直接或间接地与质子转移基团作用,切断或者重建分子的ESIPT过程,从而在作用前后表现出荧光光谱的差异.例如:Henary等[ 20 ]报道的基于磺酰胺-苯并咪唑的Zn2+探针;Callan等[ 21 ]制备的Mg2+探针.另外,ESIPT分子及衍生物在阴离子检测方面也有很多应用,可用于氟离子[ 22,23 ]和磷酸根、醋酸等含氧阴离子[ 24,25 ]的检测. 2.1 激发态分子内质子转移化合物作为阳离子荧光探针
ESIPT化合物作为阳离子荧光探针的设计原理以苯并唑类化合物为例说明.加入的金属阳离子首先与羟基质子发生置换,并与氧负离子及分子内的杂原子发生配位.分子中质子的置换直接导致了ESIPT过程受到抑制,从而改变了探针分子的光谱行为(图2.1).利用此机理设计的ESIPT类化合物阳离子荧光探针种类繁多,包括锂离子探针[ 26 ]、镁离子探针[ 21 ]、锌离子探针[ 20, 27, 28 ]、铜离子探针[ 29 ]、三价铁离子探针[ 30 ]、pH探针[ 31 ]和其他一些过渡金属离子探针等[ 32,33 ].
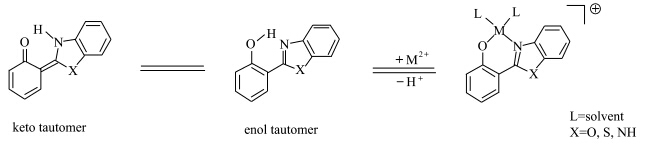 | 图2.1 金属离子对ESIPT 过程的直接抑制作用 The detection mechanism of ESIPT compouds for cations |
相对于阳离子荧光探针的广泛报道,目前基于ESIPT化合物设计的阴离子荧光探针仅涉及F-、AcO-、磷酸(氢)根、氰根离子等能够与路易斯酸作用的阴离子探针.主要设计思路来自两个方面:(1) 阴离子直接与ESIPT化合物的质子作用,切断化合物的ESIPT过程;(2) 首先将ESIPT化合物进行修饰,切断其本身的ESIPT过程,加入的阴离子与修饰基团发生作用,从而还原化合物的ESIPT过程.近年来,基于第二种设计思路的报道有所增加.
彭孝军课题组[ 24 ]报道了一类能够同时检测F-和AcO-的阴离子荧光传感器,阴离子与质子转移化合物发生相互作用,使ESIPT过程受阻,反应机理如图2.2所示.在没有阴离子存在时,ESIPT过程正常发生,体系表现出黄色发光;当加入F-时,由于F-较强的碱性使化合物分子发生去质子化作用,体系表现出较强的绿色发光;而AcO-由于其碱性相对较弱,更容易与化合物形成分子间的氢键,使分子内质子转移过程受阻,从而发射醇式的蓝色发光.
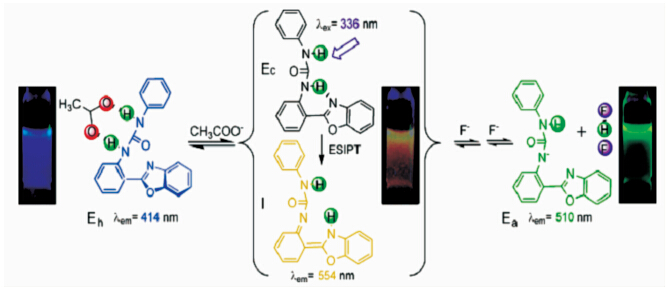 | 图2.2 ESIPT过程受阻原理制备的F-和AcO-荧光探针 Fluorescence sensing of F- and AcO- based on inhibition of excited-state intramolecular proton transfer |
基于ESIPT过程受阻原理,Goswami课题组[ 34 ]最近也设计合成了一种CN-的荧光探针5-苯并噻唑-4-羟基间苯二甲醛(BHI),该分子在乙腈与水1:1条件下在521 nm处表现出较强的酮式发光.当加入CN-后,CN-与羟基邻位的醛基发生亲核加成反应,切断了羟基向氮的质子转移,体系表现为436 nm的蓝光发射.
另外一类探针分子的设计原理与以上刚好相反,是先将化合物的ESIPT过程禁阻,再通过配位作用或化学反应使ESIPT过程还原.我们课题组设计合成了一系列的羟基硅烷化的ESIPT分子[ 35 ](图2.3),通过氟硅间的特殊相互作用还原化合物的ESIPT过程,实现了对F-的专一性检测.
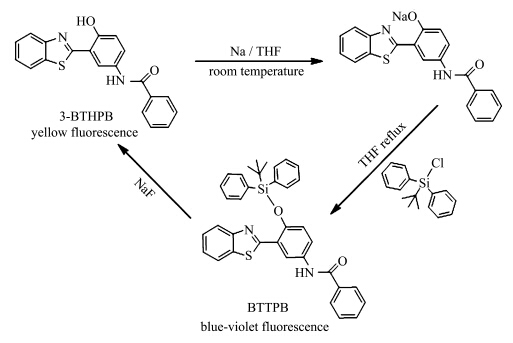 | 图2.3 硅烷化的ESIPT分子的合成及对F-的检测示意图 Synthesis and sensing mechanism of silylated ESIPT compound for the detection of NaF |
为了解决水中物种的荧光检测往往需要合成水溶性的探针分子的问题,我们课题组设计了基于ESIPT探针分子结合水凝胶的新型传感体系[ 36 ].该体系中的水凝胶首先结合在水中不溶解的羟基硅烷化的ESIPT分子形成复合体系,该复合体系不仅可以检测水中的氟离子,而且可以大大加快水中氟离子的检测速度.在对水中氟离子标准浓度(4 ppm)进行检测时,利用该体系仅仅需要15 s,为目前报道的水中氟离子检测的最快速度.更为重要的是,该工作同时提出了一个具有普适性的对水中物种检测的新方法,即利用水不溶探针分子结合水凝胶来构建传感体系用于水中物种检测,使本来是不利因素的水不溶探针分子的使用成为了有利因素,将大大扩展水中物种的荧光探针的应用范围(图2.4).
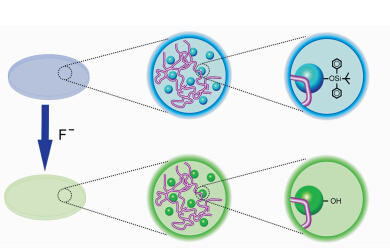 | 图2.4 水凝胶-ESIPT化合物体系检测氟离子示意图 F- detection by ESIPT compound incorporating hydrogel |
Pang等[ 37 ]将ESIPT主体分子与能够络合Zn2+的双(2-吡啶甲基)氨基相连,当体系中加入焦硫酸根(ppi)离子,ppi参与与Zn2+的作用释放出羟基,ESIPT发光恢复(图2.5),实现了对ppi的检测.
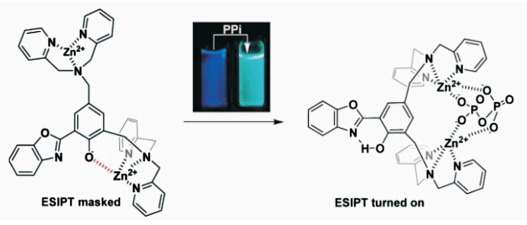 | 图2.5 ESIPT分子对ppi的检测机理 The detection mechanism of ppi sensor with ESIPT |
除了对离子的检测之外,近年来还有一些ESIPT化合物作为中性小分子荧光探针的报道.Song等[ 38 ]合成了一类2,4-二硝基苯磺酸取代的3-羟基黄酮化合物(图2.6),通过二硝基苯磺酸取代基与巯基的特异反应,水解生成具有ESIPT性质的3-羟基黄酮衍生物,通过观测反应前后光谱的差异,实现了对细胞内巯基的定量检测.
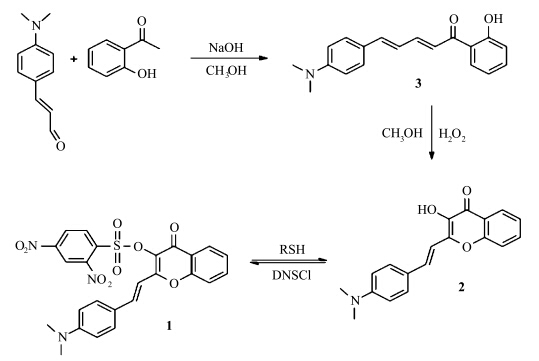 | 图2.6 3-羟基黄酮衍生物的合成及对巯基化合物的检测机理 Synthetic route of 3-hydroxyflavone probe and its reaction with thiols |
采用类似的机理,Liu课题组[ 39 ]首先采用含有苄溴的芳基硼酸酯对羟基质子进行保护,抑制分子内质子转移的发生.在含20%乙醇及0.1%DMF的体系中加入过氧化苯甲酰(BPO),化合物分子经氧化水解过程生成去保护的ESIPT化合物,进而出现长波长的发光,有效地检测了BPO分子的存在(图2.7).
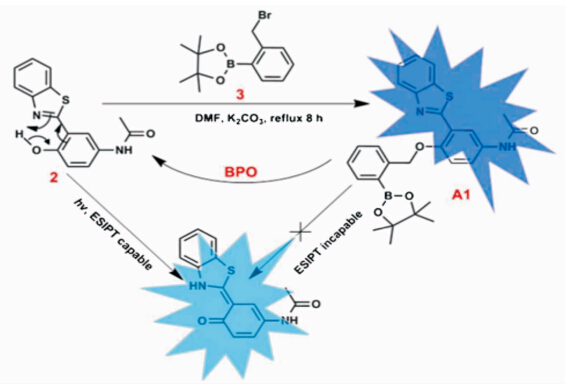 | 图2.7 ESIPT类分子对BPO的检测 Synthesis and the sensing BPO mechanism of fluorescent probe with excited-state intramolecular proton transfer |
利用对ESIPT化合物质子部分保护和去保护的机理,人们还制备了可用于乙醇分子的识别[ 40 ]、谷胱甘肽的识别[ 41 ]以及其他含氢键杂质、痕量水等方面检测[ 42,43 ]的中性小分子荧光探针. 2.4 激发态分子内质子转移化合物用作生物大分子及所处微环境的检测
由于激发态分子内质子转移的过程很容易受到所处环境的影响,而生物体系又是一个相对复杂的环境,因而很容易想到将ESIPT化合物应用于生物体系的检测.
Andrey S. Klymchenko等[ 44 ]通过将3-羟基色酮(3HC)和精胺聚阳离子连接(图2.8),实现了一种环境敏感的ESIPT荧光团与DNA分子的高效反应.该反应可以通过检测3HC基团发光强度变化情况来区分单链DNA及双链DNA,从而监测阳离子与DNA分子的反应以及DNA分子的微环境
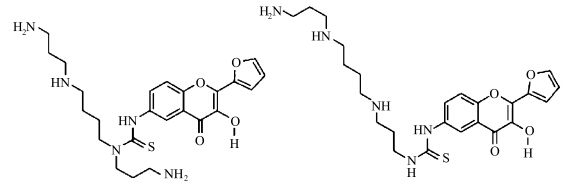 | 图2.8 3HC与精胺连接的两种结构 Two conjugates of 2-(2-furanyl)-3HC and polycationic spermine |
最近,该研究组又用3HC分子取代色氨酸分子上的吲哚基团,合成了一种具有双荧光发射的新型氨基酸,并以固相合成的方法连接于HIV-1蛋白内外两个不同的位置[ 45 ](图2.9).实验表明,取代的色氨酸37残基有效地保留了原有缩氨酸的折叠性能与分子伴侣活性,而且在与目标寡核苷酸作用时表现出明显的荧光变化,间接反映出缩氨酸与寡核苷酸的作用位点.
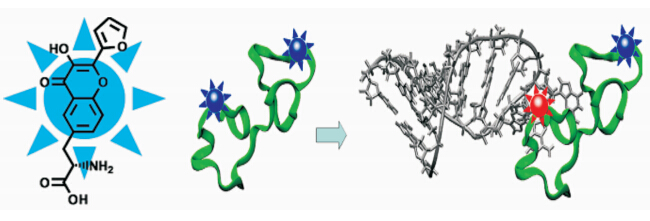 | 图2.9 3HC取代的氨基酸残基对缩氨酸与寡核苷酸相互作用的检测 Monitoring of peptide/oligonucleotide interaction using an L-amino acid based on the 3HC fluorophore |
以上列出的研究结果显示出利用ESIPT类化合物的性能可以设计出多种探针分子,相信会有更多具有优异性能的体系在未来得到发展.ESIPT化合物除了在荧光传感器方面的应用外,早在上世纪80年代,就被建议用作激光染料、紫外光稳定剂、电致发光材料并逐渐发展到光信息存储、光波导等光电子学器件中.具有ESIPT性质的化合物由于其独特的光物理性质,为继续设计并制备出新型的光功能材料提供了多种分子基础,相信未来将在多个领域有更加广泛的应用.
| [1] | Klymchenko A S, Demchenko A P. Electrochromic modulation of excited-state intramolecular proton transfer: the new principle in design of fluorescence sensors[J]. Journal of the American Chemical Society, 2002, 124: 12372-12379. |
| [2] | Park S, Kwon J E, Kim S H, et al. A white-light-emitting molecule: frustrated energy transfer between constituent emitting centers[J]. Journal of the American Chemical Society, 2009, 131: 14043-14049. |
| [3] | Sakai K, Tsuzuki T, Itoh Y, et al. Using proton-transfer laser dyes for organic laser diodes[J]. Applied Physics Letters, 2005, 86: 081103. |
| [4] | Ma D G, Liang F S, Wang L X, et al. Blue organic light-emitting devices with an oxadiazole-containing emitting layer exhibiting excited state intramolecular proton transfer[J]. Chemical Physics Letters, 2002, 358: 24-28. |
| [5] | Parejo P G, Zayat M, Levy D. Highly efficient UV-absorbing thin-film coatings for protection of organic materials against photodegradation[J]. Journal of Materials Chemistry, 2006, 16: 2165-2169. |
| [6] | Cohen M D, Flavian S. Luminescence properties of N-salicylideneananiline and related anils in solution[J]. Journal of the Chemical Society B, 1967, 317. |
| [7] | Sengupta P K, Kasha M. Excited state proton-transfer spectroscopy of 3-hytdroxyflavone and quercetin[J]. Chemical Physics Letters, 1979, 68: 382-385. |
| [8] | Heller A, Williams D L. Intramolecular proton transfer reactions in excited fluorescent compounds[J]. The Journal of Physical Chemistry, 1970, 74: 4473-4480. |
| [9] | Ikegami M,Arai T. Photoinduced intramolecular hydrogen atom transfer in 2-(2-hydroxyphenyl)benzoxazole and 2-(2-hydroxyphenyl)benzothiazole studied by laser flash photolysis[J]. Journal of the Chemical Society, Perkin Transactions 2, 2002: 1296-1301. |
| [10] | Ding K, Courtney S J, Strandjord A J. Excited-state intramolecular proton transfer and vibrational relaxation in 2-(2-hydroxyphenyl)benzothiazole[J]. The Journal of Physical Chemistry, 1983, 87(7): 1184-1188. |
| [11] | Barbara P F, Brus L E, Rentzepis P M. Intramolecular proton transfer and excited-state relaxation in 2-(2-hydroxyphenyl) benzothiazole[J]. Journal of the American Chemical Society, 1980, 102: 5631-5635. |
| [12] | Aquino A J A, Lischka H, Hattig, C. Excited-state intramolecular proton transfer: a survey of TDDFT and RI-CC2 excited-state potential energy surfaces[J]. The Journal of Physical Chemistry A, 2005, 109(14): 3201-3208. |
| [13] | Scheiner S, Kar T, C^uma M. Excited state intramolecular proton transfer in anionic analogues of malonaldehyde[J]. The Journal of Physical Chemistry A, 1997, 101(33): 5901-5909. |
| [14] | Santra S, Krishnamoorthy G, Dogra S K. Excited-state intramolecular proton transfer in 2-(2'-acetamidophenyl)benzimidazole[J]. The Journal of Physical Chemistry A, 2000, 104(3): 476-482. |
| [15] | Chou P T, Chen Y C, Yu W S. Excited-state intramolecular proton transfer in 10-hydroxybenzoquinoline[J]. The Journal of Physical Chemistry A, 2001, 105(10): 1731-1740. |
| [16] | Hu R, Li S Y, Zeng Y, Chen J P, et al. Understanding the aggregation induced emission enhancement for a compound with excited state intramolecular proton transfer character[J]. Physical Chemistry Chemical Physics, 2011, 13: 2044-2051. |
| [17] | Singla N, Chowdhury P. Density functional investigation of photo induced intramolecular proton transfer (IPT) in indole-7-carboxaldehyde and its experimental verification[J]. Journal of Molecular Structure, 2013, 1045: 72-80. |
| [18] | Baughman B M, Stennett E, Lipner R E. Structural and spectroscopic studies of the photophysical properties of benzophenone derivatives[J]. The Journal of Physical Chemistry A, 2009, 113(28): 8011-8019. |
| [19] | Gil M, Douhal A. Femtosecond dynamics of piroxicam structures in solutions[J]. The Journal of Physical Chemistry A, 2008, 112(36): 8231-8237. |
| [20] | Henary M M, Wu Y G, Fahrni C J. Zinc(II)-selective ratiometric fluorescent sensors based on inhibition of excited-state intramolecular proton transfer[J]. Chemistry-A European Journal, 2004, 10(12): 3015-3025. |
| [21] | Singh N, Kaur N, Mulrooney R C, Callan J F. A ratiometric fluorescent probe for magnesium employing excited state intramolecular proton transfer[J]. Tetrahedron Letters, 2008, 49(47): 6690-6692. |
| [22] | Peng X J, Wu Y K, Fan J L, Tian M Z, Han K L. Colorimetric and ratiometric fluorescence sensing of fluoride: tuning selectivity in proton transfer[J]. Journal of Organic Chemistry, 2005, 70(25): 10524-10531. |
| [23] | Yang X F, Qi H P, Wang L P, Su Z, Wang G. A ratiometric fluorescent probe for fluoride ion employing the excited-state intramolecular proton transfer[J]. Talanta, 2009, 80(1): 92-97. |
| [24] | Wu Y K, Peng X J, Fan J L, et al. Fluorescence sensing of anions based on inhibition of excited-state intramolecular proton transfer[J]. Journal of Organic Chemistry, 2007, 72(1): 62-70. |
| [25] | Chu Q, Medvetz D A, Pang Y. A polymeric colorimetric sensor with excited-state intramolecular proton transfer for anionic species[J]. Chemistry of Materials, 2007, 19(26): 6421-6429. |
| [26] | Obare S O, Murphy C J. Selective blue emission from an HPBO-Li complex in alkaline media[J]. New Journal of Chemistry, 2001, 25: 1600-1604. |
| [27] | Ma Q J, Zhang X B, Zhao X H, et al. A ratiometric fluorescent sensor for zinc ions based on covalently immobilized derivative of benzoxazole[J]. Spectrochimica Acta Part A, 2009, 73: 687-693. |
| [28] | Xu Y Q, Pang Y. Zn2+ triggered excited-state intramolecular proton transfer: a sensitive probe with near-infrared emission from bis(benzoxazole) derivative[J]. Dalton Transactions, 2011, 40: 1503-1509. |
| [29] | Bhalla V, Tejpal R, Kumar M. Terphenyl based fluorescent chemosensor for Cu2+ and F- ions employing excited state intramolecular proton transfer[J]. Tetrahedron, 2011, 67: 1266-1271. |
| [30] | Zhang X B, Cheng G, Zhang W J, et al. A fluorescent chemical sensor for Fe3+ based on blocking of intramolecular proton transfer of a quinazolinone derivative[J]. Talanta, 2007, 71: 171-177. |
| [31] | Chan Y P, Fan L, You Q H, et al. Ratiometric pH responsive fluorescent probes operative on ESIPT[J]. Tetrahedron, 2013, 69: 5874-5879. |
| [32] | Luo H Y, Zhang X B, He C L, et al. Synthesis of dipicolylamino substituted quinazoline as chemosensor for cobalt(II) recognition based on excited-state intramolecular proton transfer[J]. Spectrochimica Acta Part A, 2008, 70: 337-342. |
| [33] | Han D Y, Kim J M, Kim J, et al. ESIPT-based anthraquinonylcalix 4 crown chemosensor for In3+[J]. Tetrahedron Letters, 2010, 51: 1947-1951. |
| [34] | Goswami S, Manna A, Paul S, et al. Resonance-assisted hydrogen bonding induced nucleophilic addition to hamper ESIPT: ratiometric detection of cyanide in aqueous media[J]. Chemical Communications, 2013, 49: 2912-2914. |
| [35] | Hu R, Feng J, Hu D H, et al. A rapid aqueous fluoride ion sensor with dual output modes[J]. Angewandte Chemie International Edition, 2010, 49: 4915-4918. |
| [36] | Xiong L, Feng J, Hu R, et al. Sensing in 15 s for aqueous fluoride anion by water-insoluble fluorescent probe incorporating hydrogel[J]. Analytical Chemistry, 2013, 85: 4113-4119. |
| [37] | Chen W H, Xing Y, Pang Y. A highly selective pyrophosphate sensor based on ESIPT turn-on in water[J]. Organic Letters, 2011, 13: 1362-1365. |
| [38] | Chen S, Hou P, Zhou B J, et al. A red fluorescent probe for thiols based on 3-hydroxyflavone and its application in living cell imaging[J]. RSC Advances, 2013, 3: 11543-11546. |
| [39] | Wang L Q, Zang Q G, Chen W S, et al. A ratiometric fluorescent probe with excited-state intramolecular proton transfer for benzoyl peroxide[J]. RSC Advances, 2013, 3: 8674-8676. |
| [40] | Wang J F, Chu Q H, Liu X M, et al. Large fluorescence response by alcohol from a bis(benzoxazole)-zinc(II) complex: the role of excited state intramolecular proton transfer[J]. The Journal of Physical Chemistry B, 2013, 117: 4127-4133. |
| [41] | Liang W R, Zhao Z, Zhang Y, et al. Highly selective detection of glutathione using a NIP/Cu2+ complex fluorescent probe[J]. Journal of Luminescence, 2012, 132: 1160-1165. |
| [42] | McMorrow D, Kasha M. Proton-transfer spectroscopy of 3-hydroxychromones. Extreme sensitivity to hydrogen-bonding perturbations[J]. Journal of the American Chemical Society, 1983, 105: 5133-5134. |
| [43] | Mordzinski A. Polyethylene as a medium for eliminating the solvent perturbation in intramolecular proton transfer systems[J]. Chemical Physics Letters, 1988, 150: 254-258. |
| [44] | Klymchenko A S, Shvadchak V V, Yushchenko D A. Excited-state intramolecular proton transfer distinguishes microenvironments in single- and double-stranded DNA[J]. The Journal of Physical Chemistry B, 2008, 112:12050-12055. |
| [45] | Strizhak A V, Postupalenko V Y, Shvadchak V V, et al. Two-color fluorescent L-amino acid mimic of tryptophan for probing peptide-nucleic acid complexes[J]. Bioconjugate Chemistry, 2012, 23: 2434-2443. |




