汞是一种危害极大的环境污染物,汞污染传播的主要来源是各种自然活动和人为的活动,包括海洋和火山的排放、固体废物的焚烧、化石燃料的燃烧等.根据美国环境保护局(EPA)的规定,人类日常饮用水的汞离子的最大浓度不得超过10 nmol/L.据统计,每年从自然和人类活动产生的全球总汞排放可以达到将近7500吨.人类主要是通过自然界的水接触到汞污染[1],即使非常低浓度的汞,也可能给人的身体带来严重的危害.元素态或离子态的汞都可以通过环境中的细菌转换成甲基汞进入食物链,最后进入到动物和人体内.汞可导致心脏病和高血压等心血管疾病,并可影响人类的肝、甲状腺和皮肤的功能,还会导致严重的中枢神经系统和内分泌系统的损害[2].
汞污染所产生的严重影响,促进了汞离子检测技术的不断研究与发展.常见的对汞离子进行检测的方法有原子吸收/发射光谱法、电感耦合等离子质谱法、电化学方法及化学发光法等.这些方法虽然各具优点,但在实际使用中仍存在很大的弊端,如灵敏度低、仪器昂贵以及操作复杂等.近年来,荧光分子探针技术由于具有灵敏度高、操作简单、成本低等特点,已经成为目前检测汞离子污染的重要手段.荧光增强传感材料可减少检测错误,对复杂体系检测准确,可同时用多种检测物对不同分析物进行检测,近几年来逐渐成为检测汞离子的新手段[3,4,5,6,7,8,9].罗丹明类染料由于具有摩尔吸光率大、水溶性好、荧光量子产率高和和发射波长较长等特点,在汞离子识别的领域得到越来越广泛的重视.本文以罗丹明B为荧光发色团,分别引入噻吩基团和苯环合成了荧光化学传感器2-噻吩甲醛罗丹明B酰肼和苯甲醛罗丹明B酰肼.二者分子结构中的螺环结构可以在汞离子的促进作用下发生“闭环-开环”,产生荧光从无到有的变化,可以作为汞离子的检测探针. 1 实验部分 1.1 试剂与仪器
罗丹明B,分析纯,阿拉丁试剂有限公司;2-噻吩甲醛,分析纯,萨恩化学技术(上海)有限公司;水合肼,分析纯,北京益利精细化学品有限公司;其它所用试剂均为分析纯.1HNMR 测定:Bruker公司Avance DRX500 型核磁共振谱仪.荧光光谱测定:日本日立公司F-4500 荧光光谱仪. 1.2 实验过程 1.2.1 罗丹明B酰肼的合成
合成过程如图1所示.将1.92 g(4 mmol)罗丹明B、30 mL无水乙醇加入50 mL三口烧瓶中,搅拌得到紫红色溶液.在室温下,将5 mL水合肼缓慢滴加到该体系中.将体系在油浴锅中加热,85 ℃回流反应2 h,反应结束后将溶液冷却至室温.旋蒸除去反应液溶剂.然后,用60 mL 1 mol/L的HCl水溶液溶解残留物,得到酒红色液体.在上述溶液中缓慢加入约70 mL 1 mol/L的NaOH水溶液至体系的pH值达到11—12,滴加过程中不断搅拌,有白色沉淀生成.将沉淀过滤,并用去离子水洗涤三次,室温下真空烘箱干燥24 h,得浅粉色粉末.产率:84.1 %.1HNMR(600 MHz,d-DMSO):7.77(q,1H,Ar-H),7.48(m,2H,Ar-H),7.00(q,1H,Ar-H),6.37(d,2H,Xanthene-H),6.34(q,4H,Xanthene-H),4.28(s,2H,NH2),3.33(q,8H,NCH2CH3),1.10(t,12H,NCH2CH3).
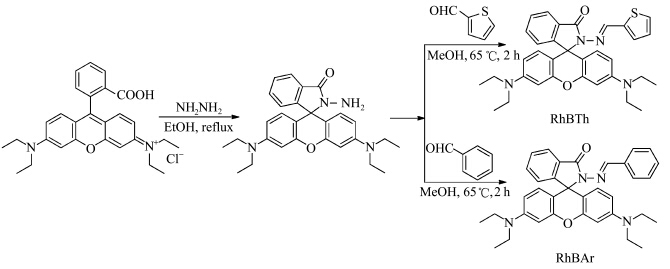 | 图1 化合物RhBTh和RhBAr的合成路线 Synthesis routes of compounds RhBTh and RhBAr |
在圆底烧瓶中加入457 mg (1 mmol)罗丹明B酰肼,0.15 mL 2-噻吩甲醛和10 mL无水甲醇,并加入3滴冰醋酸作催化剂.将温度缓慢升至65 ℃,磁力搅拌下回流2 h后停止反应.反应结束后将溶液冷却,并在室温下静置过夜,有白色物质析出,将析出的沉淀过滤,并用冰乙醇洗涤3次后,收集沉淀即为所要产物,室温下真空干燥24 h,得到白色粉末.产率:85%.1HNMR(600 MHz,CDCl3):8.95(s,1H,N=C-H),7.97(d,1H,Ar-H),7.52-7.43(m,2H,Ar-H),7.23(d,1H,Ar-H),7.13(d,1H,Thiophene-H),7.07(d,1H,Thiophene-H),6.93-6.89(m,1H,Thiophene-H),6.51(d,2H,Xanthene-H),6.45(d,2H,Xanthene-H),6.25(dd,2.5 Hz,2H,Xanthene-H),3.32(q,8H,NCH2CH3),1.16(t,12H,NCH2CH3). 1.2.3 苯甲醛罗丹明B酰肼(RhBAr)的合成
将457 mg(1 mmol) 罗丹明B酰肼,10 mL 无水甲醇和0.15ml苯甲醛加入圆底烧瓶中,并加入3滴冰醋酸作催化剂.将温度缓慢升至65 ℃,磁力搅拌下回流2 h后停止反应.待反应液冷却至室温后,有白色物质析出,过滤,并用冰乙醇洗涤该白色沉淀3次后,收集产物,室温下真空干燥24 h,得到白色粉末.产率:81%.1HNMR (600 MHz,CDCl3):8.69 (s,1H,N=C-H),7.99 (d,1H,Ar-H),7.58-7.52 (m,2H,Ar-H),7.52-7.43(m,2H,Ar-H),7.29(m,3H,Ar-H),7.13 (d,1H,Ar-H),6.53 (d,2H,xanthene-H),6.45 (d,2H,xanthene-H),6.24 (dd,2.1 Hz,2H,xanthene-H),3.32 (q,8H,NCH2CH3),1.16 (t,12H,NCH2CH3). 2 结果与讨论 2.1 探针RhBTh和RhBAr吸收光谱对汞离子响应研究
图2为RhBTh溶液和RhBAr溶液在不同浓度的汞离子下的吸收光谱.可以看到,当未加入汞离子时,二者的吸收的强度非常弱;加入汞离子后,随着汞离子浓度的增加,最大吸收峰位于520 nm处的吸收峰逐渐增强.
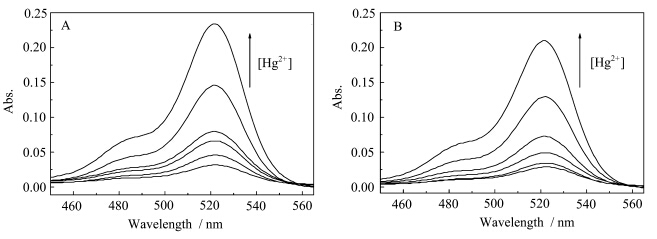 | 图2 (A)RhBTh(50 μmol/L)溶液与(B)RhBAr(50 μmol/L)溶液在不同浓度汞离子(0—100 μmol/L)下的紫外吸收光谱 溶剂:水/甲醇=9/1(体积比) UV-vis spectra of (A) RhBTh(50 μmol/L) and (B) RhBAr(50 μmol/L) in the presence of different concentrations of Hg2+(0100 μmol/L).Solvent: H2O/CH3OH=9/1(V/V) |
图3为RhBTh溶液和RhBAr溶液加入不同浓度的汞离子后的荧光发射光谱,向二者的溶液中加入汞离子后,汞离子的浓度较高时,在10 h之内就能达到很高的荧光强度,响应非常迅速,但是考虑到汞离子的浓度较低时的响应速度相对稍慢,因此向二者的溶液中加入汞离子后,稳定30 h再对其进行检测.由于二者分子结构中螺环部分的存在,破坏了整体的共轭结构,当用520 nm的激发波长激发时,二者的溶液均没有荧光.当向二者的溶液中加入汞离子后,体系表现出很强的荧光信号,应该是汞离子的加入促进二者分子结构中螺环部位发生开环反应[10],并发生螯合作用,恢复了罗丹明基整体的共轭结构.虽然与共轭结构直接相连的N原子上的孤对电子可以发生光诱导电子转移过程(PET),会使荧光发生猝灭导致荧光强度降低,但是当N原子与汞离子发生螯合作用后,N原子的供电子能力下降,抑制了PET过程,从而抑制了荧光猝灭效应.当RhBTh与汞离子发生螯合作用时,噻吩环上的S原子也参与了螯合作用(如图4所示),而且汞离子具有强烈的嗜硫性,汞离子可以稳定地螯合在RhBTh上,使得PET过程的抑制效率较高,表现出较强的荧光增强效应.但在RhBAr的分子结构中不存在S原子,其与汞离子的螯合作用稳定性相对较弱(具体见2.3节),即体系中汞离子与RhBAr结合比例相比RhBTh要低,未结合汞离子的开环RhBAr受分子内PET过程影响发光很弱,因此相同条件下发生开环反应后的RhBAr溶液荧光强度比RhBTh相对要低.
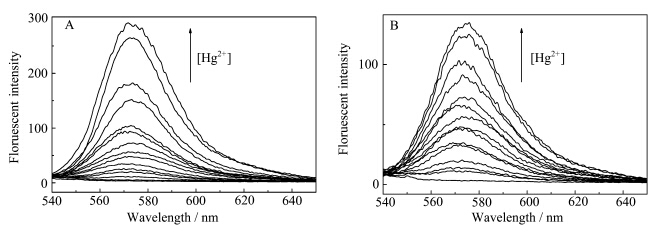 | 图3 (A)RhBTh(50 μmol/L)溶液与(B)RhBAr(50 μmol/L)溶液在不同浓度汞离子(0—100 μmol/L)下的荧光发射光谱 溶剂:水/甲醇=9/1(体积比),λex=520 nm Fluorescence emission spectra of (A) RhBTh(50 μmol/L) and (B) RhBAr(50 μmol/L) in the presence of different concentrations of Hg2+(0100μmol/L). Solvent: H2O/CH3OH=9/1(V/V),λex=520 nm |
 | 图4汞离子诱导RhBTh和RhBAr开环反应机理 The ring-open mechanism of RhBTh and RhBAr by Hg2+-induced |
通过等摩尔连续变化法(Job’s Plot)测定RhBTh和RhBAr与汞离子的结合比.固定二者与汞离子的总浓度为10 μmol/L,改变各自与汞离子的组成比例,所测定的荧光强度变化如图5所示.可以看出,二者的荧光强度均在摩尔分数为0.5时达到了最大值,表明了二者与汞离子的结合比均为1∶1,即一个探针分子只与一个汞离子发生螯合作用,这与图4中所示的探针分子与汞离子反应的机理相符.
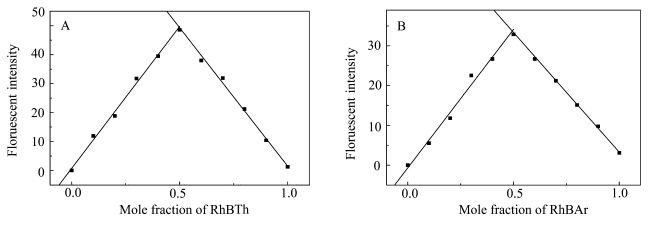 | 图5 (A)RhBTh和(B)RhBAr与汞离子的Job’s Plot曲线 Job’s Plot for RhBTh and RhBAr with Hg2+ |
图6为汞离子的浓度为0—100 μmol/L时,不同汞离子浓度下RhBTh与RhBAr的荧光光谱,插入图为573 nm处的荧光强度对汞离子浓度变化曲线.对二者的曲线图分别利用如下公式进行拟合[11]:

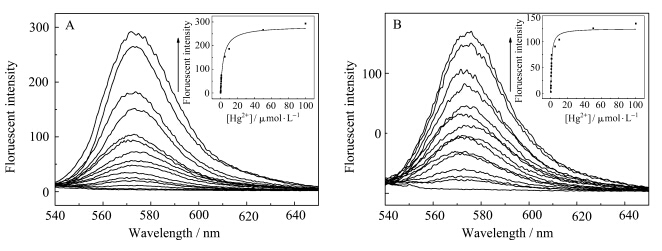 | 图6 (A)RhBTh与(B)RhBAr在不同浓度汞离子下的荧光发射光谱 插图:(A)RhBTh与(B)RhBAr在不同浓度汞离子下的最大荧光强度变化 Fluorescence emission spectra of (A) RhBTh and (B) RhBAr in the presence of different concentrations of Hg2+ Insert: The variation of fluorescence intensity of (A)RhBTh and(B)RhBAr by adding different concentrations of Hg2+ λex=520 nm,λem=573 nm |
当汞离子的浓度范围为0—900 nmol/L时,RhBTh和RhBAr对不同浓度汞离子产生荧光的最大发射峰峰值的变化曲线图如图7所示.由图中可以看出,当向二者溶液中加入的汞离子的浓度范围为0—900 nmol/L时,二者对汞离子的最大荧光强度值均呈线性增长并表现出非常好的线性关系(R2分别为0.99342和0.99497).根据国际纯粹与应用化学联合会(IUPAC)对检测限的定义,可以利用“检测限=3S0/m”这一公式来计算检测限.其中“S0”为空白样的标准偏差,对二者溶液的空白样(未加入汞离子)分别进行11次荧光测量,取测量结果并计算各自的标准偏差.“m”为线性拟合方程中拟合直线的斜率.通过公式可得,RhBTh对汞离子的检测限为7.8 nmol/L,RhBAr对汞离子的检测限为12.5 nmol/L,表明二者均可以作为理想的检测汞离子的荧光化学传感器.
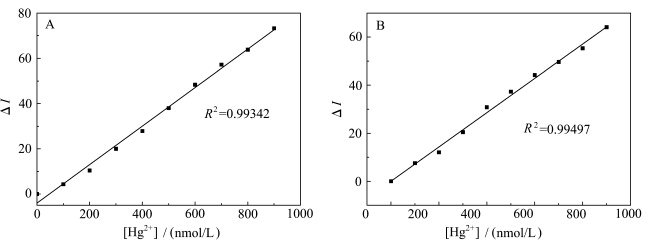 | 图7 (A)RhBTh(50 μmol/L)与(B)RhBAr(50 μmol/L)在不同浓度汞离子(0—900 nmol/L)下的最大荧光强度变化 The variation of fluorescence intensity of (A)RhBTh(50 μmol/L) and(B)RhBAr(50 μmol/L) by adding different concentrations of Hg2+(0900 nmol/L).λex=520 nm,λem=573 nm |
为了确定在检测中常见的金属离子是否会对汞离子的检测造成干扰,研究了可能对汞离子检测造成干扰的金属离子对RhBTh和RhBAr荧光强度的影响.图8是二者对汞离子的选择性的研究示意图.从图中可以看出,在向RhBTh溶液中加入不同离子时,只有汞离子能引发RhBTh产生强烈的荧光变化,荧光增强的倍数达到了235倍,其它离子对RhBTh没有明显的荧光增强响应.这主要基于汞离子强烈的嗜硫性,在罗丹明衍生物分子结构中引入了噻吩基团,噻吩基团中的硫原子可以提高在检测过程中对汞离子的选择能力,同时由于荧光增强倍数高,其它离子所产生的影响并不明显.而向RhBAr溶液中加入不同离子时,除了汞离子会引起RhBAr产生强烈的荧光变化,铜离子和银离子也会对RhBAr产生一定的荧光响应.这是由于RhBAr在检测汞离子过程中荧光增强倍数相比RhBTh低,铜离子和银离子所引起的影响则变得明显.由此可见,RhBTh对汞离子具有非常良好的选择性,非常适合用于水溶液中汞离子的检测.而RhBAr虽然对铜离子和银离子也产生了一定的荧光响应,但由于响应的增强倍数较低,并不影响其对汞离子的检测,因此RhBAr也适合用于水溶液中汞离子的检测.
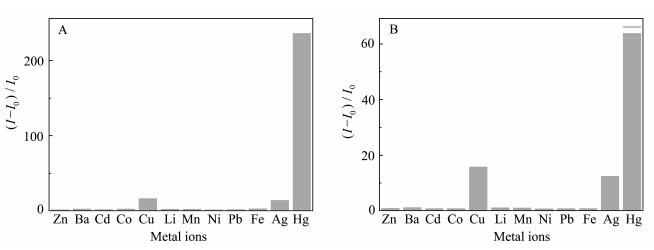 | 图8 (A)RhBTh(50 μmol/L)与(B)RhBAr(50 μmol/L)在不同金属离子(100 μmol/L)作用下的最大荧光强度的变化 Fluorescence intensity changes of (A) RhBTh (50 μmol/L) and (B) RhBAr(50 μmol/L) in the presence of different metal ions (100 μmol/L).λex=520 nm,λem=573 nm |
为了进一步测试RhBTh和RhBAr检测体系对Hg2+的检测能力,分析了RhBTh和RhBAr检测体系在不同金属离子与汞离子共存的条件下对汞离子的检测效果,结果如图9所示.可以看出,在与其它离子共存的情况下,Hg2+依然可以诱导RhBTh和RhBAr开环产生荧光增强效果,并且荧光增强的效果没有明显改变.可以得出结论,RhBTh和RhBAr作为检测Hg2+的荧光化学传感器具有很好的抗干扰能力,在检测过程中其它金属离子不会对检测结果带来明显的干扰.
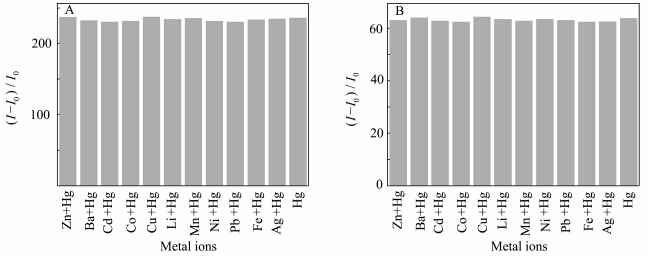 | 图9 (A)RhBTh(50 μmol/L)与(B)RhBAr(50 μmol/L)在不同金属离子(100 μmol/L)与Hg2+(100 μmol/L) 共存时的最大荧光强度的变化 Fluorescence intensity changes of (A) RhBTh (50 μmol/L) and (B) RhBAr(50 μmol/L) in the presence of different metal ions(100 μmol/L) with Hg2+(100 μmol/L).λex=520 nm,λem=573 nm |
以罗丹明B为荧光发色团并分别引入苯环和能提高对汞离子的螯合能力的噻吩基团,设计、合成了苯甲醛罗丹明B酰肼(RhBAr)和2-噻吩甲醛罗丹明B酰肼(RhBTh)这两种新型的荧光化学传感器,并考察了二者对汞离子荧光检测的性能.研究结果表明,二者在汞离子的促进下可以发生螺环开环反应,并生成相应的螯合了汞离子的产物,同时伴随着荧光从无至有的变化过程.其中RhBTh对汞离子的检测限为7.8 nmol/L,RhBAr对汞离子的检测限为12.5 nmol/L.在检测过程中其它金属离子不会对检测结果带来大的影响.综上所述,RhBTh和RhBAr对汞离子的检测具有简单、快速和高灵敏度等特点,在汞离子检测应用中具有重要的意义.
| [1] | Renzoni A, Zino F,Franchi E. Mercury levels along the food chain and risk for exposed populations. Environmental Research, 1998, 77(2): 68-72. |
| [2] | Gutknecht J. Inorganic mercury (Hg2+) transport through lipid bilayer membranes. Journal of Membrane Biology, 1981, 61(1): 61-66. |
| [3] | Vedamalai M,Wu S P. A BODIPY-based colorimetric and fluorometric chemosensor for Hg(Ⅱ) ions and its application to living cell imaging. Organic & Biomolecular Chemistry, 2012, 10(28): 5410-5416. |
| [4] | 黄文君,吴文辉. 荧光化学剂量计在汞离子检测中的应用. 影像科学与光化学, 2011, 29(5): 321-335. Huang W J, Wu W H. Fluorescent chemodosimeters for mercury(Ⅱ) ions detection. Imaging Science and Photochemistry, 2011, 29(5): 321-335. |
| [5] | Wanichacheva N, Prapawattanapol N, Lee V S, et al. Hg2+-induced self-assembly of a naphthalimide derivative by selective "turn-on" monomer/excimer emissions. Journal of Luminescence, 2013, 134: 686-690. |
| [6] | Neupane L N, Park J Y, Park J H, et al. Turn-on fluorescent chemosensor based on an amino acid for Pb(II) and Hg(II) ions in aqueous solutions and role of tryptophan for sensing. Organic Letters, 2013, 15(2): 254-257. |
| [7] | Li Q Q, Peng M, Li H Y, et al. A new "turn-on" naphthalenedimide-based chemosensor for mercury ions with high selectivity: successful utilization of the mechanism of twisted intramolecular charge transfer, near-IR fluorescence, and cell images. Organic Letters, 2012, 14(8): 2094-2097. |
| [8] | 徐全清, 王 俊, 张辉淼, 等. 基于蒽酰亚胺基团的新型Fe3+和Hg2+化学敏感器. 影像科学与光化学, 2009, 27(1): 23-31. Xu Q Q, Wang J, Zhang H M, et al. New selective Fe3+ and Hg2+ ions chemosensors based on anthracenecarbonamide derivatives. Imaging Science and Photochemistry, 2009, 27(1): 23-31. |
| [9] | Ma X, Wang J, Shan Q L, et al. A "turn-on" fluorescent Hg2+ chemosensor based on ferrier carbocyclization. Organic Letters, 2012, 14(3): 820-823. |
| [10] | Chen X, Pradhan T, Wang F, et al. Fluorescent chemosensors based on spiroring-opening of xanthenes and related derivatives. Chemical Reviews, 2012, 112(3): 1910-1956. |
| [11] | Valeur B, Berberan-Santos M N. Molecular Fluorescence: Principles and Applications. 2nd Edition. Wiley, 2013. 339-343. |




