许多巯基化合物如半胱氨酸(Cys)、高半胱氨酸(Hcy)和还原型谷胱甘肽(GSH)等,在生物体中扮演着非常重要的角色[1, 2]。它们在人体内参与多种重要的反应,也与细胞的生长有重要关系。生物体内巯基化合物浓度异常与许多疾病如肝损伤、艾滋病、阿兹海默症和帕金森症等[3, 4, 5, 6]有密切关联。鉴于它们的重要性,能够高选择性、高灵敏度并且实时检测巯基的化合物受到越来越多研究者的关注。
传统的检测巯基化合物的方法主要有:高效液相色谱法[7, 8]、毛细管电泳法[9]、分光光度法[10]、电化学方法[11]、化学发光法[12, 13]。但这些方法会受到如设备成本、复杂性、样本处理和运行时间等因素的限制。而荧光分析法因为具有灵敏度高、动态响应范围宽及易于进行原位检测等优点,在生物分子检测中受到人们广泛的关注。用来检测巯基化合物的荧光探针分子的设计思路大多数是基于巯基化合物的高亲核特征。近年来各种亲电基团被引入到探针分子中用作巯基的接受体,例 如Keillor等[14]利用马来酰亚胺与巯基的加成反应设计合成一系列识别巯基的荧光探针,但此类探针分子在识别后荧光增强的效果不是很明显,限制了其应用范围;Kim等[15]设计合成了含有醛基的探针分子,与Cys、Hcy发生环化反应从而达到检测的目的,识别前后反应体系颜色变化明显;Karuso等[16]报道了基于能量传递机制的含有二硫键的巯基传感器;Wang等[17]将磺酰胺引入探针分子实现了高选择性的识别苯硫酚,该探针需要5~10 min的响应时间;Maeda等[18]设计合成了含有磺酸酯键的巯基化学传感器,该探针在加入巯基化合物10 min后荧光强度才能得到稳定。从文献中可以看出,基于马来酰亚胺、磺酰胺和磺酸酯等这些巯基接受体的探针通常不够灵敏,只有少数的探针分子能够快速的与半胱氨酸、高半胱氨酸和谷胱甘肽等巯基化合物反应。为了改善探针分子与巯基化合物的响应速度,我们引入了强亲电子基团(多氰基)作为探针分子的巯基受体,以实现对巯基的快速、专一性检测。
本文以7-N,N-二乙基氨基香豆素和四氰基乙烯为反应底物,合成了具有强亲电基团的荧光探针分子3-三氰基乙烯基-7-N,N-二乙基氨基香豆素(TCC)。分子内强烈的电荷转移作用使得分子本身的荧光较弱,当加入巯基化合物后,巯基化合物与TCC的三氰基乙烯基发生了加成反应[19, 20],破坏分子内电荷转移,使得荧光增强。研究结果表明,TCC可以快速、高效、专一的识别半胱氨酸(Cys)、高半胱氨酸(Hcy)和还原型谷胱甘肽(GSH)等巯基化合物。
1 实验部分 1.1 试剂和仪器实验中所用四氰基乙烯(TCNE)为Acros公司的产品,使用前未做进一步纯化;4-N,N-二乙基氨基水杨醛、丙二酸二乙酯、浓盐酸、冰醋酸、N,N-二甲基甲酰胺(DMF)均为分析纯,购买于北京化学试剂公司(DMF预先加入无水CaCl2干燥过夜,滤去干燥剂,加入CaH2,加热回流4 h,减压蒸馏收集以供实验使用,其它试剂在实验中直接使用);光谱测试所用试剂均为色谱纯。
实验中所用的氨基酸:丙氨酸(Alanine)、脯氨酸(Proline)、色氨酸(Tryptophan)、丝氨酸(Serine)、谷氨酸(Glutamine)、甘氨酸(Glycine)、精氨酸(Arginine)、亮氨酸(Leucine)、异亮氨酸(Isoleucine)、苏氨酸(Threonine)、蛋氨酸(Methionine)、缬氨酸(Valine)、赖氨酸(Lysine)、酪氨酸(Tyrosine)、天门冬氨酸(Aspartic acid)、半胱氨酸(Cysteine)、高半胱氨酸(Homocysteine)及还原型谷胱甘肽(GSH)等均为分析纯,使用前未做进一步纯化。
荧光光谱和吸收光谱分别用Hitachi F-4500荧光光谱仪和Hitachi U-3010吸收光谱仪测定得到;1HNMR谱图是用Bruker-400(400 MHz)核磁共振仪测定得到;质谱在Finnigan 4021C型质谱仪和APEXII FT-ICR型质谱仪上测定。
1.2 化合物(TCC)的合成
TCC的合成路线如图1所示。
 | 图1 荧光探针分子TCC的合成方法 Synthetic route of TCC |
将1.93 g 4-N,N-二乙基氨基水杨醛(10 mmol)、3.2 g丙二酸二乙酯(20 mmol)以及30 mL无水乙醇置于100 mL的圆底烧瓶中,室温搅拌,待完全溶解后,再加入1 mL六氢吡啶,回流搅拌反应6 h。冷却至室温后旋转蒸除溶剂,然后再加入20 mL 浓盐酸和20 mL冰醋酸。继续升温至回流反应6 h,停止反应。待冷却至室温,将反应液倒入100 mL冰水中,用40% NaOH溶液调节溶液的pH值至5左右,有大量的土黄色粉末析出。继续搅拌30 h,粗产品过滤、多次水洗,真空干燥后用甲苯重结晶得到浅黄色晶体1.74 g,产率80.1%。
1HNMR (CDCl3,400 MHz): 1.21 (6H,t),3.42 (4H,m),6.06 (1H,d),6.51 (1H,s),6.59 (1H,d),7.23 (1H,d),7.55 (1H,d)。
1.2.2 化合物TCC的合成将300 mg 7-N,N-二乙基氨基香豆素 1 (1.38 mmol)溶于10 mL的DMF,溶液呈黄绿色。往溶液中加入176 mg四氰基乙烯(TCNE)(1.38 mmol),溶液颜色迅速变成蓝黑色。室温搅拌24 h,停止反应。将反应液倒入150 mL冰的氯化钠水溶液中,使深颜色固体能够充分析出。抽滤得到粗产物,经柱层析分离(洗脱剂为二氯甲烷:乙酸乙酯=4∶1),得到纯净的蓝黑色晶体160 mg,产率为55%。
1HNMR (CDCl3,400 MHz): 1.30 (6H,t),3.54 (4H,m),6.50 (1H,s),6.70 (1H,m),7.42 (1H,d),8.23 (1H,s)。EI-MS: m/z C18H14N4O2+ 318,理论EI-MS: m/z C18H14N4O2 +318.11。
1.3 光谱测试方法准确称取3.2 mg TCC(0.01 mmol)置于 10 mL容量瓶中,用色谱纯乙腈溶解并定容,得到溶液浓度为1.0×10-3 mol/L,将此储备液存放于阴凉暗处。测试前,将溶液用混合溶剂(乙腈∶水 (V∶V)=1∶1,HEPES 10 mmol/L,pH=7.4)稀释到2.0×10-5 mol/L。半胱氨酸、高半胱氨酸、还原型谷胱甘肽和各种氨基酸分别称取0.01 mmol溶于10 mL去离子水中,浓度均为 1.0×10-3 mol/L,由于巯基化合物在水溶液中很容易氧化变质,所以所有的含有巯基的化合物溶液均是配制完后立即测试。测试时用微量进样器加入到石英液槽中,测试温度为25 ℃。
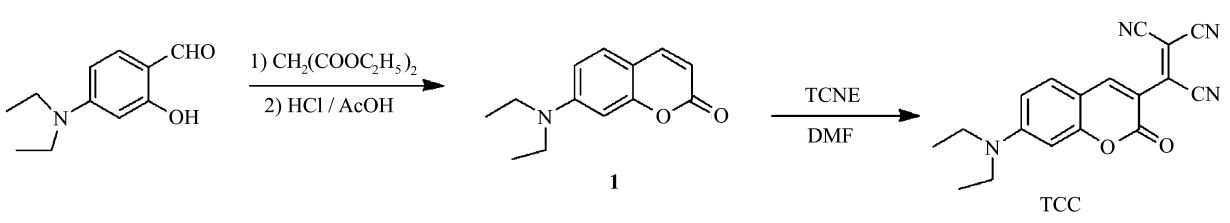
2 结果与讨论 2.1 化合物TCC的光物理性质的研究我们对化合物TCC和具有相似结构的香豆素 1 的光物理性质进行了研究。由图2可以看出香豆素 1 在378 nm处有很强的吸收,这是由于分子中存在大的共轭结构。相比于香豆素 1 的吸收光谱,化合物TCC有两个吸收峰分别在380 nm和560 nm处。位于380 nm处的弱吸收峰对应于香豆素本身,而位于560 nm处新的强吸收峰,是由于三氰基乙烯基的引入使多氰基电子受体与香豆素之间相互作用,发生强烈的分子内电荷转移而产生。
 | 图2 乙腈溶液中化合物TCC和N,N-二乙基氨基香豆素 1 的吸收光谱 Absorption spectra of compound 1 /TCC in MeCN |
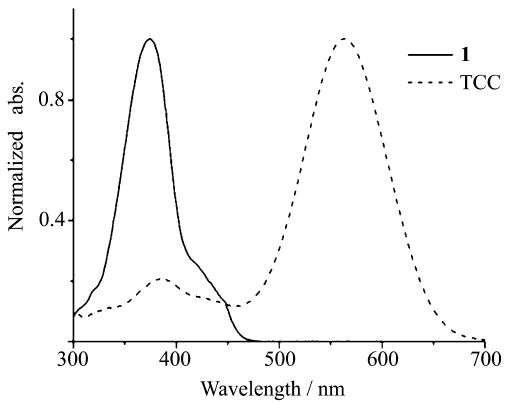
化合物TCC和香豆素 1 在乙腈溶液中的荧光发射光谱如图3所示,香豆素的最大发射波长位于460 nm处,其Stocks位移为82 nm。对应化合物TCC的最大吸收波长,以420 nm为激发波长,得到了最大发射波长为500 nm的发射峰。TCC的最大发射波长与香豆素 1 相比红移了40 nm,有可能是分子内电荷转移导致发射峰的红移。
 | 图3 乙腈溶液中化合物TCC和N,N-二乙基氨基香豆素 1 的荧光光谱 Fluorescence spectra of compound 1 /TCC in MeCN |
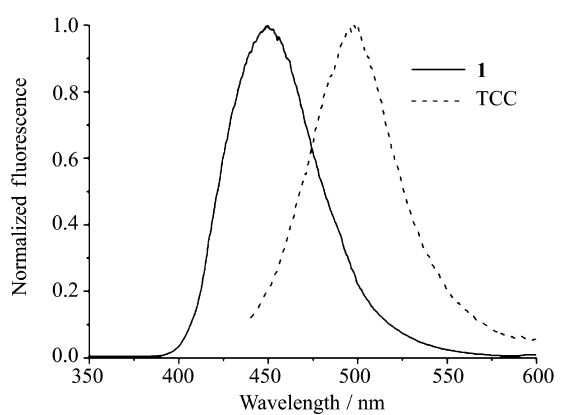
我们对于两个化合物的荧光量子产率进行了测试和计算。以荧光素为参比(0.1 mol/L NaOH溶液的荧光素的荧光量子产率为0.85)[21],量子产率的计算公式为:
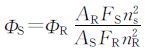
公式中,n、F和A分别代表溶液的折射率、发射峰面积和激发波长下的吸收值。下标R表示参比,S的表示未知样品。因为溶液是稀溶液,因此可用纯溶剂的折射率代替稀溶液的折射率。
在乙腈溶液中,香豆素 1 的荧光量子产率为Φ=0.84。与香豆素 1 相比,多氰基TCC的荧光量子产率(Φ=0.01)大大下降,这可能是多氰基TCC分子内电荷转移峰产生而导致的,TCC分子在500 nm处的发射峰遇到560 nm处的分子内电荷转移吸收峰,类似分子自猝灭过程,从而使发射峰强度降低。另外,光诱导电子转移可能也是化合物1的荧光量子效率降低的原因之一。
2.3 TCC在缓冲溶液中对巯基化合物识别的研究在乙腈/HEPES缓冲溶液中测试TCC对半胱氨酸(Cys)的识别作用。图4是在乙腈/HEPES缓冲溶液(体积比为1∶1,pH=7.4)中,Cys加入前后体系颜色的变化以及Cys对化合物TCC的吸收滴定曲线。从图中可以看出,随着Cys的加入,TCC的分子内电荷转移吸收峰渐渐减弱,说明巯基化合物与TCC的作用导致了TCC分子内电荷转移的减弱。相反本征吸收峰渐渐增强,并且最大吸收值的位置红移约10 nm。这是因为分子内电荷转移的减弱会导致电子给体上的电荷密度增加和LUMO能级的降低,从而使光谱能隙变窄而发生红移。吸收光谱中位于480 nm处有一个明显的等吸收点,说明TCC和半胱氨酸形成了稳定的化合物。
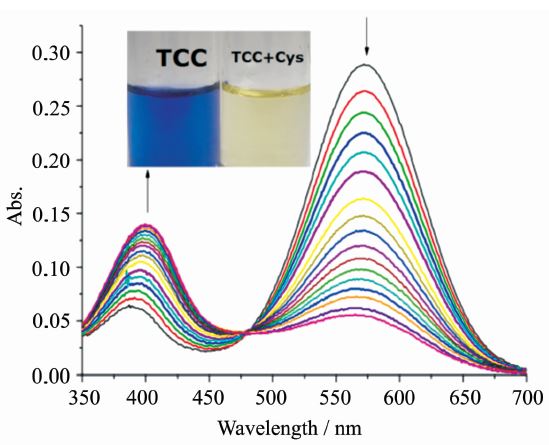 | 图4 乙腈/HEPES缓冲溶液(乙腈∶水=1∶1,HEPES 10 mmol/L,pH=7.4)中化合物TCC的吸收光谱随Cys浓度的变化 Absorption titration spectra of TCC in MeCN-HEPES buffer solution after addition of Cys [TCC]=2×10-5 mol/L,[Cys]=0-2×10-5 mol/L |
图5为乙腈/HEPES缓冲溶液体系中加入不同浓度Cys后化合物TCC的荧光发射光谱,可以看出,随着半胱氨酸的加入,识别体系的荧光强度逐渐增强,并且伴随着最大发射波长的蓝移,最终最大发射波长蓝移到480 nm处。对应于吸收光谱的变化,最大发射峰的蓝移可以用分子内电荷转移现象的减弱来解释。通过定量增加半胱氨酸的方法,测量了480 nm处荧光强度与半胱氨酸浓度的滴定曲线,每个光谱数据均是在加入半胱氨酸2 min后记录得到,结果如图6,其荧光强度与加入的半胱氨酸浓度呈良好的线性关系(R=0.998)。
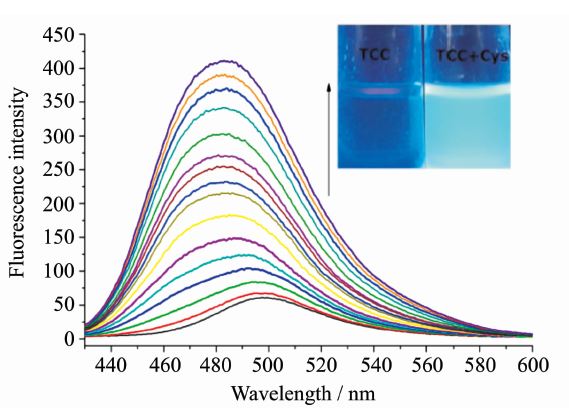 | 图5 乙腈/HEPES缓冲溶液(乙腈∶水=1∶1,HEPES 10 mmol/L,pH=7.4)中化合物TCC的荧光发射光谱随Cys浓度的变化 Fluorescence titration spectra of TCC in MeCN-HEPES buffer solution after addition of Cysλex=420 nm,[TCC]=2×10-5 mol/L, [Cys]=0-2×10-5 mol/L |
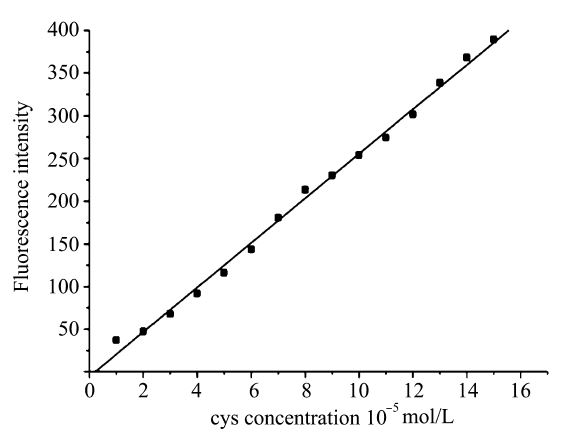 | 图6 乙腈/HEPES缓冲溶液(乙腈∶水=1∶1,HEPES 10 mmol/L, pH=7.4)中化合物TCC位于480 nm处的荧光强度与 半胱氨酸浓度(Cys)的线性关系 Linear correlation between fluorescence intensities at 480 nm of TCC and concentrations of Cys in MeCN-HEPES buffer solution λex=420 nm,[TCC]=2×10-5 mol/L, [Cys]=0-2×10-5 mol/L |
图7为高半胱氨酸和还原型谷胱甘肽在乙腈/HEPES缓冲溶液体系中对化合物TCC的荧光光谱的影响,其光谱变化情况和加入半胱氨酸的情况类似,在加入与半胱氨酸相同浓度、相同体积的高半胱氨酸和还原型谷胱甘肽后,二者荧光与TCC相比都得到一定程度的恢复,并且在480 nm处形成一个新的荧光发射峰。加入高半光氨酸和还原型谷胱甘肽后荧光强度分别是原来6倍和3倍,没有加入半胱氨酸的变化明显。也就是说多氰基化合物TCC对含有巯基的氨基酸均有响应,尤其对半胱氨酸的响应更好。
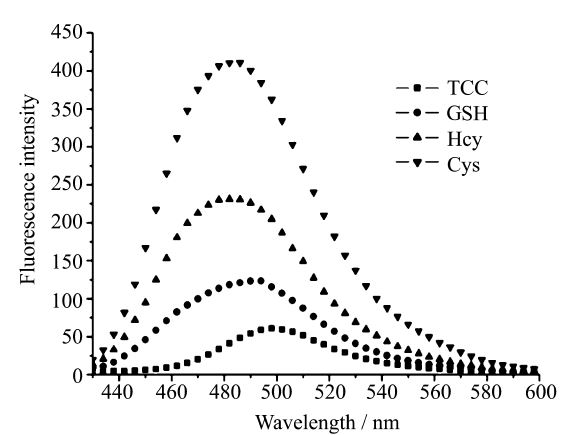 | 图7 乙腈/HEPES缓冲溶液(乙腈∶水=1∶1,HEPES 10 mmol/L,pH=7.4)中化合物TCC分别加入半胱氨酸(Cys)、高半胱氨酸(Hcy)和谷胱甘肽(GSH)的前后荧光发射光谱变化 Fluorescence spectra of TCC in the presence of various amino acids such as Cys,Hcy and GSH in MeCN-HEPES buffer solutionλex=420 nm,[TCC]=2×10-5 mol/L,[Cys]=0-2×10-5 mol/L,[Hcy]=0-2×10-5 mol/L, [GSH]=0-2×10-5 mol/L |
为了解其它阴离子、金属离子以及不含巯基的氨基酸对化合物TCC在识别半胱氨酸过程中的干扰情况,我们对不同的干扰离子(均为13倍量)和各种氨基酸(均为15倍量)共存的体系进行研究,得到如图8和图9所示的荧光干扰图,每个荧光光谱均是在加入各种氨基酸后 2 min 后测量所得。可以从干扰柱状图中清楚的看到,各种常见的离子(NO2-、NO3-、HCO3-、SCN-、CO32-、Ag+、Cu2+、Mg2+、Zn+、Pb+、Fe2+)和非巯基氨基酸(丙氨酸,精氨酸,天门冬氨酸,谷氨酸,甘氨酸,亮氨酸,赖氨酸,蛋氨酸,丝氨酸,苏氨酸,色氨酸,酪氨酸,结氨酸)对检测半胱氨酸基本没有干扰。显然这是因为这些物种不能与三氰基乙烯基进行加成反应,三氰基乙烯基的结构未破坏就不能使分子内电荷转移减弱或者是消失,从而重新恢复荧光。因此,其它常见的阴离子、金属离子和不含巯基的天然氨基酸几乎不干扰TCC对半胱氨酸的检测,即成功的实现了对巯基化合物的专一性检测。
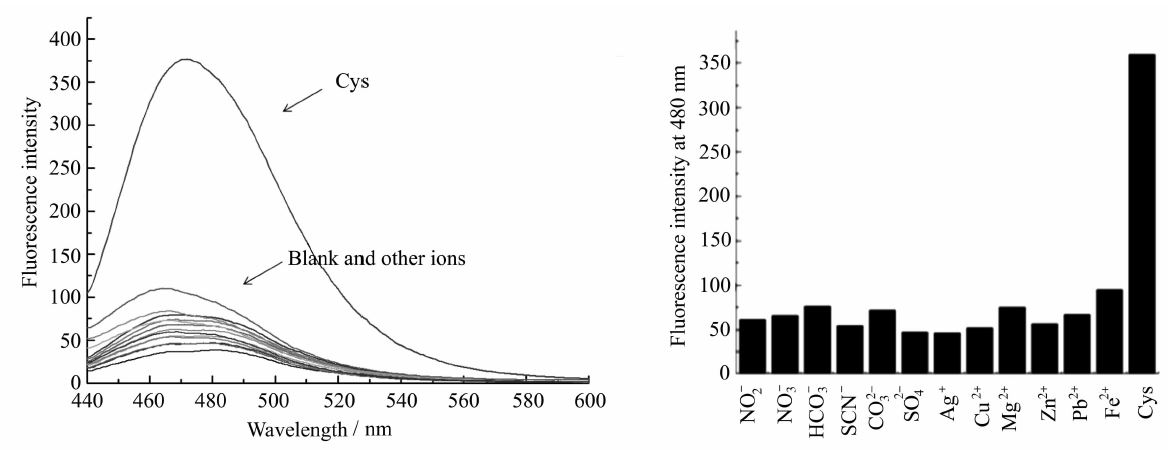 | 图8 化合物 TCC 在乙腈/HEPES缓冲溶液(乙腈∶水 (V∶V)=1∶1,HEPES 10 mmol/L,pH=7.4)加入不同的离子后 480 nm处的荧光强度对比 Comparison of fluorescence spectra of TCC in MeCN-HEPES buffer solution after addition of various ions λex=420 nm,[TCC]=2×10-5 mol/L |
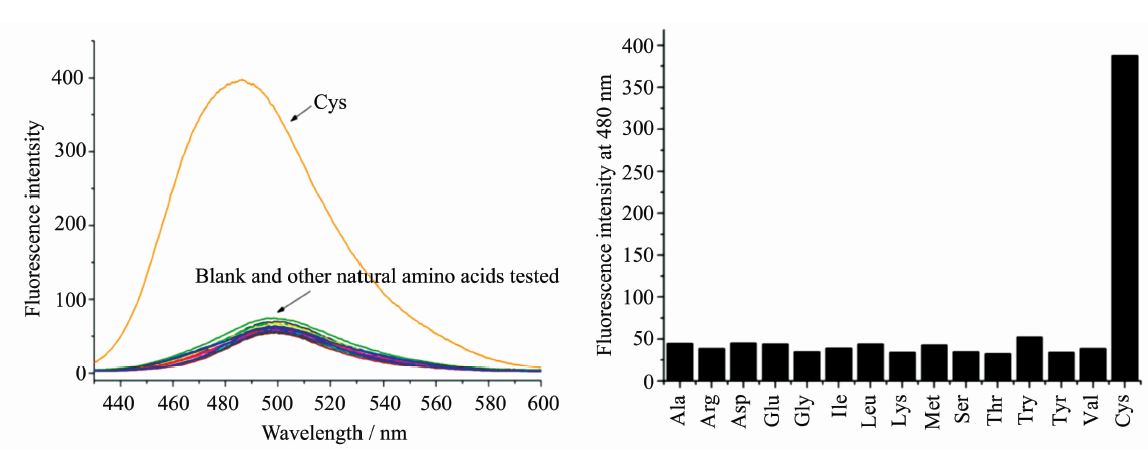 | 图9 化合物 TCC 在乙腈/HEPES缓冲溶液(乙腈∶水=1∶1,HEPES 10 mmol/L,pH=7.4)加入不同的氨基酸后 480 nm处的荧光强度对比 Comparison of fluorescence spectra of TCC in MeCN-HEPES buffer solution after addition of various natural amino acids λex=420 nm,[TCC]=2×10-5 mol/L |
本文设计合成了含有强亲电基团三氰基乙烯基的化合物TCC,基于分子内电荷转移效应,其本身荧光较弱。巯基化合物能够与TCC的三氰基乙烯基进行加成反应,从而破坏分子内电荷转移,使得荧光增强,增强的强度与巯基化合物浓度有很好的线性关系,检测限可达到10-5 mol/L。与其它检测巯基的传感器相比,多氰基化合物TCC检测前后变化明显,裸眼可见,响应速度快,并且具有良好的专一性和选择性。
| [1] | Carmel R, Jacobsen D W. Homocysteine in Health and Disease[M]. Cambridge University Press, Cambridge: U.K. 2001. |
| [2] | Wood Z A, Schrder E, Robin Harris J, Poole L B. Structure, mechanism and regulation of peroxiredoxins[J]. Trends in Biochemical Science, 2003, 28(1): 32-40. |
| [3] | Bauer H, Fritz-Wolf K, Winzer A, K hner S, Little S, Yardley V, Vezin H, Palfey B, Schirmer R H, Davioud-Charvet E. A Fluoro analogue of the menadione derivative 6-hexanoic acid is a suicide substrate of glutathione reductase. Crystal structure of the alkylated human enzyme[J]. Journal of the American Chemical Society, 2006, 128(33): 10784-10794. |
| [4] | Heafield M T, Fearn S, Steventon G B, Waring R H, Williams A C, Sturman S G. Plasma cysteine and sulphate levels in patients with motor neurone, Parkinson's and Alzheimer's disease[J]. Neuroscience Letters, 1990, 110(1-2): 216-220. |
| [5] | Herzenberg L A, De Rosa D C, Dubs J G, Roederer M, Anderson M T, Ela S W, Deresinski S C, Herzenberg L A. Glutathione deficiency is associated with impaired survival in HIV disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(5): 1967-1972. |
| [6] | Townsend D M, Tew K D, Tapiero K. The importance of glutathione in human disease[J]. Biomedicine and Pharmacotherapy, 2003, 57(3-4): 145-155. |
| [7] | Ivanov A R, Nazimov I V, Baratova L A. Qualitative and quantitative determination of biologically active low-molecular-mass thiols in human blood by reversed-phase high-performance liquid chromatography with photometry and fluorescence detection[J]. Journal of Chromatography A, 2000, 870(1-2):433-442. |
| [8] | Nekrassova O, Lawrence N S, Compton R G. Analytical determination of homocysteine: a review[J]. Talanta, 2003, 60(6): 1085-1095. |
| [9] | Chen G, Zhang L, Wang J. Miniaturized capillary electrophoresis system with a carbon nanotube microelectrode for rapid separation and detection of thiols[J]. Talanta, 2004, 64(4):1018-1023. |
| [10] | Refsum H, Smith A D, Ueland P M, Nexo E, Clarke R, McPartlin J, Johnston C, Engbaek F, Schneede J, McPartlin C, Scott J M. Facts and recommendations about total homocysteine determinations: an expert opinion[J]. Clinical Chemistry, 2004, 50(1): 3-32. |
| [11] | Shahrokhian S. Lead phthalocyanine as a selective carrier for preparation of a cysteine-selective electrode[J]. Analytical Chemistry, 2001, 73(24): 5972-5978. |
| [12] | Chow C F, Chiu B K W, Lam M H W, Wong W Y. A trinuclear heterobimetallic Ru(II)/Pt(II) complex as a chemodosimeter selective for sulfhydryl-containing amino acids and peptides[J]. Journal of the American Chemical Society, 2003, 125(26): 7802-7803. |
| [13] | Ros-Lis J V, García B, Jiménez D, Martínez-Mez R, Sancenón F, Soto J, Gonzalvo F, Valldecabres M C. Squaraines as fuoro-chromogenic probes for thiol-containing compounds and their application to the detection of biorelevant thiols[J]. Journal of the American Chemical Society, 2004, 126(13): 4064-4065. |
| [14] | Girouard S, Houle M H, Grandbois A, Keillor J W, Michnick S W. Synthesis and characterization of dimaleimide fluorogens designed for specific labeling of proteins[J]. Journal of the American Chemical Society, 2004, 127(2): 559-566. |
| [15] | Lee K S, Kim T K, Lee J H, Kim H J, Hong J I. Fluorescence turn-on probe for homocysteine and cysteine in water[J]. Chemical Communication, 2008, (46): 6173-6175. |
| [16] | Piggott A M, Karuso P. Fluorometric assay for the determination of glutathione reductase activity[J]. Analytical Chemistry, 2007, 79(22): 8769-8773. |
| [17] | Jiang W, Fu Q, Fan H, Ho J, Wang W. A highly selective fluorescent probe for thiophenols[J]. Angewandte Chemie-international Edition, 2007, 46(44): 8445-8448. |
| [18] | Maeda H, Matsuno H, Ushida M, Katayama K, Saeki K, Itoh N. 2,4-Dinitrobenzenesulfonyl fluoresceins as fluorescent alternatives to ellman's reagent in thiol-quantification enzyme assays[J]. Angewandte Chemie-international Edition, 2005, 44(19): 2922-2925. |
| [19] | Tang X L, Liu W M, Wu J S, Zhao W W, Wang P F. A colorimetric chemosensor for fast detection of thiols based on intramolecular charge transfer [J]. Terahedron Letters, 2011, 52: 5136-5139. |
| [20] | Kwon H, Lee K, Kim H J. Coumarin-malonitrile conjugate as a fluorescence turn-on probe for biothiols its cellular expression[J]. Chemical Communication, 2011, 47: 1773-1775. |
| [21] | Valeur B. Molecular Fluorescence Principles and Applications[M]. Wiley-VCH Verlag GmbH: New York, 2001. |




