有机小分子光电材料具有可控制备、确定的分子结构、多功能修饰以及器件加工重复性好等优点,在有机太阳能电池(OSCs)、有机场效应晶体管(OFETs)、有机发光二极管(OLEDs)等领域中已获得广泛的应用[1,2,3,4]。近年来,研究者们通过在有机分子的刚性骨架中嵌入硫、氮、氧等原子来改善其光电性质,从而制备性能优异的有机光电器件。设计与合成新型有机含杂原子小分子功能材料是本领域的研究热点之一[5,6,7,8,9]。
噻吩、吡啶、吡嗪、呋喃、吡喃等结构单元的引入,可以调控分子的载流子迁移特性,如p-型空穴传输或n-型电子传输,以及迁移能力。相比于硫原子,氧原子具有较小的原子半径。氧杂原子的修饰在增强有机功能分子的给电子能力以及改善溶解性方面效果显著[5]。因此,含氧原子的功能单元(如呋喃、吡喃等)常常赋予了有机小分子显著的p-型半导体特征。最近,含吡喃结构的有机杂环功能片段,引起了有机光电领域研究者们的重视[7,8,9]。例如,相比常用的给体单元,如苯并二噻吩(BDT)、二噻吩并环戊二烯(CPDT)、二噻吩并吡喃(DTP)结构单元作为供电子基团表现出更强的给电子性质[7]。然而,关于含吡喃类有机功能分子的报道仍然相对匮乏,对这类分子的性质研究有待深入,其潜在的应用性开发存在巨大的发展空间。
本论文以萘基为关键结构单元,设计并合成了一系列新型含氧杂环有机小分子:萘并[2,1-b∶6,5-b′]二苯并吡喃 4a 、萘并[2,1-b∶6,5-b′]二萘并吡喃 4b 、萘并[2,1-b∶6,5-b′]二[2-(5-己基噻吩基)]苯并吡喃 4c (路线见图1),并通过核磁与质谱检测对分子结构进行了详细表征。这类分子具有较好的溶解性和丰富的光电特性。通过对分子刚性骨架外边缘的功能修饰,可以有效调节化合物的能隙,进而调控化合物的光电性质。
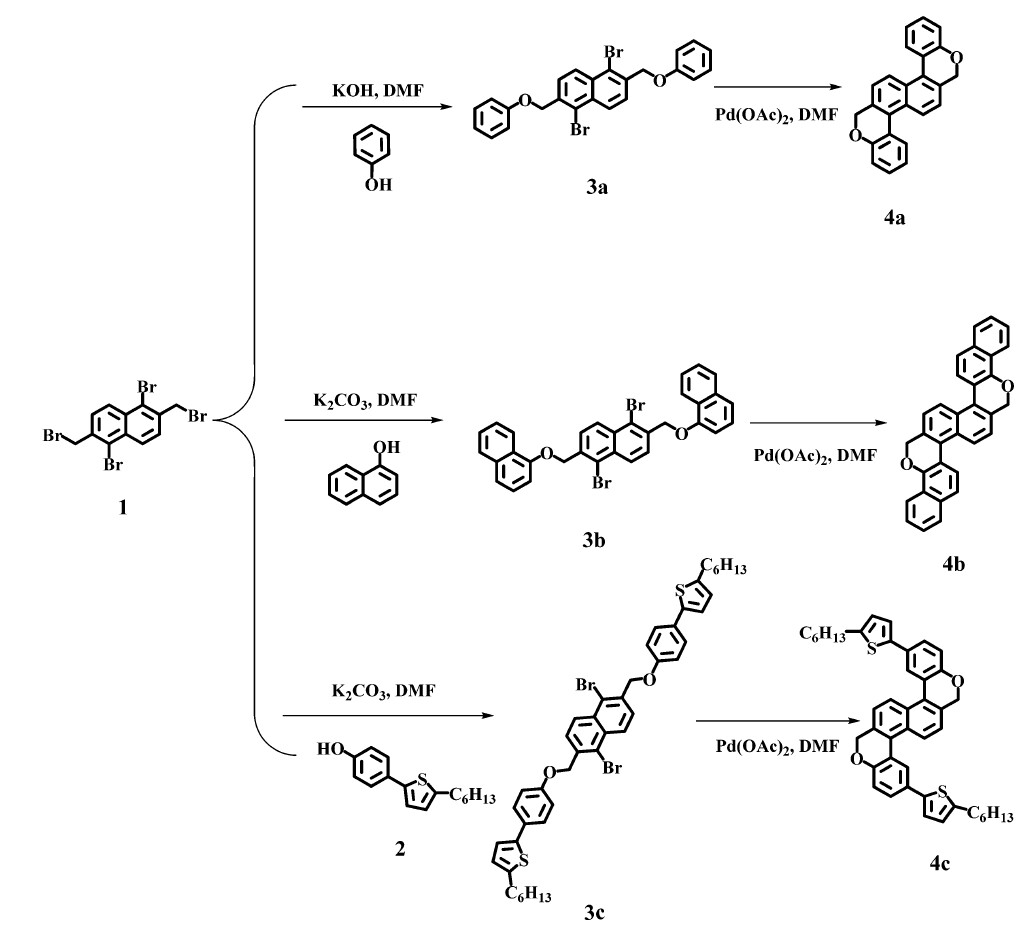 | 图1 化合物4a ~ 4c的合成路线 The synthetic scheme of compound4a ~ 4c |
试剂:镁条,化学纯,国药;1-溴代正己烷,分析纯,阿达玛斯;N-溴代丁二酰亚胺,98%,阿达玛斯;液溴,分析纯,国药;正丁基锂,分析纯,百灵威科技;异丙醇频哪醇硼酸酯,分析纯,阿达玛斯;苯酚,分析纯,国药;1-萘酚,分析纯,国药;四三苯基膦钯,99%,百灵威科技;对甲基苄氯,99%,阿拉丁试剂;4,4-二甲氧基-2-丁酮,99%,阿拉丁试剂;过氧化二苯甲酰,分析纯,国药;对碘代苯甲醚,分析纯,百灵威科技;三溴化硼,分析纯,百灵威科技;三环己基膦四氟硼酸盐,分析纯,百灵威科技;醋酸钯,分析纯,百灵威科技;噻吩,分析纯,百灵威科技。
仪器:紫外-可见吸收光谱由紫外光谱仪HITACHI Spectrophotometer U-4100测定;荧光光谱由HORIBA Scientific Fluoromax-4 Spectrofluorometer测定;核磁由Mercury Plus 400(400 MHz for proton)测定;质谱由(美国布鲁克·道尔顿公司,solariX XR 7.0T)测定。
1.2 中间体及目标化合物的合成本文主要合成了以萘基为关键结构单元的一系列新型含氧杂环有机小分子。化合物 4a ~ 4c 均是以化合物 1 ,即1,5-二溴-2,6-二(溴甲基)萘为基础,首先与不同的酚类反应起始物进行缩合反应,得到三种醚类中间体 3a ~ 3c ;再利用钯催化通过分子内碳-碳偶联成环得到目标分子 4a ~ 4c 。
化合物 1 的合成:首先以对甲基苄氯为原料制备格氏试剂,与4,4-二甲氧基-2-丁酮进行格氏加成反应,然后进行分子内关环得到化合物2,6-二甲基萘[10],利用液溴对化合物2,6-二甲基萘进行溴代反应,从而得到1,5-二溴-2,6-二甲基萘[11]。最后将1,5-二溴-2,6-二甲基萘进行NBS自由基溴代反应,从而制得化合物 1 [12]。
化合物 2 的合成:先采用2-己基-5-噻吩硼酸酯和对碘代苯甲醚经Suzuki偶联反应得到对[2-(5-己基噻吩基)]苯甲醚,再通过对[2-(5-己基噻吩基)]苯甲醚与三溴化硼反应可制得化合物 2 ,即对[2-(5-己基噻吩基)]苯酚[13]。
1.2.1 化合物 3a [14]将苯酚(35 mmol,3.29 g)和氢氧化钾(120 mmol,6.7 g)先后加入到N,N-二甲基甲酰胺(100 mL)中,搅拌1 h,然后加入化合物 1 (8 mmol,3.77 g),在80 ℃条件下,加热反应过夜。次日,确认四溴萘反应完全后,将体系倒入300 mL水中,搅拌2 h后静置,有黄色沉淀析出,抽滤。将得到的沉淀用去离子水洗涤。待干燥后收集沉淀,再用石油醚洗涤。最后用三氯甲烷/石油醚重结晶,得淡黄色固体纯产物3.32 g,产率为83%。
1HNMR(400 MHz,CDCl3):8.38 (d,J=8.8 Hz,2H),7.81 (d,J=8.8 Hz,2H),7.33(dd,J=8.4,7.2 Hz,4H),7.02 (m,6H),5.39 (s,4H,CH2)。
1.2.2 化合物 4a [15, 16]反应采用100 mL史兰克瓶,先抽真空并用加热枪加热,除水除氧。再将化合物 3a (0.598 g,1.20 mmol)、三环己基膦四氟硼酸盐(0.106 g,0.288 mmol)、碳酸钾(0.100 g,0.72 mmol)、无水N,N-二甲基甲酰胺(40 mL)依次加入其中。液氮冷冻抽真空两次后,第三次液氮冷冻后,加入醋酸钯(0.032 g,0.144 mmol)催化剂,再抽真空并解冻,在氮气氛围下,加热至130 ℃反应48 h。加入二氯甲烷,采用饱和食盐水洗涤有机相5次,用无水硫酸镁干燥有机相,抽滤,旋蒸。使用层析柱(二氯甲烷/石油醚=1∶4)纯化得到白色固体,又用二氯甲烷/石油醚重结晶得到白色固体纯产物0.34 g,产率为84%。
1HNMR(400 MHz,CDCl3):8.52 (d,J=8.4 Hz,2H),7.99 (d,J=8.4 Hz,2H),7.34 (m,4H),7.19 (m,4H),5.16 (s,4H).13CNMR(100 MHz,CDCl3):155.98,146.18,134.94,133.11,128.05,126.21,122.12,119.18,118.63,118.10,113.02,69.18。 HRMS: m/z: calcd for C24H16O2:359.1048 [M+Na+]; found,359.1056。
1.2.3 化合物 3b [14]将1-萘酚(11 mmol,1.58 g)和碳酸钾(25 mmol,3.45 g)先后加入到N,N-二甲基甲酰胺(100 mL)中,搅拌1 h,然后加入化合物 1 (2.5 mmol,1.18 g),在80 ℃条件下,加热反应过夜。次日,确认四溴萘反应完全后,将体系倒入300 mL水中,搅拌2 h,静置,有白色沉淀析出,抽滤。再将得到的沉淀用去离子水洗涤。待干燥后收集沉淀,再用石油醚洗涤,再用甲苯重结晶(100 ℃),得白色固体纯产物1.29 g,产率为86%。
1HNMR(400 MHz,CDCl3):8.43 (m,4H),7.94(d,J=8.8 Hz,2H),7.85(dd,J=6.4,3.6 Hz,2H),7.54(m,J=10,3.2Hz,4H),7.48(d,J=8.4Hz,2H),7.38(d,J=7.6Hz,2H),6.90(d,J=8.0Hz,2H),5.59(s,4H,CH2).
1.2.4 化合物 4b [15, 16]反应采用100 mL史兰克瓶,先抽真空并用加热枪加热,除水除氧。再将化合物 3b (0.2 g,0.334 mmol)、三环己基膦四氟硼酸盐(0.03 g,0.08 mmol)、碳酸钾(0.028 g,0.2 mmol)、无水N,N-二甲基甲酰胺(50 mL)依次加入其中。液氮冷冻抽真空两次后,第三次液氮冷冻后,加入醋酸钯(0.009 g,0.04 mmol)催化剂,再抽真空并解冻,在氮气氛围下,加热至130 ℃反应48 h。加入三氯甲烷后,再用饱和食盐水洗涤有机相5次,用无水硫酸镁干燥有机相,抽滤,旋蒸。使用层析柱(三氯甲烷/石油醚=1∶4)纯化得到黄绿色固体,又用甲苯重结晶得到黄绿色固体纯产物0.108 g,产率为74%。
1HNMR(400 MHz,CDCl3):8.55 (d,J=8.4 Hz,2H),8.37(dd,J=6.4,3.6 Hz,2H),8.12(d,J=8.8 Hz,2H),7.89(dd,J=6.4,2.8 Hz,2H),7.66(d,J=8.4 Hz,2H),7.55(d,J=3.6 Hz,2H),7.53(d,J=3.2 Hz,2H),7.41(d,J=4.4 Hz,2H),5.34(s,4H,CH2)。 HRMS: m/z: calcd for C32H20O2: 435.1463[M-H+]; found,435.1467。
1.2.5 化合物 3c [14]将化合物 2 (1.15 mmol,0.3 g)和碳酸钾(4.5 mmol,0.622 g)先后加入到N,N-二甲基甲酰胺(20 mL)中,搅拌1 h,然后加入化合物 1 (0.3 mmol,0.142 g),在80 ℃条件下,加热反应过夜。次日,确认四溴萘反应完全后,将体系倒入150 mL水中,搅拌2 h后静置,有白色沉淀析出,抽滤。再将得到的沉淀用去离子水洗涤。待干燥后收集沉淀,再用二氯甲烷/石油醚重结晶,得白色固体纯产物0.201 g,产率为81%。
1HNMR(400 MHz,CDCl3):8.38 (d,J=8.8 Hz,2H,Ph),7.80(d,J=9.2 Hz,2H,Ph),7.49 (d,J=8.4 Hz,4H,Ph),7.00 (d,J=3.6 Hz,2H,Th),6.99 (d,J=8.4 Hz,4H,Ph),6.70 (d,J=2.8 Hz,2H,Th),5.40 (s,4H,CH2),2.81 (t,J=3.6 Hz,4H,CH2),1.68 (m,4H,CH2),1.38~1.21 (m,12H,CH2),0.90 (t,J=6.8 Hz,6H,CH3).
1.2.6 化合物 4c [15, 16]反应采用100 mL史兰克瓶,先抽真空并用加热枪加热,除水除氧。再将化合物 3c (0.15 g,0.18 mmol)、三环己基膦四氟硼酸盐(0.016 g,0.043 mmol)、碳酸钾(0.015 g,0.108 mmol)、无水N,N-二甲基甲酰胺(30 mL)依次加入其中。液氮冷冻抽真空两次后,第三次液氮冷冻后,加入醋酸钯(0.0048 g,0.0216 mmol)催化剂,再抽真空并解冻,在氮气氛围下,加热至130 ℃反应48 h。加入二氯甲烷后,再用饱和食盐水洗涤有机相5次,用无水硫酸镁干燥有机相,抽滤,后旋蒸。使用层析柱(二氯甲烷/石油醚=1∶4)纯化得到白色固体,又用二氯甲烷/乙醇重结晶得到白色固体纯产物0.095 g,产率为79%。
1HNMR(400 MHz,CDCl3):8.54(d,J=8.4 Hz,2H,Ph),8.14(s,2H,Ph),7.54(d,J=8.4 Hz,2H,Ph),7.32(d,J=8.8 Hz,2H,Ph),7.18(d,J=8.4 Hz,2H,Ph),7.12(d,J=3.2 Hz,2H,Th),6.78(d,J=3.6 Hz,2H,Th),5.11(s,4H,CH2),2.86(t,J=3.6 Hz,4H,CH2),1.76(m,4H,CH2),1.44~1.28(m,12H,CH2),0.93(t,J=6.4 Hz,6H,CH3);13CNMR(100MHz,CDCl3): 155.99,145.52,141.71,132.41,130.59,129.00,127.58,126.45,125.68,125.60,125.26,124.38,123.76,122.36,118.28,
70.12,31.95,31.86,30.55,29.10,22.87,14.38。 HRMS: m/z: calcd for C44H44O2S2: 667.2783[M-H+]; found,667.2736。
目标化合物 4a ~ 4c 的合成路线如图1所示。以化合物1,5-二溴-2,6-二(溴甲基)萘为基础,与苯酚,1-萘酚,4-(5-己基-2-噻吩基)苯酚进行缩合反应,分别得到三种醚类物质的中间体 3a ~ 3c (产率81% ~86%)。以苯酚为例,化合物 3a 的氢谱中,化学位移在8.38 ppm和7.81 ppm的质子峰归属于萘基上的氢,化学位移在7.33 ppm和7.02 ppm的质子峰归属于苯酚上的氢,而5.39 ppm的质子峰归属于亚甲基氢。中间体化合物 3a ~ 3c ,在Pd(OAc)2的催化下,高效实现了分子内碳-碳偶联反应,分别得到目标分子化合物 4a ~ 4c (产率74%~84 %)。值得注意的是,通过中间体 3b 的分子内环合反应,只得到了萘并吡喃类主要产物,即生成了氧杂六元环结构片段,无其它大小的氧杂环结构片段(如七元环)生成,证明了吡喃环结构上相对高的稳定性。相比于中间体化合物,关环后的多环化合物共轭性明显增加,如与中间体 3a 相比,化合物 4a 呋喃片段上的亚甲基的质子峰的化学位移出现在5.16 ppm。通过氢和碳核磁谱以及高分辨质谱的结构表征,充分证明了目标化合物 4a ~ 4c 的成功制备。
2.2 4a~4c的紫外吸收光谱图2是室温下,化合物 4a ~ 4c 在二氯甲烷溶液中(浓度为10-5 mol/L)的吸收光谱图,所得吸收峰数据列于表1中。如表1所示,化合物 4a~ 4c 的最大吸收峰的摩尔消光系数的数量级都为 104(mol/L)-1·cm-1,而这个数量级是在跃迁允许范围内。从吸收光谱可以看出,目标分子的最大吸收峰集中在370~400 nm区域内。根据目标化合物的紫外吸收光谱,目标分子最大吸收峰波长大小顺序是 4b>4c>4a 。显然,4b 具有最大的共轭结构,而 4c 中的噻吩单元能够发生构象旋转,所以其分子的平面共轭性比 4b 弱,但共轭单元噻吩的引入增加了目标分子 4c 的共轭程度,从而使得其最大吸收波长比 4a 红移。另外,化合物 4c 中噻吩单元的存在,导致芳环上的π-π*电子跃迁引起的吸收增强,并在309 nm处出现了一个相应的最大吸收峰。
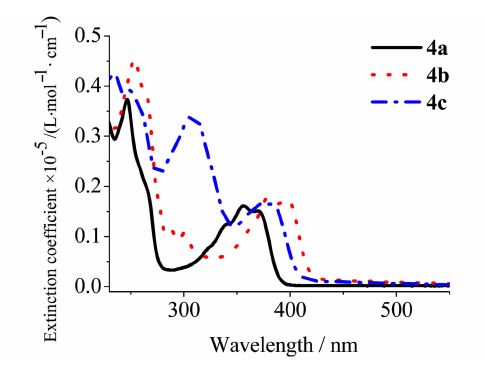 | 图2 4a ~ 4c 的 二氯甲烷溶液的紫外可见吸收光谱图 The UV-Vis spectra of 4a - 4c in dichloromethane |
有机半导体材料的能带间隙(Eg)是指有机分子中HOMO(最高已占分子轨道)与LUMO(最低未占分子轨道)的能级差,其可由紫外-可见吸收光谱中的低能吸收边来确定。化合物 4a ~ 4c 的能带间隙Eg的大小顺序为 4b<4c <4a ,说明化合物的芳香环数量的增加和芳香环键合方式,能有效地影响有机小分子化合物的共轭结构,从而影响化合物的能带间隙,进而调节化合物的光电性质。
| 表1 化合物 4a ~ 4c 在二氯甲烷中的光谱数据 Optoelectronic data of compounds 4a - 4c in dichloromethane |
图3是室温下,化合物 4a ~ 4c 在二氯甲烷溶液中(浓度为10-5 mol/L)分别以355 nm、380.5 nm、373.5 nm为激发波长得到的荧光光谱。最大发射峰波长的大小顺序为 4c>4b>4a 。从化合物 4a (417 nm)、化合物 4b (446 nm)到 4c (462 nm)可以看出荧光最大发射峰波长发生了明显的红移。这表明在刚性骨架外边缘修饰芳香环基团能有效提高目标化合物的共轭程度,降低能带间隙,这与紫外得到的结论是一致的。
 | 图1 4a ~ 4c 的二氯甲烷溶液的荧光光谱图 The photoluminescence spectra of 4a - 4c in dichloromethane |
此外,化合物 4c 的最大发射波长大于化合物 4b ,可能是由于 4b 具有更高的刚性骨架,导致其在激发态下相比于基态时的分子形状变化较小,降低了分子的结构变化(如分子内片段转动构象变化);化合物 4c 利用噻吩的构象旋转增加分子在激发态下的能级裂分,从而使得化合物 4c 的荧光峰发生红移。测得的荧光量子产率数据如表1所示。化合物 4a ~ 4c 的荧光量子产率大小顺序为 4b>4a>4c 。化合物 4c 的荧光量子产率仅为5.43%,远低于化合物 4b与4a 的数值。主要原因是化合物 4c 中的噻吩烷基链可以发生运动旋转,造成分子能量的损失,使其荧光量子产率大大降低。
3 结论本工作以化合物1,5-二溴-2,6-二(溴甲基)萘为基础,首先与不同的酚类反应起始物进行缩合反应,得到三种醚类中间体 3a ~ 3c ,再利用过渡金属催化剂Pd(OAc)2催化下的分子内碳-碳偶联反应,实现关环过程,高效获得目标分子化合物 4a ~ 4c 。核磁共振和高分辨质谱充分确定了分子结构。目标化合物紫外-可见和荧光光谱分析表明这类分子具有丰富的光电活性,通过对刚性分子骨架外边缘的功能性修饰可有效地改变分子的共轭结构,调节分子的能带间隙,进而有效调节这类分子的光电性质。
| [1] | Mishra A, Ma C Q, Bäuerle P. Functional oligothiophenes: molecular design for multidimensional nanoarchitectures and their application[J]. Chemical Reviews, 2009, 109(3): 1141-1276. |
| [2] | Murphy A R, and Frechet J M J. Organic semiconducting oligomers for use in thin film transistors[J]. Chemical Reviews, 2007, 107(4): 1066-1096. |
| [3] | Zaumseil J, Sirringhaus H. Electron and ambiolar transport in organic field-effect transistor[J]. Chemical Reviews, 2007, 107(4): 1296-1323. |
| [4] | Toby L N, Tomasz M Y, Jun Y L, Mishra S P, Belot J A, Balliet C L, Javier A E, Kowalewski T, McCullough R D. Transistor paint: high mobilities in small bandgap polymer semiconductor based on the strong acceptor, diketopyrrolopyrrole and strong donor, dithienopyrrole[J]. Advanced Materials, 2010, 22(41): 4617-4621. |
| [5] | Mitsui C, Soeda J, Miwa K, Tsuji H, Takeya J, Nakamura E. Naphthodifuran: a versatile motif available for solution-processed single-crystal organic field-effect transistors with high hole mobility[J]. Journal of the American Chemical Society, 2012, 134(12): 5448-5451. |
| [6] | Gidron O, Diskin-Posner Y, and Bendikov M. α-Oligofurans[J]. Journal of the American Chemical Society, 2010, 132(7): 2148-2150. |
| [7] | Dou L T, Chen C C, Yoshimura K, Ohya K, Chang W H, Gao J, Liu Y S, Richard E, and Yang Y. Synthesis of 5H-dithieno pyran as an electron-rich building block for donor-acceptor type low-bandgap po- lymers[J]. Macromolecules, 2013, 46(9): 3384-3390. |
| [8] | You J B, Dou L T, Yoshimura K, Ohya K, Moriarty T, Emery K, Chen C C, Gao J, Li G, Yang Y. A poly- mer tandem solar cell with 10.6% power conversion efficiency[J]. Nature Communications, 2013, 4: 1-10. |
| [9] | You J B, Chen C C, Hong Z, Yoshimura K, Ohya K, Gao J, Li G, and Yang Y. 10.2% power conversion efficiency polymer tandem solar cells consisting of two identical sub-cells[J]. Advanced Materials, 2013, 25(29): 3973-3978. |
| [10] | Mocydlahz J W, Canonne P, Lfitch L C. Synthesis of 2,5,8-trimethylphellalene[J]. Communications Synthesis, 1974, 23: 566-568. |
| [11] | Arnold R T,Liggett R W. Mechanism of the reaction between hindered carbonyl compounds and the Grignard reagent[J]. Journal of the American Chemical Society, 1942, 64(12): 2875-2877. |
| [12] | Thibault M E, Closson T L L, Manning S C, Dibble P W. Naphthodifuran: a reactive linker and cyclophane precursor[J]. The Journal of Organic Chemistry, 2003, 68(22): 8373-8378. |
| [13] | Tang K C, Chang M J, Lin T Y, Pan H A, Fang T C, Chen K Y, Hung W Y, Chou P T. Fine tuning the energetics of excited-state intramolecular proton transfer (ESIPT): white light generation in a single ESIPT system[J]. Journal of the American Chemical Society, 2011, 133(44): 17738-17745. |
| [14] | Majumdar K C, Chakravorty S, De N. Palladium mediated bis- and tris-biaryl Heck coupling for the synthesis of heterocycles[J]. Tetrahedron Letters, 2008, 49(21): 3419-3422. |
| [15] | Campeau L C, Parisien M, Jean A, Fagnou K. Catalytic direct arylation with aryl Chlorides, Bromides, and Iodides: intramolecular studies leading to new intermolecular reactions[J]. Journal of the American Chemical Society, 2006, 128(2): 581-590. |
| [16] | Campeau L C, Parisien M, Leblanc M, Fagnou K. Biaryl synthesis via direct arylation: establishment of an efficient catalyst for intramolecular processes[J]. Journal of the American Chemical Society, 2004, 126(30):9186-918. |




