银纳米粒子因其在光学、电磁学和生物相容性等方面的优点,已经在很多领域中得到应用,诸如生物检测[1]、疾病免疫[2]、抗菌材料[3]、光学器件[4]、催化材料[5,6]、表面增强拉曼光谱(SERS)[7]、数据存储[8]、3D打印[9],以及喷墨打印[10]等。
银纳米粒子的粒径和单分散性对其实际应用产生重要影响[11]。因此人们发展各种方法合成粒径可控和单分散性更好的银纳米粒子。在已有的合成方法中,化学还原法[12,13,14,15]、微乳液法[16,17,18]、多元醇法[19,20,21]等,由于操作简单、成本较低和容易放大等特点而备受关注。
尽管人们在银纳米粒子的合成上进行了很多尝试,但在较高的溶液浓度下大规模合成单分散的银纳米粒子仍然存在很大挑战。传统的合成方法多以硝酸银作为前驱体,而此合成体系中银离子浓度过高,导致成核不均,粒径单分散性较差[20]。近年来也有利用氯化银、溴化银等作为前驱体的报道[22,23],但是合成的银纳米粒子浓度较低,且形貌各异。本文以氧化银、卤化银等作为前驱体,水合肼为还原剂,在水相反应溶液中,常温条件下制备了高浓度(1 mol/L)的不同粒径的单分散性银纳米粒子。特别地,这些前驱体通过可 逆反应,可匀速地向体系中释放银离子,克服了传统体系中以硝酸银为前驱体造成银纳米粒子成核速率过快、高浓度下制备的银纳米粒子单分散性差等缺点。通过改变前驱体,可以选择性地制备粒径不同的单分散性银纳米粒子。
1 实验部分 1.1 试剂与仪器硝酸银(分析纯,国药集团),聚乙烯吡咯烷酮(PVP ,Aldrich公司),水合肼(化学纯,Aldrich公司),氯化钠(分析纯,国药集团),溴化钠(分析纯,国药集团),碘化钠(分析纯,Aldrich公司),氢氧化钠(分析纯,国药集团),无水乙醇(分析纯,国药集团),丙酮(分析纯,国药集团),水(超纯水,自制)。
紫外-可见分光光度计(U4100 ,日本Hitachi),场发射扫描电子显微镜(JSM-7500 ,日本JEOL),X射线-光电子能谱仪(XPS,ESCALAB 220i-XL),X射线-粉末衍射仪(XRD,RigakuD/max-2500),喷墨打印机(Epson C110,Epson中国),高速离心机(HC-3518,安徽中科中佳科学仪器有限公司),超纯水制备机(Milli-Q academic,美国Millipore),RFID读写测试仪(DLC-6890,深圳市德力森科技有限公司)。
1.2 制备过程将100 mL 1.0 mol/L的硝酸银溶液快速加入到含有与硝酸银同等质量的PVP(Mw为6×104 g·mol-1)的烧杯中,磁力搅拌使其充分溶解。将100 ml的1.0 mol/L的NaX(X为Cl、Br、I、OH)溶液缓慢加入到上述溶液中,磁力搅拌20 min。磁力搅拌下加入5 mL 质量分数为50%的水合肼溶液,室温下反应2 h。反应结束后,将反应液倒入1000 mL烧杯中,加入600 mL丙酮,用玻璃棒搅拌混匀,此时溶液由原来的灰色变为暗红色。混合溶液在7000 rpm 条件下离心5 min,然后将离心沉淀的银纳米粒子重新分散到200 mL 水中。如此反复两次,以洗去多余的PVP和其它杂质。银纳米粒子经离心后在丙酮的封存下贮存,待用。
2 结果与讨论化学还原法制备银纳米粒子通常是在稳定剂的保护下,用还原剂还原反应前驱体,得到银纳米粒子。其中,前驱体的选择早期大多为CH3COOAg等含银的化合物,此前驱体适用于有机相中经过化学反应制备银。此类方法需要高温加热,并需要相转移催化剂将制备的银纳米粒子从有机相转移到水相,方法较为繁琐,且易产生环境污染。在水相体系制备银纳米粒子,前驱体大多选用硝酸银,由于反应体系中银离子浓度较高,导致成核过快,最终合成的银纳米粒子单分散性较差,且粒径不可控。
为克服上述银纳米粒子合成方法的局限,本文发展了一种方法简单、环境友好、在较高浓度下粒径可控地合成单分散性银纳米粒子的方法。通过改变制备体系中的前驱体,即在稳定剂的保护下,在硝酸银溶液中加入卤素离子、氢氧根离子等与银离子结合能力强的阴离子,可以迅速得到大量纳米级的氯化银、溴化银、碘化银、氧化银晶核。通过晶核生长,得到银化合物的纳米粒子。以此作为反应的前驱体,即使在较高的合成浓度下,氯化银、溴化银、碘化银、氧化银等纳米粒子也可以缓慢地释放银离子与还原剂反应,达到均匀成核的目的,最终得到单分散性的银纳米粒子产物。
为了考察不同前驱体对银纳米粒子的平均粒径的影响,我们在1 mol/L的高浓度硝酸银溶液中,加入卤素或氢氧根等阴离子,以生成的氯化银、溴化银、碘化银、氧化银作为前驱体,水合肼为还原剂,制备得到银纳米粒子为产物。如图1所示,氯化银作为前驱体制备的银纳米粒子的平均粒径约为150 nm,以溴化银、碘化银和氧化银为前驱体制备的银纳米粒子的平均粒径分别为100 nm、60 nm、40 nm。显然,不同前驱体对产物银纳米粒子的平均粒径有明显影响。按照前驱体氯化银、溴化银、碘化银、氧化银的依次改变,所制备的银纳米粒子产物的粒径依次减小,原因是不同前驱体在水相体系中释放银离子的能力不同。氯化银的离子积常数Ksp =1.8×10-10;溴化银的离子积常数Ksp = 5.0×10-13;碘化银的离子积常数Ksp =8.3×10-17;氧化银离子积常数Ksp =6.3×10-50[24]。释放银离子的能力由强到弱依次为氯化银、溴化银、碘化银、氧化银。前驱体释放银离子的能力越强,反应体系中成核速度越快,最终形成的粒子粒径相对较大。
 | 图1 a)AgCl ,b)AgBr ,c)AgI,d)Ag2O,e)AgNO3作为前驱体合成的银纳米粒子的SEM照片 SEM images of silver nanoparticles synthesized from a)AgCl ,b)AgBr ,c)AgI,d)Ag2O,e)AgNO3 as precursors |
银纳米粒子的形成过程可以分为三个阶段:Ⅰ是银原子浓度的增大期,Ⅱ是晶核的形成期,Ⅲ是晶核的生长期,如图2(a)。随着反应过程的进行,还原生成的银原子的浓度不断升高。当银原子的浓度大于最小晶核浓度cmin,便开始生成晶核;随着体系中银原子浓度的增大,晶核的形成速度不断加快,达到一个最大值cmax。如果此时体系中银原子的浓度过大,大于cmax时,晶核便会快速聚集形成不规则的纳米结构;随着体系中银原子的浓度减小,当体系中银原子浓度重新下降到cmin时,即进入晶核的生长过程;随着反应的进行,晶核不断吸附体系中新还原的银原子,导致粒径不断增大,生长成为纳米粒子[25]。
在传统的硝酸银为前驱体的反应体系,反应过程如图2(b)所示。如果用水合肼等强还原剂,由于反应体系中银离子过多,会在瞬间发生还原反应,生成过多的晶核,当其浓度大于晶核的最大值cmax,晶核过快的聚集会产生大量粒径不均的银纳米粒子。如果利用较弱的还原剂,如葡萄糖等,则需要加热反应,反应时间较长。而利用氯化银、溴化银、碘化银、氧化银作为前驱体的反应体系,如图2(c),前驱体本身为均匀分布的纳米粒子,在整个过程中释放银离子的速率都比较均匀,晶核的成核及生长过程比较稳定,即使用水合肼这样的强还原剂,仍然可以得到单分散性好、形貌均一、规则的银纳米粒子。通过改变前驱体的种类,可以选择性地制备各种粒径的银纳米粒子。由于水合肼有强还原性,反应在常温下即可进行,且反应为水相体系,节能环保。
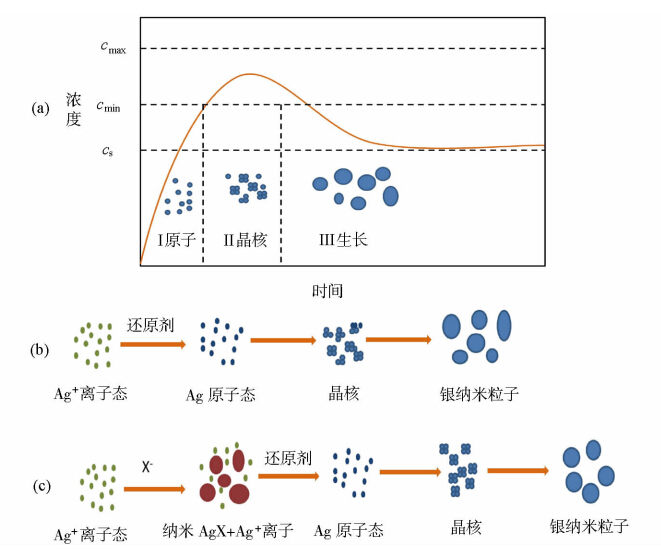 | 图2 (a)在晶核形成和生长过程中浓度与时间关系图;(b)AgNO3为前驱体的银纳米粒子形成过程; (c)AgX(X=Cl、Br、I、O)为前驱体的银纳米粒子形成过程 (a) The relationship of the concentration with time during the formation and growth of crystalnucleus,(b) the formation schematics of sliver nanoparticles with AgNO3 and (c) AgX(X=Cl,Br,I,O)as precursors |
为了考察所制备的银纳米粒子的粒径及单分散性,对所得的银纳米粒子进行了紫外吸收光谱表征。根据Mie氏理论[26],纳米粒子的紫外吸收光谱的形状和位置要归因于其表面等离子体效应,与纳米粒子的形状、大小和分散性密切相关。如图3所示,五种前驱体的紫外吸收峰位依次为462 nm、449 nm、421 nm、414 nm和427 nm。其中,通过氯化银、溴化银、碘化银、氧化银等前驱体制备的银纳米粒子的吸收峰位依次蓝移,说明其平均粒径逐渐变小,这与电镜图中所反映的银纳米粒子粒径变化相符。以这四种前驱体制备的银纳米粒子的紫外-可见吸收曲线的对称性都非常好,半峰宽都较窄,说明银纳米粒子形貌较规整,粒径分布较窄,单分散性良好。与之形成鲜明对比的是,以硝酸银为前驱体制备的银纳米粒子的紫外吸收峰对称性较差,并且半峰宽很宽,在波长400 nm至1000 nm之间都一直保持很高的吸收率,说明粒子形貌不规则,粒径分布很宽。这进一步验证了上文所述的银纳米粒子生长机理。
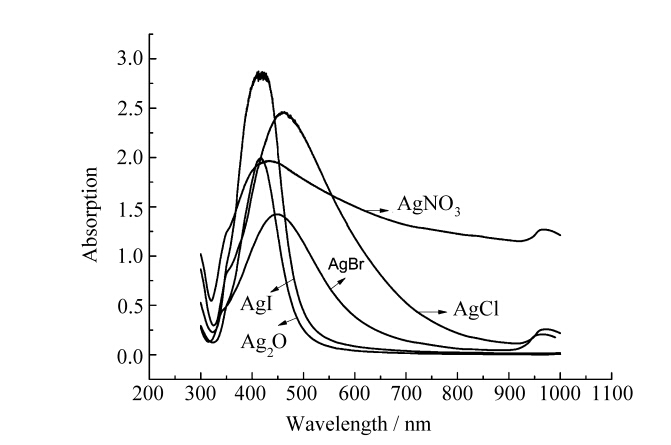 | 图3 以不同前驱体制备的银纳米粒子的紫外-可见吸收光谱图 UV-Vis spectra of silver nanoparticles synthesized with different precursors |
相较之下,氧化银作为前驱体制备的银纳米粒子尺寸较小,更适合制备适用于喷墨打印的导电墨水。我们以氧化银为前驱体的反应体系为研究对象,对合成的银纳米粒子进行了XRD和XPS表征。
为了确认所合成纳米粒子的晶型,利用X 射线粉末衍射仪对合成的银纳米粒子进行了表征,其反射吸收峰如图4所示。合成纳米粒子的111 面的反射峰为38.2°,200面的反射峰为44.4°,220 面的反射峰为64.7°,311 面的反射峰为77.7°,222 面的反射峰为81.4°,这与之前的关于银纳米粒子的晶型结构报道相一致。38.2°、44.4°、64.7°、77.7°和81.4°处的反射峰分别代表了纳米粒子111、200、220、311 和222 晶面的布拉格反射峰位置。从以上XRD的表征结果可以确定,合成的银纳米粒子为面心立方的多晶结构[27]。
 | 图4 合成银纳米粒子的XRD谱图 XRD spectrum of silver nanoparticles |
为了确认合成的纳米粒子中的化学成分,我们还利用光电子能谱仪对合成的银纳米粒子组成进行了表征。如图5所示。除了C、N、O、Ag元素外,没有检测到其他元素的吸收峰,说明合成的银纳米粒子的纯度较高。从Ag3d的结合能谱图可以看出,Ag3d5/2和Ag3d3/2的结合能分别处于367.92 eV和373.87 eV的位置,这与块状金属银相一致,其结合能为368 eV和374 eV[28]。谱图中较窄的峰形也说明此体系中只有一种价态的银存在,为零价的单质银。
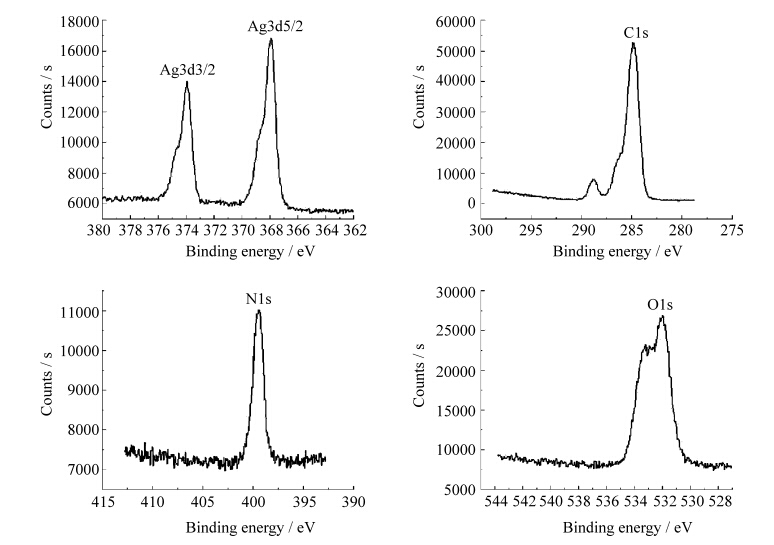 | 图5 合成的银纳米粒子的XPS结合能谱图 XPS binding energy spectra of silver nanoparticles |
在以氧化银为前驱体制备银纳米粒子的基础上,我们制备了固体含量约为15%的银纳米粒子导电墨水。并利用此墨水,在纸基材和PET 基材上进行了RFID(Radio Frequency Identification,射频识别)标签天线的喷墨打印制备,如图6 a)所示。经过烧结后处理,将其与芯片进行封装,如图6 b)所示。经检测,所制备的RFID标签可以达到6 米的响应距离,完全满足RFID标签的技术要求。
 | 图6 a)利用喷墨打印在纸质基材及PET基材上制备RFID天线;b)带芯片的RFID天线 a) RFID antennas prepared on paper and PET substrates by ink-jet printing,b) RFID antennas with chips |
利用氯化银、溴化银、碘化银、氧化银为前驱体,水合肼为还原剂,PVP为稳定剂的水相反应体系,在室温下可控制备了粒径为40 nm~150 nm的单分散性银纳米粒子。较之于传统的直接还原硝酸银的方法,这种方法具有快速、温和、产物粒径可控、单分散性好以及可高浓度合成等诸多优点。XRD和XPS的表征结果显示,所合成的银纳米粒子为面心立方结构,并且纯度较高,可以应用于喷墨打印RFID天线等印刷电子相关领域。本文的合成方法具有绿色环保、节能高效的优点,对单分散性银纳米粒子的大规模合成具有重要意义。
| [1] | Su M, Li S Y, and Dravid Vinayak P. Microcantilever resonance-based DNA detection with nanoparticle probes[J]. Applied Physics Letters, 2003, 82(20): 3562-3564. |
| [2] | Jeyaraj M, Rajesh M, Arun R, Mubarak A D, Sathishkumar G, Sivanandhan G, Dev G K, Manickavasagam M, Premkumar K, Thajuddin N. An investigation on the cytotoxicity and caspase-mediated apoptotic effect of biologically synthesized silver nanoparticles usingPodophyllum hexandrum on human cervical carcinoma cells[J]. Colloids and Surfaces B: Biointerfaces, 2013, 102: 708-717. |
| [3] | Dubas S T, Kumlangdudsana P, Potiyaraj P. Layer-by-layer deposition of antimicrobial silver nanoparticles on textile fibers[J].Colloids and Surfaces A: Physicochemical and Engineering Aspects, 2006, 289(1): 105-109. |
| [4] | Sanders A W, Routenberg D A, Wiley B J, Xia Y N, Dufresne E R, Reed M A.Observation of plasmon propagation, redirection, and fan-out in silver nanowires[J]. Nano Letters, 2006, 6(8): 1822-1826. |
| [5] | Chimentao RJ, Kirm I, Medina F, Rodriguez X, Cesteros Y, Salagre P, Sueiras J E. Different morphologies of silver nanoparticles as catalysts for the selective oxidation of styrene in the gas phase[J]. Chemical Communications, 2004, (7): 846-847. |
| [6] | Jiang Z J, Liu C Y, Sun L W. Catalytic properties of silver nanoparticles supported on silica spheres[J]. Journal of Physical Chemistry B, 2005, 109(5): 1730-1735. |
| [7] | Nie S M and EmoryS R. Probing single molecules and single nanoparticles by surface-enhanced Raman scattering[J]. Science, 1997, 275(5303): 1102-1106. |
| [8] | Ditlbacher H, Lamprecht B, Leitner A, and Aussenegg F R. Spectrally coded optical data storage by metal nanoparticles[J]. Optics Letters, 2000, 25(8): 563-565. |
| [9] | Zhou X H, Liu C Y, Zhang Z Y, Jiang L, Li J R. Formation of a three-dimensional (3D) structure of nanoparticles using Langmuir-Blodgett method[J]. Chemistry Letters, 2004, 33(6): 710-711. |
| [10] | Meier H, Löffelmann U, Mager D, Smith P J, Korvink J G. Inkjet printed, conductive, 25 μm wide silver tracks on unstructured polyimide[J]. Physica Status Solidi (a), 2009, 206(7):1626-1630. |
| [11] | Brasch W R. Method of etching circuit boards and recovering copper from the spent etch solutions. US Patent, 4378270, 1983. |
| [12] | He S T, Yao J N, Jiang P, Shi D X, Zhang H X, Xie S S, Pang S J, Gao H J. Formation of silver nanoparticles and self-assembled two-dimensional ordered superlattice[J]. Langmuir, 2001, 17(5): 1571-1575. |
| [13] | Mandal S, Gole A, Lala N, Gonnade R, Ganvir V, Sastry M. Studies on the reversible aggregation of cysteine-capped colloidal silver particles interconnected via hydrogen bonds[J]. Langmuir, 2001, 17(20): 6262-6268. |
| [14] | Kumar A, Joshi H, Pasricha R, Mandale AB, Sastry M. Phase transfer of silver nanoparticles from aqueous to organic solutions using fatty amine molecules[J]. Journal of Colloid and Interface Science, 2003, 264(2): 396-401. |
| [15] | Uznanski P,Bryszewska E. Synthesis of silver nanoparticles from carboxylate precursors under hydrogen pressure[J]. Journal of Materials Science, 2009, 45(6): 1547-1552. |
| [16] | Rong M Z, Zhang M Q, Liu H, Zeng H M. Synthesis of silver nanoparticles and their self-organization behavior in epoxy resin[J]. Polymer, 1999, 40(22): 6169-6178. |
| [17] | Petit C, Lixon P, Pileni M P. In-situ synthesis of silver nanocluster in aot reverse micelles[J]. Journal of Physical Chemistry, 1993, 97(49): 12974-12983. |
| [18] | Maillard M, Giorgio S, Pileni M P. Tuning the size of silver nanodisks with similar aspect ratios: synthesis and optical properties[J]. Journal of Physical Chemistry B, 2003, 107(11): 2466-2470. |
| [19] | Silvert PY , HerreraU R, Duvauchelle N, Vijayakrishnan V, Elhsissen K T. Preparation of colloidal silver dispersions by the polyol process[J]. Journal of Materials Chemistry, 1996, 6(4):573-577. |
| [20] | Sun Y G, Yin Y D, Mayers B T, Herricks T, Xia Y N. Uniform silver nanowires synthesis by reducing AgNO3 with ethylene glycol in the presence of seeds and poly(vinyl pyrrolidone) [J]. Chemistry of Materials, 2002, 14(11): 4736-4745. |
| [21] | Sun Y G., Mayers B, Herricks T, Xia Y N. Polyol synthesis of uniform silver nanowires: a plausible growth mechanism and the supporting evidence[J]. Nano Letters, 2003, 3(7): 955-960. |
| [22] | Wiley B J, Chen Y, McLellan J M, Xiong Y J, Li Z Y, Ginger D, Xia Y N. Synthesis and optical properties of silver nanobars and nanorice[J]. Nano Letters, 2007, 7(4): 1032-1036. |
| [23] | Sun Y G. Controlled synthesis of colloidal silver nanoparticles in organic solutions: empirical rules for nucleation engineering[J]. Chemical Society Reviews, 2013, 42(7): 2497-511. |
| [24] | 难溶化合物的溶度积常数.http://www.hxu.edu.cn/partwebs/huaxuexi/qt/hxsj/cutable1.htm. 2014-05. Solublity Products of Undissoloved Compouds. http://www.hxu.edu.cn/partwebs/huaxuexi/qt/hxsj/cutable1.htm.2014-05. |
| [25] | Wu Y L, Li Y N, Liu P, Gardner S, Ong B S. Studies of gold nanoparticles as precursors to printed conductive features for thin-film transistors[J]. Chemistry of Materials, 2006, 18(19): 4627-4632. |
| [26] | Mie G. Contributions to the Optics of Turbid Media, Particularly of Colloidal Metal Solutions[M]. Transl. into English from Ann. Phys.(Leipzig). v. 25, no. 3, 1908. 377-445. |
| [27] | Zhao M Q, Sun L, Crooks RM. Preparation of Cu nanoclusters within dendrimer templates[J]. Journal of the American Chemical Society, 1998, 120(19): 4877-4878. |
| [28] | Sharma J, Mahima S, Kakade B A, Pasricha R, Mandale A B, Vijayamohanan K. Solvent-assisted one-pot synthesis and self-assembly of 4-aminothiophenol-capped gold nano-particles[J]. The Journal of Physical Chemistry B, 2004, 108(35): 13280-13286. |




