自20世纪50年代以来,随著轨道对称守恒原理等理论研究方法以及瞬态吸收光谱等实验技术的出现和应用,光化学作为与热化学对应的一个领域取得了快速的发展。在有机合成领域中,光反应与传统的热反应相比,具有操作简单、条件温和以及合成步骤简化等优点,同时光反应更在合成一些具有特殊结构的化合物方面具有特别的优势。上世纪70年代以后,电子转移光氧化反应随着光诱导电子转移(photoinduced electron transfer,PET)反应的研究而迅速发展,并成为光氧化反应的一个重要组成部分。近几年来,很大程度上由PET反应衍生的过渡金属配合物催化的可见光引发的光反应已成为了目前光化学反应研究的一个热点;其中也已有一些过渡金属配合物催化的电子转移光氧化反应出现。这些电子转移光氧化反应都涉及到基态物种与激发态物种之间的某类电子转移过程,并以自由基离子对为反应的活性中间体。如果根据电子转移过程中激发态和基态物种的不同来划分,电子转移光氧化反应可以分为三类:一) 激发态光敏剂与作为电子给体的基态反应物之间的电子转移反应;二) 激发态反应物与基态氧之间的电子转移反应;三) 基态反应物与反应体系中经某种途径生成的单重态氧之间的电子转移反应[1]。 1 由激发态光敏剂与反应物之间的电子转移引发的光氧化反应
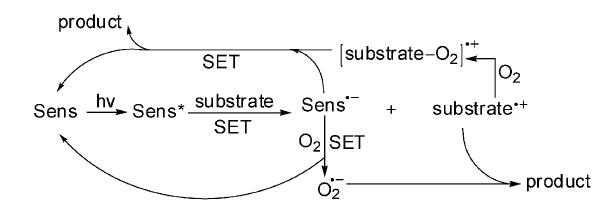
激发态的光敏剂(Sensitizer,Sens.)引发的电子转移光氧化反应是最常见的一类电子转移光氧化反应。该类反应是由作为电子受体的激发态敏化剂与作为电子给体的基态反应物之间通过电子转移,产生敏化剂负离子自由基与反应物正离子自由基而进行的(图 1)[1]。根据参与反应的光敏剂的种类可将此类反应大致分为以下四类:一)氰基芳烃类光敏剂,如9-氰基蒽(CA),9,10-二氰基蒽(DCA)、1,4-二氰基苯、1,4-二氰基萘,2,6,9,10-四氰基蒽等,其中DCA是目前电子转移光氧化中较常应用的一个光敏剂,它在可见光区有较强吸收;二)鎓盐类阳离子光敏剂,主要包括2,4,6-三苯基吡喃盐(TPP+)、10-甲基吖啶盐(Acr+)、9-芳基-10-甲基吖啶盐、1-甲基喹啉盐等,其中除喹啉盐外,都在可见光区有强吸收;三)在可见光区有强吸收的一些金属配合物类光敏剂,主要有Ru、Ir或者Pt等金属与有机小分子配体的配合物;四)有机染料类光敏剂,主要包括曙红Y(Eosin Y)、亚甲蓝(MB)以及孟加拉玫瑰(RB),该类光敏剂也在可见光区有强吸收。这些染料主要用于敏化单重态氧的产生,但在反应物氧化电位较低时,也可以用于引发电子转移反应。
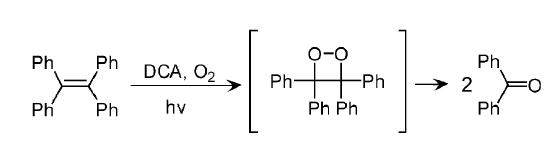
1.1 氰基芳烃类光敏剂Foote课题组[2]报道了在以9,10-二氰基蒽(DCA)为敏化剂以及氧气为氧化剂的条件下可以使一些对单重态氧呈惰性的烯烃发生光氧化反应。在DCA和氧气存在时光照,四苯乙烯在乙腈中能够被光氧化为二苯甲酮(图 2)。相关的验证实验证明了该反应并非通过单重态氧的氧化机理进行,同时认为反应是通过电子转移机理发生的,即通过激发态的敏化剂与作为电子给体的基态反应物之间的电子转移,产生了敏化剂负离子自由基和反应物正离子自由基,然后氧气被敏化剂负离子自由基还原为超氧负离子自由基并与反应物正离子自由基结合得到目标产物(图 3)。
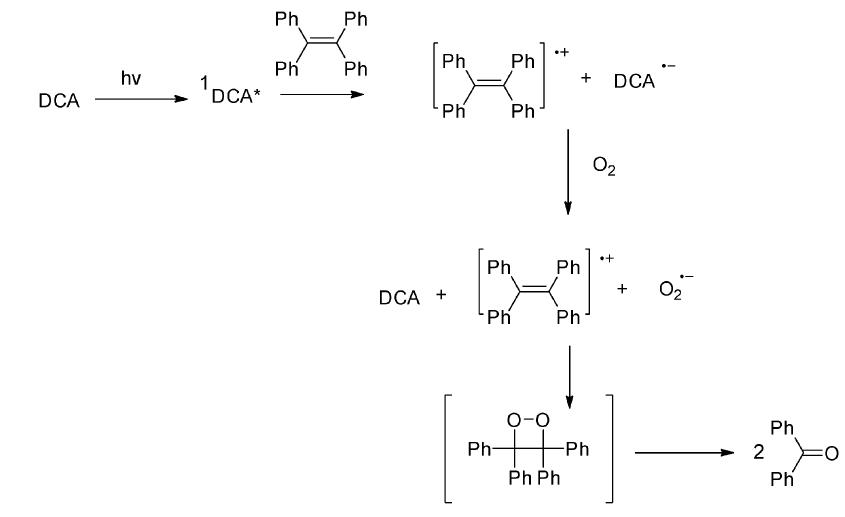 | 图 3 DCA敏化四苯乙烯的光氧化反应的可能机理[2] The possible mechanism of photo-oxidation reaction of tetraphenylethylene induced by DCA[2] |
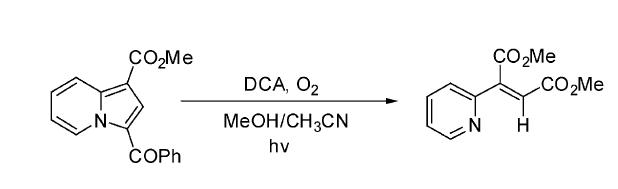
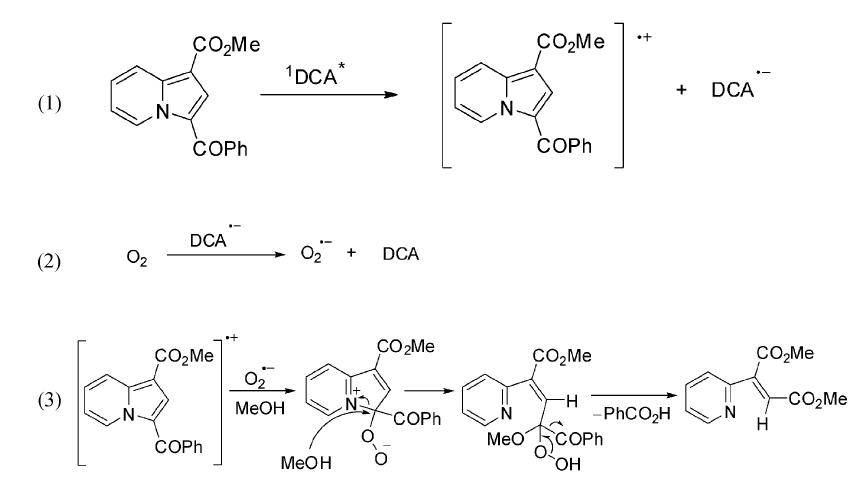 | 图 5 DCA敏化中氮茚类化合物的光氧化反应可能机理[3] The possible mechanism of photo-oxidation reaction of indolizine induced by DCA[3] |
Otsuji课题组[4]报道了联苯类化合物在以9,10-二氰基蒽(DCA)为光敏剂,并外加高氯酸镁时,在氧气饱和的乙腈溶剂中可以发生光氧化反应生成苯甲酸衍生物(图 6)。
实际上,在9-氰基蒽(CA)和9,10-二氰基蒽(DCA)等敏化的电子转移光氧化反应中,虽然由于CN和DCA的负离子自由基的氧化电位均低于基态氧的还原电位(-0.87V,SCE,MeCN),CN-·和DCA-·可以与基态氧进行电子转移而产生超氧负离子自由基O2·-,且后者与反应物正离 子自由基的结合在溶液中以扩散控制速度进行(取决于溶剂,在109~1010 mol-1·L·s-1之间); 但由于反应时使用的CN和DCA的浓度很小(~10-4 mol/L),O2·-的浓度只会比此更小。而溶液中基态氧的浓度取决于溶剂,一般在10-2 mol/L左右,约为O2·-的浓度的103倍或更多。虽然亲电的基态氧与同样是亲电的反应物正离子自由基的结合速度不会很高(已知有些情况下为~106 mol-1·L·s-1),但显然,基态氧与反应物正离子自由基结合的途径在很多情况下应可有效地与O2·-与反应物正离子自由基结合的途径竞争。例 如Majima课题组[5]报道了9,10-二氰基蒽(DCA) 可以在乙腈为溶剂和氧气存在时敏化三芳基膦化合物的氧化,以定量的产率得到三芳基膦氧化物(图 7)。相关的产物分析和瞬态吸收光谱实验发 现该反应是由激发态的DCA与电子给体三芳基膦之间通过电子转移产生三芳基膦正离子自由基而进行的;但因实测的反应速度超过了估计的O2·-与三芳基膦正离子自由基反应应有的速度,推测反应主要是经与基态氧结合的途径进行的。该反应中应用联苯(BP)为共敏化剂来促进反应进行。
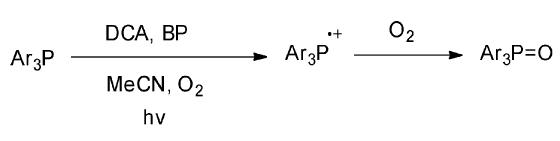 | 图 7 DCA敏化的三芳基膦化合物的光氧化反应[5] The photo-oxidation reaction of aryl phosphonic compounds induced by DCA[5] |
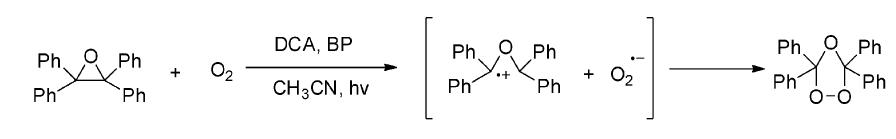
Paul Schaap课题组[6]报道了对单重态氧为惰性的四苯基环氧乙烷可以在氧气饱和的乙腈溶液中被DCA敏化而发生电子转移光氧化反应,并以高产率得到三氧杂戊烷产物(图 8)。该反应中用BP为共敏化剂,促进反应进行。
Fukuzumi课题组[7]报道了在以四氟对苯二甲腈为光敏剂以及氧气的存在下,能够高产率地把对甲基苯甲腈氧化为相应的对氰基苯甲醛 (图 9)。氧化电位较低的甲苯衍生物也可以用DCA为敏化剂氧化为相应的苯甲醛和苯甲酸。这些反应是酸性很强的甲苯正离子自由基通过脱质子为苄基自由基后,与基态氧结合而进行的。
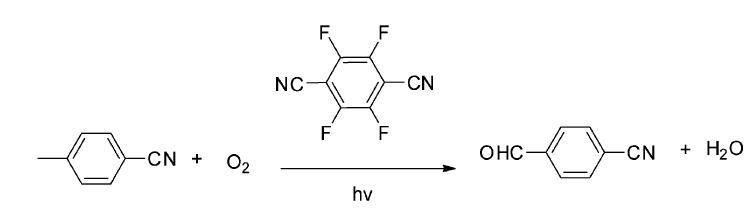 | 图 9 四氟对苯二甲腈敏化对甲基苯甲腈的光氧化反应[7] The photo-oxidation reaction of p-tolunitrile induced by 2,3,5,6-tetrafluoroterephthalonitrile[7] |
一系列2,4,6-三芳基吡喃盐在可见光区有强吸收,它们的激发单重态和激发三重态是很强的电子受体,可以分别使氧化电位在~2.5 V和~2.0 V以下的化合物转化为正离子自由基[8]。这些吡喃盐还原而得的自由基的氧化电位较高(-0.3~-0.5 V,SCE),不能与基态氧进行电子转移产生超氧负离子自由基O2·-,它们敏化的光氧化反应是经反应物正离子自由基与基态氧结合而进行的[9]。
Miranda课题组[10]报道了2,4,6-三苯基吡喃盐(TPP+BF4-)可以在DCM溶液中敏化氧化1,2-二苯乙烯衍生物,得到碳碳双键断裂的产物芳基酮以及苯甲醛衍生物(图 10)。反应中,光照下产生的激发态(TPP+)*与底物1,2-二苯乙烯衍生物进行电子转移产生1,2-二苯乙烯的阳离子自由 基,与基态氧结合得到二氧杂环丁烷正离子自由基,后者与TPP· 进行反向电子转移,并经二氧杂环丁烷中间产物发生O—O键均裂及C—C键均裂产生相应的芳基酮以及苯甲醛衍生物(图 11)。
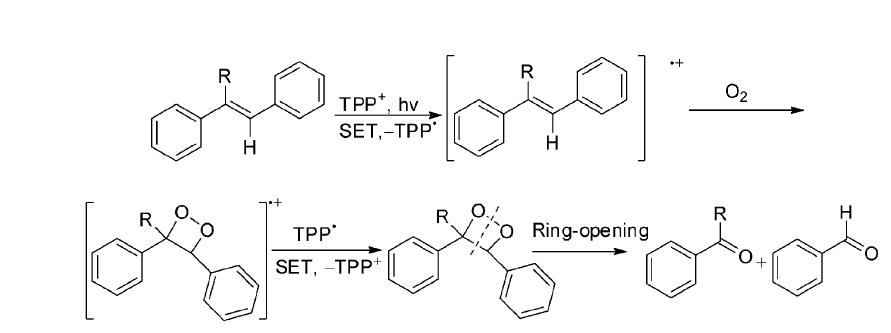 | 图 11 TPP+敏化1,2-二苯乙烯衍生物光氧化反应的可能机理[10] The possible mechanism of photo-oxidation reaction on styrenes induced by DCA[10] |
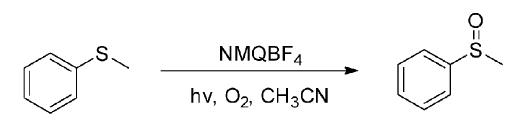
Baciocchi课题组[11]报道了对单重态氧活性较低或者为惰性的硫醚类化合物在鎓盐类光敏剂[12, 13]的作用下以电子转移的方式实现光氧化反应。底物苯甲硫醚在以N-甲基喹啉(NMQ)盐NMQBF4为光敏剂的条件下,可以在乙腈溶液中发生电子转移光氧化反应得到相应的苯甲亚砜(图 12)。通过LFP实验确认了苯甲硫醚阳离子 自由基和NMQ自由基的存在(图 13);后者的氧化电位为-0.85 V,SCE(即NMQ+的还原电位),在乙腈溶液中正好可以还原基态氧为超氧负离子自由基。
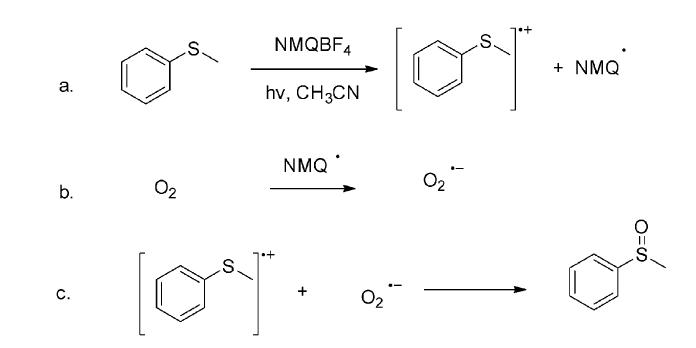 | 图 13 NMQ+敏化硫醚类化合物光氧化反应可能的机理[11] The possible mechanism of photo-oxidation reaction on thioethers induced by NMQBF4[11] |
Del Giacco课题组[14]报道了富电子的甲基苄 基醚类化合物在乙腈溶液中可以被2,4,6-三苯基吡喃盐(TPP+BF4-)敏化氧化为相应的芳酸甲酯衍生物(图 14)。该反应可能的机理类似于TPP+敏化烯烃的光氧化过程。
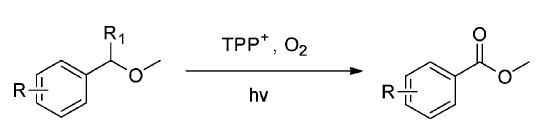 | 图 14 TPP+敏化甲基苄基醚类化合物的光氧化反应[14] The photo-oxidation reactions of dimethyl benzyl ethers induced by TPP+[14] |
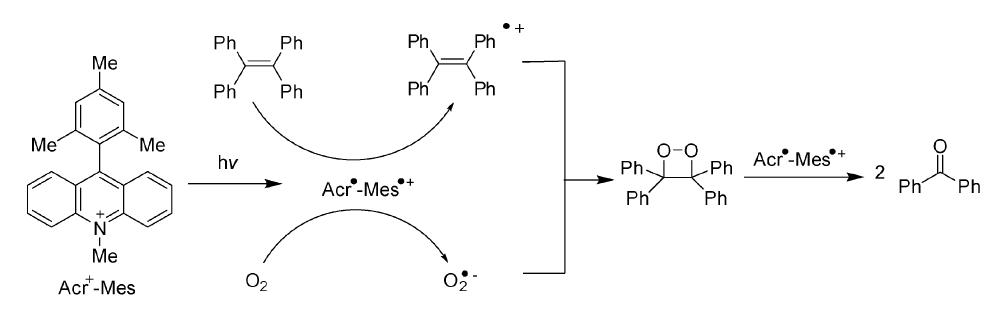
Fukuzumi课题组[15]报道了四苯乙烯在光照、光敏剂和氧气的作用下能够氧化得到二苯甲酮。 该反应首先是光照下产生的激发态鎓盐类光敏剂9-均三苯基-10-甲基吖啶盐分别与四苯乙烯以及氧气之间进行电子转移产生四苯乙烯阳离子自由基和超氧负离子自由基O2·-,而后经过自由基离子对复合形成中间产物1,2-二氧杂环丁烷,中间产物发生O—O键断裂产生最终产物二苯甲酮(图 15)。
1.3 金属配合物类光敏剂Xia课题组[16]报道了使用催化量的金属配合物类光敏剂Ru(bpy)3Cl2在可见光和空气条件下可以氧化醛基邻位的C—C键得到相应的减少一个碳原子的羰基化合物(图 16)。反应中底物醛首先与过量的哌啶反应生成相应的烯胺,它与激发态的金属配合物发生电子转移,得到烯胺的阳离子自由基,后者与超氧负离子自由基O2·-复合,形成中间产物1,2-二氧杂环丁烷,并开环得到最终的产物(图 17)。
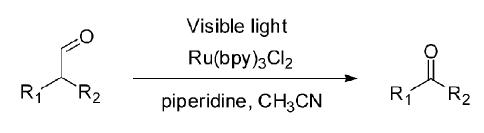 | 图 16 Ru(bpy)3Cl2敏化的醛基邻位的C—C键氧化裂解反应[16] Oxidative C—C Bond Cleavage of Aldehydes induced by Ru(bpy)3Cl2[16] |
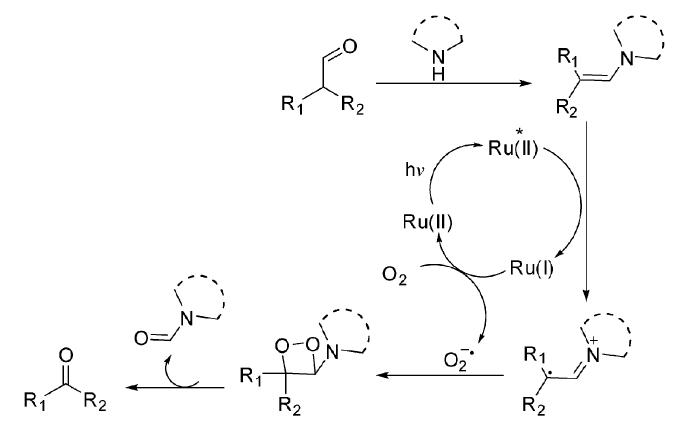 | 图 17 Ru(bpy)3Cl2敏化的醛基邻位的C—C键氧化裂解反应可能的机理[16] The possible mechanism of oxidative C—C Bond Cleavage of Aldehydes induced by Ru(bpy)3Cl2[16] |
Jiao课题组[17]报道了在催化量的光敏剂Ru(bpy)3Cl2和有机催化剂对甲氧基吡啶共同作用下,可以在室温下光照氧化α-芳基卤代物产生芳基酮衍生物(图 18)。
Xiao课题组[18]报道了在催化量的光敏剂Ru(bpy)3Cl2·6H2O作用下,芳基硼酸衍生物可以室温下被光照氧化为相应的芳基酚类衍生物(图 19)。
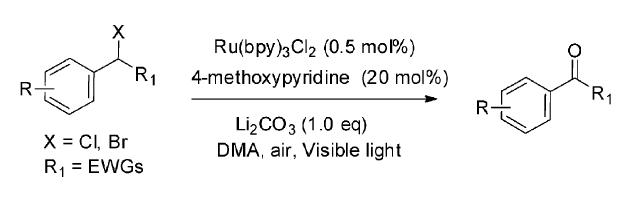 | 图 18 Ru(bpy)3Cl2敏化的芳基卤代物的光氧化反应[17] The aerobic oxidation of Benzyl Halides induced by Ru(bpy)3Cl2[17] |
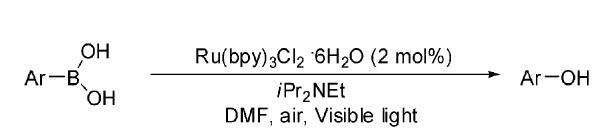 | 图 19 Ru(bpy)3Cl2·6H2O催化下的芳基硼酸衍生物的电子转移光氧化反应[18] The photo-oxidation reactions of arylboronic acids induced by Ru(bpy)3Cl2·6H2O[18] |
Yoon课题组[19]报道了双(苯乙烯)底物在氧气存在下,可以通过使用催化量的光敏剂Ru(bpz)3(BF4)2,经光催化的[2+2+2]环加成产生结构新颖的内过氧化合物(图 20)。
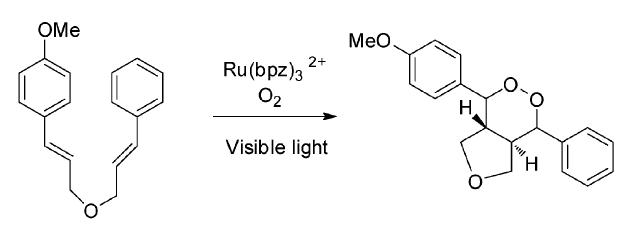 | 图 20 Ru(bpz)3(BF4)2敏化的双苯乙烯的光氧环化反应[19] The photo aerobic cycloaddtion reaction of bis(styrene) induced by Ru(bpz)3(BF4)2[19] |
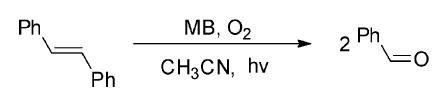
亚甲蓝和虎红等染料,通常用作产生单重态氧的敏化剂。但在底物的氧化电位较低,又对单重态氧呈惰性时,偶尔也可作为电子受体敏化剂起作用,引发电子转移光氧化反应。Foote课题组[20]报道了以有机染料类光敏剂亚甲基蓝为光敏剂,在氧气饱和的乙腈溶液中通过电子转移光氧化反应使反式二苯乙烯氧化为苯甲醛(图 21)。通过对反应机理的研究,作者发现该类氧化反应并非经过单重态氧的氧化机理进行的;同时提出了激发单重态的亚基蓝与反式二苯乙烯进行SET,产生相应的阳离子自由基,与氧气结合产生相应的苯甲醛产物的机理(图 22)。
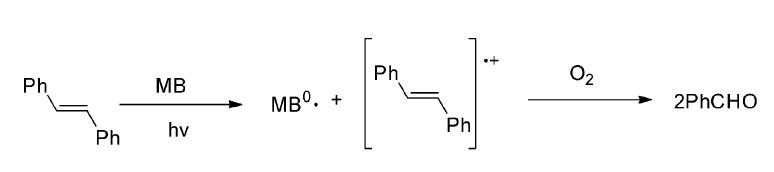 | 图 22 有机染料类光敏剂亚甲基蓝电子转移光氧化反应可能的机理[20] The possible mechanism of electron transfer photo-oxidation reaction induced by MB[20] |
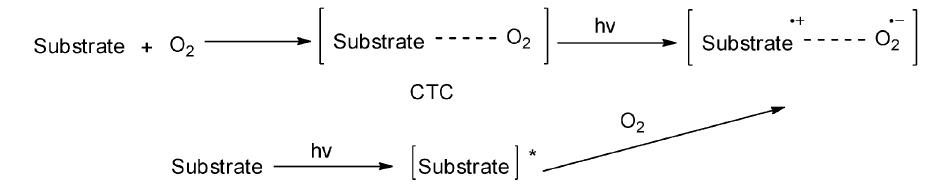
第二类电子转移光氧化反应主要是通过反应物与基态氧之间电子转移发生的。该类反应主要是通过光照来激发由基态反应物与基态氧产生的电荷转移络合物,引起电子转移;或者通过激发态的反应物与基态氧之间的电子转移,产生底物正离子自由基和超氧负离子自由基而进行的(图 23)[1]。
反应物与基态氧之间的电子转移反应主要涉及多甲基苯、部分富电子的烯烃和胺类。其中,胺类化合物虽然很容易与基态氧产生相应的电荷转移络合物,并被光激发为相应的自由基离子对,但是由于自由基离子对的能量较低,容易快速去活化回到基态反应物。
Zhang课题组[21]报道了以9,10-菲醌与富电子的烯烃为原料,经光环化-光氧化反应成功构建了联芳基并十元双内酯衍生物,其中光氧化反应为关键步骤。含有糖环的光环化产物可以在氧饱和的乙腈溶液中被氧化为相应的联芳基大环双内酯衍生物。使用该光氧化策略还可以构建联芳基并九元双内酯衍生物(图 24)。
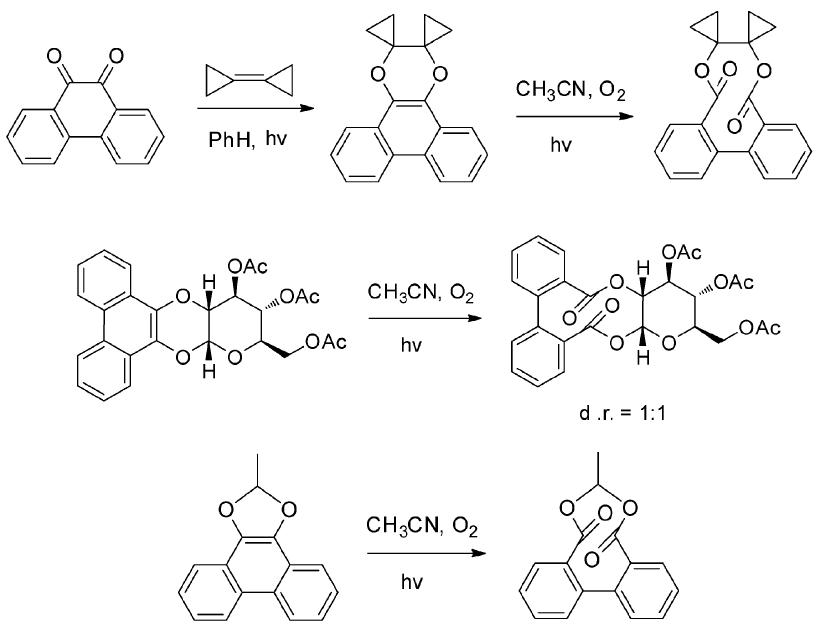 | 图 24 电子转移光氧化反应构建联芳基双内酯衍生生物[21] The synthesis of biaryl-containing bislactones via electron transfer photo-oxidation reaction[21] |
通过对产物的分析推测可能的反应机理为:光环化产物与基态氧结合得到电荷转移络合物,后者在光照下产生相应的底物正离子自由基和超氧负离子自由基,两者复合得到的二氧杂环丁烷产物可以快速开环得到最终的联芳基并十元环内酯衍生生物。为了验证可能的反应机理,首先通过实验证明,用热化学方法产生的单重态氧不能引起上述反应,排除了单重态氧反应机理。通过ESR的自旋捕获实验检测到超氧负离子自由基,证明了O2·-为反应的活性氧物种。作者还通过分析底物在氧饱和溶液中的UV-Vis光谱,确认了该反应是通过基态CTC模式进行的电子转移光氧化反应(图 25)。
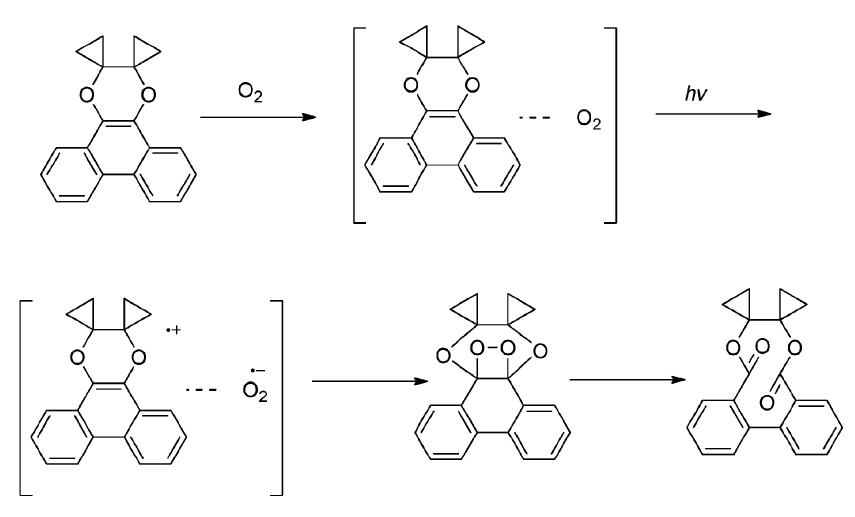 | 图 25 电子转移光氧化反应构建联芳基大环双内酯衍生物的反应机理[21] The possible mechanism of synthesis of biaryl-containing bislactones via electron transfer photo-oxidation reaction[21] |
Tokumaru课题组[22]报道了在苯-甲醇体系中,光照下能够激发六甲基苯和氧形成电荷转移络合物,产生的六甲基苯的正离子自由基经脱氢 氧化为苄基正离子,并被甲醇捕获而生成五甲基甲氧基苯。超氧负离子的pKa大于六甲基苯正离子自由基的pKa,因此产生的超氧负离子能够夺取六甲基苯的正离子自由基的质子,同时产生的氢过氧自由基又能够氧化五甲基苄基自由基为苄基正离子(图 26)。
 | 图 26 苯-甲醇体系中六甲基苯的电子转移光氧化反应[22] The electron transfer photo-oxidation reaction of hexamethylbenzene in the benzene-methanol system[22] |
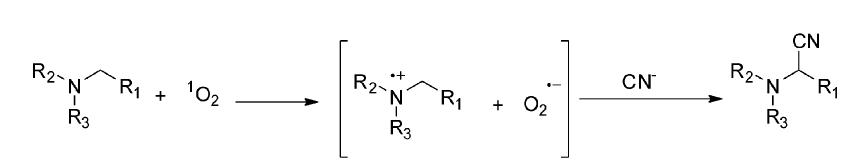
第三类电子转移光氧化反应为富电子的化合物,如胺类、酚类、富电子芳烃等,通过电荷转移机理对单重态氧进行淬灭,同时发生化学反应,其中单重态氧与叔胺、仲胺类衍生物发生的有机化学反应较为常见(图 27)[1]。
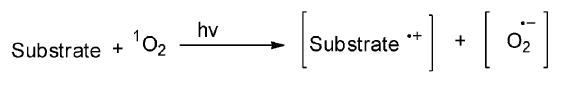 | 图 27 基态反应物与单重态氧的通过电子转移而进行的光氧化反应[1] Electron transfer photo-oxidation reaction between reactant and singlet oxygen[1] |
Santamaria课题组[23]报道了叔胺类化合物及一些叔胺类生物碱衍生物,可以通过与单重态氧发生电子转移反应,在氮原子的邻位导入氰基。在回流的DCM中,以过量的1,4-二甲萘过氧化合物为单重态氧的来源,TMSCN作为氰基负离子的来源,叔胺类生物碱可以高产率地转化为相应的氰基化合物(图 28)。该反应可能的机理如下:叔胺类化合物与单重态氧发生电子转移反应产生相应的自由基离子对,产生的超氧负离子自由基夺取胺正离子自由基的质子并发生电子转移反应产生亚胺正离子,后者被氰基负离子亲核进攻得到氰基化合物(图 29)。
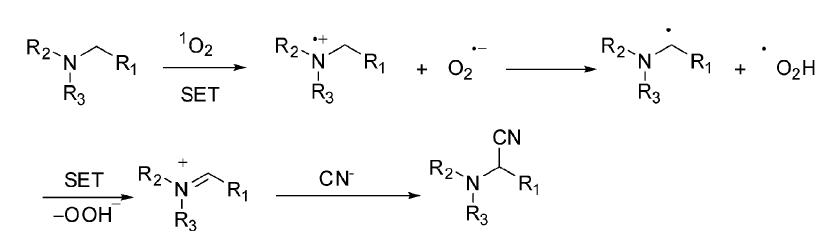 | 图 29 单重态氧引发的电子转移氰基化反应的可能机理[23] The possible mechanism of electron transfer cyano reaction induced by the singlet oxygen[23] |
Foote课题组[24]报道了由叔胺类炔化合物3-(二乙氨基)-1-丙炔与单重态氧发生电子转移反应而产生的邻取代烷基自由基与富勒烯进行环加成反应得到含有炔基的富勒烯衍生物(图 30)。反应的可能机理为:激发态富勒烯与基态氧进行能量转移得到单重态氧,3-(二乙氨基)-1-丙炔与单重态氧发生电子转移反应产生相应的自由基离子对,产生的超氧负离子自由基夺取胺正离子自由基的质子从而产生邻取代烷基自由基,后者对富勒烯上的C C双键进行加成,再经后续反应得到最终产物。
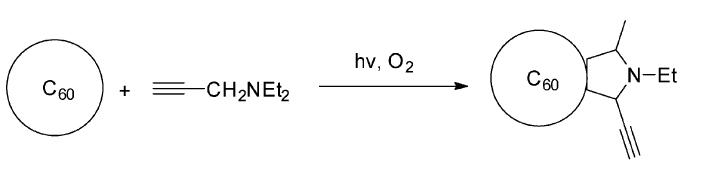 | 图 30 单重态氧引发的富勒烯与叔胺类炔化合物的光环加成反应[24] The phtoto-cycloaddtion of fullerenes and tertiary amine acetylene induced by the singlet oxygen[24] |
Gan课题组[25, 26, 27, 28]报道了一系列仲胺类化合物氨基二乙酸二甲酯,通过与单重态氧发生电子转移反应对富勒烯、马来酰亚胺衍生物等缺电子烯烃进行环加成反应(图 31)。其反应机理类似于叔胺类化合物与富勒烯反应机理。
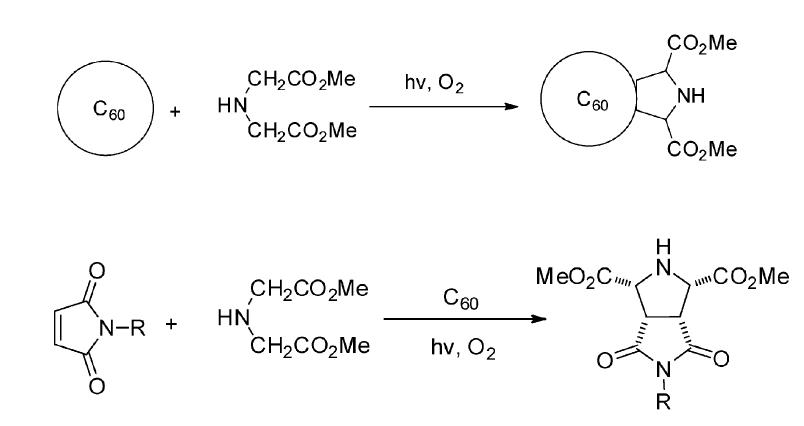 | 图 31 单重态氧引发的富勒烯与马来酰亚胺或仲胺类化合物的环加成反应[25, 26, 27, 28] The phtoto-cycloaddtions of fullerenes,maleimides and secondary amines induced by the singlet oxygen[25, 26, 27, 28] |
如上所述,电子转移光氧化反应是光化学,特别是光诱导电子转移反应的一个重要领域。它与光敏化的单重态氧反应一起,为有机化合物提供了很多具有重要合成价值的氧化方法。近几年来,过渡金属配合物催化的电子转移光氧化反应也已经出现。对于电子转移光氧化反应的机理研究,已经通过对反应中活性氧的形式、对底物的活性中间体的捕获或检测以及反应动力学的研究和对反应能量学和反应途径的理论计算取得很大进展。与传统热反应相比较,由于电子转移光氧化反应使用光来引发反应,属于绿色化学范畴,同时该类反应能构建一些热氧化反应和单重态氧反应难以合成的具有特殊骨架的有机分子,应可以在复杂有机化合物的合成中发挥较大作用。此外,还可以尝试使用此类方法构建一些具有手性的有机配体或者化合物。在电子转移光氧化反应中光敏剂引发的有机反应是最常见的,因此设计开发和应用激发态寿命较长、最好在可见光区具有强吸收、具有不同氧化还原电位和激发态能量的新型的电子转移光敏剂尤为重要,这也是这一领域发展的一个重要课题。
| [1] | 徐建华. 光氧化反应. 樊美公, 姚建年, 佟振合. 分子光化学与光功能材料科学[M]. 北京: 科学出版社, 2009. 211-377. Xu, J H. Photooxidation Reaction. In: Molecular Photochemistry and Optical Functional Materials Science[M]. Eds. Fan M G, Yao J N, Tong C H. Beijing: Science Press, 2009. 211-377. |
| [2] | Eriksen J, Foote C S, Parker T. Photosensitized oxygenation of alkenes and sulfides via a non-singlet-oxygen mechanism[J]. Journal of the American Chemical Society, 1977, 99(19): 6455-6456. |
| [3] | Li Y, Hu H Y, Ye J P, Fun H K, Hu H W, Xu J H. Reaction modes and mechanism in indolizine photooxygenation reactions[J]. Journal of Organic Chemistry, 2004, 69(7): 2332-2339. |
| [4] | Tamai T, Mizuno K, Hashida I, Otsuji Y. Photooxygenation of biphenyl and its derivatives via photoinduced electron transfer: effect of magnesium perchlorate on photooxygenation[J]. Photochemistry and Photobiology, 1991, 54(1): 23-29. |
| [5] | Yasui S, Tojo S, Majima T. Reaction of triarylphosphine radical cations generated from photoinduced electron transfer in the presence of oxygen[J]. Journal of Organic Chemistry, 2005, 70(19): 1276-1280. |
| [6] | Paul Schaap A, Lopez L, Gagnon S D. Formation of an ozonide by electron-transfer photooxygenation of tetraphenyloxirane. Cosensitization by 9, 10-dicyanoanthracene and biphenyl[J]. Journal of the American Chemical Society, 1983, 105(3): 663-664. |
| [7] | Ohkubo K, Suga K, Morikawa K, Fukuzumi S. Selective oxygenation of ring-substituted toluenes with electron-donating and-withdrawing substituents by molecular oxygen via photoinduced electron transfer[J]. Journal of the American Chemical Society, 2003, 125(42): 12850-12859. |
| [8] | Miranda M A, Gac a H. 2, 4, 6-triphenylpyrylium tetrafluoroborate as an electron-transfer photosensitizer[J]. Chemical Review, 1994, 94(4): 1063-1089. |
| [9] | Wang Y, Haze O, Dinnocenzo J P, Farid S, Farid R S, Gould I R. Bonded exciplexes. A new concept in photochemical reactions[J]. Journal of Organic Chemistry, 2007, 72(18): 6970-6981. |
| [10] | Garcia H, Miranda M A, Mojarrad F, Sabater M J. Involvement of oxirane intermediates in the electron transfer photooxygenation of 1, 1and 1, 2-diarylethylenes sensitized by 2, 4, 6-triphenylpyrylium tetrafluoroborate[J]. Tetrahedron, 1994, 50(29): 8773-8780. |
| [11] | Baciocchi E, Del Giacco T, Elisei F, Gerini M F, Guerra M, Lapi A, Liberali P. Electron transfer and singlet oxygen mechanisms in the photooxygenation of dibutyl sulfide and thioanisole in MeCN sensitized by N-methylquinolinium tetrafluoroborate and 9, 10-dicyanoanthracene. The probable involvement of a thiadioxirane intermediate in electron transfer photooxygenations[J]. Journal of the American Chemical Society, 2003, 125(52): 16444-16454. |
| [12] | Yoon U C, Quillen S L, Mariano P S, Swanson R, Stavinoha J L, Bay E. Exploratory and mechanistic aspects of the electron-transfer photochemistry of olefin-N-heteroaromatic cation systems[J]. Journal of the American Chemical Society, 1983, 105(5): 1204-1218. |
| [13] | Fukuzumi S, Kotani H, Ohkubo K, Ogo S, Tkachenko N V, Lemmetyinen H. Electron-transfer state of 9-mesityl-10-methylacridinium ion with a much longer lifetime and higher energy than that of the natural photosynthetic reaction center[J]. Journal of the American Chemical Society, 2004, 126(6): 1600-1602. |
| [14] | Carlotti B, Del Giacco T, Elisei F. Competition of C—H and C—O fragmentation in substituted p-methoxybenzyl ether radical cations generated by photosensitized oxidation[J]. Photochemical & Photobiological Sciences, 2013, 12(3): 489-499. |
| [15] | Ohkubo K, Nanjo T, Fukuzumi S. Efficient photocatalytic oxygenation of aromatic alkene to 1, 2-dioxetane with oxygen via electron transfers[J]. Organic Letters, 2005, 7(19): 4265-4268. |
| [16] | Sun H, Yang C, Gao F, Li Z, Xia W J. Oxidative C—C bond cleavage of aldehydes via visible-light photoredox catalysis[J]. Organic Letters, 2013, 15(3): 624-627. |
| [17] | Su Y, Zhang L, Jiao N. Utilization of natural sunlight and air in the aerobic oxidation of benzyl halides[J]. Organic Letters, 2011, 13(9): 2168-2171. |
| [18] | Zou Y Q, Chen J R, Liu X P, Lu L Q, Davis R L, Joergensen K A, Xiao W J. Highly efficient aerobic oxidative hydroxylation of arylboronic acids: photoredox catalysis using visible light[J]. Angewandte Chemie International Edition, 2012, 51(3): 784-788. |
| [19] | Parrish J D, Ischay M A, Lu Z, Guo S, Peters N R, Yoon T P. Endoperoxide synthesis by photocatalytic aerobic[2+2+2]cycloadditions[J]. Organic Letters, 2012, 14(6): 1640-1643. |
| [20] | Manring L E, Eriksen J, Foote C. S. Electron-transfer photooxygenation. 4. Photooxygenation of trans-stilbene sensitized by methylene blue[J]. Journal of the American Chemical Society, 1980, 102(12): 4275-4277. |
| [21] | Wu D D, Wang L, Xu K, Song J, Fun H K, Xu J H, Zhang Y. A facile and highly atom-economic approach to biaryl-containing medium-ring bislactones[J]. Chemical Communications, 2012, 48(8): 1168-1170. |
| [22] | Onodera K, Sakuragi H, Tokumaru K. Effect of light wavelength on photooxygenation of hexamethylbenzene[J]. Tetrahedron Letters, 1980, 21(29): 2831-2832. |
| [23] | Ferroud C, Rool P, Santamaria J. Singlet oxygen mediated alkaloid tertiary amines oxidation by single electron transfer[J]. Tetrahedron Letters, 1998, 39(29): 9423-9426. |
| [24] | Bernstein R, Foote C S. Singlet oxygen involvement in the photochemical reaction of C60 and amines. Synthesis of an alkyne-containing fullerene[J]. Journal of Physical Chemistry A, 1999, 103(36): 7244-7247. |
| [25] | Gan L B, Zhou D, Luo C, Tan H, Huang C, Lue M, Pan J, Wu Y. Synthesis of fullerene amino acid derivatives by direct interaction of amino acid ester with C60[J]. Journal of Organic Chemistry, 1996, 61(6): 1954-1961. |
| [26] | Gan L B, Jiang J, Zhang W, Su Y, Shi Y, Huang C, Pan J, Lue M, Wu Y. Synthesis of pyrrolidine ring-fused fullerene multicarboxylates by photoreaction[J]. Journal of Organic Chemistry, 1998, 63(13): 4240-4247. |
| [27] | Shi Y, Gan L, Wei X, Jin S, Zhang S, Meng F, Wang Z, Yan C. Fullerene-sensitized[2+3]cycloaddition between maleimides and iminodiacetic ester: formation of pyrrolidine derivatives[J]. Organic Letters, 2000, 2(5): 667-669. |
| [28] | Cheng H, Gan L B, Shi Y, Wei X. A novel[2+3] cycloaddition reaction: singlet oxygen mediated formation of 1, 3-dipole from iminodiacetic acid dimethyl ester and its addition to maleimides[J]. Journal of Organic Chemistry, 2001, 66(19): 6369-6374. |