近年来,不对称光化学取得了飞速进展,与液相光化学反应相比,由于分子在固相状态下自由度的限制,固相光化学在对映选择性和化学选择性上具有极大的优势[1, 2, 3, 4, 5, 6]。对固相不对称光化学的研究目前主要有以下几种方法:(1)绝对不对称光化学;(2)主-客体组装;(3)应用手性修饰的沸石;(4)利用手性胺作为辅助诱导剂[7, 8, 9, 10, 11, 12],其中Scheffer课题组发展的离子型手性辅助剂方法在光化学不对称合成中具有一些显著的优点[13],如:手性辅助剂易引入易移除、辅助剂的选择可以使用一些商品化的手性化合物、形成的反应物具有较高的熔点、反应能够通过X-ray进行检测和分析等等。
环戊烯衍生物作为一类重要的有机中间体,广泛应用于具有五元碳环结构单元的天然产物及药物分子的合成中,如前列腺素和碳环核苷类成分等[14],核苷类成分在抗病毒药物的研究中占有重要的地位[15]。对于获得单一异构体,通过手性拆分的方法操作复杂,因此基于不对称合成方法的研究引起了人们更多的关注。本课题组前期报道了由手性胺作为手性诱导剂进行固相不对称光化学研究的工作[16],在此基础上,本文设计合成了二环己烷酮类衍生物,利用手性胺作为手性辅助剂,在固相下发生Norrish Ⅱ型裂解光化学反应,得到了环戊烯衍生物,获得了良好的对映选择性。
1 实验部分 1.1 仪器与试剂Bruker AVANCE III 400核磁共振谱仪,频率为400 MHz,内标为TMS;Agilent 1200-6520 Q-TOF高分辨液质联用仪;Agilent 7890A-5975C气质联用仪;XPA-1光化学反应仪,500W高压汞灯;Waters 2695高效液相色谱;Büchi Melting Point B-540熔点仪;PerkinElmer SPECTRUM100红外光谱仪;WZZ-3自动旋光仪。
所用试剂均为分析纯,四氢呋喃、乙醚、二氯甲烷、乙腈经重蒸处理,其他试剂未经进一步提纯直接使用。
1.2 实验方法以二环庚二烯为起始原料,经过过氧酸重排和硼氢化钠还原醛,然后进行羟基的TBDMS醇羟基保护和双键的BH3硼氢化氧化,将二级羟基进行TBDPS醇羟基保护,然后在弱酸条件下选择性脱掉TBDMS后用PCC氧化,然后将氧化得到的醛与酯基格氏试剂加成,加成产物再进行PCC氧化及脱保护得到光化学底物二环[3.1.0]己烷酮衍生物,选择了4个手性胺作为手性辅助剂。
化合物 2 的合成:向5.1 g(30 mmol)m-CPBA的CH2Cl2溶液中,搅拌下加入2.8 g(33 mmol)Na2CO3,反应30 min,将2.5 g(27.2 mmol)化合物 1 加入反应体系,搅拌过夜,抽滤,用CH2Cl2洗涤固体,减压蒸馏除去CH2Cl2,得到淡黄色油状液体,加入100 mL甲醇,搅拌下缓慢加入1.1 g(27.2 mmol)NaBH4。反应结束后加入25 mL 10%盐酸,减压蒸馏除去甲醇,乙酸乙酯萃取(50 mL×3)。
有机层用无水Na2SO4干燥,硅胶柱层析(石油醚/乙酸乙酯=5/1)得到1.5 g无色油状液体,产率为50%。
1HNMR(400 MHz,CDCl3): 5.69~5.70(m,1H),5.60~5.62(m,1H),3.47~3.52(m,1H),3.37~3.42 (m,1H),2.52 (dd,J=8.0/18.0 Hz,1H),2.10~2.17(m,2H),1.74 (q,J=7.2 Hz,1H),1.47(s,1H),1.208~1.285(m,1H)。 13CNMR (100 MHz,CDCl3): 131.1,127.9,56.6,32.1,28.3,22.2,19.6。 IR (KBr,cm-1): 3338,3051,2899,2843,1708,1645,1596,1010,723. HRMS (ESI) calcd for C7H10O [M+H]+ 111.0810; found [M+H]+ 111.0918。LRMS (EI): [M-1] 109,92,79,66,51,39。
化合物 3 的合成:向2.05 g(18.4 mmol)化合物 2 的THF溶液中,搅拌下加入2.5 g(36.8 mmol)咪唑,降至0 ℃,向体系中缓慢滴加4.16 g(27.6 mmol)TBDMSCl,滴加完毕升至室温,反应过夜。过滤,用THF洗涤固体,将有机相用无水Na2SO4干燥,减压蒸馏除去THF,硅胶柱层析(石油醚/乙酸乙酯=20/1)得到3.8 g无色油状液体,产率为91%。
1HNMR(400 MHz,CDCl3): 5.64~5.66(m,1H),5.54~5.55(m,1H),3.37~3.49(m,2H),2.46(dd,J=8.0/17.6 Hz,1H),2.05~2.14(m,2H),1.66(q,J=8.0 Hz,1H),1.16~1.19(m,1H),0.87 (s,9H),0.02(s,6H)。 13CNMR(100 MHz,CDCl3):130.5,128.7,57.5,32.1,28.6,26.0,25.7,22.4,19.4,-5.0,-5.1。IR(KBr,cm-1): 3049,2960,2857,1463,1259,1094,1024,800 HRMS (ESI) calcd for C13H24OSi [M+H]+ 227.1831; found [M+H]+ 227.1839。 LRMS (EI): [M] 224,167,115,101,89,75,59,51,42。
化合物 4 的合成:无水无氧处理,氮气保护,0 ℃下向1.12 g(5 mmol)化合物 3 的THF溶液中缓慢滴加15 mL(1 mol/L)的BH3/THF溶液,滴加完毕升至室温,反应过夜,将体系降至0 ℃,缓慢加入15 mL(3 mol/L)的氢氧化钠溶液和15 mL的30%的双氧水。减压蒸馏除去THF,用CH2Cl2萃取(25 mL×3),无水Na2SO4干燥,减压蒸馏除去CH2Cl2,硅胶柱层析(石油醚/乙酸乙酯=5/1)得到850 mg无色油状液体,产率为70%。
1HNMR (400 MHz,CDCl3): 4.18~4.21(m,1H),3.49(d,J=6.4 Hz,2H),1.99~2.04(m,4H),1.79~1.85(m,2H),1.65(s,1H),1.54~1.57(m,2H),0.94~1.02(m,1H),0.89(s,9H),0.06 (s,6H)。 13CNMR (100 MHz,CDCl3): 76.9,60.2,35.8,26.0,22.9,20.7,18.4,-5.1。 IR(KBr,cm-1): 3472,2960,2925,1646,1384,1260,1093,800. HRMS (ESI) calcd for C13H26O2Si [M+H]+ 243.1780; found [M+H]+ 243.1774。 LRMS (EI): [M-1] 243,185,167,105,93,75,59,41。
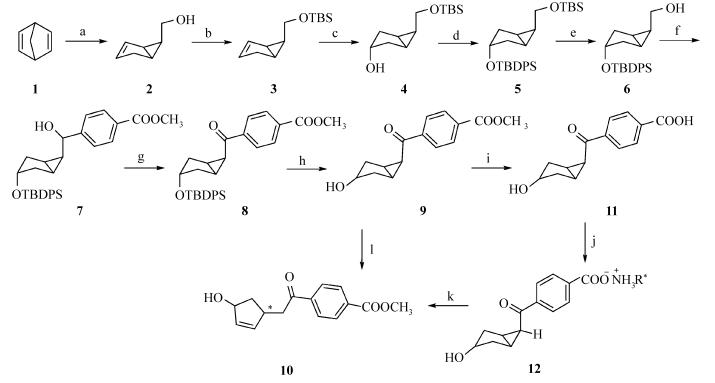
a) m-CPBA,Na2CO3,CH2Cl2; NaBH4,MeOH; b) TBDMSCl,CH2Cl2;c) BH3,THF;NaOH,H2O2;
d) TBDPSCl,Imida,CH2Cl2;e) PPTS,EtOH;f) PCC,CH2Cl2;i-PrMgBr,p-IC6H4COOCH3,THF; g) PCC,CH2Cl2;
h) 3%HCl,CH3OH/H2O;i) Na2CO3,CH3OH/H2O;j) R*NH2,MeOH; k) hν,solid state; CH2N2;l) hν,CH3CN
 | 图1 二环[3.1.0]己烷酮衍生物的合成及光化学产物 Synthesis of bicyclo hexyl ketone carbonyl reactants and their photoproducts |
化合物 5 的合成:将2.1 g(8.7 mmol)化合物 4 的CH2Cl2溶液在0℃下加入1.2 g(18 mmol)咪唑,搅拌使其溶解,缓慢滴加2.7 g(10 mmol)TBDPSCl,升至室温,TLC监测反应结束,过滤,用CH2Cl2洗涤固体,硅胶柱层析(石油醚/乙酸乙酯=50/1)得到3.9 g无色油状液体,产率为95%。
1HNMR (400 MHz,CDCl3): 7.65~7.69 (m,4H),7.35~7.42 (m,6H),4.02~4.05(m,1H),3.23(d,J=8.0 Hz,2H),1.96~2.01(m,2H),1.88(q,J=7.2 Hz,2H),1.55~1.63(m,1H),1.45~1.48(m,2H),1.05(s,9H),0.82(s,9H),-0.084 (s,6H)。13CNMR (100 MHz,CDCl3): 135.7,134.4,129.5,127.6,76.5,60.6,36.1,26.9,26.0,22.2,20.0,19.1,18.3,-5.2。 IR (KBr,cm-1): 2929,2857,1632,1427,1384,1259,1101,802,738,701。 HRMS (ESI) calcd for C29H44O2Si2 [M+H]+ 481.2958; found [M+H]+ 481.2952。 LRMS (EI): [M-1] 479,423,347,313,271,235,199,183,135,91,73,57,39。
化合物 6 的合成:将3.2 g(6.7 mmol)化合物 5 溶于30 mL乙醇中,搅拌下加入PPTS。TLC监测反应完全,硅胶柱层析(石油醚/乙酸乙酯=5/1)得到2.3 g无色油状液体,产率为90%。
1HNMR (400 MHz,CDCl3):7.68(d,J=1.2 Hz,4H),7.66(d,J=1.6 Hz,6H),7.40~7.45(m,6H),4.13~4.16 (m,1H),3.30(d,J=7.6 Hz,2H),2.08(s,1H),2.00~2.06(m,2H),1.88(d,J=7.2 Hz,2H),1.84(d,J=7.2 Hz,2H),1.55~1.58(m,2H),1.29(m,1H),1.07(s,9H)。13CNMR(100 MHz,CDCl3):135.7,134.3,129.6,127.6,77.1,60.3,36.1,26.9,22.6,20.6,19.1. IR (KBr,cm-1): 3391,3070,3034,2998,2930,2857,1741,1427,1361,1109,937,876,703,612。 HRMS (ESI) calcd for C23H30O2Si [M+Na]+ 389.1913; found [M+Na]+ 389.1912。 LRMS (EI): [M] 366,309,263,231,213,199,181,153,139,105,93,67,41。
化合物 7 的合成:将1 g(2.73 mmol)化合物 6 溶于40 mL无水CH2Cl2中,将与2 g硅藻土混合均匀的1.2 g(5.46 mmol)PCC加入体系中。TLC监测2 h后反应完全。硅胶柱层析(石油醚/乙酸乙酯=10/1)得到980 mg的无色油状物质。
无水无氧处理,氮气保护下,将1.43 g(5.46 mmol)对碘苯甲酸甲酯的30 mL无水THF溶液降至-40 ℃,缓慢加入4.1 mL异丙基溴化镁(1 mol/L),1 h后,将之前PCC氧化得到的980 mg的无色油状物质溶于10 mL无水THF,缓慢滴入反应体系,搅拌1 h后缓慢升至室温搅拌1 h。缓慢加入25 mL的10%盐酸,减压蒸馏除去THF,乙酸乙酯萃取(25 mL×3),无水Na2SO4干燥,硅胶柱层析(石油醚/乙酸乙酯=5/1)得到864.5 mg无色液体,产率为62%。
1HNMR(400 MHz,CDCl3):7.91(d,J=8.0 Hz,2H),7.67(d,J=8.0 Hz,4H),7.36~7.44(m,6H),7.16(d,J=8.0 Hz,2H),4.20~4.26(m,1H),3.87(s,3H),3.80 (d,J=12 Hz,1H),2.16(s,1H),2.14(m,2H),1.94~2.01(m,1H),1.73~1.78(m,2H),1.60~1.66(m,1H),1.45~1.51(m,1H),
1.24~1.26(m,1H),1.06 (s,9H)。 13CNMR (100 MHz,CDCl3):166.9,149.4,135.7,135.6,134.1,134.0,129.7,129.0,127.6,125.6,76.3,71.6,52.0,36.3,
36.1,29.3,26.8,21.3,21.2,19.1。 IR (KBr,cm-1): 3351,3020,2927,2857,1725,1610,1428,1278,1190,1109,961,821,740,702,613,506. HRMS (ESI) calcd for C31H36O4Si [M+Na]+ 523.2281; found [M+Na]+ 523.2292。LRMS (EI): [M-1] 499,469,443,347,281,199,135,77,41。
化合物 8 的合成:将2 g(4 mmol)化合物 7 溶于60 mL无水CH2Cl2中,将与3 g硅藻土混合均匀的1.72 g(5.46 mmol)PCC加入体系中。TLC监测2 h后反应完全。硅胶柱层析(石油醚/乙酸乙酯=10/1)得到1.8 g的无色油状物质,产率为92%。
1HNMR (400 MHz,CDCl3):8.02(d,J=8.0 Hz,2H),7.82(d,J=8.0 Hz,2H),7.55 (d,J=8.0 Hz,4H),7.28~7.36(m,6H),4.11~4.17(m,1H),3.95(s,3H),2.04~2.17(m,5H),1.94~2.00(m,2H),1.01(s,9H)。 13CNMR (100 MHz,CDCl3): 198.7,166.4,141.8,135.6,134.3,133.4,129.6,129.4,127.9,127.5,75.3,52.4,36.0,27.5,27.0,26.1,19.1。 IR (KBr,cm-1): 3070,3051,2963,2857,1730,1675,1502,1408,1278,1228,1082,986,920,821,736,612,510。 HRMS (ESI) calcd for C31H34O4Si [M+Na]+ 521.2124; found [M+Na]+ 521.2130。LRMS (EI): [M] 498,441,405,355,327,281,253,209,199,163,135,96,73,55,40。
化合物 9 的合成:将1.0 g(2.0 mmol)化合物 8 溶于20 mL的甲醇,搅拌条件下加入100 mL的3%甲醇盐酸溶液,过夜。加入饱和碳酸氢纳溶液中和盐酸溶液,调至中性,减压蒸馏除去甲醇,乙酸乙酯萃取(25 mL×3),无水硫酸钠干燥,硅胶柱层析(石油醚/乙酸乙酯=1/1)得到300 mg白色固体,产率为57%。
m.p.80~82 ℃。1HNMR(400 MHz,CDCl3): 8.12(d,J=8.4 Hz,2H),8.01(d,J=8.4 Hz,2H),4.32~4.37(m,1H),3.95(s,3H),2.34~2.42(m,3H),2.19~2.22(m,2H),1.90~1.94(m,2H),1.79 (s,1H)。 13CNMR (100 MHz,CDCl3):199.4,166.3,142.1,133.5,129.8,127.8,109.8,75.3,52.5,35.9,27.8,27.5. IR(KBr,cm-1): 3337,3024,2961,2950,2923,2852,1721,1678,1503,1438,1289,1218,1073,962,865,745。 HRMS (ESI) calcd for C15H16O4 [M+H]+ 283.0946; found [M+H]+ 283.0946。 LRMS (EI): [M-1] 259,242,229,179,163,147,135,103,82,76,67,55,39.
化合物 10 的合成:将50 mg光化学底物化合物 9 加入已干燥的光照管内,加入10 mL干燥CH3CN使其溶解,搅拌下通氮气30 min后,将光照管密封,在500 W高压汞灯光照下反应0.5 h。硅胶柱层析(石油醚/乙酸乙酯=5/1)得到白色固体29 mg,产率为58%。
m.p.79~81 ℃。1HNMR (400 MHz,CDCl3): 8.12(d,J=8.0 Hz,2H),6.00~6.02(m,1H),5.89~5.92(m,1H),4.90~4.92(m,1H),3.95(s,3H),3.49~3.53(m,1H),2.97~3.11(m,2H),
2.09~2.15(m,1H),1.83~1.80(m,1H),1.60(s,1H)。13CNMR (100 MHz,CDCl3):198.6,166.2,140.1,138.7,133.9,133.8,129.9,127.9,76.9,52.5,44.8,40.7,39.8。HRMS (ESI) calcd for C15H16O4 [M-H]- 259.0970; found [M-H]- 259.0978。LRMS (EI): [M-1] 259,243,229,179,163,149,135,103,82,55,39。
化合物 11 的合成:将420 mg(1.6 mmol)化合物 9 溶于20 mL甲醇,加入10 mL(1.6 mol/L)Na2CO3溶液,24 h后加入25 mL 10%稀盐酸中和过量的Na2CO3,减压除去溶剂甲醇,乙酸乙酯萃取(25 mL×3),无水硫酸钠干燥,硅胶柱层析(石油醚/乙酸乙酯=1/2)得到白色固体375 mg,产率为96%。
m.p.227~229 ℃。1HNMR (400 MHz,CDCl3): 8.09(d,J=8.4 Hz,2H),8.04(d,J=8.4 Hz,2H),4.72(s,1H),4.06~4.13(m,1H),2.70 (s,1H),2.14~2.19(m,2H),1.95(s,2H),1.65~1.70 (t,J=20.0 Hz,2H)。 13CNMR (100 MHz,CDCl3): 198.3,166.7,140.3,134.2,129.5,128.0,68.6,36.3,30.7,28.5。 IR (KBr,cm-1): 3350,3290,2954,2940,2670,2540,1950,1690,1505,1410,1322,1220,1101,940,872,708,668,517。 HRMS (ESI) calcd for C14H14O4 [M+H]+ 247.0970; found [M+H]+ 247.0980。 LRMS (EI): [M] 246,223,205,178,160,149,104,76,57,41。
铵盐的合成:76 mg(0.31 mmol)化合物 11 先后加入4 mL乙醚和4 mL甲醇,搅拌条件下加入等物质量的手性胺,室温反应10 min,减压除去溶剂,加入5 mL乙醚,析出白色固体,之后用甲醇重结晶。
S-苯乙铵盐:白色固体,m.p.175~177 ℃,1HNMR(400 MHz,CDCl3): 7.83~7.90(m,4H),7.37~7.41 (m,5H),4.45(t,J=20.4 Hz,1H),4.10~4.12(m,1H),2.56(s,1H),2.27 (dd,J=7.2/13.2 Hz,2H),2.10(s,2H),1.76~1.81(m,2H),1.56(d,J=6.8 Hz,3H)。 13CNMR (100 MHz,CDCl3): 204.4,174.7,140.7,139.1,137.7,129.2,128.8,127.9,126.5,70.2,51.0,35.5,32.3,30.2,19.3。 IR (KBr,cm-1): 3431,3030,2977,2930,2770,2680,2625,2145,1950,1730,1660,1617,1580,1495,1383,1250,1137,1070,
935,824,725,695,600,510。
R-苯乙铵盐:白色固体,m.p.175~177 ℃,1HNMR(400 MHz,CDCl3):7.82~7.88(m,4H),7.36~7.40(m,5H),4.45(t,J=20.4 Hz,1H),4.08~4.16(m,1H),2.54(s,1H),2.27 (dd,J=7.2/13.2 Hz,2H),2.09(s,2H),1.75~1.80 (m,2H),1.55(d,J=6.8 Hz,3H)。13CNMR(100 MHz,CDCl3):204.4,174.6,140.7,139.0,137.7,129.2,128.8,127.9,126.5,70.2,51.0,35.5,32.3,30.2,19.3。 IR (KBr,cm-1): 3441,3035,2975,2930,2853,2600,2142,1734,1664,1583,1492,1446,1288,1229,1137,1075,931,824,772,620,508。
R-环己基乙铵盐:白色固体,m.p.138~140 ℃,1HNMR (400 MHz,CDCl3): 7.83~7.90(m,4H),4.10~4.17(m,1H),3.05~3.11 (m,1H),2.56(s,1H),2.36 (dd,J=7.2/13.2 Hz,2H),2.10 (s,2H),1.76~1.80 (m,2H),1.55-1.69 (m,5H),1.40~1.47 (m,1H),1.15 (d,J=6.8 Hz,5H),0.89~1.06(m,3H)。 13CNMR (100 MHz,CDCl3): 204.4,174.6,140.7,139.1,128.8,128.0,126.5,70.2,52.3,40.8,35.6,32.3,30.2,28.3,27.3,25.5,25.4,25.3,15.0。 IR(KBr,cm-1): 3039,2935,2068,1711,1665,1581,1432,1396,1310,1226,1137,
1100,1063,992,976,963,860,828,747,728,631,566,534,465,420。
1S,2R-( - )-1-氨基-2-茚醇盐:白色固体,m.p.156~158 ℃,1HNMR (400 MHz,CDCl3):7.82~7.90(m,4H),7.26~7.40(m,4H),4.62(d,J=5.2 Hz,1H),4.10~4.17(m,1H),3.20 (dd,J=5.6/16.4 Hz,1H),2.94 (dd,J=4.0/16.4 Hz,1H),2.56(s,1H),2.27 (dd,J=7.2/13.2 Hz,2H),2.10(s,2H),1.75~1.80(m,2H)。13CNMR(100 MHz,CDCl3):204.4,174.6,141.0,139.1,135.6,130.0,128.8,127.9,127.5,125.8,124.8,70.8,70.2,57.1,38.2,35.6,32.3,30.2。 IR(KBr,cm-1): 3432,3030,2979,2933,2769,2620,2545,2145,1950,1890,1795,1618,1584,1496,1330,1290,
1253,1210,1111,1040,930,876,840,767,720,601,585,510,450,406。
液相条件下,产物为外消旋体。分别对于0.5、1、1.5 h的裂解产物进行分析,发现0.5 h的裂解产物产率最高,达到58%。Norrish Ⅱ型光化学裂解反应进行的很快,随着反应时间的延长,二级光化学反应变强,裂解产物的产率下降。
2.2 固相光化学反应光照底物 8 在脱保护时,若应用碱性条件则在脱保护之后羰基键构型发生翻转,在经过水解以及与手性胺成盐之后,无法发生光化学反应,推测是由于构型翻转后,羰基氧原子与γ-氢原子处于反式,原子之间的距离超过了可发生光化学反应的允许范围。最后在弱碱性条件下进行水解,再经过酸化和与手性胺反应制备了反应底物 12 。对于化合物 12 的固相不对称光化学反应结果如表 1所示。
从表 1可以看出,在常温下,反应时间延长,Norrish Ⅱ型光化学裂解转化率升高,但裂解产物的ee值降低;但是在低温下或低转化率下获得的对映选择性(ee值)相对较高,这是因为在上述条件下反应物的晶格得到了保持,从而构象控制(conformational control)持续作用于反应的对映选择性上。另外,在-40 ℃条件下,S-苯乙胺诱导的不对称光化学具有较好的ee值。
| 表1 铵盐 12 的固相不对称光化学研究 Asymmetric studies on the irradiation of salts 12 in the solid state |
以手性胺作为手性辅助剂,合成了二环己烷酮类衍生物,探讨了反应时间和反应温度对光化学裂解产率和对映选择性的影响,最后不对称合成了光学纯的环戊烯衍生物,为今后开展以手性环戊烯化合物为原料的天然药物合成奠定了基础。
| [1] | Buschmann H, Scharf H D, Hoffmann N, Esser P. The isoinversion principle-a general model of chemical selectivity[J]. Angewandte Chemie International Edition, 1991, 30(5): 477-515. |
| [2] | Inoue Y. Asymmetric photochemical reactions in solution[J]. Chemical Reviews, 1992, 92(5): 741-770. |
| [3] | Peter J P. Advances in Photochemistry[M].New York and London: Wiley, 1996, 21, 135-216. |
| [4] | Rau H. Asymmetric photochemistry in solution[J]. Che-mical Reviews, 1983, 83(5): 535-547. |
| [5] | Yang C, Xia W J. Solid-state asymmetric photochemical studies using the ionic chiral auxiliary approach[J]. Asian Journal of Chemistry, 2009, 4(12): 1774-1784. |
| [6] | Natarajan A, Ng D, Yang Z, Garcia-Garibay M. A. Parallel syntheses of (+)-and (-)-α-cuparenone by radical combination in crystalline solids[J]. Angewandte Chemie International Edition, 2007, 46(34): 6485-6487. |
| [7] | Elgavi A, Green B S, Schmidt G M J. Reactions in chiral crystals. Optically active heterophotodimer formation from chiral single crystals[J]. Journal of the American Chemical Society, 1973, 95(6): 2058-2059. |
| [8] | Toda F. Solid state organic chemistry: efficient reactions, remarkable yields, and stereoselectivity[J]. Accounts of Chemical Research, 1995, 28(12): 480-486. |
| [9] | Ramamurthy V, Eaton D F, Caspar J V. Photochemical and photophysical studies of organic molecules included within zeolites[J]. Accounts of Chemical Research, 1992, 25(7): 299-307. |
| [10] | Gamlin J N, Jones R, Leibovitch M, Patrick B, Scheffer J R, Trotter J. The ionic auxiliary concept in solid state organic photochemistry[J]. Accounts of Chemical Research, 1996, 29(4): 203-209. |
| [11] | Natarajan A, Wang K, Ramamurthy V, Scheffer J R, Patrick B. Control of enantioselectivity in the photochemical conversion of α-oxoamides into β-lactam derivatives[J]. Organic Letters, 2002, 4(9): 1443-1446. |
| [12] | Bach T, Bergmann K, Harms K. High facial diastereoselectivity in the photocycloaddition of a chiral aromatic aldehyde and an enamide induced by intermolecular hydrogen bonding[J]. Journal of the American Chemical Society, 1999, 121(45): 10650-10651. |
| [13] | Gudmundsdottir A D, Scheffer J R. Asymmetric induction in the solid state photochemistry of salts of carboxylic acids with optically active amines[J]. Tetrahedron Letters, 1990, 31(47): 6807-6810. |
| [14] | Collins P W, Djuric S W. Synthesis of therapeutically useful prostaglandin and prostacylin analogs[J]. Chemical Reviews, 1993, 93(4): 1533-1564. |
| [15] | Arita M, Adachi K, Ito Y, Sawaki H, Ohno M. Enatioselective synthesis of the carbocyclic nucleosides (-)-aristeromycin and (-)-neplanocin A by a chemicoenzymatic approach[J]. Journal of the American Chemical Society, 1983, 105(12): 4049-4055. |
| [16] | Ma M L, Yang C, Li B, Shao Y T, Zhao G L, Xia W J. Photochemical studies on 5-methylbicyclopentane derivatives: p-orbital overlap controlled enantioselectivity[J]. Chinese Journal of Chemistry, 2012, 30(1): 91-95. |




