四苯基乙烯(tetraphenylethene,TPE)及其衍生物在溶液中几乎没有发光,而在固态有高的荧光量子产率,是一类具有聚集诱导发光(Aggregation Induced Emission)性质的化合物[1,2,3]。溶液状态下,四苯基乙烯的四个苯环可以自由旋转,激发态失活以非辐射跃迁主导;聚集态下,分子内苯环旋转受限,抑制了分子内基团旋转引起的非辐射失活,体系辐射跃迁增强,因此,TPE及其衍生物在聚集态下具有高的荧光量子产率。TPE及其衍生物因其易于合成及其在固态具有高发光量子产率的特性被广泛应用于有机发光器件(OLEDs)、生物及化学传感器等研究领域。
TPE及其衍生物作为一类光功能材料,其应用与光的关系密不可分,研究其光稳定性有重要意义。已有大量的研究表明,二苯基乙烯及其衍生物除可以发生顺反异构化反应外[4]还可以发生光氧化反应[5],cis-1,2-二苯基乙烯在一定条件下发生光氧化反应,生成关环产物菲。TPE相比1,2-二苯基乙烯多了两个取代苯基,虽然对TPE发色团的光物理性质的研究已有大量报道,但对TPE发色团光氧化反应的报道却非常有限[6]。
本工作设计合成了TPE衍生物Model-TPE,研究了其光物理性质及光氧化反应。研究结果表明,Model-TPE具有AIE性质,在氧气存在下可以发生光氧化关环反应,生成二苯基取代菲衍生物。 1 实验部分 1.1 仪器及主要试剂
Bruker Avance Ⅱ-400 核磁共振仪;Waters LCT Premier XE高分辨液质联用仪;Bruker Microflex (MALDI-TOF) 基质辅助激光解吸附飞行时间质谱仪和Shimadzu LCMS-2010 (ESI)液质联用质谱仪;Shimadzu UV-1601PC紫外可见吸收光谱仪;日立F-4500荧光光谱仪;北京电光科学仪器厂XT4-100X显微熔点仪。
合成所用试剂来自于国药集团北京化学试剂公司、Alfa Aesar、Aldrich或J&K Chemical公司分析纯或化学纯产品,除特别说明外使用前未经进一步纯化;四氢呋喃(THF)用金属钠干燥重蒸后使用;测试用甲醇和四氢呋喃为迪马公司HPLC 纯度试剂,测试用水为MilliQ 纯水系统制备的超纯水(电阻率18.3 MΩ·cm)。 1.2 Model-TPE的合成
本工作中四苯基乙烯衍生物通过醇式中间体脱水的方法获得[7]。目标化合物通过如图1所示反应路线进行,二苯甲烷和丁基锂反应首先得到二苯甲基锂,接着再与二苯酮衍生物反应得到醇式中间体,然后脱水得到苯环上带有取代基的四苯基乙烯衍生物(TPE-1OMe),最后通过一系列反应得到末端带有羧基的1-(4-羧基甲氧基苯基)-1,2,2-三苯基乙烯(TPE-1COOH)和外围羧基被正丙胺封端的模型化合物(Model-TPE)。
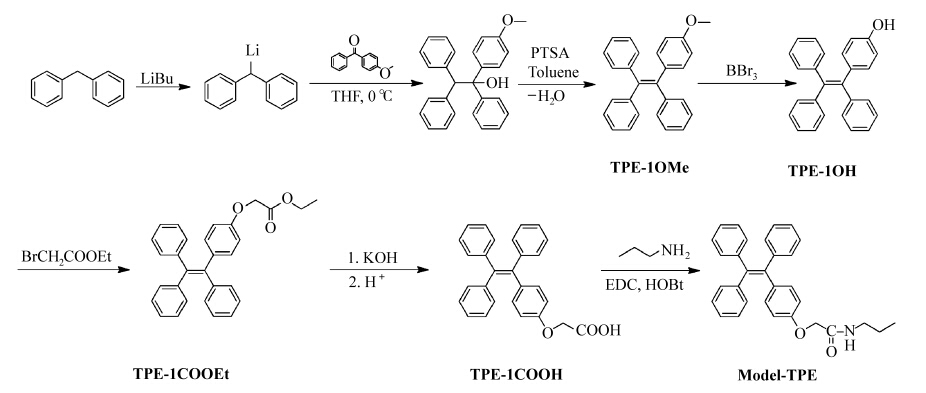 | 图1 Model-TPE化合物的合成路线 Synthetic route of compounds |
(1) 1-(4-甲氧基苯基)-1,2,2-三苯基乙烯(TPE-1OMe)
在50 mL的Schlenk反应瓶中加入2.02 g (12 mmol)二苯甲烷和20 mL干燥的四氢呋喃,除水除氧后将体系置于0 ℃冰水浴中,将4.55 mL(10 mmol) 2.2 mol/L的丁基锂迅速注射到反应体系内,0 ℃下反应30 min。然后将1.9 g (9 mmol) 4-甲氧基二苯酮溶于适量的干燥四氢呋喃并注入到反应体系中,反应体系置于室温下继续反应6 h。反应结束后,将反应液倒入水中终止反应,用二氯甲烷分3次萃取反应液,合并有机相,用饱和氯化铵,饱和食盐水,水各洗涤3次。有机相用无水MgSO4干燥,旋干即得白色中间体产物1-(4-甲氧基苯基)-1,2,2-三苯基乙醇。
将中间体醇和0.342 g(1.8 mmol)对甲苯磺酸置于250 mL的三口瓶中,加入80 mL甲苯,加热回流4 h,用分水器将生成的水分出。反应完毕后将反应体系冷却到室温,用10%碳酸氢钠水溶液洗涤3次,通过甲苯/乙醇混合溶液重结晶,得到白色固体2.31 g,产率为71%。熔点:132~133 ℃。
1HNMR (400 MHz,CDCl3) : 7.16~7.05(m,9H,ArH),7.05~6.96(m,6H,ArH),6.92(d,J=8.8 Hz,2H,ArH),6.62(d,J=8.8 Hz,2H,ArH),3.72(s,3H,OCH3)。
(2) 1-(4-羟基苯基)-1,2,2-三苯基乙烯(TPE-1OH)
在50 mL两口瓶中将2 g (5 mmol)的1-(4-甲氧基苯基)-1,2,2-三苯基乙烯(TPE-1OMe)溶于20 mL干燥的二氯甲烷,将反应体系置于-78 ℃的丙酮/液氮浴中冷却。将1 mL (10 mmol)三溴化硼溶于10 mL二氯甲烷,通过恒压滴液漏斗缓慢滴加到反应液中,滴加完毕后将温度缓慢升至室温,搅拌12 h。在冰水浴下向反应瓶中加入20 mL水淬灭反应,瓶中产生大量白色固体,过滤,将固体溶于乙醚,水洗3次,无水MgSO4干燥,旋干得到1.6 g白色固体,产率:93%。熔点:225~226 ℃。
1HNMR (400 MHz,CDCl3): 7.05~7.10(m,9H,ArH),6.98~7.01(d,J=7.6 Hz,6H,ArH),6.87(d,J=8.7 Hz,2H,ArH),6.54(d,J=8.7 Hz,2H,ArH),4.56(s,1H,OH)。
(3) 1-(4-乙氧羰基甲氧基苯基)-1,2,2-三苯基乙烯(TPE-1COOEt)
在50 mL的两口瓶中加入1.2 g (3.4 mmol) 1-(4-羟基苯基)-1,2,2-三苯基乙烯(TPE-1OH),1.9g (1.5 mL,13.8 mmol)溴乙酸乙酯,2 g (15 mmol)无水碳酸钾和30 mL干燥的四氢呋喃,通氮气除氧,加热回流12 h,冷却至室温,过滤除去无机盐,滤液旋干后得到粗产品。将粗产品溶于乙酸乙酯,水洗3次,无水硫酸镁干燥后用柱层析分离纯化。先用石油醚为洗脱剂将溴乙酸乙酯洗出,再用二氯甲烷/石油醚(1/1,5/1,v/v)梯度洗脱,得到淡黄色粘稠状固体1.4 g,产率>99%。熔点:225~226 ℃。
1HNMR(400 MHz,CDCl3):7.05~7.10(m,9H,ArH),6.97~7.01(m,6H,ArH),6.92(d,J=6.7 Hz,2H,ArH),6.62 (d,J=8.9 Hz,2H,ArH),4.52(s,2H,ArOCH2CO),4.23 (q,J=7.1 Hz,2H,CH2CH3),1.25 (t,J=7.1 Hz,3H,CH2CH3)。
(4) 1-(4-羧基甲氧基苯基)-1,2,2-三苯基乙烯(TPE-1COOH)
在50 mL圆底烧瓶中加入1.4 g (3.4 mmol) TPE-1COOEt,依次向其中加入30 mL THF/MeOH(1∶1)混合溶剂和5 mL水,再加入1.12 g KOH,加热回流5 h使之完全皂化,将有机溶剂旋干,加入20 mL水稀释,用浓盐酸调节pH值到2,过滤并且洗涤析出固体,真空烘箱中抽干,得到白色固体1.3 g,产率99%。熔点:153~156 ℃。
1HNMR(400 MHz,DMSO-d6):7.29~7.03(m,9H,ArH),7.03~6.91(m,6H,ArH),6.86(dd,J=9.2,2.3 Hz,2H,ArH),6.67(d,J=8.8 Hz,2H,ArH),4.57(s,2H,ArOCH2CO)。 13CNMR(400 MHz,DMSO-d6): 170.03,156.03,143.40,139.95,139.82,135.66,131.81,130.62,127.87,127.74,126.43,126.13,113.75,64.25。ESI-MS: calc. 406.1569,found [M+Na]+ 429.1467。
(5) 丙胺封端模型化合物(Model-TPE)
在50 mL两口瓶中加入1 mmol TPE-1COOH和15 mL THF,待固体溶解后依次加入1.4 mmol 1-(3-二甲氨基丙基)-3-乙基碳二亚胺盐酸盐(EDC)、1 mmol 1-羟基苯并三氮唑(HOBT)。氮气保护下室温搅拌反应2 h,将反应液缓慢滴加至15 mL溶有16 mmol正丙胺的THF溶液中,在35 ℃条件下,氮气氛围中继续搅拌反应48 h,将反应液慢慢倒入水溶液中,过滤并用适量水洗涤固体,烘干。以二氯甲烷/甲醇为洗脱剂硅胶色谱柱分离,得到白色固体,产率64%。
1HNMR(400 MHz,CDCl3):7.06~7.16(m,9H,ArH) ,6.99~7.06(m,6H,ArH),6.97(d,J=8.9 Hz,2H,ArH) ,6.66(d,J=8.9 Hz,2H,ArH) ,6.53(br s,1H,NHCH2),4.42(s,2H,ArOCH2CO) ,3.27(m,2H,NHCH2CH2CH3),1.55(m,2H,NHCH2CH2CH3),0.92(t,J=7.4 Hz,3H,CH2CH2CH3)。 13CNMR(100MHz,CDCl3):168.2,155.8,143.8,140.8,140.2,137.8,132.9,131.4,127.9,127.7,126.5,114.0,67.4,40.8,22.9,11.4。 MS (ESI): calc。 m/z 447.2198,found [M+Na]+: 470.2091。 2 结果与讨论 2.1 Model-TPE光物理性质研究
选择对Model-TPE模型化合物溶解较好的四氢呋喃为良溶剂,对其溶解能力不好的水作为不良溶剂,通过吸收光谱和荧光光谱研究四苯基乙烯发色团聚集诱导发光现象。
图2(a)给出了模型化合物在THF和含水量为99%的THF/H2O混合溶剂中的吸收光谱,在含水量99%的混合溶剂中,化合物的吸收光谱在长波可见光区出现散射导致的拖尾现象,最大吸收峰位置发生了约10 nm的红移,并且在该体系中可以观察到丁达尔现象,说明Model-TPE在含水量为99%的THF/H2O混合溶剂中主要以聚集体的形式存在。
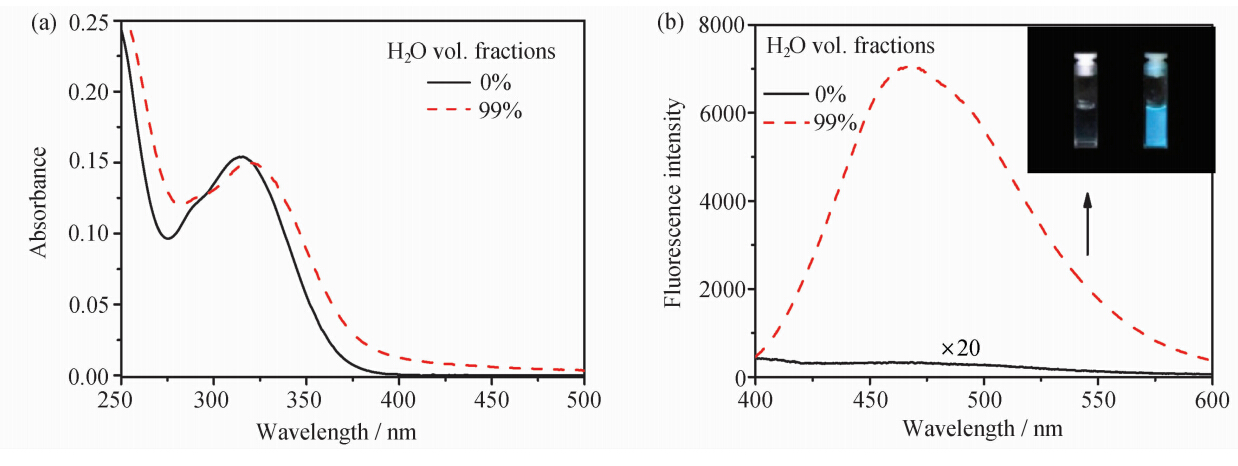 | 图2 Model-TPE在不同比例THF/H2O (1/99,v/v)中紫外可见吸收光谱(a)和荧光发射光谱(b),λex= 315nm 插入图:365 nm紫外灯下图片,[Model-TPE] = 1.0×10-5mol/L Absorption (a) and emission (b) spectra of Model-TPE in THF and THF/H2O (1/99,v/v) Inset shows the photograph of samples in different solvents under 365 nm irradiation (λex= 315 nm,[Model-TPE] = 1.0×10-5 mol/L) |
以315 nm的光激发Model-TPE,得到图2(b)所示的荧光光谱,TPE模型化合物在THF溶液中几乎检测不到荧光信号,而在THF/H2O = 1/99(v/v)条件下,体系出现最大峰在470 nm左右无结构的强荧光发射峰,为典型的TPE发色团聚集态发光。图2(b)插入图为Model-TPE在THF和THF/H2O (1/99,v/v)体系中365 nm紫外灯照射下的照片,可以看到Model-TPE表现出聚集诱导发光特性。
理论和实验研究表明[8],TPE发色团聚集诱导发光机理是苯环旋转受限导致非辐射失活降低的原理,溶液状态下,TPE中的苯环处于自由旋转的状态,激发态能量主要通过非辐射跃迁衰减,体系几乎不发光;当其发生聚集或在固态条件下,其TPE中的苯环旋转处于受限的状态,非辐射失活过程被极大地抑制,辐射跃迁增加,因此具有很强的荧光发射。 2.2 Model-TPE光反应研究
在Model-TPE稳态荧光光谱研究过程中,我们发现Model-TPE的发射光谱随扫描次数的增加,在四苯基乙烯聚集态发射峰更短波长处出现了带有精细结构的新荧光发射峰,最大峰分别为368 nm、385 nm和405 nm,并且该荧光发射强度随扫描次数增加而增强,推测Model-TPE在荧光光谱测试过程中由于激发光的作用发生了光化学反应。我们进一步用波长为365 nm的紫外光直接照射Model-TPE的THF溶液([Model-TPE]=1.0×10-5 mol/L),每隔30 min检测其荧光发射光谱,如图3所示,溶液荧光强度随光照时间的增加逐渐增强。类似地,我们在TPE衍生物TPE-1OMe、TPE-1OH、TPE-1COOEt和TPE-1COOH中也观察到了类似的实验现象。由于所得荧光光谱形状与菲的荧光光谱形状类似,我们推测体系中TPE发色团在紫外光的作用下发生了光氧化关环反应,导致其荧光发射光谱发生了明显变化。
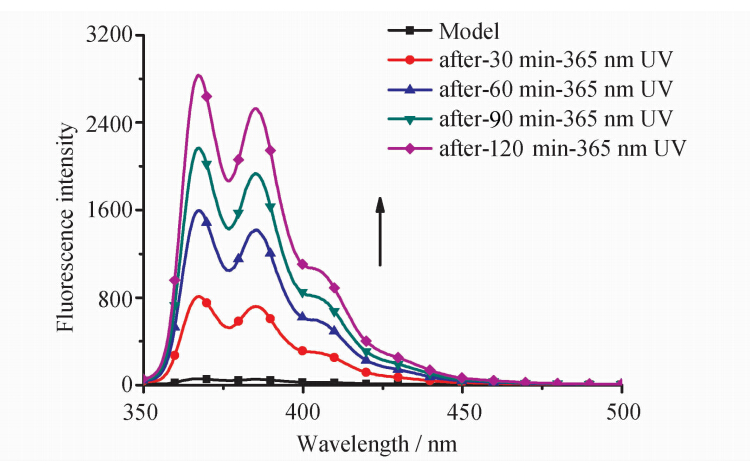 | 图3 不同光照(365 nm)时间下Model-TPE在THF中的荧光发射光谱λex=315 nm,[Model-TPE] = 1.0×10-5 mol/LFluorescence spectra of Model-TPE after various UV irradiation time( λex=315 nm,[Model-TPE] = 1.0×10-5 mol/L) |
为了验证我们的推测,我们进一步利用高效液相色谱分离光反应产物,并用1HNMR和 MALDI-TOF对分离得到的化合物进行了鉴定。为了避免氘代氯仿在紫外光的照射下光解干扰Model-TPE的光化学反应,我们选择在氘代乙腈中研究Model-TPE的光化学反应。
图4为光照前后体系的1HNMR图谱,对比光照前后体系的核磁图谱,可以明显看到光照后 体系中除了保持原有Model-TPE的核磁信号峰外,在化学位移为4.71和4.41 ppm出现了两个新的核磁信号峰(单峰),化学位移大于7.2 ppm更低场方向出现了多重峰,显然体系中发生了光化学反应。
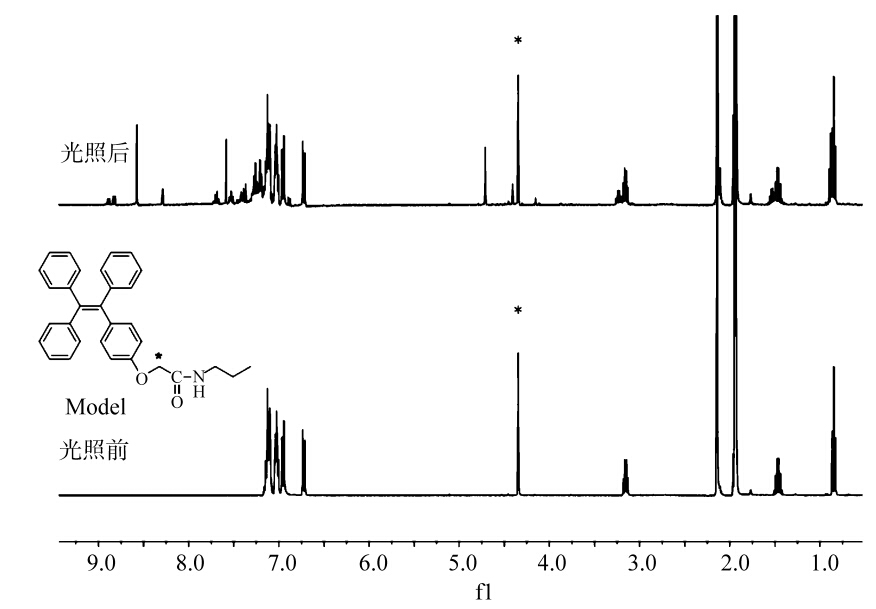 | 图4 Model-TPE经过365 nm紫外光照射前后1HNMR变化图(400MHz,CD3CN) 1HNMR spectra(400 MHz,CD3CN) of Model-TPE before and after irradiation under 365 nm light |
为了更清楚地了解体系中发生的光化学反应,我们利用高效液相色谱(HPLC)对Model-TPE紫外光照射后的混合物进行分离,HPLC图谱如图5所示,可以清楚地看到体系中含有Ⅰ、Ⅱ和Ⅲ三种化合物。
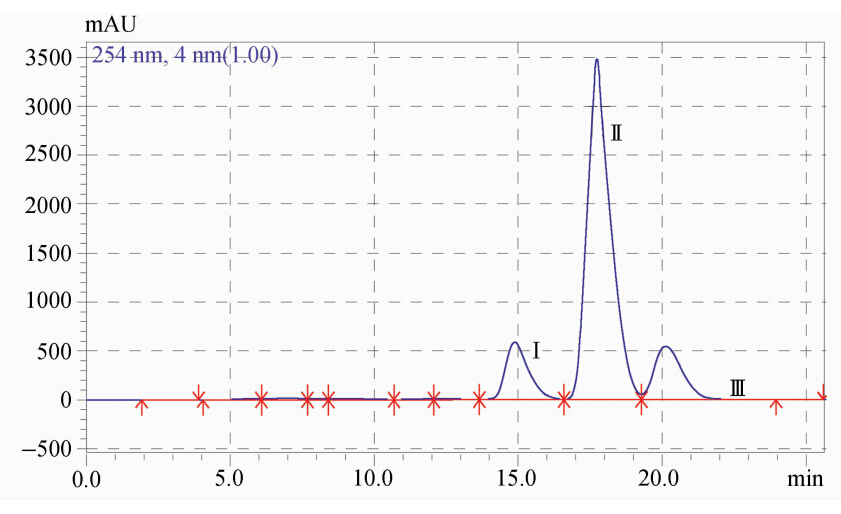 | 图5 Model-TPE经过紫外光照射后混合物的液相图,流动相为甲醇/水=7/3,流速为1.0 mL/min HPLC data of Model-TPE after UV irradiation (eluent: methanol/water 7/3,1.0 mL/min) |
由图中可见,化合物Ⅰ的保留时间与Model-TPE的保留时间相同,可以判断化合物I为未发生光反应的Model-TPE,化合物Ⅱ和Ⅲ应该是体系在紫外光照射下生成的光反应产物。进一步我们用核磁和质谱对HPLC分离得到的化合物Ⅱ和Ⅲ进行表征。从质谱数据可以看出,化合物Ⅱ和Ⅲ加钠后分子量均为468.3,而化合物Ⅰ的加钠后分子量为470.3。比较三个化合物的分子量,化合物Ⅱ和Ⅲ的分子量相比化合物Ⅰ少了2个质量 数,推测化合物Ⅱ和Ⅲ为Model-TPE(化合物Ⅰ)光氧化关环产物,两个光氧化关环产物分析为不同取代侧两个苯环关环的结果(见机理部分图6)。由 1HNMR表征结果得知两个关环产物的氧原子相连的亚甲基氢化学位移分别为4.47和4.74 ppm,化学位移较大的亚甲基所连接的基团去屏蔽效应较大,由此推测亚甲基更接近菲基团,这是关环反应发生在含取代基一侧的化合物,此外,从低场质子的化学位移和个数判断,取代基一侧关环的化合物中菲结构对称性较差,质子的化学环境较另一产物复杂,由此推测化合物Ⅱ和Ⅲ的结构归属以及具体表征数据如下。
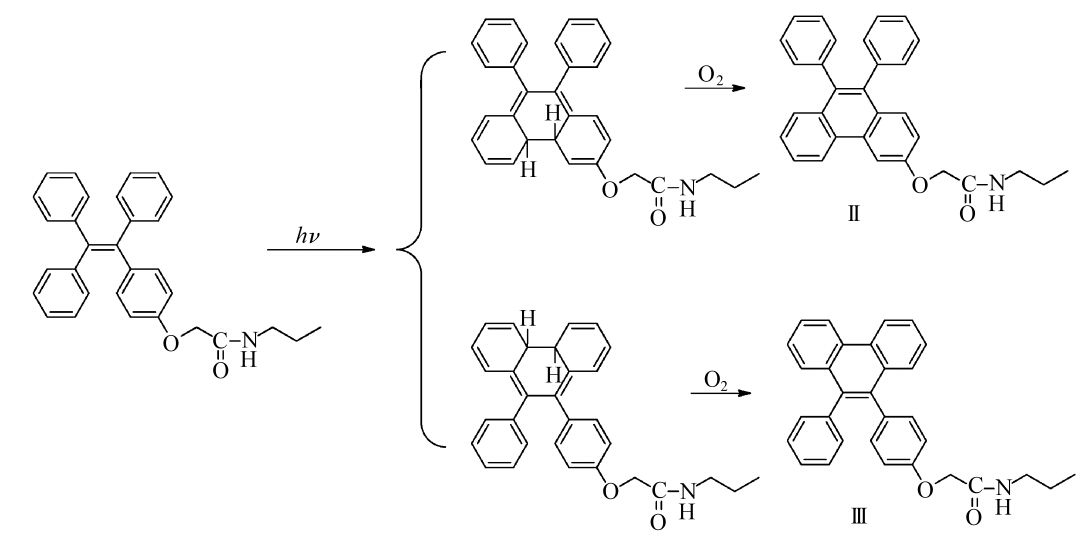 | 图6 推测的Model-TPE光氧化关环反应机理 Proposed mechanism of photocyclization of Model-TPE |
化合物Ⅱ:1HNMR (400 MHz,CDCl3) :8.68(d,J=12 Hz,1 H,ArH),8.20 (d,J=2.6 Hz,1H,ArH),7.66(m,1H,ArH) ,7.53 (m,3H,ArH),7.30~7.17(m,6H,ArH),7.00~7.17(m,5H,ArH),6.71(br s,1H,NHCH2),4.74(s,2H,ArOCH2CO),3.37(m,2H,NHCH2CH2CH3),1.60(m,2H,NHCH2CH2CH3),0.96 (t,J=7.4 Hz,3H,CH2CH2CH3)。MALDI-TOF MS: calc. m/z 445.5,found [M+Na] +: 448.3。
化合物Ⅲ:1HNMR(400MHz,CDCl3):8.81 (d,J=8.4 Hz,2H,ArH) ,7.67(m,2H,ArH) ,7.40~7.60(m,4H,ArH) ,7.30~7.17(m,3H,ArH),7.00~7.17(m,4H,ArH),6.81(d,J=8.7 Hz,2H,ArH),6.57 (br s,1H,NHCH2),4.47(s,2H,ArOCH2CO),3.29(m,2H,NHCH2CH2CH3),1.57(m,2H,NHCH2CH2CH3),0.94(t,J=7.4 Hz,3H,CH2CH2CH3)。 MALDI-TOF MS: calc.m/z 445.5,found [M+Na] +: 448.3。 2.3 Model-TPE光反应机理探讨
TPE的结构与cis-1,2-二苯基乙烯有关类似的结构,参考cis-1,2-二苯基乙烯光氧化关环反应的机理[9,10],我们推测Model-TPE光氧化关环反应按图6所示反应路线进行。Model-TPE化合物具有顺式二苯基乙烯的结构,在紫外光照射下发生关环反应,生成二氢菲结构的化合物,在氧的作用下脱氢生成化合物Ⅱ和Ⅲ,其中,化合物Ⅱ为主产物,推测是由于含取代基一侧两个苯环的构象角度更适合发生关环反应所致[9]。 3 结论
研究了四苯基乙烯衍生物Model-TPE的光物理性质,该化合物具有典型的AIE性质。利用稳态荧光光谱、1HNMR、质谱以及高效液相色谱等手段,研究了Model-TPE光化学反应。有氧条件下,TPE发色团在紫外光照射下发生光氧化关环反应,生成二苯基取代菲衍生物,提出了TPE发色团光氧化关环反应机理。本工作对TPE衍生物在发光及传感领域的应用有一定的指导意义。
| [1] | Hong Y N, Lam J W Y, Tang B Z. Aggregation-induced emission[J]. Chemical Society Reviews, 2011, 40 (11):5361-5388. |
| [2] | Zhao Z J, Chen S M, Deng C M, Lam J W Y, Chan C Y K, Lu P, Wang Z M, Hu B B, Chen X P, Lu P, Kwok H S, Ma Y G, Qiu H Y, Tang B Z. Construction of efficient solid emitters with conventional and AIE luminogens for blue organic light-emitting diodes[J]. Journal of Materials Che-mistry, 2011, 21 (29):10949-10956. |
| [3] | Huang J, Jiang Y B, Yang J, Tang R L, Xie N, Li Q Q, Kwok H S, Tang B Z, Li Z. Construction of efficient blue AIE emitters with triphenylamine and TPE moieties for non-doped OLEDs[J]. Journal of Materials Chemistry C, 2014, 2 (11):2028-2036. |
| [4] | Tamai N, Miyasaka H. Ultrafast dynamics of photochromic systems[J]. Chemical Reviews, 2000, 100 (5): 1875-1890. |
| [5] | Jorgensen K B. Photochemical oxidative cyclisation of stilbenes and stilbenoids-the mallory-reaction[J]. Molecules, 2010, 15 (6): 4334-4358. |
| [6] | Huang G X, Ma B D, Chen J M, Peng Q, Zhang G X, Fan Q H, Zhang D Q. Dendron-containing tetraphenylethylene compounds: dependence of fluorescence and photocyclization reactivity on the dendron generation[J]. Chemistry-A European Journal, 2012, 18 (13):3886-3892. |
| [7] | Banerjee S. Synthesis and characterization of novel hyperbranched poly(arylene ether) from a AB(2) monomer[J]. Journal of Polymer Materials, 2007, 24 (3):247-254. |
| [8] | Hong Y N, Lam J W Y, Tang B Z. Aggregation-induced emission: phenomenon, mechanism and applications[J]. Chemical Communications, 2009, (29): 4332-4353. |
| [9] | Petek H, Yoshihara K, Fujiwara Y, Zhe L, Penn J H, Frederick J H. Is the nonradiative decay of S-1 Cis-stilbene due to the dihydrophenanthrene isomerization channel-suggestive evidence from photophysical measurements on 1,2-diphenylcycloalkenes[J]. Journal of Physical Chemistry, 1990, 94 (19):7539-7543. |
| [10] | Momotake A, Arai T. Photochemistry and photophysics of stilbene dendrimers and related compounds[J]. Journal of Photochemistry and Photobiology C-Photochemistry Reviews, 2004, 5 (1): 1-25. |




