2. 中国科学院 理化技术研究所 光化学转换与功能材料重点实验室, 北京 100190
2. Key Laboratory of Photochemical Conversion and Optoelectronic Materials, TIPC, CAS, Beijing 100190, P.R.China
生命体中存在多种多样的超分子自组装,对于生命体的功能起着重要的作用,这种自组装通常能提供高度有序的微环境并具有特殊的结构,比如酶、生物膜等就是生命体在长期进化过程中存留下来的典型范例。通过分子自组装形成超分子功能体系,受到了越来越多化学家的关注和研究。各类超分子主体,比如冠醚、环糊精、葫芦脲和环联吡啶等都可以用来构建超分子体系,其中环糊精以其无毒、生物降解性、对光无吸收等优良性能而受到广泛的关注[1,2,3,4,5,6,7,8]。
轮烷(rotaxane)是一个或多个环状分子与一个或多个线型分子通过非共价键连接在一起的超分子体系,其链分子作为轴穿过环状分子的空腔,线型分子的两端用体积较大的基团封端以防止轴分子的滑出,从而形成稳定的轮烷结构[9, 10]。相应的没有封端的超分子配合物则称为准轮烷。若线型分子为长链高分子聚合物,则可以有多个环状分子“串”在轴分子上,这样形成的超分子配合物一般被称为多聚准轮烷,对线型高分子封端后的配合物则被称为多聚轮烷。环糊精的外亲水内疏水的特性可以有效地包结疏水性的小分子和高分子,构建成轮烷或高分子轮烷。
Ritter等[11]首先报道了侧链轮烷的合成,首先预制备了单端封闭化的假轮烷中间体,然后端基的氨基和聚丙烯酸反应,制备出新型的侧链化轮烷结构。通过类似的合成步骤,Ritter制备了一系列的分子结构,并进行了广泛研究。同时,Yamamoto等[12]也合成了类似的侧链轮烷,不同的是他们使用的是聚苯并咪唑为主链,端基三苯甲烷的溴代烷基链为侧链反应分子的轮烷结构,研究了侧链间隔空间对环糊精传入率的影响,由于空间效应,当间隔空间越大的时候,越多的环糊精分子容易被侧链轴分子穿入而形成侧链式轮烷。Wei等[13]报道了星形的侧链轮烷,以苯乙醇取代的卟啉为核心,在辛酸锌的催化下,以端羟基为起始端,己内酯开环聚合为聚酯而形成四条臂的星形轴分子,和α-CD构成了星形的轮烷结构。对于轴分子,轮烷有着更强的荧光信号,可以应用在分子显像或者生物探针方面。Harada等[14]合成了侧链为己烷偶氮苯或十二烷偶氮苯的聚丙烯酸,然后在水性条件下将环糊精单向包合在侧链上生成侧链聚轮烷。
本文合成了侧链含C7、Azo两个疏水基团修饰的聚合物4,并基于α-CD、β-CD与两个疏水基团C7、Azo的不同结合能力,制备了含两个识别点的侧链准聚轮烷。并以紫外-可见光谱、圆二色谱、二维核磁谱等手段研究了侧链准聚轮烷的制备。 1 实验部分 1.1 试剂和仪器
试剂:偶氮苯-4-苯甲酸(Aldrich公司);4,7,10-三氧-1,13-十三烷二胺(DEG,TCI公司);苯并三唑-1-三(三甲氨基)-三氟磷酸酯(BOP,Sigma公司);二环己基碳二亚胺(DCC,Aldrich公司);1-羟基苯并三唑(HOBt,Aldrich公司);8-(Boc-氨基)羊脂酸(Aldrich公司);三氟乙酸(TFA,Aldrich公司);聚丙烯酸(PAA,Mw=25000,和光纯药株式会社);4-(4,6-二甲氧基三嗪)-4-甲基吗啉盐酸盐(DMT-MM,Aldrich公司);8-氨基辛酸(Sigma公司); α-环糊精(α-CD,TCI公司);β-环糊精(β-CD,TCI公司);其它试剂和溶剂均购于北京化工厂,溶剂使用前均经干燥处理,水溶液均使用去离子水配置。
仪器:JEOL ECA 500核磁共振波谱仪,VARIAN UNITY-600核磁共振波谱仪,Finnigan MAT 95 (San Jose,CA) model LCQ ion-trap质谱仪,Hitachi U-3900紫外-可见光谱仪。 1.2 聚合物4的合成
按照文献[15]合成化合物1、2、3。偶氮苯-4-苯甲酸(5.67 g,25.1 mmol)与BOP(19.5 g,37.5 mmol)溶于400 mLDMF中,在上述溶液中加入10.5 mL(75.4 mmol)三乙胺及DEG(5.5 g,25.0 mmol),室温搅拌10 h,反应结束后,将溶液过滤,浓缩,溶解在氯仿里,用硅胶柱色谱分离,得红色固体8.01 g,为化合物1,产率为78%。1HNMR (DMSO-d6,30 ℃,500 MHz): 8.60 (t,1H),8.05 (td,2H),7.96~7.92 (m,4H),7.65~7.59 (m,2H),7.16 (m,1H),3.55~3.30 (m,14H),2.55 (t,2H),1.72~1.76 (m,4H).ESI-MS: 451.5 [M+Na] +。
称取化合物1(8.01 g,18.7 mmol)溶于200 mL DMF中,冰浴冷却至0 ℃,加入DCC(5.4 g,25.5 mmol)和HOBt(3.6 g,25.5 mmol),在 0 ℃搅拌1 h后,撤去冰浴,继续在室温搅拌8 h。反应结束后,过滤,滤液经浓缩后干燥。将粗产物溶于0 ℃的TFA (H2O/TFA=1/9 (v/v),60 mL)溶液中,搅拌0.5 h后,将滤液浓缩。溶解在氯仿里,用硅胶柱色谱分离,得红色固体6.92 g,为化合物3,产率为65 %。1HNMR (DMSO-d6,30 ℃,500 MHz): 8.60 (t,1H),8.05 (td,2H),7.96~7.92 (m,4H),7.65~7.59 (m,2H),7.16 (m,1H),3.60~3.10 (m,16H),2.55 (t,2H),2.03 (t,2H),1.79 (m,4H),1.60 (m,4H),1.60 (m,6H). ESI-MS: 569.6 [M+Na] +。
将化合物3 (0.16 g,0.28 mmol)及PAA (0.34 g,PAA单体单元为4.7 mmol)溶于50 mL DMF中,冰浴冷却至0 ℃,加入DCC(1.1 g,5.1 mmol)和HOBt(0.72 g,5.1 mmol),在 0 ℃搅拌1 h后,撤去冰浴,继续在室温搅拌8 h。反应结束后,滤液经浓缩后干燥后溶于少量水中,滤去不溶物,用截留分子量MWCO=5000 的透析袋透5 d 除去未反应小分子,冷冻干燥得到产物0.3 g,为聚合物4,产率60%。1HNMR 测得聚合物中侧链偶氮部分含量为4%。
合成路线见式1。
 | 式1 聚合物4的合成 Synthesis procedure of polymer 4 |
光顺-反异构化循环实验: 用Hitachi U-3900紫外-可见光谱仪测定化合物的紫外-可见吸收光谱。用波长365 nm的紫外光光照聚合物4的溶液,记录光照时间t时聚合物4在338 nm处的吸光度,达到光稳态后,改用430 nm的可见光光照溶液,记录在光照时间t时测定溶液在338 nm处的吸光度,依次循环。 2 结果与讨论 2.1 模型化合物与α-CD、β-CD结合常数的计算
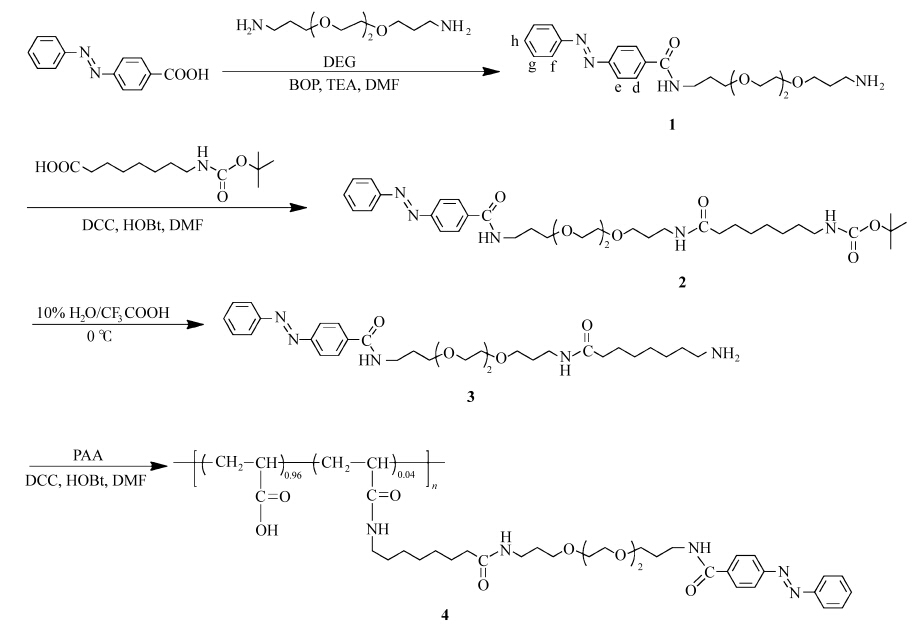
首先测定了α-CD、β-CD与模型化合物8-氨基辛酸及1的结合常数。图1为不同α-CD浓度下8-氨基辛酸的1HNMR核磁图,随着α-CD浓度的增加,A、B、B’、C、C’、D的质子峰逐渐变宽,并且化学位移逐渐向低场移动。表明α-CD可以与8-氨基辛酸发生包结作用。以质子A、B、B’化学位移变化的倒数(1/Δδobs)与α-CD浓度的倒数(1/cCD)作图(图1B),从图中可以看出,两者呈现很好的线性关系,表明8-氨基辛酸可以与α-CD形成1∶1的包结物。并根据公式1的Benesi-Hildebrand方程计算得两者间的结合常数为7.4×101 mol-1·L。而对于不同α-CD浓度下8-氨基辛酸的1HNMR核磁图则由于烷基链部分质子的化学位移移动幅度不大,表明两者之间相互作用很弱,结合常数无法精确测定。
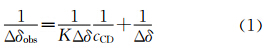
 | 图1 (A)不同α-CD浓度下,1.0 mmol/L 8-氨基辛酸的1HNMR核磁图,溶剂D2O, cCD: 0、5.0、10.0、15.0、 20.0、30.0、 40.0 mmol/L; (B) 8-氨基辛酸与α-CD的Benesi-Hildebrand图 1HNMR spectra of 1 mmol/L 8-Aminooctanoic acid in the presence of various concentration of α-CD, cCD: 0、5.0、10.0、15.0、 20.0、30.0、 40.0 mmol/L; (B) Benesi-Hildebrand plot of 8-Aminooctanoic acid and α-CD |
在构筑侧链准聚轮烷的过程中,其中一个识别点为偶氮苯(Azo),Azo具有优异的顺-反光异构特性,因此考察了光异构前后α-CD、β-CD与模型化合物1的主客体相互作用。测定了不同α-CD、β-CD浓度下模型化合物1光异构前的1HNMR图。以Azo质子化学位移变化的倒数(1/Δδobs)与α-CD、β-CD浓度的倒数(1/cCD)作图,从图2中可以看出,两者呈现很好的线性关系,表明光异构前trans-Azo基团可以与α-CD、β-CD均可以形成1∶1的包结物,并计算出α-CD、β-CD与trans-Azo的结合常数分别为2.0×103 mol-1·L和8.3×102 mol-1·L。
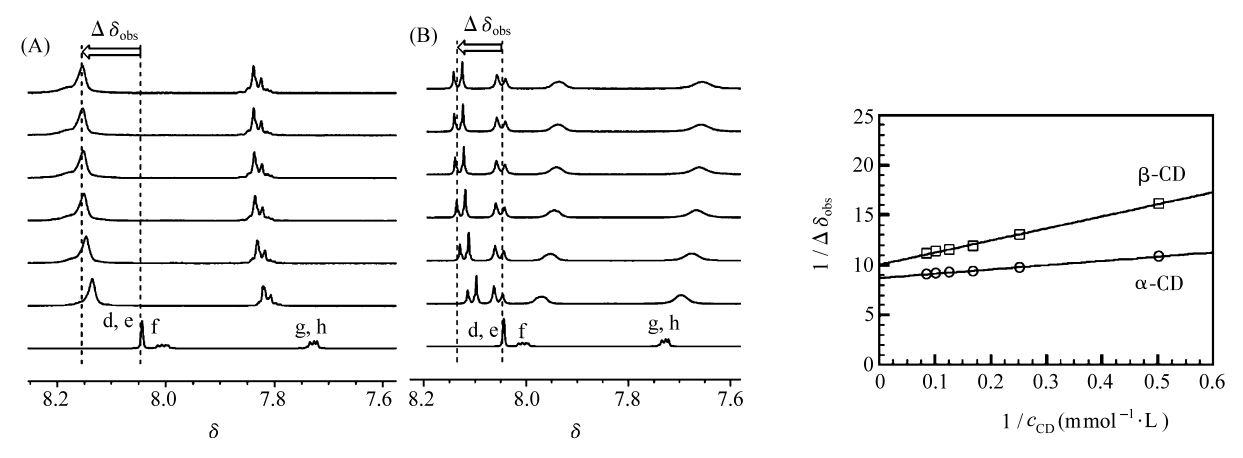 | 图2 0.8 mmol/L模型化合物1与α-CD,β-CD的核磁图(A,B)及Benesi-Hildebrand图 溶剂DMSO-d6和D2O (v∶v=1∶9),cCD: 0、2.0、4.0、6.0、8.0、10.0、12.0 mmol/L 1HNMR spectra of model compound 1 with α-CD and β-CD (A,B),and Benesi-Hildebrand plot,cCD: 0,2.0,4.0,6.0,8.0,10.0,12.0 mmol/L |
Azo具有优异的光异构特性,因此考察了α-CD、β-CD与光异构后模型化合物cis-1的主客体相互作用。在365 nm紫外光的光照下,约有91%的trans-Azo异构为cis-Azo,利用1HNMR谱测定了α-CD、β-CD与模型化合物中cis-Azo基团的结合常数。分别以质子f及d化学位移变化的倒数(1/Δδobs)与α-CD及β-CD浓度的倒数(1/CCD)作图,从图中可以看出,两者呈现很好的线性关系,表明cis-Azo基团可以与α-CD、β-CD均能形成1∶1的包结物,通过计算得到α-CD、β-CD与cis-Azo的结合常数2.1×101 mol-1·L和5.0×102 mol-1·L。
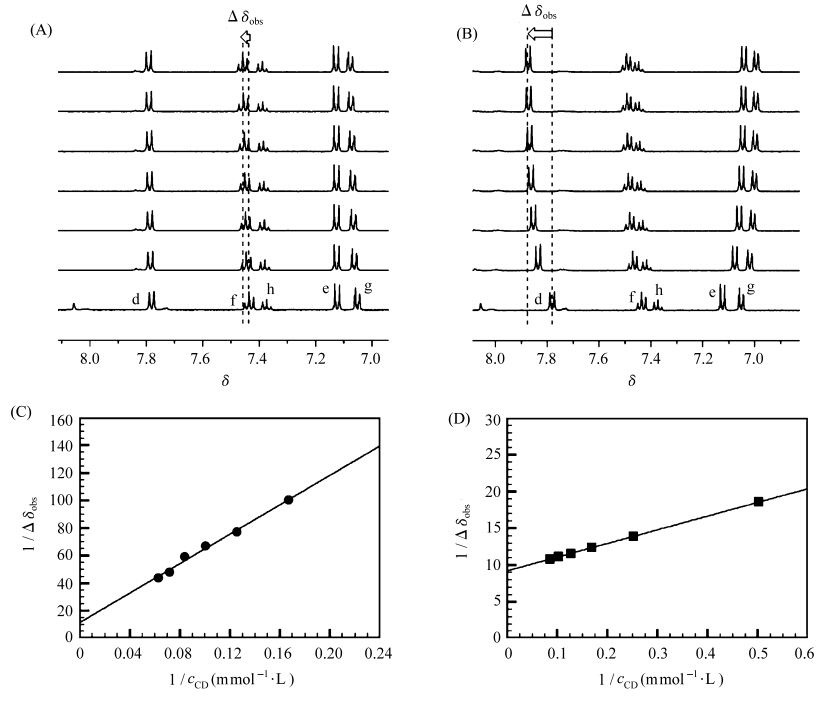 | 图3 α-CD、β-CD与0.8 mmol/L cis-1的核磁图(A,B)及Benesi-Hildebrand图(C,D) 溶剂DMSO-d6和D2O (v∶v=1∶9),cCD: 0、2.0、4.0、6.0、8.0、10.0、12.0、14.0、16.0 mmol/L 1HNMR spectra of 0.8 mmol/L cis-1 in the presence of various concentration of α-CD,β-CD,cCD: 0、2.0,4.0,6.0,8.0,10.0,12.0,14.0,16.0 mmol/L |
表1列出了α-CD、β-CD与模型化合物8-氨基辛酸及1光异构前后的结合常数。
| 表1 α-CD、β-CD与模型化合物8-氨基辛酸及1的结合常数 The association constant of 8-Aminooctanoic acid and compound 1 with α-CD and β-CD |
制备侧链准聚轮烷的第一步是将α-CD加入到聚合物4的溶液中,并且由于α-CD与烷基链C7的结合常数(K=7.4×101 mol-1·L)并不大,在溶液中加入过量的α-CD是必要的,因此将α-CD的浓度固定为12.0 mmol/L。
图4为聚合物4及α-CD的圆二色谱(cd)图,谱图中trans-Azo的n-π* 和π-π*跃迁分别诱导了负的和正的圆二色性,表明α-CD包结在了trans-Azo的部分[16]。该结果也得到2D NOESY核磁 图的佐证。图5为聚合物4与α-CD的2D NOESY核磁图,从图中看出,偶氮苯基团的的质子(d,e,f,g,h)以及烷基基团C7的质子(a,b,c)与α-CD空腔内的H3、H5质子有明显的交叉峰,表明α-CD可以分别包结在Azo及C7两个识别点。
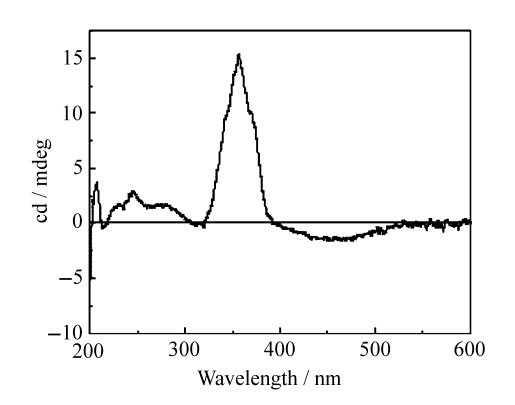 | 图4 0.10 mmol/L 聚合物4与12.0 mmol/L α-CD的混合溶液cd谱cd spectra of 0.10 mmol/L polymer 4 with 12.0 mmol/L α-CD |
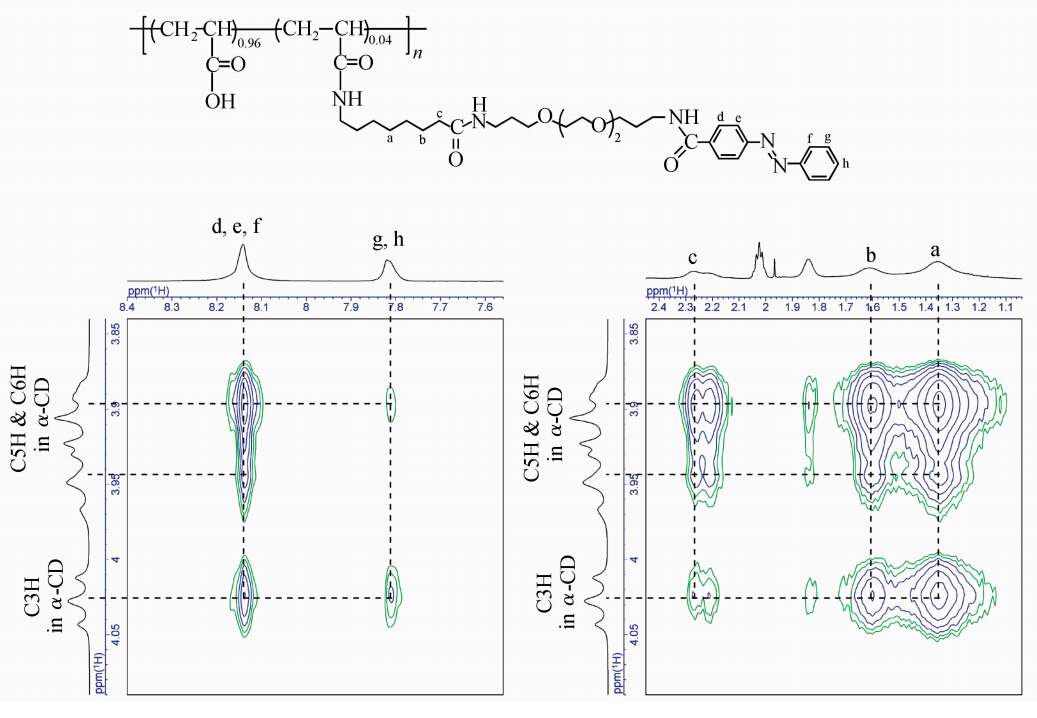 | 图5 1.0 mmol/L 聚合物4与12.0 mmol/L α-CD的2D NOESY核磁图 在5.0 mmol/L NaHCO3/Na2CO3缓冲溶液中测试,温度30 ℃,混合时间200 ms 2D NOESY NMR spectra of 1.0 mmol/L polymer 4 with 12.0 mmol/L α-CD,30 ℃,mixed time 200 ms |
制备侧链聚轮烷的第二步是通过trans-Azo基团异构后成为cis-Azo将α-CD锁在聚合物4的侧链上[17, 18]。测定了聚合物4加入12.0 mmol/L α-CD后的随光照时间的紫外可见(UV-Vis)光谱图,如图6所示。从图中可以看出,随着光照的进行,Azo基团在338 nm左右的吸光度逐渐下降,而在430 nm处的吸光度逐渐升高。图7为聚合物4与α-CD混合物光异构后(cis-4/α-CD)的2D NOESY核磁图,图中可以很清晰地看到烷基C7质子与α-CD的H3、H5之间的交叉峰,而没有cis-Azo质子与α-CD的H3、H5之间的交叉峰。这些结果综合显示,形成了侧链聚轮烷。
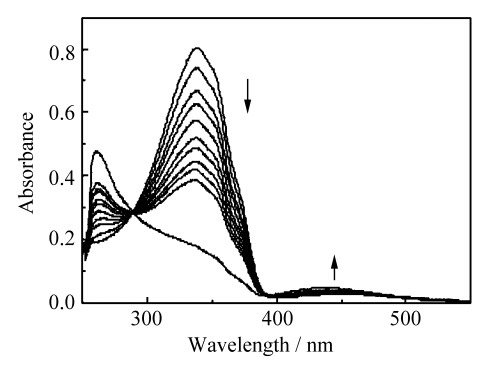 | 图6 0.10 mmol/L聚合物4加入12.0 mmol/L α-CD 的UV-Vis图谱 在5.0 mmol/L NaHCO3/Na2CO3缓冲溶液中测试,温度30 ℃,混合时间200 ms UV-Vis spectra of 0.10 mmol/L polymer 4 after adding the 12.0 mmol/L α-CD |
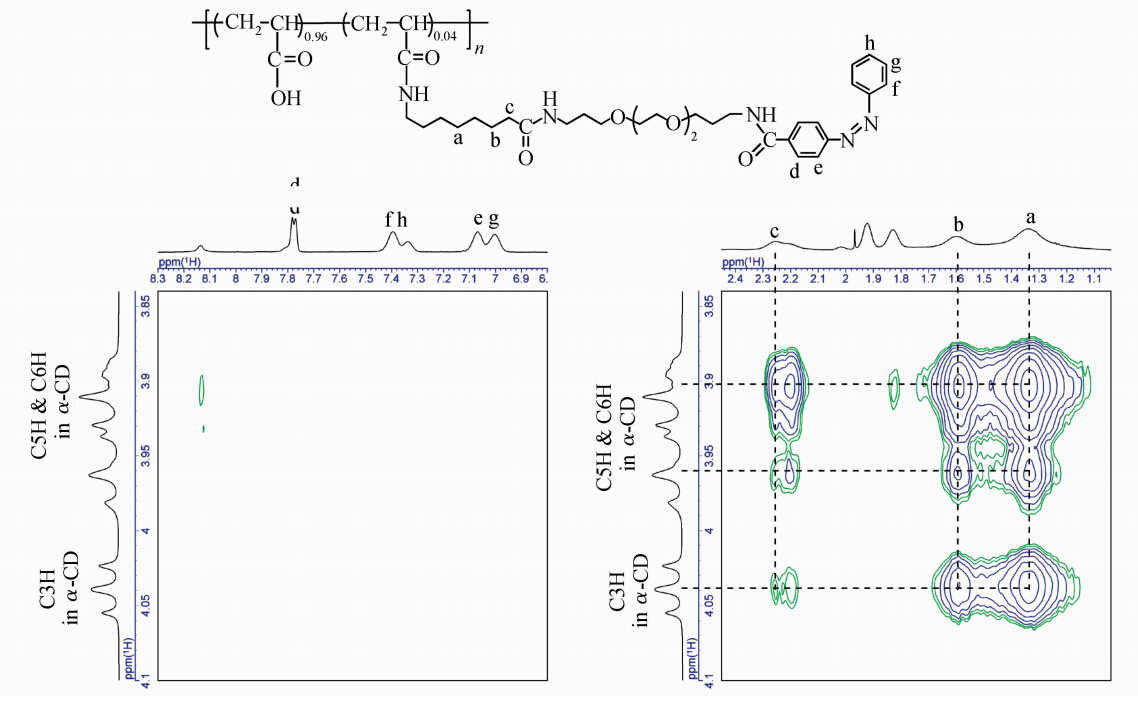 | 图7 1.0 mmol/L 聚合物4与12.0 mmol/L α-CD在365 nm紫外光光照后的2D NOESY核磁图 在5.0 mmol/L NaHCO3/Na2CO3缓冲溶液中测试,温度30 ℃,混合时间200 ms 2D NOESY NMR spectra of 1.0 mmol/L polymer 4 with 12.0 mmol/L α-CD after photoirradiation at 365 nm,30 ℃,mixed time 200 ms |
制备侧链异-准聚轮烷的最后一步是在cis-4/α-CD混合溶液中加入β-CD,β-CD包结在聚合物4的cis-Azo部分。图8为cis-4/α-CD混合溶液中加入β-CD后的2D NOESY核磁图,从图中看出,烷基C7的质子(a,b,c)与α-CD的空腔内的H3、 H5质子有明显的交叉峰,cis-Azo的质子(e、f、g、h)与α-CD空腔内的H3、H5有明显的交叉峰。表明α-CD与β-CD分别包结在聚合物4侧链的两个识别点C7及Azo部分。制备的侧链准聚轮烷示意图如图式2所示。
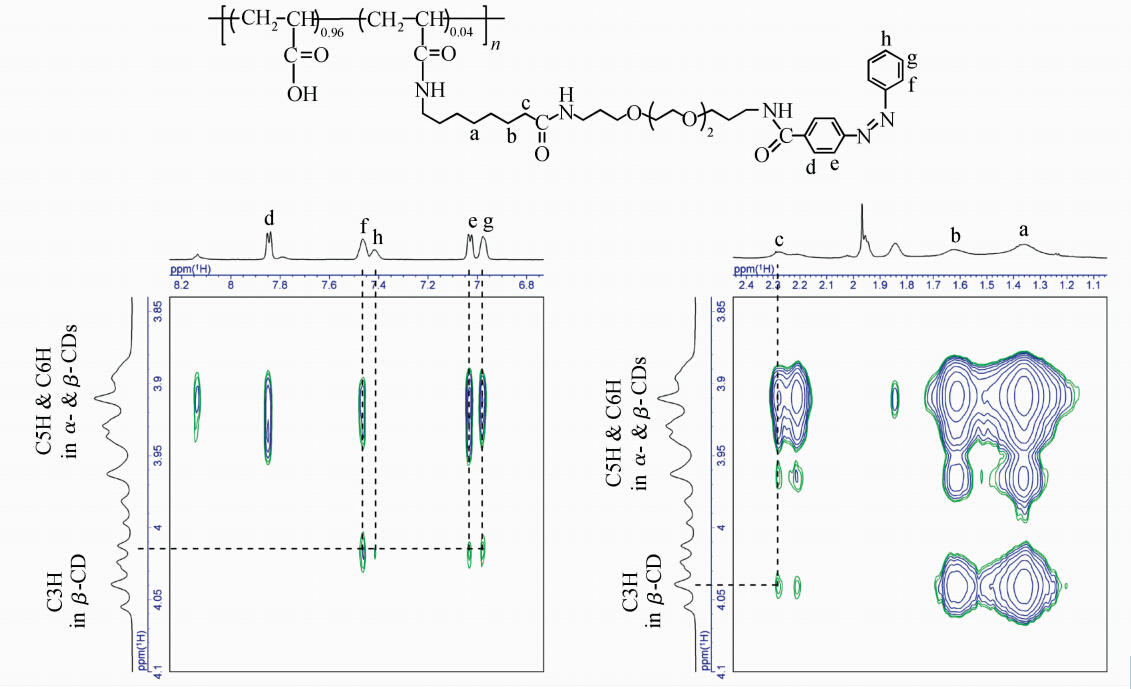 | 图8 6.0 mmol/L β-CD与cis-4/α-CD的2D NOESY核磁图 在5.0 mmol/L NaHCO3/Na2CO3缓冲溶液中测试,温度30 ℃,混合时间200 ms 2D NOESY NMR spectra of cis-4/α-CD with 6.0 mmol/L β-CD,30 ℃,mixed time 200 ms |
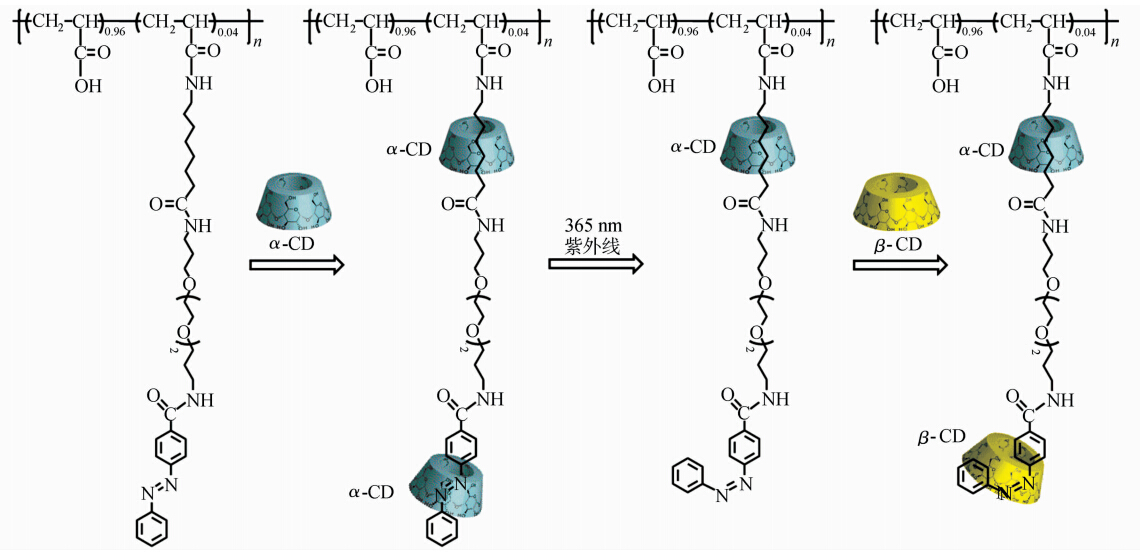 | 式2 侧链准聚轮烷示意图 Illustration of side-chain polypseudorotaxane |
通过1HNMR的方法测定了α-CD、β-CD与模型化合物8-氨基辛酸及1的结合常数,并合成了侧链含两个疏水基团C7及Azo的水溶性聚合物4,基于α-CD、β-CD与C7及Azo的不同结合能力,通过三步法合成了侧链准聚轮烷。首先,在聚合物4的溶液中加入α-CD、β-CD分别包结在 C7及Azo部分;第二步,在365 nm的紫外光光照下,trans-Azo异构为cis-Azo,α-CD从Azo部分解离,但包结在C7部分的α-CD仍保留;第三步,在cis-4/α-CD溶液中加入β-CD,β-CD包结在cis-Azo部分,制备了侧链含两个识别点的侧链准聚轮烷。环糊精与支链大分子组装的研究,拓展了聚轮烷的研究范围,发现了许多与直链大分子组装所不具备的奇异性质。对该类体系的深入研究将推动环糊精超分子结构的广泛应用。
| [1] | Murakami H, Kawabuchi A, Matsumoto R, Ido T, Nakashima N. A multi-mode-driven molecular shuttle: photochemically and thermally reactive azobenzene rotaxanes[J]. Journal of the American Chemical Society, 2005, 127: 15891-15899. |
| [2] | Coulston R J, Onagi H, Lincoln S F, Easton C J. Harnessing the energy of molecular recognition in a nanomachine having a photochemical on/off switch [J]. Journal of the American Chemical Society, 2006, 128: 14750-14751. |
| [3] | Ma X, Qu D H, Ji F Y, Wang Q C, Zhu L L, Xu Y, Tian H. A light-driven [1]rotaxane via self-complementary and Suzuki-coupling capping [J]. Chemical Communications, 2007, 1409-1411. |
| [4] | Nijhuis C A, Ravoo B J, Huskens J, Reinhoudt D N. Electrochemically controlled supramolecular systems [J]. Coordination Chemistry Reviews, 2007, 251: 1761-1780. |
| [5] | Champin B, Mobian P, Sauvage J P. Transition metal complexes as molecular machine prototypes [J]. Chemical Society Reviews, 2007, 36: 358-366. |
| [6] | Bonnet S, Collin J P. Ruthenium-based light-driven molecular machine prototypes: synthesis and properties [J]. Chemical Society Reviews, 2008, 37: 1207-1217. |
| [7] | Credi A. Artificial molecular motors powered by light [J]. Austrilian Journal of Chemistry, 2006, 59: 157-169. |
| [8] | Wu J, Leung K C F, Ben ltez D, Han J Y, Cantrill S J, Fang L, Stoddart J F. An acid base-controllable [c2]daisy chain [J]. Angewandte Chemie International Edition, 2008, 47: 7470-7474. |
| [9] | Sauvage J P, Dietrich-Buchecker C. Catenanes, Rotaxanes and Knots. A Journey Through the World of Molecular Topology[M].Wiley-VCH: Weinheim, 1999. [ZK)] |
| [10] | Blanco M J, Jiménez-Molero M C, Chambron J C, Heitz V, Linke M, Sauvage J P. Rotaxanes as new architectures for photoinduced electron transfer and molecular motions [J]. Chemical Society Reviews, 1999, 28: 293-305. |
| [11] | Born M, Ritter H. Pseudo-polymer analogous reactions: Methylation of alcohol groups of non-covalently anchored 2,6-dimethyl-β-cyclodextrin components located in branched side chains of a poly(tandem-rotaxane) [J]. Advanced Materials, 1996, 8: 149-151. |
| [12] | Yamaguchi I, Osakada K, Yamamoto T. Introduction of a long alkyl side chain to poly(benzimidazole)s. N-Alkylation of the imidazole ring and synthesis of novel side chain polyrotaxanes [J]. Macromoleculars, 1997, 30: 4288-4294. |
| [13] | Dai X, Dong C, Fa H, Yan D, Wei Y. Supramolecular polypseudorotaxanes composed of star-shaped porphyrin-cored poly(ε-caprolactone) and α-cyclodextrin [J]. Biomacromoleculars, 2006, 7: 3527-3533. |
| [14] | Tomatsu I, Hashidzume A, Harada A. Cyclodextrin-based side-chain polyrotaxane with unidirectional inclusion in aqueous media [J]. Angewandte Chemie International Edition, 2006, 45: 4721-4724. |
| [15] | Li S J, Taura D, Hashidzume A, Takashima Y, Yamaguchi H, Harada A. Light-switchable janus [2]rotaxanes based on α-cyclodextrin derivatives bearing two recognition sites linked with oligo(ethylene glycol) [J]. Chemistry-An Asian Journal, 2010, 5: 2281. |
| [16] | Kodaka M. Application of a general rule to induced circular dichroism of naphthalene derivatives complexed with cyclodextrins [J]. The Journal of Physical Chemistry A, 1998, 102: 8101-8103. |
| [17] | Sarvothaman M K, Ritter H. Discriminating influence of α- and methylated β-cyclodextrins on complexation and polymerization of diacrylate and dimethacrylate monomers [J]. Macromolecular Rapid Communications, 2004, 25: 1948-1952. |
| [18] | Yamaguchi I, Osakada K, Yamamoto T. Introduction of a long alkyl side chain to poly(benzimidazole)s. N-alkylation of the imidazole ring and synthesis of novel side chain polyrotaxanes [J]. Macromolecules, 1997, 30:4288-4294. |




