2. 中国科学院 化学研究所 胶体、界面与化学热力学院重点实验室, 北京 100190
2. CAS Key Laboratory of Colloid Interface and Chemical Thermodynamics, Institute of Chemistry, Chinese Academy of Sciences, Beijing 100190, P. R. China
超分子自组装提供了一种自下而上并且可控的方法,可以便捷地构筑具有多种结构或功能的纳米材料,一直以来得到了研究者们的广泛关注,为创造新物质与新材料开拓了发展空间。而超分子凝胶,作为超分子自组装重要的研究方向之一,因其独特的响应特性和物理化学性质已成为目前的一大研究热点,在有机纳米结构材料的制备、无机材料合成、生物医学、光电功能材料、催化等领域具有广阔的应用前景[1,2,3,4]。
超分子凝胶,主要是指低分子量胶凝剂分子(具有明确结构式和确定分子量)通过协同的非共价相互作用力在溶剂介质中自组装形成交联的三维网络结构后得到的一种软物质材料。在超分子凝胶中,仅仅需要相当少量的胶凝剂(质量分数大约小于5%)便能将大量的溶质液体束缚和固定住,与超分子凝胶相关的很多应用的设想和发现都是基于它的这种特性。前面提到的非共价键相互作用即为超分子凝胶形成的主要驱动力,通常包括氢键作用、主客体作用、π-π堆积作用、配位作用、静电作用、亲疏溶剂作用等。一方面,这些非共价相互作用能够协同作用使得凝胶能够维持住三维网络结构,另一方面,非共价相互作用与生俱来的较弱性以及可逆性,又能使凝胶能够对外界刺激做出一定的反应。例如,很多超分子凝胶具有热响应性,在给定的温度下可以发生凝胶到溶液状态的转变,高于凝胶溶液转变温度(Tgel-sol)时维持凝胶稳定的非共价相互作用受到破坏,凝胶转变为溶液,冷却后非共价相互作用恢复,又可以再次形成凝胶。
因此,在超分子凝胶体系中引入外界刺激,例如金属离子、阴离子、改变pH值、光、电场或超声处理等,有可能会改变超分子凝胶的物理或化学性质,实现其刺激响应性,从而制备许多有趣的智能材料[5]。其中,光响应的超分子凝胶自组装体系一般能够发生光化学反应,如光致异构反应和光致聚合反应[6]等。超分子凝胶中的光化学反应的分类及应用示意图如图1所示。
 | 图1 超分子凝胶中的光化学反应的分类及其应用示意图 The classification and applications of photochemical reactions in supramolecular gels |
一般来说,光化学反应的过程中不会引入其它的化学物质,反应结束后也不会产生额外的废物,且在溶液或者晶体的状态下发生光化学反应是比较常见的现象。凝胶状态下的光化学反应不仅具有在溶液或晶体状态下的反应特点,而且具有凝胶态的独特性,其光化学反应会伴随产生相变化或组装形貌变化,进而带来性质和功能的转变。更有意思的是,很多光化学反应对两种不同波长的光都有响应,从而可用于构筑具有可逆光化学反应的超分子凝胶体系。因此,研究超分子凝胶中的光化学反应有着十分重要的科学意义。 2 超分子凝胶中的光化学反应
在超分子凝胶的设计中,或者设计光响应取代基团的小分子胶凝剂,或者直接引入光响应分子作为第二组分,在紫外光或可见光照射下进行光致变色或光聚合反应,同时伴随着凝胶与溶液的相转变或是吸收与荧光光谱的显著变化。作为新型的功能性材料,这类小分子凝胶在光信息存储、光开关及光转换器件等前沿领域具有广阔的应用前景。超分子凝胶中的光化学反应主要包括光致异构(光致变色)反应、光聚合反应和拓扑化学反应。 2.1 超分子凝胶的光致变色反应
能够发生光致变色反应的超分子凝胶往往带有光致异构官能团,如偶氮苯、螺吡喃和二芳基乙烯等,在特定的波长下发生光致变色反应,体系的光谱会发生明显的变化,有些体系甚至可以直接用肉眼观察到颜色的差异。
偶氮苯是典型的光敏感型物质,其光致变色特性是分子内的氮氮双键在光或热的作用下发生顺反异构而产生的(过程如图2[7]所示)。采用不同波长的光对偶氮化合物进行照射,使其在顺反两种异构体间进行可逆的转变。由于顺式的偶氮苯结构是热力学不稳定的构型,光照结束后得到的顺式结构放置一段时间会自发恢复到热力学稳定的反式结构。含有偶氮苯基团的有机凝胶因子很多,但只有少部分能够形成光致可逆的有机凝胶。这是因为在凝胶状态下,偶氮苯基团的顺反异构会受到抑制,因此研究含有偶氮苯基团的超分子凝胶体系具有重要意义。此外,含有偶氮苯基团的超分子凝胶在紫外光照射下往往会发生凝胶到溶液的相转变,这是偶氮苯类的超分子凝胶体系区别于其他光致变 色超分子凝胶的一个重要的特点,通过判断相转变的程度可以粗略地估计光致异构反应的程度。
 | 图2 偶氮苯类化合物光致变色过程示意图 The structural change of azobenzene in the photochromic progress |
Kim等报道了含有偶氮苯基团的不对称双树枝状胶凝剂分子1[8],可以胶凝化多种有机溶剂,在环己烷中临界成胶浓度低至0.02% (质量分 数)。当使用365 nm的紫外光对1的环己烷凝胶进行照射时,偶氮苯基团发生由反式到顺式的异构化,位于321 nm 处反式偶氮基团的π-π* 吸收峰逐渐降低,而260 nm和450 nm附近分别归属于顺式异构体的π-π*和n-π* 吸收峰则逐渐升高。约2 min凝胶便发生坍塌,逐渐转变为溶液状态。随后用可见光照射溶液,仅需5 s凝胶便可重新构筑,对应吸收光谱上的反式异构体的π-π* 吸收峰升高。除了紫外可见光谱和相态发生改变,体系的自组装形貌也发生了相应的变化,实现了由凝胶状态的纤维状纳米结构到溶液状态无定形结构的转变。
 | 图3 胶凝剂分子1的结构式,紫外光(a)和可见光(b)照射引起吸收光谱及SEM图像(c,d)的可逆变化 Structure of gelator 1,absorption spectra change by UV (a) and visible light (b) with time,and the related reversible change of SEM images |
江明等[9]则通过超分子的方法实现了准聚轮烷(PPR)型水凝胶的光转换可逆。α-CD和PEG可以共组装成PPR型水凝胶,合成水溶性的偶氮吡啶盐,将AZO-N+与PPR型水凝胶混合,由于AZO与α-CD的结合能力比PEG与α-CD的结合能力要强的多,因此原来组装结构中的CD分子逐渐被拉出成为自由的链段,这一作用使得凝胶在几分钟内变为透明的溶液。紫外光照该溶液使得trans-AZO变为cis-AZO,失去与α-CD的结合能力,AZO-CD复合物解离,α-CD分子返回到PEG 链,几个小时后可以重新构筑水凝胶。可见光照射后,凝胶再次解散。这种光转换可逆的“凝胶—溶液—凝胶”转变可以通过三种组分主客体相互作用的竞争来实现,显示了包结络合控制材料的重要性和巨大的潜力(见图4)[10]。
 | 图4 三组分体系在紫外-可见光下的组装变化示意图 The assembly changes of three-component system under UV and visible light |
在光的作用下,一类常见的有机光致变色基团是上面提到的能发生顺反异构的偶氮苯和二苯乙烯,另一类是能发生闭环和开环反应的二芳基乙烯、螺吡喃、螺嗪、俘精酰亚胺等。
二芳基乙烯是一种非常高效的光致异构的染料分子,在合适光照射下化合物能够在不同吸收波长之间进行化学形式转换:可以在紫外光照射下发生开环反应,可见光照射下发生闭环反应。噻吩乙烯类化合物是这一类的典型代表,含有光致变色能力的基团引入到凝胶分子中,可以使凝胶分子能够进行光诱导可逆的结构异构化,使凝胶的颜色发生改变。
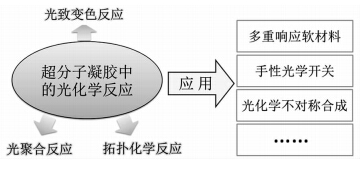
Feringa小组在这方面做出了很多突出的工作,将具有光致变色功能的二芳基乙烯基团与手性氨基酸相结合作为小分子有机胶凝剂[11,12],利用紫外/可见光照射、加热/冷却等物理变化,可以实现超分子体系的手性开关效应。最近,Feringa小组又报道了一种由光可逆的二芳基乙烯两亲分子2构成的新型刺激响应性材料[13],采用疏水的胆固醇和亲水的聚乙二醇连在吡啶基团来修饰二芳基乙烯分子。这种独特的两亲分子2在水或有机溶剂中自组装都能对光表现出可逆的刺激响应性。以水作溶剂时,紫外光照可以使其聚集形成囊泡,可见光照射使其可逆的形成双层膜结构。而在非极性的芳香性溶剂中,则可以自组装成凝胶,可以通过紫外-可见光照可逆的控制凝胶纤维的形成与解体,如图5所示。这样一来,既可以在水中又可以在有机溶剂中实现光调控超分子结构的可逆构筑。
 | 图5 两亲分子2凝胶体系中光调控的动态自组装行为 Dynamic self-assembly behavior of 2 in organogel upon light-induced switching |
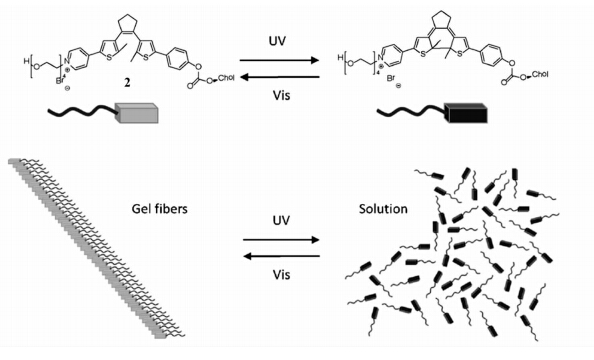
田禾研究组对二噻吩乙烯基类化合物进行了系统深入的研究,探索了二噻吩乙烯类光致变色材料分子数据存储、分子逻辑门、分子导线、非线性光开关等方面的诸多应用[14]。同时,在二噻吩乙烯基凝胶材料的研究方面也做了一些工作。例如,合成了以萘二酰胺为荧光响应基团的二噻吩乙烯类胶凝剂分子3[15],该化合物可使苯、甲苯、邻二甲苯等苯类溶剂形成稳定凝胶并在凝胶状态下表现出良好的光致变色特性,能形成具有光致变色性质的荧光型有机凝胶,光刺激下能够在开环和关环之间发生可逆的肉眼可见的颜色改变,可作为荧光可逆分子开关。如图6a所示,365 nm 的紫外光照下,无论在凝胶中还是溶液中,二噻吩乙烯都可以发生光致变色过程,由黄色的开环状态转变为红色的闭环状态。用可见光照射(>510 nm),凝胶或溶液又逐渐由红色转变为原来的黄色。同时,凝胶相和溶液相的转变又可以通过热刺激轻松地得到转变。又如,在含冠醚基团光响应二噻吩乙烯类超分子凝胶中[16],含冠醚基团的二噻吩乙烯分子4与卵磷脂钙形成二组分凝胶,在紫外/可见光照射下可逆地捕获和释放钙离子,伴随着可逆的凝胶-溶液转变(如图6b所示)。这一超分子凝胶有望在药物缓释方面有所应用。
 | 图6 化合物3(a)和4(b)的二噻吩乙烯凝胶在紫外可见光下的开关环转换 The photochromic process of 3 and 4 Gel under UV and visible light alternate irradiation |
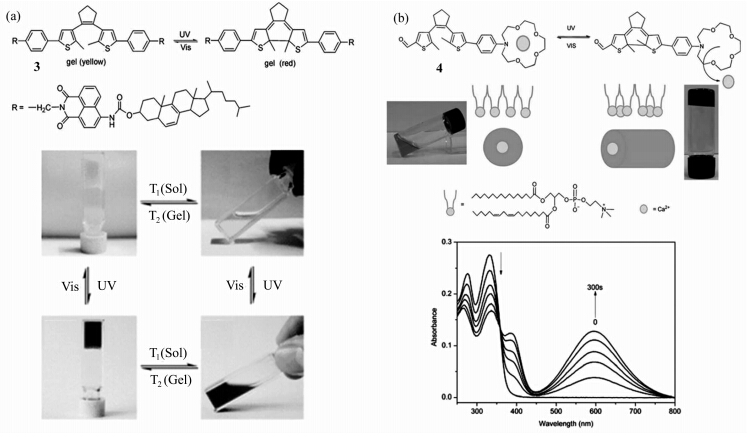
易涛研究组报道了一种萘酰亚胺类分子可以在非质子溶剂中形成凝胶,其自组装结构会随着不同的溶剂而发生改变[17]。加入含有三聚氰胺基团的二噻吩乙烯衍生物后,二者通过多重氢键相互作用形成超分子凝胶。在365 nm 紫外光照射下,二噻吩乙烯基团发生关环反应,对应的吸收光谱和荧光光谱随着光照时间的变化发生改变,如图7所示。由于闭环异构体具有大的π电子离域,490 nm处出现新的吸收带。此外,在关环异构体中,有效的分子间能量转移被允许,产生了强的荧光猝灭,365 nm的光照90 min后荧光猝灭达80%,并达到稳定状态。通过紫外/可见光的交替照射可以调控自组装体系的荧光、自组装形貌及其形成表面的湿润度等。这一工作为光控自组装材料的设计及应用提供了重要的参考意义。
 | 图7 复合物5的乙酸乙酯凝胶在紫外/可见光的作用下的吸收光谱(a)和荧光光谱(b)的变化 Absorption (a) and fluorescence (b) spectral changes of complex 5 in ethyl acetate upon irradiation of 365 nm light |
二芳基乙烯在365 nm 紫外光照射下可以发生闭环反应,在可见光照射下可以发生开环反应。与之相反,有机染料分子螺吡喃则在365 nm 紫外光照射下发生开环反应,而在可见光照射下则发生闭环反应。例如,Raghavan等[18]利用螺吡喃基衍生物掺杂制备了光可逆的流变凝胶(图8)。软磷脂和胆酸钠在环己烷中形成有机凝胶,向凝胶体系中加入光响应的螺吡喃基衍生物后,在可见光下螺吡喃基衍生物处于闭环状态(SP),与凝胶剂没有相互作用,凝胶性能保持;用紫外光照射,螺吡喃基衍生物发生开环,异构化为带电体部花菁(MC)束缚于软磷脂的头部,凝胶剂的静电作用发生变化,凝胶流变性能也发生变化。即由于螺吡喃基衍生物在可见/紫外照射下会发生可逆的结构变化,因此实现了光响应的凝胶可逆流变性。
 | 图8 螺吡喃基衍生物掺杂的凝胶体系光响应性 The photoresponsive property of spiropyran derivatives doped gel system |
张德清研究组和范青华研究组合成了螺吡喃功能化的树枝状分子6[19]。将热溶液冷却到30 ℃并用紫外光照射溶液,螺吡喃分子由闭环状态转变成开环的部花菁结构,并发射很强的红光。若将热的溶液直接冷却到0 ℃则会导致凝胶的形成,成胶的驱动力主要是分子间的π-π堆积作用。紫外光照不能破坏凝胶,但形成的紫蓝色凝胶也可以发射很强的红色荧光。并且这种凝胶的荧光发射能力可以用紫外-可见光的交替照射来控制(见图9)。紫外光照使凝胶发射很强的荧光,而可见光照后,凝胶荧光几乎消失。这项工作在荧光成像尤其是生物领域的荧光成像方面具有潜在的应用价值。
 | 图9 化合物6在365 nm紫外光及可见光下发生的光致变色反应及多次循环的荧光光谱 Photochromic reactions and fluorescence spectra of the gel of 6 before and after UV light (365 nm) irradiation |
另一类光反应凝胶主要发生的是光聚合反应,研究多为基于能聚合反应的联乙炔基团的凝胶。有序排列的联乙炔分子在加热或紫外光照射下,邻近的丁二炔键能够进行1,4加成反应,生成具有烯-炔键交替共轭骨架的聚联乙炔。聚联乙炔往往表现出一定的颜色,可见光激发共轭骨架的离域π电子,产生π-π*跃迁,使得聚联乙炔在可见光区有强烈的吸收而呈现出蓝色。在外界刺激影响下,聚合物骨架的构象发生改变,引起离域电子的状态变化,会使聚联乙炔的颜色变为红色(图10)[22]。因此,聚联乙炔骨架可直接作为光学传感器件[20,21],通过颜色的改变,可以有效地感知温度、pH等多种物理、化学及生物刺激。
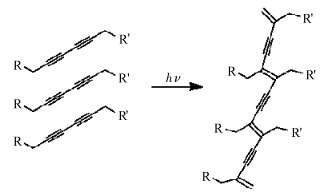 | 图10 联乙炔的光聚合反应示意图 Polymerization reaction of diacetylene |
Shinkai研究组在基于联乙炔的光活性小分子凝胶研究方向做了许多有意思的工作。譬如结构中心含有联乙炔基团的分子在形成凝胶后,经紫外光照射可以聚合变色,且聚合变色具有奇偶效应[23],如图11所示。当桥连的烷基链碳数是奇 数时,聚合后呈红色;碳数是偶数时,聚合后呈蓝色。这种奇偶效应的原因是由凝胶态中联乙炔不同的堆积结构造成的。
 | 图11 不同烷基链碳数的联乙炔胶凝剂分子聚合后的照片 Photo of gelator with different alkyl chain number after dimerization |
Morin课题组发展了含有联乙炔的化合物在凝胶体系中的自组装行为及光对其聚合反应的影响[24,25,26]。如图12a所示的苯乙炔大环化合物7中,大环骨架内外侧的联乙炔基团在紫外光照的情况下可以发生拓扑光化学聚合反应。乙酸乙酯中7进行柱状堆积从而形成凝胶,在干凝胶状态下,紫外光照时发生如图12a所示的1,4加成反应,得到了共价连接的纳米棒状结构。而如图12b所示的含三个丁二炔基团的星状分子8,通过自组装可以在甲苯、氯苯等有机溶剂中形成凝胶[25]。将其干凝胶置于紫外光下可得到由交联的聚丁二炔链组成的一维共轭的水溶性纳米线。发展具有不同或更多扩展的π-共轭核的星形分子,在制备低带隙纳米线方面具有潜在的价值[26]。
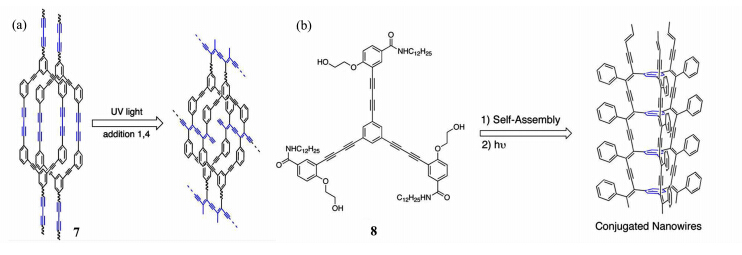 | 图12 干凝胶状态下,分子7和8的光聚合反应 The polymerization of molecule 7 and 8 in the dried gel state |
我们课题组则利用凝胶化诱导的方法,由非手性的联乙炔分子凝胶光聚合得到了具有光学活性的PDA聚合物[27],见图13。利用简单的混合成胶的方法,将非手性的PCDA 分子与手性的胶凝剂分子9混合得到共凝胶。在紫外光的存在下,共凝胶可以实现光聚合反应而形成PDA有机凝胶。如果不添加Zn(Ⅱ),则不能发生光聚合反应,但可以制备成干凝胶,实现光聚合。这一结果表明,Zn(Ⅱ)的加入促进了PCDA 的有序排列,有利于光照聚合的发生。虽然PCDA 单体没有手性,但是与胶凝剂分子混合后,经光聚合可以得到具有光活性的PDA,同时可以观察到螺旋的纤维结构。凝胶因子的手性转移到了PDA 聚合物主链上,从而导致左手性和右手性螺旋纤维的形成。利用这种方法制备得到PDA 的诱导手性很稳定,即使PDA 因环境改变而发生颜色变化,其诱导手性却能被完整地保留下来。该工作为光活性聚合物的制备提供了一种简单而高效的方法。
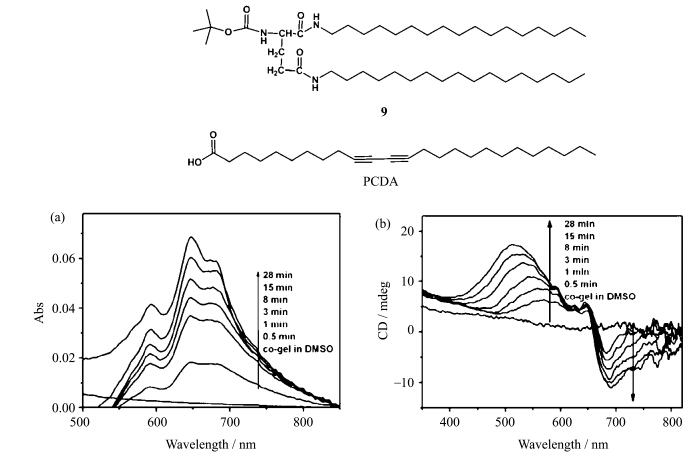 | 图13 共凝胶体系随紫外光照时间变化的UV-vis光谱(a)和CD光谱(b) UV-Vis (a) and CD (b) spectra of co-gel irradiated by UV 254 nm at various time |
邹纲等制备了带有光响应性的偶氮基团和联乙炔基团的胆固醇类有机凝胶,并研究了形貌调控、光开关和光聚合方面的特性[28]。研究发现胶凝剂分子最初的浓度对微观的自组装结构具有很大的影响。365 nm紫外光照后,部分反式构型的偶氮转变为顺式构型,吸收光谱如图14a所示,顺式和反式偶氮结构的分子10共组装形成了螺旋纳米结构。而254 nm紫外光照后,有机凝胶则可以发生光聚合反应,颜色由黄色变为红色,吸收光谱如图14b所示,且光聚合的凝胶对光刺激和热刺激表现出很强的稳定性。这项研究提供了一种新的构筑功能性螺旋结构的方法,而且通过自组装的方法合成联乙炔组装体具有很重要的价值。
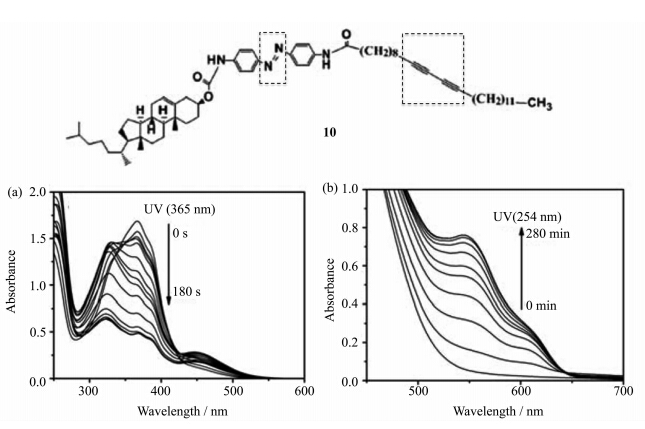 | 图14 凝胶10的UV-Vis光谱在365 nm(a) 和254 nm (b) 紫外光下随光照时间的变化 The chemical structure of gelator 10,and the variation of the UV-Vis spectra of the gel upon irradiation at 365 nm (a) and 254 nm (b) |
拓扑化学反应,例如烯烃的[2+2]光环化反应,是有机合成化学中比较独特的反应[29]。拓扑化学反应是通过局部化学反应或局部规整反应来制备固体材料的一种方法,运用这类反应常常可以得到由其它方法所不能得到或难以得到的固体材料,而且得到的这些材料具有独特的物理和化学性质及独特的结构形式。
在拓扑化学反应中,具有反应活性的功能基团之间分开的距离、彼此的取向和空间对称性都非常的重要。以烯烃的[2+2]光环化反应为例,头对头单体中邻近的相互平行的双键间距离需要满足0.39~0.41 nm,而头对尾排列形式邻近距离则需满足0.36~0.41 nm,才能按照拓扑化学原则进行[2+2]光聚合反应[30]。为了实现拓扑化学反应,分子或者功能性基团必须按照特定的方向和距离进行排列。因此,已报道的很多拓扑化学反应发生在分子高度有序排列的晶体[31,32]或Langmuir-Blodgett膜[33,34]上。凝胶是介于固态和液态的一个中间状态,分子排列的有序性远不如晶体或LB膜。在有机凝胶中,尽管胶凝剂分子能进行有序的组装,但是网络状结构周围环绕着大量的溶剂分子,这些溶剂分子能够微妙地影响官能团的堆积。所以,在凝胶中发生拓扑化学反应是非常有难度的。
我们通过大量的尝试,发现一种萘丙烯酸-L-谷氨酰胺衍生物11在乙醇的凝胶中能够发生拓扑光化学反应[35]。11在乙醇中形成的白色有机凝胶对光有一种独特的响应,只需要自然光光照8 h,凝胶就能完全转变成沉淀,然而其他溶剂中的有机凝胶非常稳定,对光没有任何响应。紫外、红外、XRD、质谱等各种测试结果证明,11的乙醇有机凝胶中发生了光触发的[2+2]拓扑化学环加成反应。以紫外可见光谱为例,如图15 a所示,原来凝胶中262 nm和271 nm处的两个尖峰逐渐平滑成一个峰,300 nm和310 nm的峰变平直至消失,同时324 nm处的新峰出现并逐渐变得明显,这些光谱的变化与乙醇凝胶中的拓扑化学反应直接相关。用SEM跟踪整个光照的变化过程,最初在凝胶中形成的是纤维状纳米结构(图15 b),随着光照时间的增加逐渐变化,最终得到一系列中空共轴的念珠状的纳米结构(图15 d),这种独特纳米结构的产生正是由凝胶中发生光触发的[2+2]拓扑化学环加成反应引起的。伴随着光聚合反应的进行,有机凝胶逐渐坍塌,最终完全转变成沉淀。再次加热沉淀,纳米纤维结构的有机凝胶再次出现,从而得到一个可逆的转变过程。
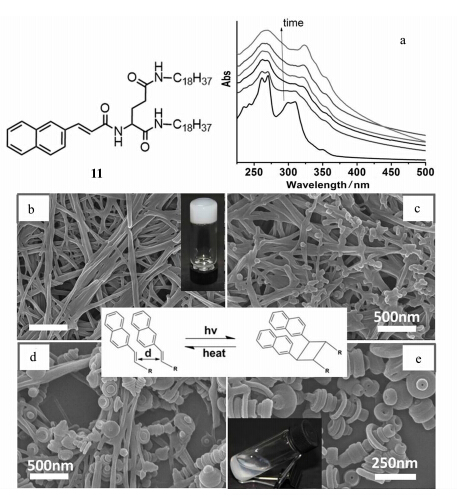 | 图15 11的乙醇凝胶随光照时间的吸收光谱(a),及其对应的形貌变化(b~d) The absorption spectra (a) of gel 11 with time under photo irradiation,and the corresponding morphology change (b-d) |
进一步研究发现,在其他烷基醇溶剂、含醇溶剂的混合溶剂,甚至于醇蒸气氛围下的干凝胶体系中也有类似的现象,因此,得到了醇溶剂凝胶控制的拓扑化学反应[36]。实验表明,拓扑化学反应发生的条件是十分微妙的,醇溶剂分子巧妙的改变胶凝剂分子的堆积方式使其满足拓扑化学反应的要求。并且醇在该体系的超分子凝胶形成过程中具有近旁溶剂效应,即最靠近胶凝剂分子的醇溶剂会极大程度地影响胶凝剂分子的排列,在光照时引发拓扑化学反应从而改变自组装纳米结构。 3 超分子凝胶光化学反应的应用
具有光响应活性的超分子凝胶对外界的光刺激具有独特的响应性,因此,利用超分子凝胶的光化学反应可以构筑具有光活性的功能性材料,如多重刺激响应性软物质材料、手性光学开关,甚至在光化学不对称合成等方面也有重要的应用。 3.1 多重刺激响应凝胶
我们设计了一种含有偶氮苯基团的谷氨酸类脂胶凝剂分子12,通过多重渠道控制其凝胶的超分子手性,构筑了一种多重响应性的手性光学开关[37]。该胶凝剂分子在很宽的有机溶剂范围内都能成有机凝胶,虽然偶氮苯本身没有手性,但是形成凝胶后偶氮苯部分表现出了光活性,这是分子手性通过超分子组装转移造成的。更有趣的是,有机凝胶的超分子手性对温度、光照甚至溶剂极性都表现出了响应性。首先,可以用这种有机凝胶构筑一种热驱动的手性光学开关。当有机凝胶被加热成溶液时,胶凝剂分子形成的聚集体解组装,CD 信号消失;冷却成胶后,手性再次出现。此过程可重复多次且不改变CD 信号强度,即实现了热驱动的可逆的手性光学开关。其次,可得到溶剂极性控制的超分子手性开关。不同极性溶剂中的凝胶观察到完全相反的CD 信号:极性溶剂的凝胶中得到正的康顿效应,非极性溶剂的凝胶是负的康顿效应。通过XRD 结合理论计算表明,胶凝剂分子在极性溶剂和非极性溶剂中采取两种不同的方式堆积,导致了手性的翻转现象。再次,由于偶氮苯基团的光致异构会改变凝胶因子的组装方式,也可获得光控的超分子手性光学开关。如图16所示,在非极性溶剂凝胶中,偶氮苯基团之间的相互作用很弱,对光照有响应性,紫外光照后,凝胶状态转变为溶液状态,且超分子手性信号明显降低;经可见光照后,凝胶状态及超分子手性信号恢复。而在极性溶剂中,偶氮苯发色团之间强的相互作用限制了其光致异构,因此不能发生光异构现象和光诱导的凝胶-溶液转变,其超分子手性不能实现光响应性。因此,在非极性溶剂中可以构筑一种光响应的超分子手性光学开关,最终,可以方便地构筑一种温度、光照和溶剂控制的多重响应的超分子手性光学开关。
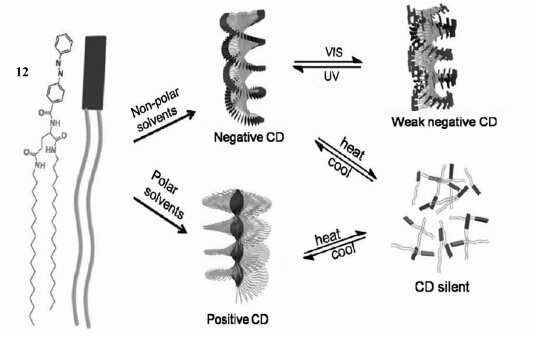 | 图16 胶凝剂分子12构筑的多通道手性光学开关示意图 Illustration of the multi-channel supramolecularchiroptical switches of gelator 12 |
黄建滨课题组也研究了多种含有偶氮苯基团分子的超分子组装[38, 39],以偶氮苯基二肽类两亲分子13[40]为例(图17),发现多种外界刺激(如pH、光以及表面活性剂的加入)都能够对分子的组装产生一定的影响。分子13高浓度时可以组装成超分子水凝胶,TEM证实得到了左手性的双螺旋纳米结构,并具有明显的CD信号,显示出负的Cotton效应。首先,当紫外及可见光照射时,偶氮苯可发生光致异构,伴随着吸收光谱特征吸收峰位置及强度的交替变化。同时,紫外光照时,组装体的形貌由螺旋纳米带结构转变为球状胶束,并且原本较强的CD信号显著降低。其次,分子13中的胺基N原子在酸性条件下易被质子化,因此赋予了13组装体的pH-敏感性。加入酸可导致从螺旋纳米纤维到小胶束的转变,并伴有Cotton效应的消失。再次,离子型表面活性剂的加入也可对组装产生影响,通过疏水作用和静电相互作用导致到双螺旋的纳米纤维的解离。如十二烷基磺酸钠的加入得到单股的纳米纤维结构,而十二烷基苯磺酸钠的加入则可有助于囊泡形成。从而实现了超分子组装结构对pH、光以及表面活性剂的刺激响应性。
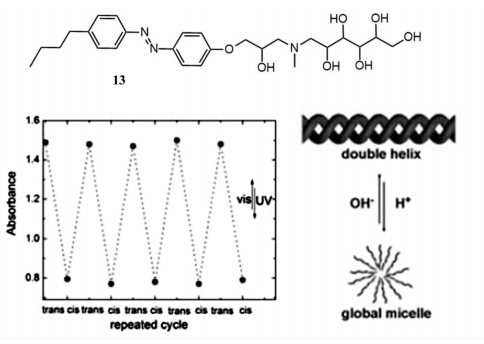 | 图17 两亲分子13组装体的多重刺激响应性 The multi-stimuli-responsive supramolecular assemblies of amphiphile 13 |
利用偶氮苯基团的顺反异构性质可以构筑凝胶中超分子层次的手性光学开关。例如,Bola 型谷氨酸衍生物两亲分子14在水中可以形成水凝胶,得到单臂螺旋纳米管结构[41]。将螺旋纳米管与偶氮衍生物(AZO)进行如下两种层次上的组装,实现了纳米管的功能化[42]:(1)AZO与形成的螺旋纳米管共组装(超分子层次);(2)AZO与凝胶分子共组装然后共同形成螺旋纳米管(分子层次)。这两种方法分别实现了偶氮苯基团的手性聚集和胶凝剂分子到偶氮基团的手性传递,如图18所示。在两种情况下,我们都发现了螺旋结构的稳定存在和超分子手性的出现,且不同组装方式可以达到不同的功能。AZO与螺旋纳米管共组装时,得到了非常强的CD信号裂分,紫外光照后CD信号几乎消失,且进一步的可见光照虽然可使偶氮发生顺反异构,但无法使其CD信号还原。但在另外一种情况下,如果AZO与凝胶分子共组装然后形成螺旋纳米管,紫外-可见吸收和CD信号都可以在紫外-可见光循环光照时发生可逆的变化,表明经过交替的紫外光和可见光照,分别实现了手性光学开关/可见光学开关的构筑。该结果对有机纳米管的功能化提供了一条简单易行的思路。
 | 图18 Azo与Bola两亲分子14通过两种方式组装的示意图:(1)Azo与纳米管共组装;(2)Azo与两亲分子14共组装 Illustration on the co-assembly of Azo with 14: (1) Azo co-assembly with helical nanotubes; (2) Azo and 14 co-assembly |
不对称光化学是一种获得光学纯化合物的最佳途径,运用热转化和酶反应的方法都很难得到,因此引起了研究人员极大的兴趣,但是提高光化学不对称合成的选择性却是研究过程中面临的重大挑战。光化学不对称合成反应中,蒽的光二聚是最古老的光化学反应之一,通常认为该反应是由蒽单线态激基缔合物中间体以[4+4]环加成的方式形成二聚体。对于9-取代蒽来说,其二聚体存在着头-头(h-h)和头-尾(h-t)两种形式的立体异构体。而2-取代蒽的情况更为复杂,除了考虑头-头和头-尾的构型,还要考虑其顺式及反式,因此2-取代蒽具有四种光二聚产物:反式、顺式头-头(anti h-h,synh-h)和反式、顺式头-尾(antih-t,synh-t)产物。所以,提高取代蒽光二聚反应的化学选择性及对映选择性显得尤为重要。超分子凝胶是由胶凝剂分子通过多种非共价相互作用形成的有序组装体,超分子凝胶结构中的相对有序的分子环境为进行立体选择过程提供了一个理想的平台。
张德清课题组研究了基于带有脲基的蒽衍生物凝胶的光二聚行为[43]。发现当用紫外光照射凝胶因子的THF溶液会形成h-t构象的光二聚体,h-t二聚体可通过1HNMR和13CNMR得到验证,而且形成的光二聚体可以在很多有机溶剂中包括环己烷、正己烷、正庚烷中形成凝胶(图19)。他们的研究表明光照前的凝胶以及光照之后的蒽二聚体凝胶非常稳定,用UV-Vis交替照射或者加热都不会使凝胶转变成为溶液。利用化合物15的超分子凝胶的平台成功实现了9-取代蒽光二聚的对映选择性。
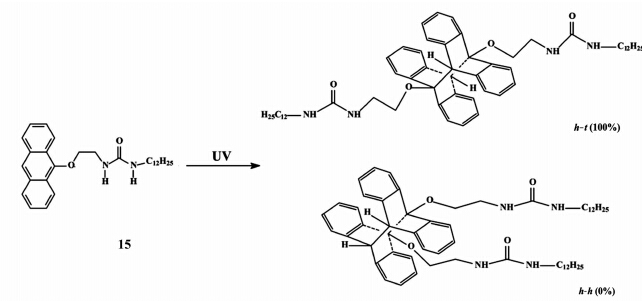 | 图19 化合物15在365 nm紫外光照下发生对映选择性的光二聚反应 Photodimerization of 15 upon UV light (365 nm) irradiation |
Shinkai课题组研究了较为复杂的2-取代蒽的有机凝胶的光二聚行为[44]。他们合成的手性凝胶剂分子16(图20)可以在有机溶剂、混合溶剂以及手性溶剂中形成凝胶。他们发现在凝胶状态下的光二聚反应具有很好的立体选择性和手性选择性。在凝胶中,头-头(h-h)构型的二聚体比头-尾(h-t)构型的二聚体更易形成。在对映体缩水甘油基甲基醚的凝胶中,手性synh-t光二聚体的对映体过量(ee)值高达-56%。手性h-h光二聚体的ee值与凝胶体系的强弱有关,ee值随着凝胶强度的增加而增大,说明光二聚与凝胶体系中分子间的氢键相互作用和π-π堆积作用的协同作用的强度有关。这是首例在凝胶介质中进行的手性光化学过程的研究,得到了很好的手性选择性,其手性可通过超分子相互作用精确控制。可见,使用超分子凝胶作为介质来进行光不对称合成是一种很有前途且新颖的不对称合成策略。
 | 图20 自由态的2-蒽酸分子在紫外光下发生光二聚得到的二聚体形式,以及胶凝剂16的结构式 Schematic of photodimerization of 2-anthracenecarboxylic acid in the free state,and the structure of gelator 16 |
具有光活性基团的超分子凝胶,能够对单一或多个特定波长的光产生响应,发生光化学反应,包括顺反异构和开闭环反应的可逆光致变色反应,以及光致聚合反应。其中报道较多的光致变色反应一般涉及含有偶氮苯、二芳基乙烯、螺吡喃等基团的化合物,光致聚合反应则以联乙炔基团和取代蒽基团为主。不仅仅利用光响应基团的性质,在胶凝剂分子的设计中也可以引入多种刺激响应性基团,用于构筑超分子凝胶。通过光调控超分子凝胶的结构和性质,有利于构筑光控自组装材料,在光学开关、手性光学开关、逻辑门、生物成像以及光学传感器等方面具有广阔的发展前景和空间。
目前,凝胶体系中研究的光化学反应的种类相对较少,主要是文中介绍的类型,亟待拓展其他类型的光化学反应在超分子凝胶介质中的应用,利用超分子凝胶的响应性和限域性,或者超分子凝胶构筑的有序自组装纳米结构有可能提高光化学反应的转化率,尤其是具有手性的螺旋纳米带和螺旋纳米管结构的超分子凝胶,在手性光催化反应中或许会有助于立体选择性和对映体选择性的实现。
| [1] | George M, Weiss R G. Molecular organogels. soft matter comprised of low-molecular-mass organic gelators and organic liquids[J]. Accounts of Chemical Research, 2006, 39:489-497. |
| [2] | Dastidar P. Supramolecular gelling agents: can they be designed[J]. Chemical Society Reviews, 2008, 37(12): 2699-2715. |
| [3] | Yu X, Chen L, Zhang M, Yi T. Low-molecular-mass gels responding to ultrasound and mechanical stress: towards self-healing materials[J]. Chemical Society Reviews, 2014, 43(15): 5346-5371. |
| [4] | Zhao F, Ma M L, Xu B. Molecular hydrogels of therapeutic agents[J]. Chemical Society Reviews, 2009, 38(4): 883-891. |
| [5] | Yang X, Zhang G, Zhang D. Stimuli responsive gels based on low molecular weight gelators[J]. Journal of Materials Chemistry, 2012, 22(1): 38-50. |
| [6] | Yagai S, Kitamura A. Recent advances in photoresponsive supramolecular self-assemblies[J]. Chemical Society Reviews, 2008, 37(8): 1520-1529. |
| [7] | Russew M-M, Hecht S. Photoswitches: from molecules to materials[J]. Advanced Materials, 2010, 22(31): 3348-3360. |
| [8] | Kim J H, Seo M, Kim Y J, Kim S Y. Rapid and reversible Gel-Sol transition of self-assembled gels induced by photo isomerization of dendritic azobenzenes[J].Langmuir, 2009, 25(3): 1761-1766. |
| [9] | Liao X, Chen G, Liu X, Chen W, Chen F, Jiang M. Photoresponsive pseudopolyrotaxane hydrogels based on competition of host guest interactions[J]. Angewandte Chemie International Edition, 2010, 49(26): 4409-4413. |
| [10] | Chen G, Jiang M. Cyclodextrin-based inclusion comple-xation bridging supramolecular chemistry and macromole-cular self-assembly[J]. Chemical Society Reviews, 2011, 40(5): 2254-2267. |
| [11] | de Jong J J, Lucas L N, Kellogg R M, Van Esch J H, Feringa B L. Reversible optical transcription of supramolecular chirality into molecular chirality[J]. Science, 2004, 304(5668): 278-281. |
| [12] | de Jong J J, Tiemersma-Wegman T D, van Esch J H, Feringa B L. Dynamic chiral selection and amplification using photoresponsive organogelators[J]. Journal of the American Chemical Society, 2005, 127(40): 13804-13805. |
| [13] | vanHerpt J T, Areephong J, Stuart M C A, Browne W R, Feringa B L. Light-controlled formation of vesicles and supramolecular organogels by a cholesterol-bearing amphiphilic molecular switch[J]. Chemistry-A European Journal, 2014, 20(6): 1737-1742. |
| [14] | Tian H, Wang S. Photochromic bisthienylethene as multi-function switches[J]. Chemical Communications, 2007: 781-792. |
| [15] | Wang S, Shen W, Feng Y, Tian H. A multiple switching bisthienylethene and its photochromic fluorescent organo-gelator[J]. Chemical Communications, 2006: 1497-1499. |
| [16] | Zhang J, Jin J, Zou L, Tian H. Reversible photo-controllable gels based on bisthienylethene-doped lecithin micelles[J]. Chemical Communications, 2013, 49(85): 9926-9928. |
| [17] | Cao X H, Zhou J, Zou Y, Zhang M M, Yu X D, Zhang S, Yi T, Huang C H. Fluorescence and morphology modulation in a photochromic diarylethene self-assembly system[J]. Langmuir, 2011, 27(8): 5090-5097. |
| [18] | Lee H-Y, Diehn K K, Sun K, Chen T, Raghavan S R. Reversible photorheological fluids based on spiropyran-doped reverse micelles[J].Journal of the American Chemical Society, 2011, 133(22): 8461-8463. |
| [19] | Chen Q, Feng Y, Zhang D, Zhang G, Fan Q, Sun S, Zhu D. Light-triggered self-assembly of a spiropyran-functionalized dendron into nano-/micrometer-sized particles and photoresponsive organogel with switchable fluorescence[J]. Advanced Functional Materials, 2010, 20(1): 36-42. |
| [20] | Reppy MA, Pindzola BA. Biosensing with polydiacetylene materials: structures, optical properties and applications[J]. Chemical Communications, 2007: 4317-4338. |
| [21] | Lee J, Kim J. Multiphasic sensory alginate particle having polydiacetylene liposome for selective and more sensitive multitargeting detection[J]. Chemistry of Materials, 2012: 2817-2822. |
| [22] | Su Y L. Preparation of polydiacetylene/silica nanocompo-site for use as a chemosensor [J]. Reactive and Functional Polymers, 2006, 66(9): 967-973. |
| [23] | Fujita N, Sakamoto Y, Shirakawa M, Ojima M, Fujii A, Ozaki M, Shinkai S. Polydiacetylenenanofibers created in low-molecular-weight gels by post modification: control of blue and red phases by the odd-even effect in alkyl chains[J].Journal of the American Chemical Society, 2007, 129(14): 4134-4135. |
| [24] | Rondeau-Gagne S, Neabo J R, Desroches M, Cantin K, Soldera A, Morin J F. The importance of the amide confi-guration in the gelation process and topochemical polymerization of phenylacetylene macrocycles[J]. Journal of Materials Chemistry C, 2013, 1(15): 2680-2687. |
| [25] | Rondeau-Gagne S, Neabo J R, Desroches M, Larouche J, Brisson J, Morin J F. Topochemical polymerization of phenylacetylene macrocycles: a new strategy for the preparation of organic nanorods[J].Journal of the American Chemical Society, 2013, 135(1): 110-113. |
| [26] | Neabo J R, Rondeau-Gagne S, Vigier-Carriere C, Morin J F. Soluble conjugated one-dimensional nanowires prepared by topochemical polymerization of a butadiynes-containing star-shaped molecule in the xerogel state[J]. Langmuir, 2013, 29(10): 3446-3452. |
| [27] | Duan P F, Li Y G, Liu M H. Preparation of optical active polydiacetylene through gelating and the control of supramolecular chirality[J]. Science China-Chemistry, 2010, 53(2): 432-437. |
| [28] | Wang J, Yang G, Jiang H, Zou G, Zhang Q. Photo-responsive cholesterol-substituted diacetylenic organogels: morphology tuning, photo-switching and photo-polymerization[J]. Soft Matter, 2013, 9(41): 9785. |
| [29] | Coates G W, Dunn A R, Henling L M, Ziller J W, Lobkovsky E B, Grubbs R H. Phenyl-perfluorophenyl stacking interactions: topochemical [2+2]photodimerization and photopolymerization of olefinic compounds[J]. Journal of the American Chemical Society, 1998, 120(15): 3641-3649. |
| [30] | Ramamurthy V, Venkatesan K. Photochemical-reactions of organic-crystals[J]. Chemical Reviews, 1987, 87(2): 433-481. |
| [31] | Kole G K, Tan G K, Vittal J J. Crystal engineering studies on the salts of trans-4,4 '-stilbenedicarboxylic acid in the context of solid state 2+2 cycloaddition reaction[J]. Crystengcomm, 2011, 13(9): 3138-3145. |
| [32] | Kihara H, Tamaoki N. An H-bonded main-chain liquid-crystalline polymer obtained by in situ photochemical conversion from an H-bonded LC dimer[J]. Macromolecular Chemistry and Physics, 2008, 209(14): 1424-1431. |
| [33] | Lu Q, Liu M H. Spontaneous two-dimensional crystallization and photochemical reaction of a novel bolaamphiphilic naphthol ester in the spreading Langmuir film at the air/water interface and transferred Langmuir-Blodgett film[J]. Thin Solid Films, 2003, 425: 248-254. |
| [34] | Liu L, Zhang L, Wang T, Liu M. Interfacial assembly of amphiphilicstyrylquinoxalines: alkyl chain length tunable topochemical reactions and supramolecular chirality[J]. Physical Chemistry Chemical Physics, 2013, 15(17): 6243-6249. |
| [35] | Wang X, Duan P, Liu M. Organogelation-controlled topochemical [2+2] cycloaddition and morphological changes: from nanofiber to peculiar coaxial hollow toruloid-like nanostructures[J]. Chemistry-A European Journal, 2013, 19(47): 16072-16079. |
| [36] | Wang X, Liu M. Vicinal solvent effect on supramolecular gelation: Alcohol controlled topochemical reaction and the toruloid nanostructure[J]. Chemistry-A European Journal, 2014, 20(32): 10110-10116. |
| [37] | Duan P F, Li Y G, Li L C, Deng J G, Liu M H. Multiresponsive chiroptical switch of an azobenzene-containing lipid: solvent, temperature, and photoregulated supramolecular chirality[J]. Journal of Physical Chemistry B, 2011, 115(13): 3322-3329. |
| [38] | Lin Y Y, Cheng X H, Qiao Y, Yu C L, Li Z B, Yan Y, Huang J B. Creation of photo-modulated multi-state and multi-scale molecular assemblies via binary-state molecular switch[J]. Soft Matter, 2010, 6(5): 902-908.. |
| [39] | Lin Y Y, Qiao Y, Tang P F, Li Z B, Huang J B. Controllable self-assembled laminated nanoribbons from dipeptide-amphiphile bearing azobenzene moiety[J]. Soft Matter, 2011, 7(6): 2762-2769. |
| [40] | Lin Y Y, Wang A D, Qiao Y, Gao C, Drechsler M, Ye J P, Yan Y, Huang J B. Rationally designed helical nanofibers via multiple non-covalent interactions: fabrication and modulation[J]. Soft Matter, 2010, 6(9): 2031-2036. |
| [41] | Zhan C L, Gao P, Liu M H. Self-assembled helical spherical-nanotubes from an L-glutamic acid based bolaamphiphilic low molecular mass organogelator[J]. Chemical Communications, 2005: 462-464. |
| [42] | Cao H, Jiang J, Zhu X F, Duan P F, Liu M H. Hierarchical co-assembly of chiral lipid nanotubes with an azobenzene derivative: optical and chiroptical switching[J]. Soft Matter, 2011, 7(10): 4654-4660. |
| [43] | Wang C, Zhang D, Xiang J, Zhu D. New organogels based on an anthracene derivative with one urea group and its photodimer: fluorescence enhancement after gelation[J]. Langmuir, 2007, 23(18): 9195-9200. |
| [44] | Dawn A, Shiraki T, Haraguchi S, Sato H, Sada K, Shinkai S. Transcription of chirality in the organogel systems dictates the enantiodifferentiating photodimerization of substituted anthracene[J]. Chemistry-A European Journal, 2010, 16(12): 3676-3689. |




