近年来,离子液体(IL)由于具有优良的物理和化学性质而引起人们的广泛关注,如较低的蒸气压、较高的化学和热稳定性、低毒性、良好的导电性、可控的疏水性[1,2]。离子液普遍被认为是绿色溶剂,因为它们可回收,因而可替代传统的有机溶剂[2,3]。这些独特性使离子液体在有机合成[4,5,6,7]、电化学[8,9]、分离科学[10,11,12,13]、材料制备[14,15,16,17,18]中具有巨大的应用潜力。目前,对离子液体在生命科学领域应用的研究比较活跃。乙基咪唑四氟(EtImBF4)被成功地用于设计含有离子液体的DNA导电膜,这开创了一个新的生物体系[19,20]应用领域。通过涂敷一层咪唑型[21]离子液体,可以制备相对稳定的毛细管用于DNA分离。最近,离子液体被用于定量地提取痕量DNA或细胞色素C[22,23]。此外,还发现离子液体可作为理想溶剂或添加剂用于酶[24,25]的固定和分离、蛋白质[26]的溶解和再生以及生物大分子[9,27,28,29]的电化学行为研究。然而,所有这些应用,包括相关性能,都与离 子液体和生物大分子之间的相互作用有关[30]。因此,研究离子液体和生物大分子之间的相互作用,对于理解和发展离子液体在生命科学领域的应用非常重要。
蛋白质在细胞和生物体的生命活动过程中起着十分重要的作用,其功能的发挥直接与其结构有关。研究发现,表面活性剂能够调节蛋白质的构象,从而调控蛋白质的性能[31,32]。最近,有研究又发现离子液体能调节核糖核酸酶等蛋白质的稳定性和活性[33,34,35]。Singh等[36]研究了不同链长离子液体与明胶的相互作用;于丽等[37,38]以表面张力和荧光光谱法研究了咪唑类离子液体与牛血清蛋白的相互作用行为。然而,有关离子液体与蛋白质相互作用的系统性研究,尤其是关于其相互作用机理的信息非常有限[39]。
在本工作中,以紫外-可见光谱法、荧光光谱法、同步荧光光谱法、圆二色谱法以及全反射红外光谱等光谱学方法系统研究了咪唑型离子液体[Bmim]Cl与典型蛋白质牛血清蛋白(BSA)的缔合特性。通过表面张力法、负染-透射电镜法、激光光散射以及等温滴定微量热法(ITC)等实验手段探讨了离子液体与牛血清蛋白的相互作用机理。研究发现,咪唑型离子液体与BSA具有较强的缔合特性,导致其α-螺旋和β-折叠的构象发生变化,从而可调节蛋白质的二级结构及其性能。上述研究将对于理解离子液体与蛋白质的相互作用非常重要,并为离子液体在生命科学领域的应用提供了理论依据。 1 实验部分 1.1 实验试剂
牛血清蛋白(上海生工公司,99%),离子液体1-甲基-3-丁基咪唑盐酸盐 [Bmim]Cl(上海成捷化学有限公司,99%),Tris(上海生工,99.8%),盐酸(国药集团,36.0%~38.0%),Milli-Q去离子水。 1.2 实验方法 1.2.1 溶液的配置
先用Tris-HCl缓冲溶液(pH = 7.34)配制一定浓度的BSA和[Bmim]Cl母液,用定量的移液管准确量取一定量的母液于5 mL刻度离心管中,并用缓冲溶液精确定容,于振荡器充分振荡后置于0 ℃冰箱内保存2 h左右。 1.2.2 紫外-可见光谱的测定
将样品于25 ℃水浴中恒温30 min后置于石英比色皿中,以紫外分光光度计(Shimadzu UV-2550,Japan)测定样品的紫外吸收光谱,该测定以Tris-HCl缓冲溶液作参比,光谱范围为200~700 nm。 1.2.3 同步荧光光谱和荧光发射光谱的测定
将样品于25 ℃的水浴中恒温30 min后置于荧光比色皿中,以荧光分光光度计(Shimadzu RF-5301PC,Japan)测定同步荧光光谱和荧光发射光谱。同步荧光光谱选择激发波长与发射光波长差分别为20 nm和60 nm,进行扫描。荧光发射光谱中激发波长为280 nm,狭缝宽度为1.5 nm。 1.2.4 圆二色谱测定
配制一系列不同离子液体浓度的BSA溶液,在25 ℃下恒温30 min后,测定BSA在185~255 nm的圆二色谱(JASCO J-810,Japan)。石英杯光径为1.0 cm,扫描条件:带宽1.0 nm,扫描速率100 nm/min,响应时间0.1 s,分辨率0.l nm,扫描次数4次。测量时对光源系统通氮气以除去空气和水汽。 1.2.5 衰减全反射红外光谱的测定
衰减全反射红外技术(ATR-FITR)相对于透射红外而言可进一步深入得到谱图的精细结构从而获得更多信息。实验中选择硒化锌(ZnSe)作为ATR附件中发生全反射的晶体材料,晶体直径为2 cm;调节入射光入射角为45°;附件中压力微调器刻度为-25。测量红外光谱时设定选择吸收范围在4000~400 cm-1之间,扫描次数为25次。 1.2.6 流体力学半径的测定
以动/静态激光光散射仪(ALV/DLS/SLS-5022,德国 ALV公司)测定平衡体系中聚集体的粒径分布。该光散射仪配备圆柱形的He-Ne激光光源(输出功率:25 mW,波长:632.8 nm),同时连接有ALV SP-86数字相关器,测试中散射角为90°,累加时间为240~300 s,重复扫描 2次以上。所有样品均经过0.45 μm的Milliporesterile薄膜过滤到经丙酮内外除尘的DLS样品池中,然后在实验温度下恒温至平衡。 1.2.7 负染色法透射电镜观察
实验时先将样品滴在具有Formvar膜的铜网上,让其在Formvar膜上吸附15 min左右,以滤纸吸干多余溶液,再用磷钨酸溶液负染1~2 min后吸干负染液,并于室温下烘干。以TECNAI透射电镜(荷兰,Philip)观察样品形貌。 1.2.8 等温滴定微量热测定
实验由等温滴定微量热仪(MicroCal,LLC,USA)完成。所有的溶液都在相应温度条件下真空脱气处理以减小信号噪音。在滴定实验中,将较浓的离子液体溶液装入上部250 μL的滴定注射器中,注意不能带入气泡。蛋白质溶液置于1.439 mL的不绣钢瓿瓶中,实验温度为25.0 ℃,每滴量为5 μL,每滴的持续时间为10 s,总滴数为50滴,滴定的间隔时间为240 s,搅拌器转速固定在307 r/min,待基线在搅拌下稳定后启动实验,测定体系随滴定液浓度变化的体系热量变化。 2 结果与讨论 2.1 离子液体对BSA紫外可见吸收光谱的影响
紫外可见吸收光谱对分子的构象变化比较敏感,能够反映出蛋白质分子微小的结构振动。已知我们所选用的离子液体[Bmim]Cl在所研究光谱范围内无紫外吸收。图1为不同浓度的[Bmim]Cl对1.0× 10-5 mol/L的BSA溶液紫外可见吸收光谱的影响。图1中位置位于278 nm处的紫外吸收峰为BSA的特征吸收峰,是由其肽键上色氨酸(Trp)、酪氨酸(Tyr)和苯丙氨酸(Phe)的芳杂环π-π* 跃迁引起的。当加入[Bmim]Cl时,该特征峰峰形几乎不变,但峰强不断上升,即蛋白质的吸收强度发生了变化,说明离子液体和BSA发生了缔合,生成了配合物,导致BSA中Trp、Tyr和Phe芳香族残基的微环境发生了变化,疏水性增强。以上紫外光谱变化表明咪唑型离子液体和牛血清白蛋白发生了反应,引起了BSA中肽键构象和结构的变化。
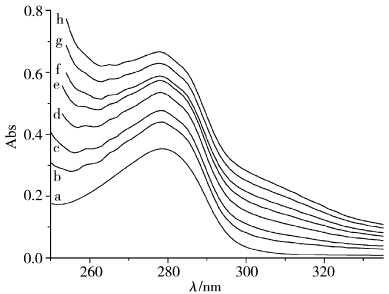 | 图1 不同[Bmim]Cl浓度下1.0×10-5 mol/L的BSA溶液紫外-吸收谱图 [Bmim]Cl浓度(mol/L):a-0,b-0.2,c-0.4,d-0.6,e-0.8,f-1.0,g-1.2,h-1.4 UV-Vis spectra of 1.0×10-5 mol/L BSA solution with addition of [Bmim]Cl [Bmim]Cl concentration(mol/L): a-0,b-0.2,c-0.4,d-0.6,e-0.8,f-1.0,g-1.2,h-1.4 |
蛋白质的内源荧光主要来自于分子中的色氨酸残基和酪氨酸残基。在280 nm光激发下,BSA分子中的内源荧光发射峰位于340 nm附近。图2为固定BSA浓度下体系荧光发射光谱随咪唑型离子液体含量变化的曲线。由图2可见,随着加入[Bmim]Cl量的增加,荧光强度有规律地降低,同时谱图中355 nm处逐渐出现一个肩峰。我们认为原因可能是:一方面,离子液体含量增加,与带负电的BSA结合的正电荷量增多,导致其静电吸引作用增强,使得更多BSA由在水溶液中的分散状态转为与离子液体结合,形成[Bmim]Cl / BSA复合物,从而产生新的荧光峰,同时使得BSA中色氨酸残基周围非极性增加,暴露在更加亲水的环境中;另一方面,随着离子液体含量的增加,BSA与[Bmim]Cl烷基链间的疏水作用增强,使得BSA的构象发生改变,导致BSA荧光猝灭。
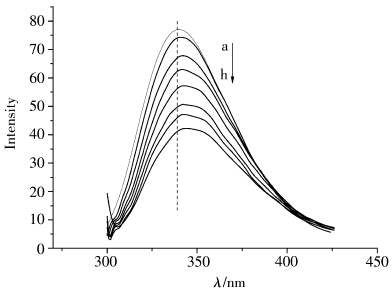 | 图2 不同[Bmim]Cl浓度下1.0×10-5 mol/L的BSA溶液的荧光发射光谱 [Bmim]Cl浓度(mol/L):a-0,b-0.2,c-0.4,d-0.6,e-0.8,f-1.0,g-1.2,h-1.4 Fluorescence spectra of 1.0×10-5 mol/L BSA solution with addition of [Bmim]Cl [Bmim]Cl concentration(mol/L): a-0,b-0.2,c-0.4,d-0.6,e-0.8,f-1.0,g-1.2,h-1.4 |
利用同步荧光法可以了解蛋白质构象的变化。因为氨基酸残基最大发射波长与其所处的微环境有关,故而可由氨基酸发射波长的改变判断蛋白质构象的变化。若实验条件改变后,同步荧光红移,表明残基所处环境的极性增加;若蓝移,则疏水性增加。
蛋白质的荧光通常由色氨酸残基和酪氨酸残基贡献,在普通的荧光光谱上,这两种残基的发射峰重叠在一起,无法分辨。同步荧光具有谱带窄、分辨率高的特点,通过使用适合的波长差(Δλ)可以将在普通荧光光谱上相互重叠的荧光峰分开,从而得到色氨酸和酪氨酸残基的特征峰[40,41]。图3A和3B分别为BSA在不同浓度[Bmim]Cl溶液中的同步荧光光谱图。由图3可见,当激发光和发射光的波长差(Δλ)为20 nm时,在血红蛋白的同步荧光光谱中可观察到一个在315 nm处的荧光峰(图3A),这是酪氨酸(Tyr)的贡献;当激发光和发射光的波长差(Δλ)为60 nm时,在BSA的同步荧光光谱中可观察到一个在349 nm处的荧光峰(图3B),这是色氨酸(Trp)的贡献。由图3A还可以看出,BSA酪氨酸残基的特征峰(340 nm)随 离子液体的加入并无明显位移,而色氨酸残基特 征峰则略有红移,这表明离子液体[Bmim]Cl与BSA色氨酸残基作用相对较强。以上结果表明在离子液体与蛋白质的相互作用过程中,色氨酸残基的微环境发生了改变,色氨酸残基由“包埋”逐渐变为“暴露”的状态,环境的极性增强,疏水性减弱[42]。因为BSA的空间结构由3个结构域组成,每个结构域由2个亚结构域以槽口相对的方式形成圆筒状结构,几乎所有疏水性氨基酸残基都包埋在圆筒内部,构成疏水腔[43]。而且经分析在此反应中[Bmim]Cl分子主要是与蛋白质中接近色氨酸残基的区域发生了相互作用,使蛋白质的构象发生了改变,所以它们的结合部位可能处于这种疏水腔中,使BSA内部的疏水结构有所改变,引起肽链的收缩[44]。
 | 图3 BSA在不同浓度[Bmim]Cl溶液中的同步荧光光谱图 A:Δλ=20 nm,B:Δλ=60 nm [Bmim]Cl浓度(mol/L):a-0,b-0.2,c-0.4,d-0.6,e-0.8,f-1.0,g-1.2,h-1.4 Synchronous fluorescence spectra of BSA solution with addition of [Bmim]Cl [Bmim]Cl concentration(mol/L): a-0,b-0.2,c-0.4,d-0.6,e-0.8,f-1.0,g-1.2,h-1.4 |
荧光猝灭可由动态猝灭、静态猝灭所引起。动态猝灭是一种能量转移或电子转移引起的猝灭过程,并不影响蛋白质的结构和活性。静态猝灭则是由于发生了配合作用,通常是产生了不发荧光的配合物,对蛋白质的二级结构可发生影响,并影响其生理活性。所以在测定其结合常数时必须首先确定其荧光猝灭的类型。一般情况下,动态和静态猝灭可依据不同温度条件下的结果加以区别。动态猝灭是猝灭剂和荧光物质的激发态分子间相互作用引起的,温度的升高将增加有效碰撞的离子数和加剧电子转移过程,使荧光物种的猝灭常数随着温度的升高而增大,猝灭服从Stern-Volmer方程:

式中F0与F分别为加入猝灭体Q前后的荧光强度,Kq为双分子猝灭常数,τ0为生物大分子的荧光寿命,KSV是Stern-Volmer猝灭常数;而静态猝灭,是由于荧光体和猝灭剂之间发生了非辐射能量转移,二者形成了复合物而引起,温度的升高将降低复合物的稳定性使猝灭常数减小,应服从Stern-Volmer方程以及Lineweaver-Burk方程[45]:
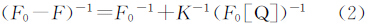
式中F0与F分别为加入猝灭剂Q前后的荧光强度,K为表观缔合常数。
根据加入[Bmim]Cl后的BSA的荧光强度的变化,以F0/F与相应的[Q]作Stern-Volmer图(图4),其线性相关系数均大于0.999,表明该Stern-Volmer曲线具有良好线性关系。在不同温度下由图4所得的KSV结果列于表1。由表1可见,随温度升高,猝灭常数不断减小。根据猝灭原理,可知离子液体与牛血清白蛋白的反应过程是一个静态猝灭过程。
 | 图4 25 ℃下BSA-[Bmim]Cl的Stern-Volmer曲线 Stern-Volmer curve of BSA-[Bmim]Cl system at 25 ℃ |
根据修正后的Stern-Volmer方程[46]:
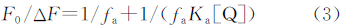
式中F0是未加猝灭剂的荧光强度,ΔF是未加和加入猝灭剂时的荧光强度的差值,Ka是反应的结合常数,fa是被猝灭剂猝灭的荧光基团占总荧光基团的百分比。图5是F0/ΔF关于1/[Q]的图,1/fa值等于直线在纵坐标上截距,1/faKa等于直线在坐标上的斜率,由此可求出Ka的值,Ka也一并列于表1。
 | 图5 25 ℃时BSA-[Bmim]Cl体系修正后的Stern-Volmer曲线 Corrected Stern-Volmer curve of BSA-[Bmim]Cl system at 25 ℃ |
| 表1 [Bmim]Cl与BSA相互作用的猝灭常数 Quenching constant of BSA in the present of [Bmim]Cl |
圆二色性可直接反映蛋白质分子二级结构,一般情况下,蛋白质的圆二色性曲线可分成两段:185~245 nm远紫外区和245~320 nm近紫外区。远紫外区是肽键吸收峰,因而此区域反映了 蛋白主链的构象。牛血清蛋白分子的主链主要由α-螺旋、β-折叠以及无规卷曲等几种结构单元组成。通常情况下,在圆二色性曲线图中,典型的α-螺旋给出209 nm以及222 nm左右的两个负槽-双负槽曲线。负槽对应的椭圆[θ]值越负,α-螺旋在蛋白质分子结构中的含量越高。BSA为一种典型的球状蛋白,其分子二级结构中含有大量α-螺旋结构,因此通过拟合α-螺旋的含量可大致得到BSA的变性情况[47]。但由于离子液体分子的极不对称性,因此也具有一定的圆二色性,在较高浓度下会影响BSA的圆二色谱图,但我们通过实验发现[Bmim]Cl在0.008 mol/L以下时基本没有圆二色信号,因此为了避免干扰,同时定性地对两者的相互作用进行分析,我们选择该值以下的离子液体浓度对我们的体系进行研究。图6为较低[Bmim]Cl浓度下BSA的圆二色谱图。由图6可见,当离子液体浓度低于1.4 × 10-3 mol/L时,BSA圆二色谱中的负槽-双负槽曲线比纯BSA的更负(图6a~d),但当[Bmim]Cl浓度进一步增大时,[θ]值开始增大,并高于纯BSA的曲线(图6e~f)。这表明,离子液体虽然能导致BSA的变性和二级结构的破坏,但较低浓度的离子液体反而能使其变得更稳定,结构也更紧密。
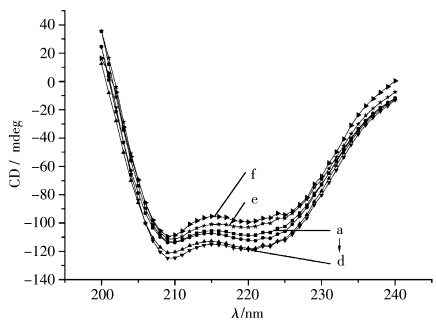 | 图6 [Bmim]Cl对BSA圆二色谱的影响 [Bmim]Cl浓度(10-3 mol/L):a-0,b-1.0,c-1.2,d-1.4,e-1.6,f-1.8 Circular dichroism spectra in the present of [Bmim]Cl with different concentrations [Bmim]Cl concentration (10-3 mol/L):a-0,b-1.0,c-1.2,d-1.4,e-1.6,f-1.8 |
表2为通过圆二色谱分析软件拟合得到的不同[Bmim]Cl浓度下BSA的α-螺旋、β-折叠结构的比例。由该表可见,随着离子液体浓度的增加,BSA中α-螺旋、β-折叠结构含量均下降,这可能是因为离子液体头基与蛋白头基通过静电作用和疏水作用相结合,蛋白的二级结构被打开而引起的。
| 表2 不同[Bmim]Cl浓度下BSA的α-螺旋和 β-折叠结构的含量 The α-helix,β-fold content of BSA in present of [Bmim]Cl |
衰减全反射红外光谱技术(ATR-FTIR)相对于传统红外透射法而言不需对样品进行预处理,其测定灵敏度更高,且可以辨别谱图中更为精细的结构。现分别扫描BSA缓冲溶液和纯缓冲溶液体系的红外光谱,差减得到BSA与IL作用前的纯BSA红外光谱图(图7A)。在同样条件下记录离子液体和离子液体与BSA作用后的红外光谱,差减得到BSA和离子液体作用后的红外光谱图(图7B)。
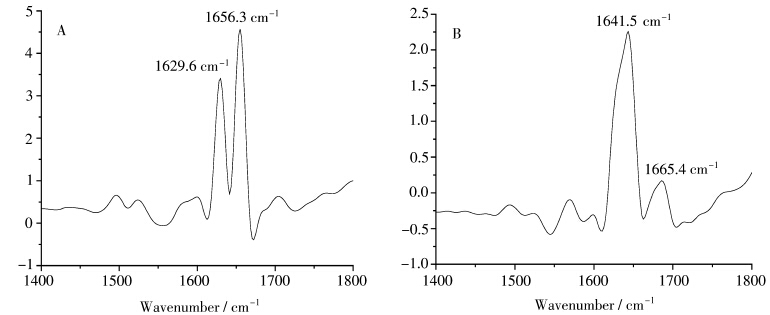 | 图7 BSA-[Bmim]Cl体系的ATR-FTIR谱图 ATR-FTIR spectra of BSA-[Bmim]Cl system A.1.0×10-5 mol/L BSA,B.1.0×10-5 mol/L BSA+0.6 mol/L [Bmim]Cl |
在牛血清蛋白质分子的结构中,肽链骨架由肽键上的C、N原子与氨基酸残基中的α碳原子组 成,交替形成了肽键主链,它从N端到C端为顺时针方向的右手螺旋结构。相邻螺旋之间,由第1个氨基酸肽键上C=O,隔三个氨基酸残基,与第5个氨基酸肽键上N—H之间形成氢键,每相邻间有三个氢键维持其空间结构的相对稳定[43],因此其氨基酸肽键上C=O和N—H可在一定程度上代表了蛋白的α-螺旋,而β-折叠主要指蛋白质中多肽链充分伸展,各肽键平面折叠成的锯齿状结构,侧链R基团交错位于锯齿状结构上下方,它们之间靠链间肽键羧基上的氧和亚氨基上的氢形成氢键维系构象稳定。据文献报道[48],波数为1651~1658 cm-1以及1618~1642 cm-1的红外吸收峰分别对应了BSA中α-螺旋和β-折叠的特征吸收峰。由图7可以看出,加入离子液体后牛血清白蛋白的红外光谱的两个特征峰仍然存在,但都发生了明显的红移,α-螺旋的红外吸收峰从1656.3 cm-1位移到1665.4 cm-1,β-折叠的峰从1629.6 cm-1移到1641.5 cm-1。也就是说,咪唑型离子液体的加入对BSA的α-螺旋、β-折叠都产生了较强烈的影响,从而引起蛋白质二级结构的变化。 2.5 离子液体对BSA形貌的影响
图8为不同浓度[Bmim]Cl下BSA以及纯离子液体的负染-透射电镜照片。由图8A可见,BSA是球形或类球形蛋白。当体系中加入少量离子液体[Bmim]Cl时,可观察到黑色的[Bmim]Cl聚集体(图8D)在BSA上的吸附,但是对蛋白球形结构的影响并不显著(图8B)。随着[Bmim]Cl浓度的进一步增加,BSA的二级结构逐渐打开,分子的结构由原来的球状逐渐变得松散,呈现带状聚集体,并且逐渐聚集到一起(图8C),这也验证了之前全反射红外和圆二色谱的结论。
 | 图8 [Bmim]Cl/BSA体系负染-透射电镜照片 A~D分别对应体系为:A.1.0×10-5 mol/L BSA;B.[BSA]=1.0×10-5 mol/L,[[Bmim]Cl]=0.4 mol/L; C.BSA=1.0×10-5mol/L,[[Bmim]Cl]=1.2 mol/L;D.1.2 mol/L [Bmim]Cl Negative staining-transmission electron microscope images of [Bmim]Cl/BSA system AD corresponds to the systems: A.1.0×10-5 mol/L BSA;B.[BSA]=1.0×10-5 mol/L,[[Bmim]Cl] =0.4 mol/L;C.BSA=1.0×10-5 mol/L,[[Bmim]Cl]=1.2 mol/L;D.1.2 mol/L [Bmim]Cl |
图9为咪唑型离子液体加入BSA溶液后体系流体力学半径的变化情况。由图9a可见,纯牛血清蛋白粒径大约在6 nm左右,这也与文献报道一致[49]。随着体系中离子液体的加入,该蛋白质的峰逐渐右移(图9b~e)。我们认为原因是离子液体分子吸附在BSA分子上,与其结合导致粒径增大,这也与之前的结论一致。同时我们发现,在BSA溶液中加入离子液体后,在Rh =70~100 nm左右出现了一个新的峰,这主要是因为离子液体本身在水溶液中也能自聚集为类似胶束的聚集体[50],且该聚集体大小随着离子液体浓度的增加而增加。图8D即为[Bmim]Cl类胶束的聚集体的负染TEM照片,由图可见,该聚集体为球形,粒径大约为200~300 nm,除了少量发生聚集之外,分布也比较均匀。
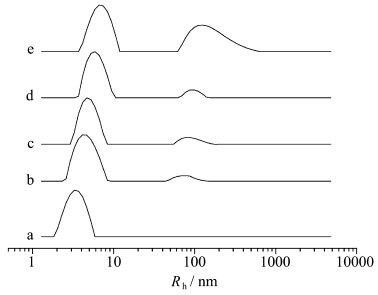 | 图9 [Bmim]Cl/BSA体系流体力学半径 BSA浓度:1.0×10-5 mol/L;[Bmim]Cl浓度(mol/L): a-0,b-0.2,c-0.4,d-0.6,e-1.2 Hydrodynamic radius distribution of [Bmim]Cl/BSA system Hydrodynamic radius distribution of [Bmim]Cl/BSA system BSA concentration:1.0×10-5 mol/L; [Bmim]Cl concentration(mol/L): a-0,b-0.2,c-0.4,d-0.6,e-1.2 |
图10为[Bmim]Cl/BSA体系表面张力随离子液体浓度的变化曲线。在我们所研究的浓度范围内,单纯的[Bmim]Cl溶液表面张力随浓度变化不明显,保持在45.2~44.8 mN/m(图略),但由图可见,离子液体的加入使体系表面张力曲线产生明显变化:当[Bmim]Cl浓度较小时,体系的表面张力较单纯的BSA溶液的表面张力降低,说明少量离子液体分子吸附在BSA分子的表面上,使其表面的极性下降,增强了其疏水性。随着离子液体浓度的增加,其与BSA疏水作用力进一步增强,同时生成[Bmim]Cl / BSA复合物,表面层的BSA分子会逐渐被[Bmim]Cl分子取代,该取代作用接近饱和时,体系的表面张力的下降开始变得不明显,并趋于不变。溶液表面性质主要依赖于吸附现象,因此我们认为BSA与离子液体间存在较强的疏水作用。
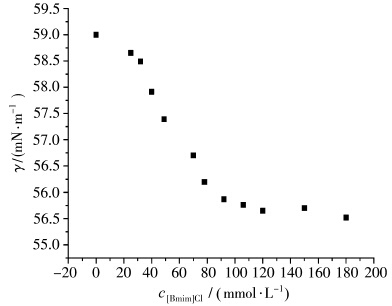 | 图10 BSA-[Bmim]Cl体系表面张力随[Bmim]Cl浓度变化曲线 BSA浓度:1.0×10-5 mol/L Surface tension curve of 1.0×10-5 mol/L BSA solution with addition of [Bmim]Cl |
图11为25 ℃时[Bmim]Cl分别滴定Tris-HCl缓冲溶液以及滴定1.0×10-5 mol/L BSA缓冲溶液的等温滴定微量热曲线。由图11A可以看出,纯离子液体滴定缓冲溶液时,体系的热效应由吸热向放热方向转变。由于胶束化是自发放热和熵增加的过程,而与胶束解离则相反。因此,上述变化是由于离子液体在水溶液中达到一定浓度会自聚集成类胶束所致。对比图11A和图11B可以发现两曲线存在明显差异,在有BSA存在时体系吸热程度增加。这也说明[Bmim]Cl与BSA确实存在着较为强烈的相互作用。
 | 图11 25 ℃时等温滴定微量热曲线 A.1.2 mol/L[Bmim]Cl滴定Tris-HCl缓冲溶液, B.1.2 mol/L[Bmim]Cl滴定1.0×10-5 mol/L BSA/缓冲溶液 ITC curves of Tris-HCl system (left) and 1.0×10-5 mol/L BSA in buffer (right) titrated by 1.2 mol/L [Bmim]Cl |
我们将两者相减可除去离子液体解胶束和胶束化的影响,得到了如图12所示的ITC曲线。由图12可见,该曲线存在两个转折点,其对应的离子液体浓度分别为c1和c2。当离子液体浓度低于c1时,体系处于放热区域,且向吸热方向转变。在该区域离子液体单体通过静电作用和疏水作用吸附到BSA表面,且结合表面张力结果分析可知,此时两者间的主要作用力为疏水作用,这种缔合作用是放热的。另一方面,这种疏水作用导致BSA的α-螺旋、β-折叠等二级结构逐渐解折叠,前述圆二色谱的变化可证明。由于这种作用是吸热的,其热效应比缔合作用引起的放热效应更显著,因此,向吸热方向转变。当离子液体浓度介于 c1和c2浓度之间时,体系焓变继续上升,但增加的幅 图11 25 ℃时等温滴定微量热曲线
A.1.2 mol/L[Bmim]Cl滴定Tris-HCl缓冲溶液, B.1.2 mol/L[Bmim]Cl滴定1.0×10-5 mol/L BSA/缓冲溶液 ITC curves of Tris-HCl system (left) and 1.0×10-5 mol/L BSA in buffer (right) titrated by 1.2 mol/L [Bmim]Cl 图12 25 ℃时[Bmim]Cl滴定1.0×10-5 mol/L BSA/缓冲溶液扣除缓冲溶液背景后的等温滴定微量热曲线 Corrected differential enthalpy against the [Bmim]Cl concentration The corrected differential enthalpies were derived by integration of the ITC profile shown in Figure 11B, followed by subtraction of the corresponding dilution heats derived from the control titrations of [Bmim]Cl into buffer alone(Figure 11A) 度变缓。由于静电作用的热效应几乎为0[51, 52],因此这可能是由于离子液体与BSA之间发生了协同缔合作用,离子液体[Bmim]Cl分子在BSA链上形成了胶束状聚集体,破坏BSA的二级结构,使其α-螺旋、β-折叠等二级结构慢慢展开而使结构变得疏松,从而导致蛋白变性。这种离子液体[Bmim]Cl在BSA链上的胶束化缔合作用的热效应显著高于其单体在BSA上的热效应,但仍低于BSA变性的吸热效应,因此,体系向吸热方向转变的趋势变缓。当离子液体浓度继续增大到c2以上时,[Bmim]Cl分子在BSA上的缔合趋于饱和,更高的[Bmim]Cl浓度也无法与BSA结合,而只能形成自由聚集体,因此,其作用的热效应趋近于零。相对于常规表面活性剂,如十二烷硫酸钠(SDS)与BSA的作用方式[32],离子液体诱导BSA构象的变化呈现出独特的作用方式,从而为离子液体在蛋白质领域的应用,尤其是蛋白质的复性,提供了新型途径。
 | 图12 25 ℃时[Bmim]Cl滴定1.0×10-5 mol/LBSA/缓冲溶液扣除缓冲溶液背景后的等温滴定微量热曲线 Corrected differential enthalpy against the [Bmim]Cl concentration The corrected differential enthalpies were derived by integration of the ITC profile shown in Figure 11B, followed by subtraction of the corresponding dilution heats derived from the control titrations of [Bmim]Cl into buffer alone(Figure 11A) |
咪唑型离子液体[Bmim]Cl分子可与蛋白质BSA中接近色氨酸残基的区域发生强烈的缔合作用,使蛋白质的构象和内部的疏水结构发生改变,引起肽链的收缩;离子液体的加入对BSA的α-螺旋、β-折叠都产生了较强烈的影响,使得BSA二级结构中α-螺旋、β-折叠的含量均降低,引起蛋白质二级结构的变化,离子液体与BSA的作用为静电作用和疏水作用共同作用的结果,但主要以疏水作用为主。上述研究将为理解离子液体与蛋白质的相互作用,并为拓展离子液体在蛋白质领域的应用提供重要的理论依据。
| [1] | Huddleston J G,Visser,A E,Reichert W M,Willauer H D,Broker G A,Rogers R D. Characterization and comparison of hydrophilic and hydrophobic room temperature ionic liquids incorporating the imidazolium cation[J]. Green Chemistry,2001,3(4):156-164. |
| [2] | He Y,Li Z,Simone P,Lodge T P. Self-assembly of block copolymer micelles in an ionic liquid[J]. Journal of the American Chemical Society,2006,128(8):2745-2750. |
| [3] | Seth D,Chakraborty A,Setua P,Sarkar N. Interaction of ionic liquid with water in ternary microemulsions (Triton X-100/Water/1-butyl-3-methylimidazolium hexafluoro-phosphate) probed by solvent and rotational relaxation of coumarin 153 and coumarin 151[J]. Langmuir,2006,22(18):7768-7775. |
| [4] | Welton T. Room-temperature ionic liquids. solvents for synthesis and catalysis[J]. Chemical Reviews,1999,99(8):2071-2084. |
| [5] | Avery T D,Jenkins N F,Kimber M C,Lupton D W,Taylor D K. First examples of the catalytic asymmetric ring-opening of meso 1,2-dioxines utilising cobalt(II) complexes with optically active tetradentate schiff base ligands:formation of enantio-enriched cyclopropanes[J]. Chemical Communications,2002,1(1):28-29. |
| [6] | Huddleston J G,Rogers R D. Room temperature ionic liquids as novel media for 'clean' liquid-liquid extraction[J]. Chemical Communications,1998,16:1765-1766. |
| [7] | Smietana M,Mioskowski C. Preparation of silyl enol ethers using (bistrimethylsilyl) acetamide in ionic liquids[J]. Organic Letters,2001,3(7):1037-1039. |
| [8] | Fukumoto K,Yoshizawa M,Ohno H. Room temperature ionic liquids from 20 natural amino acids[J]. Journal of the American Chemical Society,2005,127(8):2398-2399. |
| [9] | Leone A M,Weatherly S C,Williams M E,Thorp H H,Murray R W. An ionic liquid form of DNA:redox-active molten salts of nucleic acids[J]. Journal of the American Chemical Society,2001,123(2):218-222. |
| [10] | Wasserscheid P,Keim W. Ionic liquids:new "solutions" for transition metal catalysis[J]. Angewandte Chemie-International Edition,2000,39(21):3772-3789. |
| [11] | Anderson J L,Ding J,Welton T,Armstrong D W. Characterizing ionic liquids on the basis of multiple solvation interactions[J]. Journal of the American Chemical Society,2002,124(47):14247-14254. |
| [12] | Chun S,Dzyuba S V,Bartsch R A. Influence of structural variation in room-temperature ionic liquids on the selectivity and efficiency of competitive alkai metal salt extraction by a crown ether[J]. Analytical Chemistry,2001,73(15):3737-3741. |
| [13] | Blanchard L A,Brennecke J F. Recovery of organic products from ionic liquids using supercritical carbon dioxide[J]. Industrial & Engineering Chemistry Research,2001,40(11):287-292. |
| [14] | Kim K S,Demberelnyamba D,Lee H. Size-selective synthesis of gold and platinum nanoparticles using novel thiol-functionalized ionic liquids[J]. Langmuir,2004,20(3):556-560. |
| [15] | Zhou Y,Antonietti M. Synthesis of very small TiO2 nanocrystals in a room-temperature ionic liquid and their self-assembly toward mesoporous spherical aggregates[J]. Journal of the American Chemical Society,2003,125(49):14960-14961. |
| [16] | Taubert A. CuCl nanoplatelets from an ionic liquid-crystal precursor[J]. Angewandte Chemie-International Edition,2004,43(40):5380-5382. |
| [17] | Brezesinski T,Erpen C,Iimura K,Smarsly B. Mesostructured crystalline ceria with a bimodal pore system using block copolymers and ionic liquids as rational templates[J]. Chemistry of Materials,2005,17(7):1683-1690. |
| [18] | Scheeren C W,Machado G,Dupont J,Fichtner P F P,Texeira S R. Nanoscale Pt(0) particles prepared in imidazolium room temperature ionic liquids: synthesis from an organometallic precursor,characterization,and catalytic properties in hydrogenation reactions[J]. Inorganic Chemistry,2003,42(15):4738-4742. |
| [19] | Nishimura N,Ohno H. Design of successive ion conduction paths in DNA films with ionic liquids[J]. Journal of Materials Chemistry,2002,12(8):2299-2304. |
| [20] | Nishimura N,Nomura Y,Nakamura N,Ohno H. DNA strands robed with ionic liquid moiety[J]. Biomaterials,2005,26(27):5558-5563. |
| [21] | Qin W D,Li S F Y. Electrophoresis of DNA in ionic liquid coated capillary[J]. Analyst,2003,128(1):37-41. |
| [22] | Wang J H,Cheng D H,Chen X W,Du Z,Fang Z L. Direct extraction of double-stranded DNA into ionic liquid 1-butyl-3-methylimidazolium hexafluorophosphate and its quantification[J]. Analytical Chemistry,2007,79(2):620-625. |
| [23] | Shimojo K,Kamiya N,Tani F,Naganawa H,Naruta Y,Goto M. Extractive solubilization,structural change, and functional conversion of cytochrome c in ionic liquids via crown ether complexation[J]. Analytical Chemistry,2006,78(22):7735-7742. |
| [24] | Bagheri M,Rodríguez H,Swatloski R P,Spear S K,Daly D T,Rogers R D. Ionic liquid-based preparation of cellulose dendrimer films as solid supports for enzyme immobilization[J]. Biomacromolecules,2008,9(1):381-387. |
| [25] | Shimojo K,Nakashima K,Kamiya N,Goto M. Crown ether-mediated extraction and functional conversion of cytochrome c in ionic liquids[J]. Biomacromolecules,2006,7(1):2-5. |
| [26] | Phillips D M,Drummy L F,Conrady D G,Fox D M,Naik R R,Stone M O,Trulove P C,De Long H C,Mantz R A. Dissolution and regeneration of bombyx mori silk fibroin using ionic liquids[J]. Journal of the American Chemical Society,2004,126(44):14350-14351. |
| [27] | Wang S F,Chen T,Zhang Z L,Shen X C,Lu Z X,Pang D W,Wong K Y. Direct electrochemistry and electrocatalysis of heme proteins entrapped in agarose hydrogel films in room-temperature ionic liquids[J]. Langmuir,2005,21(20):9260-9266. |
| [28] | Lu X,Hu J,Yao X,Wang Z,Li J. Composite system based on chitosan and room-temperature ionic liquid:direct electrochemistry and electrocatalysis of hemoglobin[J]. Biomacromolecules,2006,7(3):975-980. |
| [29] | Wang S F,Chen T,Zhang Z L,Pang D W. Activity and stability of horseradish peroxidase in hydrophilic room tempe-rature ionic liquid and its application in non-aqueous biosen-sing[J]. Electrochemistry Communications,2007,9(6):1337-1342. |
| [30] | Xie Y N,Wang,S F,Zhang Z L,Pang D W. Interaction between room temperature ionic liquid [bmim]BF4 and DNA investigated by electrochemical micromethod[J]. Journal of Physical Chemistry B,2008,112(32):9864-9868. |
| [31] | Tanford C. The Hydrophobic Effect: Formation of Micelles and Biological Membranes[M]. New York:Wiley Interscience,1980. |
| [32] | Ding Y H,Shu Y,Ge,L L,Guo R. The effect of sodium dodecyl sulfate on the conformation of bovine serum albumin[J]. Colloids and Surfaces A-Physicochemical and Engineering Aspects,2007,298(3):163-169. |
| [33] | Patel R,Kumari M,Khan A B. Recent advances in the applications of ionic liquids in protein stability and activity: a review[J]. Applied Biochemistry and Biotechnology,2014,172(8):3701-3720. |
| [34] | Constatinescu D,Herrmanna C,Weingärtner H. Patterns of protein unfolding and protein aggregation in ionic liquids[J]. Physical Chemistry Chemical Physics,2010,12(8):1756-1763. |
| [35] | Weingärtner H,Cabreleb C,Herrmannc C. How ionic liquids can help to stabilize native proteins[J]. Physical Chemistry Chemical Physics,2012,14(2):415-426. |
| [36] | Singh T,Boral S,Bohidar H B,Kumar A. Interaction of gelatin with room temperature ionic liquids:a detailed physicochemical study[J]. Journal of Physical Chemistry B,2010,114(25):8441-8448. |
| [37] | Geng F,Zheng L,Yu L,Li G,Tung C. Interaction of bovine serum albumin and long-chain imidazolium ionic liquid measured by fluorescence spectra and surface tension[J]. Process Biochemistry,2010,45(3):306-311. |
| [38] | Yan H,Wu J Y,Dai G L,Zhong A. G,Chen H,Yang J G,Han D. Interaction mechanism of ionic liquids [Cnmim]Br (n= 4,6,8) with bovine serum albumin [J]. Journal of Luminescene,2012,132(3):622-628. |
| [39] | Wang X Q,Liu J,Sun L M,Yu L,Jiao J J,Wang R. Interaction of bovine serum albumin with ester-functionalized anionic surface-active ionic liquids in aqueous solution:a detailed physicochemical and conformational study[J]. Journal of Physical Chemistry B,2012, |




