2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, P.R.China
发展廉价、高效的催化剂一直是人工光合成领域科学家关注的焦点。早在20世纪80年代,科学家就发现镍氧化物/镍的复合结构可作为光催化产氢过程中的催化中心,并有着很好的催化效果[1]。随后,一系列的镍氧化物或者氢氧化物的催化产氢活性被不断报道[2,3,4,5,6,7]。
随着研究的深入,人们发现硫化镍亦具有优异的催化产氢活性。Xu等[8]通过研究证实NiS由于高的电化学活性、部分金属性质、不饱和的镍配位环境,以及合适的费米能级,具有优异的产氢催化活性[8]。事实上,关于NiS用于光催化产氢的研究已有一定报道。Domen小组在2010年发现分散在溶液中的NiS催化产氢活性甚至高于负载在半导体表面的贵金属铑[9]。张金龙等[10]通过 水热法将NiS负载于TiO2上,发现负载NiS的体系催化产氢活性较TiO2本身提高了30倍。余家国小组也证明了通过水热法形成的NiS-CdS纳米棒材料催化产氢效果甚至高于Pt颗粒负载的CdS纳米棒[11]。Xu等[12]通过水热的方法将NiS直接负载在CdS纳米颗粒上,体系用于光催化产氢的效率可达51.3%。随后,该小组又通过水热合成得到NiS纳米颗粒,在使用赤藓红作为电子牺牲体时,于520 nm处产氢量子效率可以达到15%[8]。最近,他们再次通过水热法将NiS负载在g-C3N4上,相比单独的g-C3N4,负载有NiS的g-C3N4材料催化活性提高了250倍[13]。需要指出的是,在这些体系中NiS表现出良好的催化产氢活性,但NiS的制备往往是通过水热法实现,方 法相对单一。 本文中,我们发展了一种非水热制备CN-NiS催化剂的方法。以硫化的聚苯胺PANI-S为模板及硫源,通过将其与氯化镍混合后高温煅烧,制备得到负载硫化镍的碳氮纳米管(CN-NiS)。通过扫描电子显微镜(SEM)、透射电子显微镜(TEM)、X-射线固体粉末衍射(XRD)和光电子能谱(XPS)等表征方法,证实了CN-NiS的组成、结构及形貌特征。使用荧光素作为光敏剂,三乙胺作为电子牺牲体,在最优条件下,基于CN-NiS的光催化体系产氢效率可达18.6 mmol·g-1·h-1。 1 实验部分 1.1 试剂与仪器
苯胺、酒石酸和过硫酸铵购自国药集团化学试剂有限公司,曙红和荧光素购自Alfa Alsa,六水合氯化镍购自天津市津科精细化工研究所,浓盐酸(HCl)、三乙胺、三乙醇胺和二硫化碳购自北京化工试剂厂。
采用日立公司S-4800扫描电子显微镜、日本电子株式会社JEM-2100F透射电子显微镜对材料进行表征;采用岛津UV-1601紫外可见分光光度计进行用紫外-可见吸收光谱测量;采用ESCALAB250型X射线光电子能谱对材料进行XPS分析;采用Shimadzu GC-14B气相色谱工作站进行反应气体定量分析;采用Bruker D8 X射线多晶衍射粉末仪进行XRD测试。 1.2 实验过程 1.2.1 聚苯胺纳米管PANI的制备
本文中采用软模板法合成聚苯胺纳米管,其优点在于不需要破坏模板,且形貌尺度易控制。具体操作如下[14]:将375 mg (10 mmol)酒石酸溶于50 mL去离子水中,待溶液澄清透明后,向其中加入二次蒸馏过的苯胺913 μL (2.5 mmol),分别在室温和0 ℃下搅拌30 min。再向其中迅速加入预先于0 ℃下冷却30 min的0.2 mol/L过硫酸铵溶液(50 mL),继续搅拌5 min后,0 ℃下静置12 h。反应结束后,抽滤并反复洗涤所得固体,50 ℃条件下干燥12 h,得墨绿色产物,研磨后干燥保存。 1.2.2 硫化聚苯胺PANI-S的制备
取0.1 g聚苯胺和0.4 g升华硫溶于二硫化碳中并均匀混合。待二硫化碳完全挥发后,将混合物转移至反应釜中,氩气保护下升温至155 ℃和280 ℃分别反应12 h,自然冷却后取出,研磨得黑色样品。 1.2.3 负载NiS的碳氮材料CN-NiS的制备
取0.1 g硫代聚苯胺与0.37 g六水合氯化镍混合并仔细研磨后,转移至管式炉中进行煅烧。氩气保护下,先以3 ℃/min升温至200 ℃反应1 h,再以6.7 ℃/min升温至600 ℃反应2 h,随后使体系自然冷却(具体升温曲线如图1所示),得黑色固体,研磨后用水反复洗涤以除去过量的镍盐。
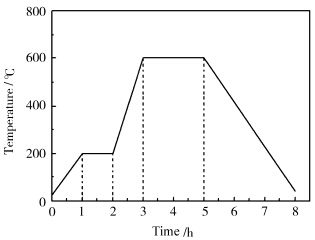 | 图1 PANI-S与NiCl2煅烧以制备CN-NiS的具体升温曲线 Heating curve for preparation of CN-NiS from PANI-S and NiCl2 |
光催化产氢反应在Schlenk管中进行。以最优条件下的产氢实验为例,在Schlenk管中加入2 mg CN-NiS、10 mmol荧光素、0.25 mL三乙胺。补加二次水使溶液总体积为5 mL,调节体系pH,通氮气30 min以除去溶液和管内残留的空气,再向体系中注入1 mL的甲烷标准气体。体系密封后,将其转移至LED灯下进行光照。体系所产生的氢气量使用内标法进行检测,其中氢气对甲烷的响应因子为3.93。 2 结果与讨论 2.1 CN-NiS的表征
我们首先以酒石酸为软模板,制得聚苯胺(PANI)的纳米管(见图2a,图2b),随后使用单质硫对其进行硫化,得到硫化的聚苯胺(PANI-S,图2c,图2d)。如图2所示,聚苯胺PANI和硫化后的聚苯胺PANI-S均为管状结构,且其表面较为粗糙,这和文献报道的结果一致[14]。随后,我们以硫化的聚苯胺(PANI-S)为模板及硫源,将其与镍源混合,氩气保护下煅烧制得CN-NiS。通过SEM和TEM表征,引入镍盐煅烧后,CN-NiS在一定程度上保持了PANI及PANI-S的形貌,大部分仍为负载有很多小颗粒的纳米管状结构(图2e,图2f)。进一步地,TEM表明CN-NiS在100 nm视野下结构为多孔洞的薄膜状堆积物,与文献报道的一些g-C3N4结构类似[15]。
 | 图2 PANI(a和b)、PANI-S(c和d)及CN-NiS(e和f)的SEM图 SEM images of PANI (a and b), PANI-S (c and d) and CN-NiS(e and f) |
同时,我们还观察到该薄膜上负载有一定数量的纳米颗粒,其尺寸最大可达上百纳米,我们推测这些纳米颗粒可能为NiS(图3)。XRD表征(图4)进一步证实了这一推测,CN-NiS样品在29.98、34.43、45.53和53.23的四个高强度衍射峰分别对应于NiS(PDF卡片号为65-5762)的(100)、(101)、(102)和(110)晶面,且其峰强度亦与卡片数据很好地吻合,证明得到的CN-NiS材料中含有六方晶系结构的NiS。通过CN-NiS材料的TEM电镜图谱晶面距分析,我们可以明显观察到NiS(100)晶面的存在(对应的晶面距为2.9 Å,图3d),进一步证明了体系中NiS的生成。
 | 图3 CN-NiS的TEM图 TEM images of CN-NiS |
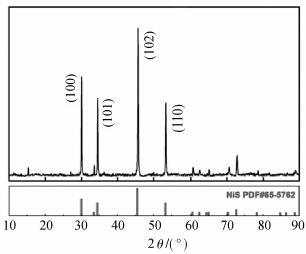 | 图4 CN-NiS样品的XRD谱图及其主要衍射峰归属 The XRD patterns of CN-NiS and the identification of the main peaks |
XPS分析进一步给出了CN-NiS中元素的组成及化学态,实验证实,CN-NiS中存在C、N、S和Ni四种元素(图5及表1)。对于N元素而言,其1s轨道在398.45 eV的结合能对应于聚苯胺上的胺基结构,而在400.40 eV处的结合能可归属为体系存在除氧不完全所引入的氮氧键结构。对于S元素,其2p 3/2轨道在161.35、163.52、167.08 eV结合能则分别对应于NiS(还原态的硫)、体系在氧化过程中引入的S—S键结构(零价硫)、硫氧化物(氧化态的硫)。其中还原态的硫元素原子百分含量为1.75。而Ni元素的2p 3/2和2p 1/2轨道峰位置分别位于854.4 eV和872.2 eV,两者相距17.8 eV,与文献中所报道的NiS材料有着很好的吻合[16]。实验测得Ni元素的原子百分含量为2.23,而体系中Ni(Ⅱ)与还原态的S的比例为1.3,说明体系中除了NiS外,可能还含有少量残留的二价镍。根据XPS给出的各元素含量结果分析,可估算出NiS在CN-NiS中的质量百分数为17.1%。
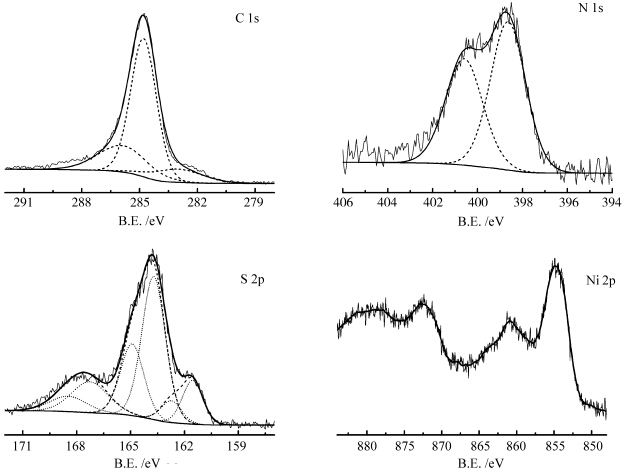 | 图5 CN-NiS中各元素谱图的拟合结果 High resolution of XPS data of the component in CN-NiS |
| 表1 CN-NiS材料的XPS具体数据分析及其元素个组分含量分析 Analysis of different components of elements invovled in CN-NiS |
为了避免体系中贵金属的使用,我们分别利用氧杂蒽类有机染料曙红或荧光素为光敏剂,CN-NiS为催化剂,三乙胺为电子牺牲体构筑光催化产氢体系。使用曙红时,产氢体系的颜色在光照下很快由荧光红变成了荧光绿。通过对光照前后体系吸收光谱的对比(图6),我们发现溶液中曙红在516 nm处的特征吸收峰已经完全消失,同时溶液在488 nm处出现了新的吸收峰,且其吸收光谱的形状与荧光素的吸收光谱高度相似。这说明在光照条件下,曙红发生脱溴反应生成了荧光素[17]。而使用荧光素作为光敏剂时,体系的催化效率及稳定性都相对较好。
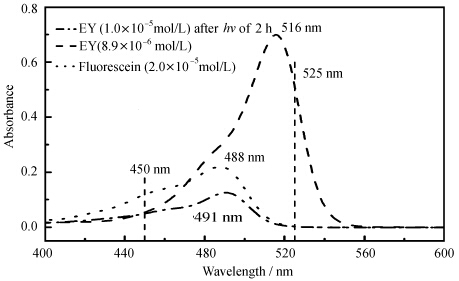 | 图6 曙红(EY)和荧光素(Fl)以及基于CN-NiS和曙红的产氢体系光照2 h后的吸收光谱 Absorption spectra of EY, Fl and system with CN-NiS and EY for hydrogen evolution after illumination of 2 h |
研究还发现,当体系不含有CN-NiS时(图7),基本检测不到氢气。而体系中不含镍元素,仅有聚苯胺或是硫化的聚苯胺时,体系中的产氢量也十分少,这从一定程度上说明了CN-NiS中镍元素 在产氢体系中的重要性。进一步地,当体系中仅有镍元素或是将硫化聚苯胺与镍盐简单混合后,其产氢活性仍远小于CN-NiS。另一方面,如果CN-NiS没有经过水洗,即未除去体系中未反应的氯化镍时,体系的产氢活性也会出现明显的下降。这说明镍与硫元素键合后形成的NiS是更好的催化位点,催化产氢活性主要来自于NiS。
 | 图7 使用0.1 mmol/L的EY、15%的TEA和3 mg的不同催化材料所构筑的5 mL光催化产氢体系在使用LED光源(525 nm)光照2 h后的产氢量 Hydrogen amounts evolved from systems containing of 0.1 mmol/L EY, 15% TEA and 3 mg of various materials in 5 mL solution after illumination of 2 h with LED light source (525 nm) |
向体系中引入不同的电子牺牲体同样表现出不同的产氢效率。从图8a可以看出,当使用甲醇作为电子牺牲体时,体系基本上不产氢。当使用三乙醇胺(TEOA)时,产氢体系的效率会明显受到pH的影响[18]:随着体系pH值由碱性减小接近至中性,产氢效率增强。而三乙胺(TEA)作为电子牺牲体时,体系产氢效果明显优于三乙醇胺及甲醇。我们还对体系中三乙胺的用量进行了考察。从图8b可以看出,TEA的含量在5%到25%的范围内时,体系的产氢量相当,5%含量的三乙胺已足够用于有效地捕获光生空穴,体系的产氢效率更多受光敏单元和催化单元之间的电子转移或者后续的催化过程的影响。
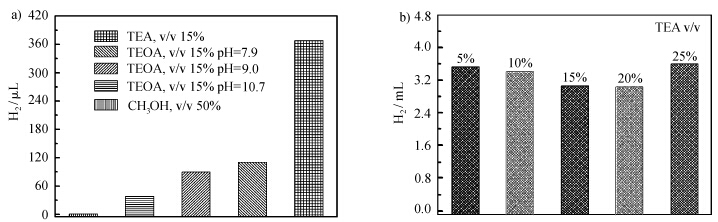 | 图8 a)基于CN-NiS的产氢体系中不同的电子牺牲体对产氢的影响 产氢体系的组成:曙红0.1 mmol/L、CN-NiS 3 mg、溶液总体积5 mL,使用LED(525 nm)光源光照2h;b)基于CN-NiS的产氢体系中不同含量的TEA对产氢的影响 产氢体系的组成:荧光素0.1 mmol/L、CN-NiS 3 mg、溶液总体积5 mL,使用LED(525 nm)光源光照5 h a) Effect of different electron donors on the efficiency of hydrogen evolution system, composed of 0.1 mmol/L EY and 3 mg CN-NiS in 5 mL solution, after illumination of 2 h with LED (525 nm) light source; b) Effect of different amounts of TEA on the efficiency of hydrogen evolution system, composed of 0.1 mmol/L Fl and 3 mg CN-NiS in 5 mL solution, after illumination of 5 h with LED (525 nm) light source |
接着,我们研究了pH值对体系产氢效率的影响。从图9可以看出,当体系pH值为12.67(即不调节pH)时,体系的产氢效率最高,而随着体系中pH值的逐渐下降,产氢效率也依次降低,当体系pH达到中性时,基本上不产氢,这和文献报道一致[19]。对于有机染料荧光素而言,体系的碱性越强,荧光素相对越稳定。而三乙胺在高的pH条件下亦是更好的电子牺牲体。在pH较低的情况下,三乙胺容易发生质子化,给出电子的能力下降,同时给出电子后的三乙胺正离子自由基TEA+·也不容易脱除质子发生进一步的解离。结合pH值对光敏单元和电子牺牲体的影响,说明在较碱性的环境更有利于体系的产氢。
 | 图9 a)基于CN-NiS的产氢体系中不同的电子牺牲体对产氢的影响 产氢体系的组成:曙红0.1 mmol/L、CN-NiS 3 mg、溶液总体积5 mL,使用LED(525 nm)光源光照2h;b)基于CN-NiS的产氢体系中不同含量的TEA对产氢的影响 产氢体系的组成:荧光素0.1 mmol/L、CN-NiS 3 mg、溶液总体积5 mL,使用LED(525 nm)光源光照5 h a) Effect of different electron donors on the efficiency of hydrogen evolution system, composed of 0.1 mmol/L EY and 3 mg CN-NiS in 5 mL solution, after illumination of 2 h with LED (525 nm) light source; b) Effect of different amounts of TEA on the efficiency of hydrogen evolution system, composed of 0.1 mmol/L Fl and 3 mg CN-NiS in 5 mL solution, after illumination of 5 h with LED (525 nm) light source |
最后,我们研究了体系中CN-NiS用量对产氢的影响。如图10所示,当体系中引入CN-NiS后,体系的催化效率出现了明显的增加,且产氢效率随着CN-NiS用量的增加也相应增加。但是,当CN-NiS用量增加到2 mg以上时,体系的产氢效率开始下降。这是因为,CN-NiS作为体系的催化中心,刚开始其用量的增加使得体系中光生电子利用率增加,有助于体系产氢效率的提高。但是CN-NiS材料本身为黑色,过多的CN-NiS会影响体系的吸光,使得体系中光敏剂可利用的光子数下降。
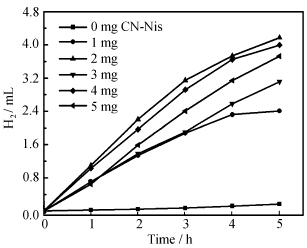 | 图10 CN-NiS不同用量对产氢体系效率的影响产氢体系的具体组成:V(EtOH)=V(H2O)=2.5 mL,V(TEA)=0.25 mL,Fl 2 mmol/L;光源:LED(525 nm),体系pH = 12.7 The effect of different amounts of CN-NiS on the efficiency for hydrogen evolution in systems involving 2.5 mL EtOH, 2.5 mL H2O, 0.25 mL TEA and 2 mmol/L Fl, without adjustment of the pH value. Light source: LED (525 nm) |
综上所述,我们考察了最优条件下体系的光催化效率,使用2 mmol/L荧光素及5%体积的三乙胺,在5 mL产氢体系中,2 mg CN-NiS的产氢寿命约为5 h,产氢量为186 μmol(4.2 mL)。随后,我们对光照后的样品进行离心洗涤回收,并重新加入到荧光素和三乙胺溶液中进行新一轮的光照,实验结果显示CN-NiS依然具有较好的产氢活性。这说明CN-NiS作为催化中心的稳定性较好,体系失活的原因可能是由于有机光敏剂荧光素的分解。事实上,当体系不再产氢后,体系的颜色由溶液最初较浓的翠绿色(荧光素的颜色)明显变为了较浅的暗绿色,这也从一定程度上证实了我们的推测。 3 结论
本文以聚苯胺为前驱体及模板,经过对其硫化及后续的煅烧,成功制备了NiS负载的碳氮纳米管。光催化产氢实验表明非水热法制备得到的CN-NiS有着明显的催化活性。使用荧光素和三乙胺分别作为光敏单元和电子牺牲体,体系在5 h内的产氢效率可达186 μmol,基于CN-NiS的催化效率可以达18.6 mmol·h-1·g-1(图11)。相比其它文献中通过水热法制备的NiS催化剂,我们的合成方法为NiS催化剂的制备提供了一种新思路。
 | 图11 在三乙胺(TEA)为电子牺牲体,荧光素(Fl)为光敏剂时, 基于CN-NiS催化剂体系的光催化产氢机理。结合三乙胺的浓度大小,受激后的荧光素在此更容易发生还原性猝灭 The photocatalytic hydrogen evolution mechanism for system involving TEA as the electron donor, Fl as the photosensitiser and CN-NiS as the catalyst. Here, Fl is more likely to be reductively quenched with consideration of the concentration of TEA |
| [1] | Kudo A, DomenK, Maruya K I, Onishi T. Photocatalytic activities of TiO2 loaded with NiO[J].Chemical Physics Letters,1987,133(6): 517-519. |
| [2] | Ran J, Yu J, Jaroniec M. Ni(OH)2 modified CdS nanorods for highly efficient visible-light-driven photocatalytic H2 generation[J].Green Chemistry,2011,13(10): 2708-2713. |
| [3] | Khan Z, Khannam M, Vinothkumar N, DeM, Qureshi M. Hierarchical 3D NiO-CdS heteroarchitecture for efficient visible light photocatalytic hydrogen generation[J]. Journal of Materials Chemistry,2012,22(24): 12090-12095. |
| [4] | Townsend T K, Browning N D, Osterloh F E. Overall photocatalytic water splitting with NiOx-SrTiO3 - a revised mechanism[J]. Energy & Environmental Science,2012,5(11): 9543-9550. |
| [5] | Zeng P, Zhang X, Zhang X, Chai B, Peng T. Efficient photocatalytic hydrogen production over Ni@C/TiO2 nanocomposite under visible light irradiation[J]. Chemical Physics Letters,2011,503(4-6): 262-265. |
| [6] | Shimizu K, Itoh S,Hatamachi T,Kodama T,Sato M, Toda K. Photocatalytic water splitting on Ni-intercalated ruddlesden-Popper tantalate H2La2/3Ta2O7[J]. Chemistry of Materials,2005,17(20): 5161-5166. |
| [7] | Kato H, Asakura K, Kudo A. Highly efficient water splitting into H2 and O2 over lanthanum-doped NaTaO3 photocatalysts with high crystallinity and surface nanostructure[J]. Journal of the American Chemical Society,2003,125(10): 3082-3089. |
| [8] | Zhang W, Xu R. Hybrid photocatalytic H2 evolution systems containing xanthene dyes and inorganic nickel based catalysts[J]. International Journal of Hydrogen Energy,2012,37(23): 17899-17909. |
| [9] | Tabata M, Maeda K, Ishihara T, Minegishi T, Takata T, Domen K. Photocatalytic hydrogen evolution from water using copper gallium sulfide under visible-light irradiation[J]. Journal of Physical Chemistry C,2010,114(25): 11215-11220. |
| [10] | Zhang L, Tian B, Chen F, Zhang J. Nickel sulfide as co-catalyst on nanostructured TiO2 for photocatalytic hydrogen evolution[J]. International Journal of Hydrogen Energy,2012,37(22): 17060-17067. |
| [11] | Zhang J, Qiao S Z, Qi L, Yu J. Fabrication of NiS modified CdS nanorod p-n junction photocatalysts with enhanced visible-light photocatalytic H2-production activity[J]. Physical Chemistry Chemical Physics,2013,15(29): 12088-12094. |
| [12] | Zhang W, Wang Y, Wang Z, Zhong Z, Xu R. Highly efficient and noble metal-free NiS/CdS photocatalysts for H2 evolution from lactic acid sacrificial solution under visible light[J]. Chemical Communication,2010,46(40): 7631-7633. |
| [13] | Hong J, Wang Y, Wang Y, Zhang W, Xu R. Noble-metal-free NiS/C3N4 for efficientphotocatalytichydrogen evolution from water[J]. ChemSusChem,2013,6(12): 2263-2268. |
| [14] | Xiao L, Cao Y, Xiao J, Schwenzer B, Engelhard M H, Saraf L V, Nie Z, Exarhos G J, Liu J. A soft approach to encapsulate sulfur: polyaniline nanotubes for lithium-sulfur batteries with long cycle life[J]. Advanced Materials,2012,24(9): 1176-1181. |
| [15] | Hou Y, Laursen A B, Zhang J, Zhang G, Zhu Y, Wang X, Dahl S, Chorkendorff I. Layered nanojunctions for hydrogen-evolution catalysis[J]. Angewandte Chemie International Edition,2013,52(13): 3621-3625. |
| [16] | Li N, Zhou B, Guo P, Zhou J, Jing D. Fabrication of noble-metal-free Cd0.5Zn0.5S/NiS hybrid photocatalyst for efficient solar hydrogen evolution[J]. International Journal of Hydrogen Energy,2013,38(26): 11268-11277. |
| [17] | Jeong HW, Park H. Carbon-catalyzed dye-sensitization for solar hydrogen production[J]. Catalysis Today,2014,230(0): 15-19. |
| [18] | Lazarides T, McCormick T, Du P, Luo G, Lindley B, Eisenberg R. Making hydrogen from water using a homogeneous system without noble metals[J]. Journal of the American Chemical Society,2009,131(26): 9192-9194. |
| [19] | Han Z, McNamara W R, Eum M-S, Holland P L, Eisenberg R. A nickel thiolate catalyst for the long-lived photocatalytic production of hydrogen in a noble-metal-free system[J]. Angewandte Chemie International Edition,2012,51(7): 1667-1670. |




