香豆素类荧光染料具有荧光量子产率较高、分子量小、生物相容性好、合成简单且结构易修饰的特点,被广泛应用于生物医学[1,2]、荧光探针[3,4]和激光染料[5,6]等领域,但受其结构本身的影响,吸收发射一般位于蓝紫色区域,一定程度上限制了它的应用。香豆素母体本身不具有荧光发射性能,它的荧光发射功能在很大程度上取决于香豆素母体环的修饰。常见的是在7-位引入推电子基团(如羟基、烷基、烷氧基或烷氨基等),在3-位或4-位引入拉电子基团(如醛基,也便于进一步修饰),形成典型的分子内电荷转移(ICT)化合物,可以很大程度的改变香豆素荧光发射波长范围[7]。然而仅靠外围取代基的修饰,对香豆素化合物的发光波长的调节范围毕竟有限,为此我们设想:如果我们能够在香豆素母体环上增加一个苯环,这不仅增大了其π共轭体系,同时还可以保留其刚性环的结构,避免外围取代修饰带来的量子效率下降的弊端,将可以有效的扩展其发射波长范围,得到一类具有较长发射波长的荧光发色团。
基于以上设想,通过在7-(N,N-二乙氨基)-3-甲酰基香豆素醛(CA)母环上增加一个苯环,我们合成了具有长波长发射的8-二乙氨基-2-氧-2H-苯并[h]香豆素醛(BCA)(图1)。利用吸收光谱和荧光光谱比较了CA和BCA在二氯甲烷中的光物理性质,并研究了其在不同极性溶剂中吸收光谱和荧光光谱的变化情况,探索了溶剂极性与化合物BCA光物理性质之间的关系。
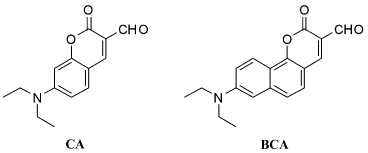 | 图1 CA和BCA的结构 Structures of CA and BCA |
实验中所用叔丁醇钾购自Alfa Aesar公司;3,3-二乙氧基丙腈、碘甲烷、氢氧化钠均为北京化学试剂公司产品,分析纯,使用前未作进一步纯化;光谱分析中所用的水为去离子水;溶剂效应研究所用溶剂均为色谱纯。
实验中的荧光光谱和吸收光谱分别在Hitachi F-4500荧光光谱仪和Hitachi U-3010型吸收光谱仪上测定。1HNMR、13CNMR在Bruker-400(400 MHz)型核磁共振仪上测定;质谱在Finnigan 4021C型质谱仪和APEXII FT-ICR型质谱仪上测定;化合物的熔点在X-4显微熔点仪上测定。 1.2 合成实验 1.2.1 BCA的合成
BCA的合成路线如图2所示。
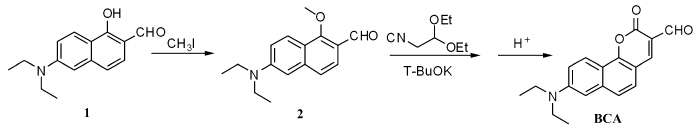 | 图2 化合物BCA的合成路线 Synthesis of BCA |
(1) 6-二乙氨基-1-羟基萘酚-2-甲醛(1)的合成
根据文献[8],合成化合物1,经核磁共振和质 谱分析鉴定,结构与文献报道一致。
(2) 6-二乙氨基-1-甲氧基-2-甲醛(2)的合成
0.48 g化合物1(2 mmol)溶于15 mL乙腈,加入1.2 g K2CO3,搅拌条件下加入过量的CH3I(1.5 mL)。体系加热到70 ℃,TLC检测反应,3 h后反应完全。冷却至室温,减压旋出溶剂,加入水和乙酸乙酯,分层,萃取,有机相用无水硫酸镁干燥过夜。去除溶剂后,粗产品经柱层析分离(石油醚∶乙酸乙酯=10∶1)得到浅黄绿色固体(0.51 g)。产率为90%,熔点:94~96 ℃。1HNMR(400 MHz,CDCl3):10.47 (s,1H),8.13 (s,1H),7.77 (s,1H),7.42 (s,1H),7.26 (s,1H),7.19 (s,1H),4.12 (s,3H),3.52 (d,J=5.3 Hz,4H),1.27 (t,J=7.1 Hz,6H). 13CNMR (100 MHz,CDCl3):188.74,163.32,148.43,140.88,124.96,123.62,122.66,121.34,115.56,105.55,77.26,77.05,76.73,65.45,44.81,12.68. EI-MS M+,calc. for C16H19NO2,257.1;found,257.1。
(3) BCA的合成
将80 mg叔丁醇钾溶于5 mL无水THF,形成悬浊液,向体系中滴加3,3-二乙氧基丙腈(70 μL)的THF溶液(3 mL),反应液呈桔黄色。再称取100 mg化合物2(0.39 mmol)溶于5 mL无水THF,直接加到反应体系中。在40 ℃反应过夜,停止反应。反应液浓缩后,加入水并调节反应液pH值为中性,用乙酸乙酯萃取有机相,合并有机相后干燥。柱色谱分离出黄绿色荧光点后,将其溶解到乙醇和水的混合溶剂中,加入1 mol/L的盐酸,在回流温度下反应1 h。停止反应,用KOH 中和反应液至中性,乙酸乙酯萃取反应液,干燥。柱色谱分离(乙酸乙酯∶石油醚=6∶1),收集红色产物点,乙酸乙酯-正己烷重结晶,得到针状晶体。产率约30%,熔点:216 ℃。1HNMR (CDCl3,400 MHz): 1.28(t,J=7.1Hz,6H),3.54 (q,J=7.1Hz,4H),6.85 (s,1H),7.15(dd,1H),7.34~7.42(m,2H),8.39(d,J=9.4Hz,1H),8.43(s,1H),10.24(s,1H); 13CNMR (CDCl3,100 MHz): 12.8,44.9,105.1,110.9,113.6,115.7,117.1,123.8,125.5,139.6,146.4,149.6,155.7,161.4,188.0; EI-MS M+,calc. for C18H17NO3,295.1205; found,295.1208。 1.2.2 CA的合成
根据文献[9]合成CA。经核磁共振和质谱分析鉴定,结构与文献报道一致。 1.3 光谱测试
称取一定量的固体化合物BCA和CA,选取不同极性的溶剂,分别配成5.0×10-6mol/L的溶液,测试时用移液枪吸取2 mL溶液于石英液槽中,采用相应波长激发,测试温度为室温。 1.4 荧光量子产率测定
纯溶液中荧光量子产率:CA以硫酸奎宁为参比(1 N H2SO4中荧光量子产率为0.6)[10];BCA以罗丹明B为参比(水中的荧光量子产率为0.31)[11],采用稀溶液方法测定,计算公式为:
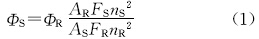
BCA在香豆素母体上比CA多了一个苯环,分子的共轭体系增大。我们对比了两者在二氯甲烷中的光物理性质,如图3所示,与CA相比,BCA最大吸收峰和发射峰均发生了明显的红移。表1列出了二者在二氯甲烷中的光物理数据,相对于化合物CA,BCA的吸收峰和发射峰分别红移了44 nm和80 nm,Stokes位移增大了2倍,荧光量子产率略有降低,这主要是由于共轭体系增大,化合物能隙降低,非辐射衰变的速率常数增加,使吸收和发射光谱发生红移,荧光量子效率降低。鉴于BCA与CA类似的优异光物理性质,预计BCA有望成为荧光探针的新型长波长荧光发色团。
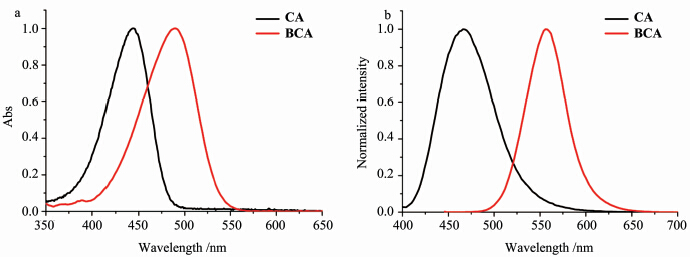 | 图3 二氯甲烷中CA和CBA的吸收(a)和发射(b)光谱 The absorption (a) and fluorescence spectra (b) of CA and BCA in CH2Cl2 |
| 表1 二氯甲烷中CA与BCA的光物理性质对比a The photophysical property of BCA in contrast to CA in CH2Cl2a |
许多荧光分子,如ICT化合物,其光谱特别是荧光光谱易受溶剂极性的影响。因此我们进一步考察了BCA在不同极性溶剂中的吸收和荧光光谱。如图4所示,随着溶剂极性的增大,BCA的吸收峰值波长略有红移,颜色从浅绿色经橙色变到粉色(图5a),表明溶质分子在基态与溶剂间存在着相互作用,反映了随着环境的改变(溶剂极性)其分子内电荷转移的程度也有所改变。由于具有ICT特征,BCA的发射峰值随着溶剂极性的增大而呈现非常明显的红移,由正己烷到DMSO,红移了54 nm。紫外灯照射下,溶液颜色经历了从蓝绿色→绿色→橙色→红色的变化(图5b),同时发光强度也逐渐减弱,说明BCA激发态的极性随着溶剂极性增大而增大,导致荧光光谱随溶剂极性增大而向长波方向移动[12]。
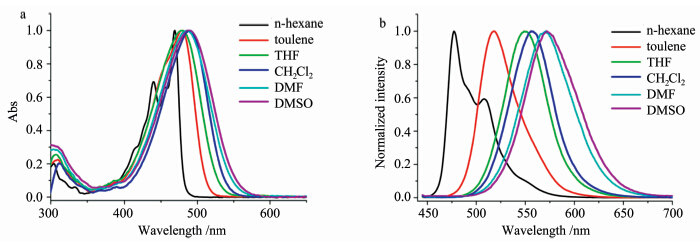 | 图4 BCA在不同溶剂中的吸收(a)和荧光光谱(b) The absorption (a) and fluorescence spectra (b) of BCA in different solvents |
 | 图5 BCA在不同极性溶剂中(5 μmol/L)在可见光(a)和紫外光(b)下的图片 1.正己烷,2.甲苯,3. 四氢呋喃,4.二氯甲烷,5. N,N-二甲基甲酰胺,6. 二甲亚砜 The pictures of BCA irradiated by visible or UV light in different solvents 1. n-hexane; 2. toluene; 3. THF; 4. CH2Cl2; 5. DMF; 6. DMSO |
溶剂-溶质间的作用通常是比较复杂的,笼统的说可以将溶剂-溶质间的作用归纳为非特异性作用(non-specific interaction)和特异性作用(specific interaction)[13]。非特异性作用通常由溶剂的折光指数(n)和介电常数(ε)来决定,而特异性作用通常是指氢键、电荷转移、质子转移形成复合物等情况。这些作用往往会导致分子整个电子结构的改变,如导致偶极矩变化,从而对光物理性质带来 影响。利用Lippert-Mataga方程[14]((2)式)可以估算BCA分子基态和激发态偶极矩的差值(Δμ=μe-μg):
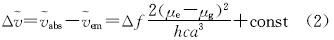
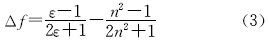
表2是BCA在一系列溶剂中的光谱数据,包括吸收、发射峰值、Stokes位移、量子产率以及溶剂的极性参数。
| 表2 BCA在不同极性溶剂中的光物理性质和溶剂极性参数aa The photophysical characteristic of BCA in different solvents and solvent polar parameter |
我们以BCA的Stokes位移(即Δν)对溶剂极性参数Δf之间作图(图6),利用其斜率,再根据方程(2)可以得到BCA基态与激发态偶极矩差值Δμ大约为14.6 D。从这个数值可以看出BCA在激发态具有比基态大得多的偶极矩,这也正是其发射光谱随着溶剂极性改变而具有明显的红移的主要原因。
 | 图6 BCA的Stokes位移(Δν)对溶剂极性参数Δf之间的关系 Lippert plot Stokes shift (Δν) vs orientational polarizability (Δf) for BCA |
此外,我们还考察了BCA在一系列溶剂中荧光量子产率的变化情况。由表2可知,BCA的荧光量子产率随着溶剂极性的增大而减小,这种规律在非质子性溶剂中具有良好的体现。这是由于溶剂极性增大,会加强溶剂和溶质分子间的相互作用,引起发光分子激发态能级下降,使能级间的间隙减小,增大无辐射跃迁,从而导致荧光量子产率降低。以极性参数Δf为横坐标,荧光量子产率Φf为纵坐标作图时,可以得到一个很好的线性关系(图7)。
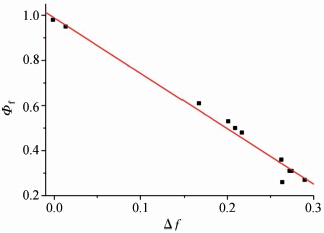 | 图7 BCA荧光量子产率与Mataga极性参数Δf 间的关系 Plot of fluorescence quantum yields of BCA vs Mataga polar parameter Δf |
本文设计并合成了一类新型的具有较长发射波长的苯并香豆素醛BCA。通过在香豆素的母体环上增加一个苯环结构,不仅有效的增加了其π共轭结构,而且保持了其固有的刚性结构,使BCA具有较高发光效率和较长发射波长。BCA具有明显的溶致变色效应,其发射波长在不同的极性溶剂中表现出较宽的变化范围,可以实现从蓝绿到红光的调节。BCA结构的特点及特殊光物理性质将有助于解决香豆素类荧光探针共轭体系小、发射波长短的问题。
| [1] | Chia Y C,Chang F R,Wang J C,Wu C C,Chiang M Y N,Lan Y H,Chen K S,Wu Y C. Antiplatelet aggregation coumarins from the leaves of Murraya omphalocarpa[J]. Molecules, 2008,13(1):122-128. |
| [2] | Dekic B R,Radulovic N S,Dekic V S,Vukicevic R D,Palic R M. Synthesis and antimicrobial activity of new 4-heteroarylamino coumarin derivatives containing nitrogen and sulfur as heteroatoms[J]. Molecules, 2010,15(4):2246-2256. |
| [3] | Xu Z C,Liu X,Pan J,Spring D R. Coumarin-derived transformable fluorescent sensor for Zn2+[J]. Chemical Communications, 2012,48(39):4764-4766. |
| [4] | Ray D,Nag A,Jana A,Goswami D,Bharadwaj P K. Coumarin derived chromophores in the donor-acceptor-donor format that gives fluorescence enhancement and large two-photon activity in presence of specific metal ions[J]. Inorganica Chimica Acta, 2010, 363(12):2824-2832. |
| [5] | Wolfbeis O S. Synthesis and properties of some new hydroxy substituted coumarin derived laser-dyes[J]. Monatshefte Für Chemie, 1978,109(6):1413-1421. |
| [6] | Raikar U S,Tangod V B,Mannopantar S R,Mastiholi B M. Ground and excited state dipole moments of coumarin 337 laser dye[J]. Optics Communications, 2010,283(21):4289-4292. |
| [7] | Czajkowski W,Kazmierska M. Coumarin-derived fluorescent dyes[J]. Przemysl Chemiczny, 2002,81(3):177-180. |
| [8] | Kim H M,Yang P R,Seo M S,Yi J S,Hong J H,Jeon S J,Ko Y G,Lee K J,Cho B R. Magnesium ion selective two-photon fluorescent probe based on a benzo[h]chromene derivative for in vivo imaging[J]. Journal of Organic Chemistry, 2007,72(6):2088-2096. |
| [9] | Chen J H,Liu W M,Ma J J,Xu H T,Wu J S,Tang X L,Fan Z Y,Wang P F. Synthesis and properties of fluorescence dyes: tetracyclic pyrazolo[3,4-b]pyridine-based coumarin chromophores with intramolecular charge transfer character[J]. Journal of Organic Chemistry, 2012,77(7):3475-3482. |
| [10] | Eaton D F. Reference materials for fluorescence measurement[J]. Pure and Applied Chemistry, 1988,60(7):1107-1114. |
| [11] | Magde D,Rojas G E,Seybold P G. Solvent dependence of the fluorescence lifetimes of xanthene dyes[J]. Photochemistry and Photobiology, 1999,70(5):737-744. |
| [12] | Du C Y,Chen J M,Guo Y L,Lu K,Ye S H,Zheng J,Liu Y Q,Shuai Z G,Yu G. Dicyanovinyl heterotetracenes: synthesis,solid-state structures,and photophysical properties[J]. Journal of Organic Chemistry, 2009,74(19):7322-7327. |
| [13] | Reichardt C. Solvatochromic dyes as solvent polarity indicators[J]. Chemical Reviews, 1994,94(8):2319-2358. |
| [14] | Teale F W J. Principles of fluorescence spectroscopy-Lakowicz,Jr[J]. Nature, 1984,307(5950):486-486. |
| [15] | Raju B B. Photophysical properties of ground-state twisted bicoumarins[J]. Journal of Physical Chemistry A, 1997,101(6):981-987. |
| [16] | Schneide F, Lippert E. Electron spectra and electron structure of 9,9'-dianthryl[J]. Berichte Der Bunsen-Gesellschaft Für Physikalische Chemie, 1968,72(9-10):1155-1160. |




