2. 华东理工大学 科技信息研究所, 上海 200237
2. Institute of Science and Technology Information, East China University of Science & Technology, Shanghai 200237, P.R.China
近年来,人们设计了许多荧光传感器用于生物体的检测[1,2,3,4],例如唾液酸、线粒体及血清蛋白含量的变化都可以通过荧光技术进行检测[5,6]。医学工作者可以通过检测特征标志物含量的变化来检测某些疾病,急性骨髓性白血病 (AML)就是其中一种,其主要临床表现为骨髓内异常细胞的快速增殖影响了正常血细胞的产生,以面色苍白、发热、身困无力为主要特征,并伴有心悸、气短、胸胁压痛和关节痛等[7,8]。AML的发病率随着年龄增长而增大[9],故建立一种快速检测该类疾病的方法十分重要。
研究发现,许多AML都是由于异柠檬酸脱氢酶-1 (IDH1)及异柠檬酸脱氢酶-2 (IDH2)突变引起,该突变将导致α-酮戊二酸 (α-KA)转变为2-羟基戊二酸 (2HG),因此检测α-KA转变为2HG的过程具有十分重要的意义[10,11]。现有的检测方法一般通过液质联用 (LC-MS)或核磁共振 (NMR)来检测2HG含量的变化,进而确定IDH的突变[12,13],但其昂贵的测试成本及繁琐的样本预处理过程使其无法得到广泛的应用。2HG由于化学结构没有易于检测的特征官能团,直接检测十分困难,而α-KA的羰基被邻位强吸电子的羧基活化,因此本文的出发点就是通过检测活性羰基来检测α-KA含量的变化。
荧光检测以其高灵敏度、高选择性、非破坏性等优点受到越来越多的关注[14,15,16,17,18]。罗丹明由于具有荧光量子产率高、光稳定性好、摩尔消光系数高、激发波长及发射波长较长等优点,在荧光探针中被广泛应用[19,20,21,22,23]。针对传统测试条件的不足,本文合成了一个含有肼基作为响应基团的罗丹明B衍生物荧光传感器RBN(图1)。其识别机理是,RBN本身是闭环的结构没有荧光,但水合肼可以与α-KA的活性羰基发生反应生成Schiff碱,所生成Schiff碱的酞胺螺环的吸电子能力增强,诱导开环,进而导致RBN荧光增强(图2)。为了选择一个合适的测试条件,既可以使RBN对α-KA有较强的荧光响应,又使测试在接近人体中性环境下进行,进一步对测试条件进行了系列优化。以加入α-KA前RBN荧光强度为I0,与α-KA反应后产物的荧光强度作为I,通过比较反应后荧光增强倍数(I/I0),对检测温度、pH、响应时间等测试条件进行了系列优化。此外,用人体内常见的氨基酸、化学结构类似的羰基化合物及活性氧化物(ROS)作参比,RBN对α-KA均表现出很好的选择性,具有潜在的应用价值。
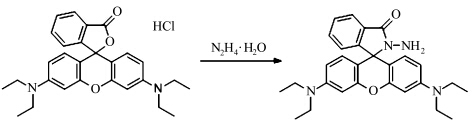 | 图1 荧光探针RBN的合成 Synthesis of fluorescent sensor RBN |
 | 图2 荧光探针RBN检测α-KA的原理 Fluorescence response mechanism between RBN and α-KA |
核磁共振氢谱和碳谱的测定采用了Bruker Avance超导傅里叶变换核磁共振波谱仪(400 MHz),室温下以TMS为内标测定;质谱的测试仪器为Waters LCT Premier XE spectrometer;紫外-可见光吸收光谱的测定采用了Varian Cary 100紫外-可见分光光度计;荧光发射光谱为Varian Cary Eclipse荧光光谱仪测定;荧光动力学曲线所用仪器为海洋光学公司定制,其中所用光源为Hamamatsu LC6 Lightningcure,300 W汞氙灯提供,发射光谱由海洋光学CCD Maya2000pro跟踪检测。
实验测试所用试剂均为市售分析纯试剂,罗丹明B购自国药集团化学试剂有限公司,α-酮戊二酸及4-羟乙基哌嗪乙磺酸购自阿拉丁试剂有限公司。测试过程所用超纯水是经上海涞科仪器有限公司LAKECORE-S040D型超纯水器净化处理的蒸馏水。不同pH的HEPES缓冲溶液是在2 mmol·L-1的4-羟乙基哌嗪乙磺酸的超纯水溶液中滴加1 mol·L-1的氢氧化钠水溶液,用pH计实时测量,调节pH为5.7~7.0。RBN母液是500 μmol·L-1的RBN的二甲基亚砜溶液,α-KA母液的浓度是10 mmol·L-1,溶剂为超纯水。 1.2 探针RBN的合成
在100 mL单口烧瓶中,加入罗丹明B(1.2 g,2.5 mmol)、水合肼(3 mL)和乙醇(30 mL),氩气保护下油浴加热至80~90 ℃回流反应3 h,减压下旋转蒸发除去溶剂,得到浅紫色固体。加入1 mol·L-1的稀盐酸(50 mL)使固体全部溶解,再用1 mol·L-1的氢氧化钠水溶液(100 mL)调节pH至7~8,有粉色固体析出,抽滤,所得固体经10 mL乙醇重结晶,得淡粉色固体粉末0.9 g,产率84.0%[24]。
1HNMR (400 MHz,CDCl3): 1.16 (t,12H,—NCH2CH3,J=7.2 Hz),3.33 (q,8H,—NCH2-CH3,J=7.2 Hz),3.60 (br,2H,—NH2),6.28 (dd,2H,phenyl-H,J1=8.8 Hz,J2=2.0 Hz),6.41 (d,2H,phenyl-H,J=2.0 Hz),6.45 (d,2H,phenyl-H,J=8.8 Hz),7.10 (t,1H,phenyl-H,J=3.6 Hz),7.44 (t,2H,phenyl-H,J=3.6 Hz),7.93 (t,1H,phenyl-H,J=3.6 Hz). 13CNMR (100 MHz,CDCl3): 12.62,44.38,65.96,97.95,104.50,108.04,123.01,123.84,128.11,128.14,130.00,132.55,148.89,151.56,153.86,166.19. HRMS (ESI): calcd for C28H32-N4O2[M+H]+: 457.2604,found 457.2595。 2 结果与讨论
2.1 探针RBN对α-KA的滴定曲线
取2 mL HEPES缓冲溶液 (pH = 6.1),加入40 μL的RBN母液,保持检测温度为37.4 ℃,通过荧光光谱仪检测激发波长为558 nm时,检测α-KA的加入对产物荧光变化的影响(图3)。随着α-KA的不断加入,其荧光强度不断增强,表现出很好的线性关系。其机理可以认为是,RBN本身是闭环结构,没有荧光,但随着α-KA的加入会促进罗丹明B螺环部位发生开环,使罗丹明B整体的共轭结构发生变化,进而导致RBN荧光增强(图2)[25,26,27,28]。随着α-KA的加入,探针RBN的紫外吸收光谱图也表现出明显变化(图4)。这是由于RBN自身是闭环结构,由于空间构型扭曲,芳香环之间没有形成共轭结构,在450~650 nm之间几乎没有紫外吸收。当RBN与100 eq的α-KA反应后,在450~650 nm之间表现出明显的吸收峰,且最大吸收峰为558 nm,这是由于α-KA使RBN开环导致共轭结构增大。此外,探针RBN与α-KA反应产物的高分辨率质谱的分子离子峰[M+H]+出现在585.2710,这与对应的开环体的理论值(585.2713)非常一致,也进一步证明了Schiff碱的生成使RBN发生开环的机理。
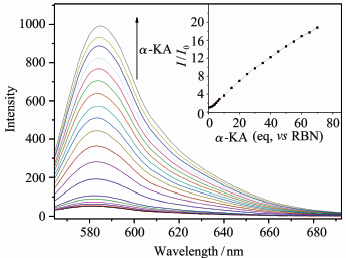 | 图 3 RBN与不同浓度α-KA反应产物的荧光光谱图 插图是585 nm处I/I0随α-KA当量的变化曲线 Fluorescence spectra of RBN upon increasing concentrations of α-KA,inset: fluorescence intensities as a function of α-KA concentrations |
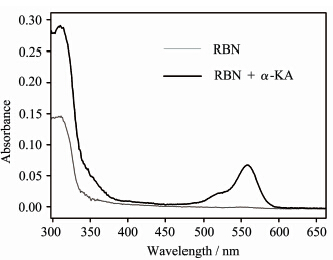 | 图 4 探针RBN与α-KA作用前后的紫外吸收光谱图 Absorption spectrum of RBN and RBN reaction with α-KA |
反应体系的pH是影响反应速率的重要因素之一。为了选择一个合适的pH环境,进行了一系列平行检测,以比较不同pH下RBN与α-KA反应生成Schiff碱的荧光变化。在37.4 ℃的检测温度下,向不同pH的HEPES缓冲溶液(2 mL)中加入40 μL的RBN母液,使用558 nm的光激发,同样通过荧光光谱仪分别测试加入α-KA (20 μL)前后溶液的荧光,得到585 nm处I/I0随pH的变化曲线(图5)。研究发现,当pH大于6.1时,随着pH值的增大,产物的荧光增长倍数持续减小,这是由于酸性减弱不利于生成Schiff碱反应的发生。但由于罗丹明B在强酸性情况下容易发生自身的开环反应,会导致RBN自身荧光增强(I0变大),因此测试环境的pH不能无限制的减小。事实上,实验证明在pH小于6.1后,产物的荧光增强倍数开始变得不明显,这是由于检测体系酸性太强,使RBN开环导致其自身荧光I0增强,进而导致荧光增强倍数变化不明显。考虑到在pH接近中性的条件下,测试环境更接近于人体体液的特点,同时pH为5.7~6.1时RBN荧光增强倍数十分接近,故在后面系列优化实验中选择在更靠近中性环境(pH=6.1)的体系中进行。
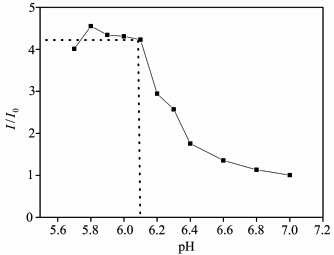 | 图 5 在585 nm处荧光强度(I/I0)随pH的变化曲线 Fluorescence response of RBN (585 nm) at different pH |
反应时间是影响探针性能的另外一个重要因素,可以通过在线实时监测RBN与α-KA反应生成Schiff碱的荧光变化来评价响应速度。在温度为37.4 ℃的环境下,向2 mL HEPES缓冲溶液(pH=6.1)中加入40 μL的RBN母液,再加入20 μL的α-KA,使用波长为558 nm的光激发,测试在585 nm处的荧光强度随时间的变化曲线(图6),发现探针RBN与α-KA的反应非常迅速,仅1.25 s后产物的荧光强度就达到平衡,这明显优于目前报道的关于检测α-KA的荧光探针的响应时间(需1 h以上)[4],而RBN将反应时间缩短到1.25 s,瞬间内即可完成反应,极大程度地提高了检测的效率,有利于在线快速检测,具有很大的应用潜能。
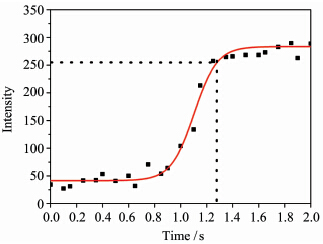 | 图 6 在585 nm处RBN荧光动力学曲线 Fluorescence kinetics of RBN at 585 nm |
由于RBN与α-KA的反应是典型的生成Schiff碱的反应,反应体系的温度也可能对反应速率有重要影响。因此进行了一系列平行实验以检测温度变化对反应速率的影响。采用上面优化的pH、响应时间,即取2 mL HEPES缓冲溶液(pH = 6.1),加入40 μL的RBN母液及20 μL的α-KA,通过荧光光谱仪测试温度在5~45 ℃范围内的荧光变化(图7)。很明显,RBN与α-KA反应产物的荧光强度随温度变化并不明显,因此在后续的测试中选择在人体温度即37.4 ℃条件下进行,有利于后期实际应用。
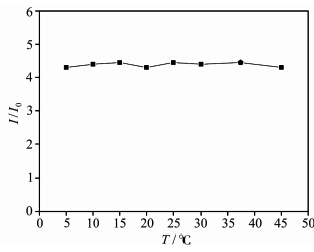 | 图 7 在585 nm处I/I0随温度的变化曲线 Fluorescence response of RBN (585 nm) at different temperature |
经过上述一系列对反应温度、pH、响应时间等条件的优化,发现在检测温度为37.4 ℃、pH为6.1的HEPES缓冲溶液中,RBN与α-KA响应非常迅速,仅需1.25 s即可达到检测平衡。在下面测试中采用优化后的条件,进一步探讨探针RBN对α-KA的选择性。 2.3 探针RBN的选择性研究
由于α-KA存在于人体体液中,同时体液中还存在许多其它种类的氨基酸,所以选择了L-精氨酸(Arg)、L-缬氨酸(Val)、L-组氨酸(His)、甘氨酸(Ami)、L-丝氨酸(Ser)、L-甲硫氨酸(Met)、DL-丙氨酸(Ala)、L-亮氨酸(Leu)、L-酪氨酸(Tyr)、L-脯氨酸(Pro)、L-苏氨酸(Thr)、L-色氨酸(Trp)、L-苯丙氨酸(Phe)、L-谷氨酸(Glu)、L-谷氨酰胺(Gln)、肌氨酸(Sar)、L-天门冬氨酸(Asp)、DL-天冬酰胺(Asn)、L-异亮氨酸(Ile)和DL-半胱氨酸(Cys)20种常见氨基酸与α-KA进行对比测试。检测温度为37.4 ℃,在pH为6.1的HEPES缓冲溶液中加入RBN母液,然后分别加入α-KA或20种常见氨基酸,采用558 nm激发,585 nm下检测产物的荧光。如图8所示,测试发现探针RBN只有与α-KA反应产物的荧光有明显的增强,与20种常见氨基酸反应产物的荧光几乎无变化,表明探针RBN即使在各种氨基酸存在的环境中对α-KA也有很好的选择性。
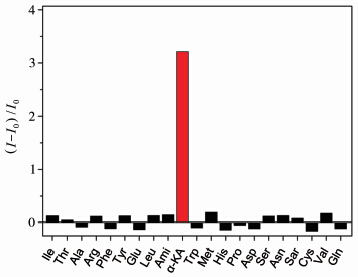 | 图 8 探针RBN基于不同氨基酸的荧光选择性测试 Fluorescence response of RBN (585 nm) upon various amino acids |
除上述20种常见氨基酸外,还有一些化学结构类似的羰基化合物及ROS可能会对RBN的选择性产生干扰。因此选择丙酮酸钠(PAS)、乙二醛(GO)、3-苯丙醇(PGO)、丙酮醛(MGO)、苯丙酮酸(PPA)、过氧化氢(H2O2)等几种化学结构类似的物质测试其选择性。在与上述氨基酸相同条件下检测发现,除了RBN对PAS有微弱的响应之外,只有α-KA与RBN反应产物的荧光有明显增强(图9),这说明RBN对α-KA有很好的选择性,具有潜在的应用价值。
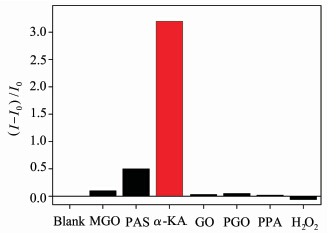 | 图 9 探针RBN基于不同羰基化合物及ROS的荧光选择性测试 Fluorescence response of RBN upon various dicarbonyl derivatives and ROS |
基于传统的Schiff碱反应,设计合成了一个含有罗丹明B的荧光探针RBN以检测α-KA。经过一系列的平行实验,优化了RBN与α-KA的反应条件,最后选定在pH为6.1的HEPES缓冲溶液中,检测温度为37.4 ℃,RBN的浓度为10 μmol·L-1,检测响应时间仅1.25 s。在相同的条件下,本文还采用20种常见氨基酸、化学结构类似的羰基化合物及ROS进行了选择性测试,发现RBN对α-KA表现出很好的选择性。和传统的高效液相及核磁共振检测α-KA的方法相比,RBN更加方便、经济、快捷,为血清等体液检测提供了可能,具有潜在的应用价值。
| [1] | Yang Y M, Zhao Q, Feng W, Li F Y. Luminescent chemodosimeters for bioimaging [J]. Chemical Reviews, 2013, 113(1): 192-270. |
| [2] | Shi H F, Chen X J, Liu S J, Xu H, An Z F, Lang O Y, Tu Z Z, Zhao Q, Fan Q L, Wang L H, Huang W. Hyper-branched phosphorescent conjugated polyelectrolytes for time-resolved heparin sensing [J]. ACS Applied Materials Interfaces, 2013, 5(11): 4562-4568. |
| [3] | Niu L Y, Guan Y S, Chen Y Z, Wu L Z, Tung C H, Yang Q Z. BODIPY-based ratiometric fluorescent sensor for highly selective detection of glutathione over cysteine and homocysteine [J]. Journal of the American Chemical Society, 2012, 134(46): 18928-18931. |
| [4] | Jin P W, Jiao C H, Guo Z Q, He Y, Zhu S Q, Tian H, Zhu W H. Rational design of a turn-on fluorescent sensor for α-ketoglutaric acid in a microfluidic chip [J]. Chemical Science, 2014, 5(10): 4012-4016. |
| [5] | Key J A, Li C, Cairo C W. Detection of cellular sialic acid content using nitrobenzoxadiazole carbonyl-reactive chromophores [J]. Bioconjugate Chemistry, 2012, 23(3): 363-371. |
| [6] | Leung C W T, Hong Y N, Chen S J, Zhao E G, Lam J W Y, Tang B Z. A photostable AIE luminogen for specific mitochondrial imaging and tracking [J]. Journal of the American Chemical Society, 2013, 135(1): 62-65. |
| [7] | Wang J H, Chen W L, Li J M, Wu S F, Chen T L, Zhu Y M, Zhang W N, Li Y, Qiu Y P, Zhao A H, Mi J Q, Jie J, Wang Y G, Ma Q L, Huang H, Wu D P, Wang Q R, Li Y, Yan X J, Yan J S, Li J Y, Wang S, Huang X J, Wang B S, Jia W, Shen Y, Chen Z, Chen S J. Prognostic significance of 2-hydroxyglutarate levels in acute myeloid leukemia in China [J]. Proceedings of the National Academy of Sciences, 2013, 110(42): 17017-17022. |
| [8] | DiNardo C D, Propert K J, Loren A W, Paietta E, Sun Z X, Levine R L, Straley K S, Yen K, Patel J P, Agresta S, Abdel-Wahab O, Perl A E, Litzow M R, Rowe J M, Lazarus H M, Fernandez H F, Margolis D J, Tallman M S, Luger S M, Carroll M. Serum 2-hydroxyglutarate levels predict isocitrate dehydrogenase mutations and clinical outcome in acute myeloid leukemia [J]. Blood, 2012, 121(24): 4917-4924. |
| [9] | Zadran S, Remacle F, Levine R D. miRNA and mRNA cancer signatures determined by analysis of expression levels in large cohorts of patients [J]. Proceedings of the Natio-nal Academy of Sciences, 2013, 110(47): 19160-19165. |
| [10] | Rendina A R, Pietrak B, Smallwood A, Zhao H Z, Qi H W, Quinn C, Adams N D, Concha N, Sweitzer S, Schwartz B. Mutant IDH1 enhances the production of 2-hydro-xyglutarate due to its kinetic mechanism [J]. Biochemistry, 2013, 52(26): 4563-4577. |
| [11] | Sandala G M, Smith D M, Marsh E N G, Radom L. Toward an improved understanding of the glutamate mutase system [J]. Journal of the American Chemical Society, 2007, 129(6): 1623-1633. |
| [12] | Langenbeck U, Möhring H U, Dieckmann K P. Gas chromatography of α-keto acids as their o-trimethylsilylquino-xalinol derivatives [J]. Journal of Chromatography A, 1975,115(1): 65-70. |
| [13] | Montenegro P, Valente I M, Goncalves L M, Rodrigues J A, Barros A A. Single determination of α-ketoglutaric acid and pyruvic acid in beer by HPLC with UV detection [J]. Analytical Methods, 2011, 3(5): 1207-1212. |
| [14] | Shao J Y, Sun H Y, Guo H M, Ji S M, Zhao J Z, Wu W T, Yuan X L, Zhang C L, James T D. A highly selective red-emitting FRET fluorescent molecular probe derived from BODIPY for the detection of cysteine and homocysteine: an experimental and theoretical study [J]. Chemical Science, 2012, 3(4): 1049-1061. |
| [15] | Kumar V, Anslyn E V. A selective turn-on fluorescent sensor for sulfur mustard simulants [J]. Journal of the American Chemical Society, 2013, 135(16): 6338-6344. |
| [16] | 殷丽艳, 陈甜甜, 朱维平. 基于萘酰亚胺的Turn-on型Fe3+荧光探针 [J]. 影像科学与光化学, 2014, 32(1): 84-90. Yin L Y, Chen T T, Zhu W P. A turn-on fluorescent probe for Fe3+ based on naphthalimide [J]. Imaging Science and Photochemistry, 2014, 32(1): 84-90. |
| [17] | 胡 睿, 郭旭东, 杨国强. 激发态分子内质子转移化合物的性能及作为荧光化学传感器的应用研究 [J]. 影像科学与光化学, 2013, 31(5): 335-348. Hu R, Guo X D, Yang G Q. Investigation on the property of the excited state intramolecular proton transfer compounds and its application as fluorescence chemical sensor [J]. Imaging Science and Photochemistry, 2013, 31(5): 335-348. |
| [18] | Zeng Y, Li Y Y, Li M, Yang G Q, Li Y. Enhancement of energy utilization in light-harvesting dendrimers by the pseudorotaxane formation at periphery [J]. Journal of the American Chemical Society, 2009, 131(25): 9100-9106. |
| [19] | Sakabe M, Asanuma D, Kamiya M R, Iwatate J, Hanaoka K, Terai T, Nagano T, Urano Y. Rational design of highly sensitive fluorescence probes for protease and glycosidase based on precisely controlled spirocyclization [J]. Journal of the American Chemical Society, 2013, 135(1): 409-414. |
| [20] | Wu Y X, Li J B, Zhang X B, Tan W H, Shena G L, Yua R Q. A rhodamine-appended water-soluble conjugated polymer: an efficient ratiometric fluorescence sensing platform for intracellular metal-ion probing [J]. Chemical Communications, 2014, 50(16): 2040-2042. |
| [21] | Zhou L Y, Zhang X B, Wang Q Q, Lv Y F, Mao G J, Luo A L, Wu Y X, Wu Y, Zhang J, Tan W H. Molecular engineering of a TBET-based two-photon fluorescent probe for ratiometric imaging of living cells and tissues [J]. Journal of the American Chemical Society, 2014, 136(28): 9838-9841. |
| [22] | Li K, Xiang Y, Wang X Y, Hu J L R R, Tong A J, Tang B Z. Reversible photochromic system based on rhodamine B salicylaldehyde hydrazone metal complex [J]. Journal of the American Chemical Society, 2014, 136(4): 1643-1649. |
| [23] | 杨 博, 吴文辉. 具有荧光增强性能的罗丹明B衍生物的合成及其对汞离子的检测 [J]. 影像科学与光化学, 2013, 31(6): 421-429. Yang B, Wu W H. Synthesis of the rhodamine B derivatives with fluorescence ""turn-on"" effect and their application to the detection of Hg2+ [J]. Imaging Science and Photochemistry, 2013, 31(6): 421-429. |
| [24] | Dujols V, Ford F, Czarnik A W. A long-wavelength fluorescent chemodosimeter selective for Cu(Ⅱ) ion in water [J]. Journal of the American Chemical Society, 1997, 119(31): 7386-7387. |
| [25] | Karakuş E, Vçüncüa M, Emrullahoğ lu M. A rhodamine/BODIPY-based fluorescent probe for the dierential detection of Hg(Ⅱ) and Au(Ⅲ) [J]. Chemical Communications, 2014, 50(9): 1119-1121. |
| [26] | Best Q A, Sattenapally N, Dyer D J, Scott C N, McCarroll M E. pH-Dependent Si-fluorescein hypochlorous acid fluorescent probe: spirocycle ring-opening and excess hypochlorous acid-induced chlorination [J].Journal of the American Chemical Society, 2013, 135(36): 13365-13370. |
| [27] | Zhao Y, Zhang X B, Han Z X, Qiao L, Li C Y, Jian L X, Shen G L, Yu R Q. Highly sensitive and selective colorimetric and off-on fluorescent chemosensor for Cu2+ in aqueous solution and living cells [J]. Analytical Chemistry, 2009, 81(16): 7022-7030. |
| [28] | Yu H B, Jin L J, Dai Y, Li H Q, Xiao Y. From a BODIPY rhodamine scaffold to a ratiometric fluorescent probe for nitric oxide [J]. New Journal of Chemistry, 2013, 37(6): 1688-1691. |




