2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, P. R. China
1971年,瑞典学者Engvail和Perlmann[1],荷兰学者Van Weeman和Schuurs[2]分别报道了将免疫技术发展为检测体液中微量物质的固相免疫测定方法,即酶联免疫吸附测定法 (enzyme-linked immunosorbent assay ,ELISA) 。它是将抗体吸附固定在聚苯乙烯(Polystyrene,PS)表面,通过抗原-抗体间特异性的免疫反应而对分析物进行定性或定量分析。ELISA以其灵敏度高(可达ng甚至pg水平)、特异性好等优点,在生命科学、环境分析等领域得到广泛应用。然而该方法存在检测时间较长、操作繁琐的缺点,其中抗体包被步骤长达10 h以上,检测时间也需2~4 h[3],且该方法仅能对单一分析物进行分析,上述问题限制了其在快速诊断领域的应用。
心力衰竭(Heart Failure)简称心衰,是一种严重威胁人类健康的全球性疾病,它具有较高的发病率和死亡率,据文献报道,在2010年世界范围内就有2300万人受到心衰的影响[4]。心衰的传统诊断手段存在一些不可靠性,容易让医生产生误诊或漏诊,为了提高临床诊断的准确性,采用测定心衰标志物含量水平来诊断评定心衰等级的方 法被广泛应用。与心衰相关的心脏标志物有很多种,但是这些标志物的特异性、敏感性和临床可行性差异很大。目前,N端脑钠肽前体(NT-proBNP)是公认最为有效的心衰标志物[5];心肌肌钙蛋白I(cTnI)虽然不是特异性的心衰标志物,但是近年来的研究显示[6, 7],其可以作为心衰诊断的辅助标志物。NT-proBNP和cTnI的联合检测,可以有效提高检测准确性。
本文参考ELISA方法,建立了心衰标志物在硅片表面的可视化免疫检测方法。与ELISA相比,本方法从抗体包被到检测结束不超过1 h,并且操作简单,可以在同一硅片上对两种标志物NT-proBNP和cTnI同时检测,大大缩短了心衰疾病的诊断时间,提高了诊断的准确性。本工作对心衰发病的早期快速诊断、治疗、改善其转归有重要的意义,该方法的灵敏度和准确度都可以满足临床检测需要。
1 实验部分 1.1 仪器、试剂和分析软件仪器:超纯水仪器(EASY pure LF,美国Barnstead公司),光学显微镜(Olympus BX-51,日本),匀胶机(KW-4A,中国科学院微电子所),分析天平(MettlerToleDo,AB 104-N,美国),Cobas e411免疫分析仪(Roche公司),Access2免疫分析仪(Beckman Coulter公司)。
试剂:NT-proBNP抗原(NT-proBNP,芬兰Hytest公司),cTnI抗原(Cardiac troponin I,美国 NIST),NT-proBNP抗体(NT-proBNP-A5(固定抗体),NT-proBNP-A1(标记抗体)芬兰Hytest公司),cTnI抗体(cTnI-B3(固定抗体),cTnI-B1(标记你抗体)美国BiosPacific公司),人血清样本(北大深圳医院和深圳人民医院),链霉亲和素磁颗粒(Streptavidin-beads,粒径500±10 nm,东莞博识科技有限公司),硅片(6.6 mm×10.7 mm×0.75 mm,二氧化硅膜厚200 nm,北京大学微电子系),其他化学试剂都为分析纯。
软件:显微镜拍照软件DP controller(Olympus公司),Image Pro Plus 6.1(MediaCybernetics公司),Origin 8.5(OriginLab公司),Excel 2013(Microsoft公司)。
1.2 免疫反应原理与步骤硅片表面可视化免疫检测方法与夹心ELISA免疫分析原理[8]是相同的,即夹心免疫反应(Sandwich immunoassay)原理。但是由于反应基底和检测方法不同,两种方法检测步骤有较大的差异,硅片表面可视化免疫检测方法主要步骤(如 图1所示):①硅片表面功能化,硅片表面旋涂上厚度约为40 nm的聚苯乙烯功能化薄膜;②抗体固定,采用点样仪在硅片表面点上固定抗体,使抗体得以固定,之后加入BSA封闭液进行封闭;③加入样本,样本中的待测抗原(标志物)与固定抗体特异性结合,之后使用冲洗液清除未反应的残留样本;④加入生物素修饰的标记抗体,标记抗体可以特异性识别被捕捉固定在硅片表面的抗原,形成抗体-抗原-抗体的夹心结构,之后使用冲洗液清除未反应的残留标记抗体;⑤加入表面修饰了链霉亲和素的磁颗粒信号探针,磁颗粒探针与被固定的标记抗体上的生物素结合后,使用冲洗液清除未反应的残留磁颗粒;⑥对固定在硅片表面的磁颗粒进行定量分析,硅片上结合的磁颗粒的密度与样本中标志物抗原浓度成正相关性。通过磁颗粒数目与抗原浓度对应关系的标准曲线,计算得到样本中的抗原浓度。
 | 图1 硅片表面的夹心免疫反应 Sandwich immunoassay on the surface of silicon chip |
光学显微镜以放大5倍的拍摄倍数拍摄硅片反应点,可以获得拍摄面积为3.52 mm×2.64 mm的图像,如图2A所示。荧光显微镜以放大100倍的拍摄倍数,拍照硅片反应点内的磁颗粒分布情况,可以获得拍摄面积为176 μm×132 μm,像素面积为680 pixel× 510 pixel的图片,利用分析软件Image pro plus对该图像中颗粒分布进行分析,结果如图2B、2C和2D所示。图2A为光学显微镜在明场情况下,放大倍数5倍,曝光时间 0.5 s的图像;图2B为光学显微镜在明场情况下,放大倍数100倍,曝光时间0.5 s的图像,黄色点为磁颗粒,淡绿色区域为硅片颜色;图2C为光学显微镜在暗场情况下,放大倍数100倍,曝光时间60 s的图像,白色点为磁颗粒,黑色区域为硅片颜色;图2D为2C中的长方形区域的放大图像,该图像采用Image pro plus进行颗粒计数处理,该区域内有23个圆形斑点。
 | 图2 光学显微镜拍摄的磁颗粒分布图像 Magnetic particles distribution image shot by microscope |
通过设定Image pro plus软件的容差和滤镜参数,可以计算出图像中颗粒的数目以及颗粒所占的像素面积。图2C中磁颗粒数目为236个,总像素面积为9398 pixel2。图2D中磁颗粒数目为23个,总像素面积为1009 pixel2。磁颗粒数目和像素面积就是硅片表面单位面积(176 μm×132 μm)的磁颗粒密度分布的定量化信息。
1.4 NT-proBNP和cTnI标准曲线建立方法首先,利用254 nm紫外光照射硅片15 min,使硅片表面PS薄膜活化。然后,采用点样仪,将浓度均为50 μg/mL的NT-proBNP和cTnI固定抗体(NT-proBNP-A5和cTnI-B3)溶液分别点滴到活化后硅片表面的不同位置,室温干燥5 min。最后在硅片表面滴加含有1%牛血清白蛋白的封闭液,封闭5 min后用滤纸吸干封闭液,完成“抗体生物硅片”的制作。
将不同浓度的抗原溶液滴加到“抗体生物硅片”上,滴加量为20 μL,抗原溶液浓度如表1所示。37 ℃温育5 min,之后采用冲洗液(pH值7.4的磷酸盐缓冲液)冲洗1 min。然后滴加浓度均为20 μg/mL的NT-proBNP和cTnI的混合标记抗体溶液,滴加量为20 μL,37℃温育5 min,之后采用冲洗液冲洗1 min。最后滴加10倍稀释的链霉亲和素标记的磁颗粒溶液,滴加量为20 μL,37 ℃温育5 min,之后采用冲洗液冲洗1 min。最终拍摄磁颗粒分布图像,并利用Image Pro Plus软件分析图片定量磁颗粒密度,该步骤耗时约5 min。
| 表1 NT-proBNP和cTnI标准曲线中抗原的浓度水平 Concentration level of NT-proBNP and cTnI for standard curves |
由于两标志物之间没有交叉干扰,硅片可以提供多个固定抗体的包被位置,因此该实验可以实现在同一硅片表面进行两种标志物的检测。抗原浓度为0的浓度水平,平行组为10组,其他浓度水平,平行组为3组。最终根据检测磁颗粒密度分布与标志物抗原的浓度关系,分别绘制NT-proBNP和cTnI的标准曲线。 1.5 硅片表面可视化免疫检测方法的准确度评估
从北大深圳医院和深圳人民医院收集85例实际人血清样本,其中51例用Roche公司的Cobas e411免疫分析仪对NT-proBNP浓度进行了定标,全部85例用Beckman Coulter公司的Access2免疫分析仪对cTnI浓度进行了定标。
采用可视化免疫检测方法对这85例样本进行检测,检测得到的磁颗粒数目依据标准曲线转化为抗原标志物的浓度。根据Pearson相关性分析[9],对比可视化免疫检测方法的检测结果与商品化免疫分析仪的定标结果的相关性,评价该方法检测的准确度。 2 结果与讨论 2.1 磁颗粒定量研究
磁颗粒定量研究过程中发现两个问题需要解决:一是单个磁颗粒所占像素面积不相同;二是高密度磁颗粒分布时,磁颗粒不是单个分布的,而是多个磁颗粒相互聚集分布。
单个磁颗粒所占像素面积不相同的原因:一方面,虽然商品化磁颗粒的标示粒径为500 nm±10 nm,但是实际上其中还是存在少量更大粒径磁颗粒和更小粒径的磁颗粒。最终拍摄图像当中非500 nm磁颗粒所占的像素面积与500 nm磁颗粒的相差较大。另一方面,由于显微镜自身对焦的误差,也会导致单个磁颗粒所占像素面积不相同。 为了研究单个磁颗粒所占像素面积差异程度,本实验随机选择并分析了1181个磁颗粒单点像素面积的分布情况,发现这些单点像素面积是呈现正态分布的。其中像素面积36~45 pixel2所占数量最多,所占总数比例为34.8%。像素面积26~65 pixel2所占数目可以达到总数的76.1%。正态分布的峰值为41.38 pixel2。1181个磁颗粒的平均像素面积为46.8 pixel2。因此为了方便数据处理,可以规定单个磁颗粒所占的像素面积为41.38 pixel2。
当磁颗粒密度较低时,磁颗粒分散度较高,几乎没有聚集的情况,软件计算的白点数目与磁颗粒分布数目相一致,如图4A所示。当磁颗粒密度较高时,部分磁颗粒之间会聚集在一起,该软件获得的白色的点数目与磁颗粒结合的真实数目有所偏差,如图4B所示。当磁颗粒密度更高时,磁颗粒几乎都是呈现聚集状态,此时软件获得的白色的点数目与磁颗粒结合的真实数目的偏差进一步加大,如图4C所示。由于磁颗粒是单层聚集,因此聚集在一起所占的像素面积与相互分开所占面积是一致的,并且磁颗粒的聚集程度与磁颗粒的密度之间存在相关性。因此可以采用计算图像中白点像素面积的方式来分析磁颗粒在硅片上的分布情况。由于规定单个磁颗粒的像素面积为41.38 pixel2。因此图4A计算得到的磁颗粒数目为53(2183 pixel2),图4B计算得到的磁颗粒数目为990(40967 pixel2),图4C计算得到的磁颗粒数目为1577(65266 pixel2)。
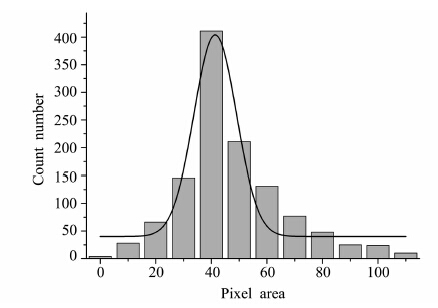 | 图3 1181个磁颗粒点像素面积的正态分布情况 Gaussian distribution of pixel areas of 1181 magnetic particles |
 | 图4 磁颗粒不同分布密度的图像 Magnetic particles distribution image in different density |
在最佳反应条件下,利用可视化免疫分析方法对NT-proBNP标准品浓度分别为0 pg/mL、20 pg/mL、50 pg/mL、100 pg/mL、200 pg/mL、500 pg/mL、1000 pg/mL、4000 pg/mL、10000 pg/mL、20000 pg/mL和40000 pg/mL的检测结果如图5所示。可以看到,随着NT-proBNP抗原浓度的提升,单位面积内的磁颗粒数目在逐渐增多。当NT-proBNP抗原溶液浓度低于500 pg/mL时,磁颗粒分散度比较高,无明显磁颗粒聚集情况。当NT-proBNP抗原溶液浓度高于1000 pg/mL时,磁颗粒出现明显聚集情况。当NT-proBNP抗原溶液浓度为20000 pg/mL和40000 pg/mL时,磁颗粒聚集非常严重。由表2的数据可知,采用Image Pro Plus软件对图5的图像进行磁颗粒计数,抗原浓度10000 pg/mL组的数据点已经达到饱和,更高浓度难以区分。但是采用对磁颗粒像素面积进行分析的方式,抗原浓度20000 pg/mL组与40000 pg/mL还存在一定的区分。因此采用 计算像素面积的方法,并且根据规定的单个磁颗粒的像素面积,可以获得折算出了单位面积内的磁颗粒数目。cTnI的计算方法与NT-proBNP计算方法相同。因此,依据上述方法得到的数据分别绘制出NT-proBNP以单位面积磁颗粒折算数目为Y轴与浓度为X轴的标准曲线(图6A),以及cTnI的标准曲线(图6B)。
 | 图5 NT-proBNP不同浓度免疫反应的磁颗粒分布图像 Magnetic particles distribution image of NT-proBNP immunoassay in different concentration |
| 表2 NT-proBNP不同浓度免疫反应的磁颗粒分布图像中磁颗粒的数量和像素面积信息 Number and Pixel Area of magnetic particles in the image of NT-proBNP immunoassay in different concentration |
 | 图6 心衰标志物的标准曲线 (A)NT-proBNP; (B)cTnI Standard curves of NT-proBNP (A) and cTnI (B) |
为了验证磁颗粒定量方法的可靠性,以及上述标准曲线的准确性,本文研究了磁颗粒在固相表面的吸附模型。
根据Wang等[10]的研究,单位面积内固相表面的免疫反应过程可以根据Langmuir吸附等温方程简化为如下方程:
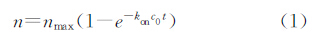
如果针对固定抗体-抗原反应,可以采用如下方程:

抗原与标记抗体结合情况,以及标记抗体上生物素和磁颗粒的链霉亲和素结合情况理论上也符合上述公式。
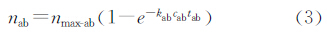
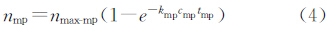
上述公式中,下标ab代表抗原与标记抗体的结合过程的参数,下标mp代表标记抗体上生物素和磁颗粒的链霉亲和素结合过程参数。
对于夹心免疫过程,虽然在设定的时间内反应没有达到饱和结合状态,但是标记抗体浓度与磁颗粒的浓度都是固定的,抗原反应时间、标记抗体反应时间和磁颗粒反应时间也都是固定的。并且对于同一反应体系,结合速率常数也是固定的,可以采用常数K代替。因此,公式(2)、(3)和(4)可以转换为如下公式:
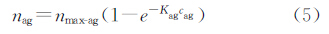


由于nmax-ab与nag具有相关性,nmax-mp与nab具有相关性,对于固定反应体系也存在一个固定的相关系数,通过进一步的简化,就可以得出磁颗粒在硅片上的吸附量nmp与抗原浓度cag的相关性公式(8)。
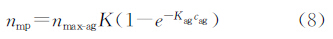
由于硅片表面免疫系统有背景吸附的存在,需要在上述公式中添加背景吸附参数。 nmax-agK也可以简化固定的参数nmax。因此上述公式可以转变为如下形式:
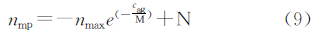
从NT-proBNP和cTnI的实验数据、标准曲线、硅片表面磁颗粒的吸附模型以及临床相关研究,可以获得如表3的数据。其中检测限(Limit of detection,LOD)为背景(抗原浓度为0)检测均值加两倍标准差所得到的结果。
标志物NT-proBNP和cTnI的标准曲线的公式与硅片表面磁颗粒的吸附模型相吻合。理论上的两个标志物反应体系的磁颗粒最大吸附量(nmax*)和背景吸附(N*-nmax*)都与真实检测结果(nmax和N-nmax )相接近。因此,定量计算得到的单位面积内磁颗粒数目与理论推算是一致的,磁颗粒定量方法是可靠的,NT-proBNP和cTnI标准曲线是准确的。
| 表3 心衰标志物NT-proBNP和cTnI检测的相关参数 Parameters of heart failure biomarkers (NT-proBNP and cTnI) detection |
对于NT-proBNP标志物的检测,测试样本数为83例,其中无标示样本数为32例,有效样本数为51例。硅片表面可视化免疫检测方法与对比仪器Cobas e411的Pearson相关分析结果如图7A所示。Pearson相关系数为rp=0.9874(P<0.001),两种方法测定结果一致性良好。两测量值拟合的线性回归方程为y=-4.6808+1.0559x(R2=0.9749),回归方程成立(P<0.001),截距及斜率的95%置信区间(Confidence Interval,CI) 分别为[-87.9,78.6]、[1.0320,1.0799]。
对于cTnI标志物的检测,测试样本数为85例,其中遗失样本数为2例,有效样本数为83例。硅片表面可视化免疫检测方法及对比仪器Access2的Pearson相关分析结果见图7B所示。Pearson相关系数为rp = 0.9897(P<0.001),两种方法测定结果相关性好。两测量值拟合的线性回归方程为y=0.0005+0.9758x(R2=0.9793),回归方程成立(P<0.001),截距及斜率的95%CI分别为[-0.0776,0.0785]、[0.9601,0.9915]。
 | 图7 硅片表面免疫分析法及Cobas e411对NT-proBNP检测的Pearson相关性分析(A);硅片表面免疫分析法及Access2对cTnI检测的Pearson相关性分析图(B) Pearson correlation analysis for Cobas e411 and silican chip NT-proBNP detection (A),Pearson correlation analysis for Access2 and silican chip cTnI detection (B) |
利用Image Pro Plus软件分析176 μm×132 μm面积内的磁颗粒数目来定量分析免疫反应抗原浓度的方法是可行的。建立的磁颗粒数目与标志物抗原浓度关系的标准曲线方程与理论推导的表面吸附模型相吻合。硅片表面可视化心衰标志物检测方法,从抗体包被到检测结束不超过1 h,并且操作简单,可以在同一硅片上对两种标志物NT-proBNP和cTnI同时检测,大大缩短了心衰疾病的诊断周期。NT-proBNP和cTnI最低检测浓度都低于临床cut-off值,检测范围也达到了商品化免疫分析仪的检测水平。85例不同程度心血管疾病患者的血清样本的检测结果与商品化免疫分析仪(Roche Cobas e411和Beckman Coulter Access2)的检测结果相一致,相关系数r>0.98(R2>0.97)。因此,硅片表面可视化心衰标志物联合检测方法可以满足心衰标志物NT-proBNP和cTnI临床快速检测的需要。并且该方法未来也会在医学检测的其他领域发挥巨大的应用价值。
| [1] | Engvall E, Perlmann P. Enzyme-linked immunosorbent assay (ELISA) quantitative assay of immunoglobulin G [J]. Immunochemistry, 1971, 8(9): 871-874. |
| [2] | Van Weemen B K, Schuurs A H W M. Immunoassay using antigen-enzyme conjugates [J]. FEBS Letters, 1971, 15(3): 232-236. |
| [3] | Wild D. The Immunoassay Handbook [M]. Gulf Professional Publishing, 2005. |
| [4] | Lloyd J D,Adams R J,Brown T M.,Carnethon M,Dai S,De Simone G,Ferguson T B,Ford E,Furie K,Gillespie C. Heart disease and stroke statistics-2010 update a report from the American Heart Association [J]. Circulation, 2010, 121(7): e46-e215. |
| [5] | Seino Y,Ogawa A,Yamashita T,Fukushima M,Ogata K I,Fukumoto H,Takano T. Application of NT-proBNP and BNP measurements in cardiac care: a more discerning marker for the detection and evaluation of heart failure [J]. European Journal of Heart Failure, 2004, 6(3): 295. |
| [6] | Horwich T B,Patel J,MacLellan W R,Fonarow G C. Cardiac troponin I is associated with impaired hemodynamics, progressive left ventricular dysfunction, and increased mortality rates in advanced heart failure [J]. Circulation, 2003, 108(7): 833-888. |
| [7] | Peacock IV W. F,De Marco T,Fonarow G C,Diercks D, Wynne J,Apple F S,Wu A H. Cardiac troponin and outcome in acute heart failure [J]. New England Journal of Medicine, 2008, 358(20): 2117-2126. |
| [8] | ELISA [M].http://en.wikipedia.org/wiki/ELISA#Sandwich_ELISA.2015. |
| [9] | Neuendorf K A. The Content Analysis Guidebook[M]. Sage Publications Thousand Oaks, CA, 2002. |
| [10] | Wang S X,Gaster R S,Xu L,Han S J,Wilson R. Magnetic Sensor Based Quantitative Binding Kinetics Analysis [M]. Google Patents. 2011. |





 +1443.41 R2=0.9887 NT-proBNP
+1443.41 R2=0.9887 NT-proBNP