2. 中国科学院大学, 北京 100049
2. University of Chinese Academy of Sciences, Beijing 100049, P. R. China
具有大的双光子吸收截面的有机材料在频率上转换激射[1,2]、三维光存储[3]、三维微加工[4,5]、光动力治疗[6,7,8]等领域受到了广泛的关注。近年来,由于双光子荧光显微镜的发展,基于双光子光诱导的荧光成像成为生物技术领域中的研究热点[9,10,11]。对大多数荧光材料而言,单光子的摩尔消光系数为~10-16 cm2,而双光子的吸收截面为~10-50cm4·s/photon,材料的双光子吸收与激发光光强的平方有强烈的关联,因此要产生双光子吸收,激光光场必须有足够高的光子密度,只有焦点附近的光强才能达到产生双光子吸收的光密度条件(在聚焦条件下,双光子吸收仅局限于物镜焦点处空间体积约为λ3的小范围内),所以双光子光化学过程只局限在焦点附近极小的区域内。此外,由于双光子诱导的荧光发射所用的激发波长往往是近红外光,可产生很少的光散射和更深的穿透,在这种情况下,荧光成像可以得到很高的空间分辨率。
虽然双光子荧光成像吸引了人们极大的兴趣,但同时具有双光子吸收截面大、荧光量子产率高、合成简单、成本低等具有实用价值的双光子荧光材料并不多见,限制了这一技术的发展。因此,开发具有大的双光子吸收截面、高的荧光量子产率、以及制备简单的新型双光子荧光染料成了材料化学一个研究热点[12,13,14,15]。本文设计合成了具有 D-π-A-π-D对称型结构的化合物2,5-双(对二甲氨基苯乙烯基)吡嗪 1 (图1),研究结果表明,该化合物具有双光子荧光性质,在820 nm波长光激发下,获得了较大的双光子吸收截面(σ=212 GM)。与其它已报道的双光子荧光染料相比,化合物1具有以下一些优点:合成简单、产率高、荧光量子产率大、双光子荧光强。
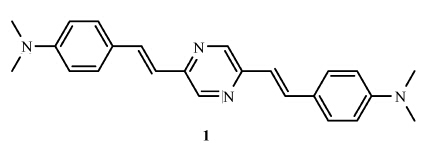 | 图1 化合物1的化学结构式 Chemical structure of compound 1 |
核磁共振氢谱和碳谱采用Bruker-400核磁共振仪,TMS为内标,室温测定;高分辨质谱采用GC-TOF MS质谱仪测试;紫外-可见光吸收光谱采用 Hitachi U-3010紫外分光光度仪测试;荧光发射光谱采用 Hitachi F-2500荧光分光光度仪测试;双光子荧光采用钛宝石飞秒激光器(Ti-sapphire laser)发出的激光脉冲作为辐射光源,其重复频率为82 MHz,脉冲宽度为120 fs。测试时样品的浓度为 1×10-4 mol/L,整个测试采用的样品池均为 1.0 cm×1.0 cm四面通光的石英比色皿。双光子吸收截面(σ)采用荧光素为参比,根据文献报道的双光子荧光方法进行测试计算[16]。
所用试剂和溶剂分别购于北京依诺凯试剂公司和北京化学试剂公司,试剂使用前未经纯化,直接使用;光谱测试用溶剂按有机溶剂标准纯化方法进行纯化。
1.2 化合物1的制备化合物 1 的合成线路如图2所示,其合成方法如下:在 100 mL的圆底烧瓶中加入2,5-二甲基吡嗪(0.125 g,1.16 mmol)、叔丁醇钾(0.26 g,2.31 mmol)、DMF(25 mL)。反应混合物加热到 80 ℃,反应15 min后,加入N,N-二甲基对氨基苯甲醛(0.34 g,2.31 mmol),反应混合物在80 ℃下继续反应4 h,直到原料点消失(TLC检测反应)。停止加热,冷却至室温,有固体析出,过滤所得固体用石油醚(V)∶乙酸乙酯(V)= 1∶2为洗脱剂,硅胶柱层析分离,得到化合物1(0.35 g,红色固体),产率81%。
 | 图2 化合物1的合成路线 Synthesis of compound 1 |
1HNMR (CDCl3): 3.02(12H,s),6.72(4H,d,J=8.9 Hz),6.96(2H,d,J=16.0 Hz),7.49 (4H,d,J=8.9 Hz),7.62(2H,d,J= 16.0 Hz),8.49 (2H,s)。13CNMR (CDCl3,100 MHz): 39.3,111.2,118.7,123.7,127.5,132.8,141.7,148.0,149.7。 HRMS: calcd. for C24H26N4,370.2158; found,370.2164。
1.3 化合物1的双光子吸收截面的测定化合物 1 的双光子吸收截面使用双光子荧光法测定[16]。以10-4mol/L的荧光素NaOH水溶液(pH=11)为参比,将 1 配成10-4mol/L的DMSO溶液,通过测量双光子诱导荧光的荧光强度,计算出 1 的双光子吸收截面,计算公式如下:

化合物 1 的制备非常简单,以DMF为溶剂,2,5-二甲基吡嗪和N,N-二甲基对氨基苯甲醛在叔丁醇钾强碱作用下一步反应即可获得,产率高达81%。从化合物 1 氢谱中—CH CH—的耦合常数J=16.0 Hz这一数据可以判断,2,5-二甲基吡嗪和N,N-二甲基对氨基苯甲醛缩合反应生成的产物2,5-双(对二甲氨基苯乙烯基)吡嗪分子中的双键结构为反式结构,如图1所示。
图3是化合物 1 在DMSO溶液中的吸收光谱和荧光光谱图。 化合物 1 在DMSO溶液中有两个主要的吸收峰分别在460 nm (ε=3.1×104L·mol-1·cm-1)和340 nm(ε=9.2×103L·mol-1·cm-1)。这两个吸收峰分别对应于化合物 1 的π→π*电子跃迁和分子内电荷转移(N,N-二甲基为给体,吡嗪环为受体)跃迁。用460 nm的光激发,得到如图3所示的化合物 1 的荧光光谱图。从图3可以看到,化合物 1 在DMSO溶液中的最大发射波长在570 nm。以罗丹明B(Φf=0.31,H2O)为参比,测得化合物 1 在DMSO溶液中的相对荧光量子产率为0.27,大的荧光量子产率表明化合物 1 在DMSO溶液中有强的荧光发射。
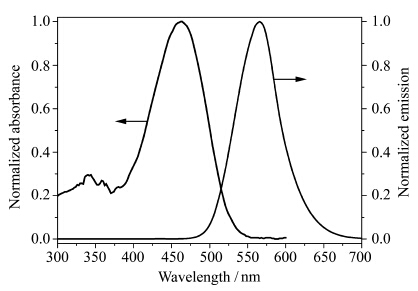 | 图3 化合物1在DMSO溶液(1×10-5mol/L)中的吸收光谱和荧光光谱图 Absorption and fluorescence spectral of 1 in DMSO(1×10-5mol/L)λex=460 nm |
对化合物 1 在其他溶剂中的吸收和荧光性质也进行了表征。从表1的实验数据可以看到,化 合物 1 表现出正的溶致变色效应:最大吸收波长 和荧光发射峰随溶剂极性的增大发生红移。此外,还可以看到:化合物 1 的荧光量子产率随溶剂极性增大而依次减小,表现出常见的正溶致动力学效应。这些实验结果证实了化合物 1 在极性溶剂中发生分子内的电荷转移跃迁。
采用Ti:sapphire的激光作为激发光源,测定了化合物 1 在DMSO溶液中的双光子荧光。所测溶液的浓度为 1×10-4mol/L,激发波长从720 nm到920 nm,每相隔10 nm作为一个激发波长,并采用荧光参比法,以荧光素为参比,得到了化合物 1 从720 nm到920 nm的双光子吸收截面(图4)。从图4中可以看到,化合物 1 从730 nm到790 nm波长范围内的双光子吸收截面(σ=200 GM)没有明显变化,其对应着单光子吸收范围360~400 nm。从图3可以看到,化合物 1 在DMSO溶液中短波长处的单光子吸收峰在310~400 nm处没有明显差别,受激光器本身调谐波长的限制,激光器波长最小调到720 nm,因而310~350 nm所对应的双光子吸收在620~700 nm左右的吸收截面无法测得,化合物 1 在920 nm处(对应单光子吸收峰460 nm)的双光子吸收截面为28.5 GM。从图4中可以看到,化合物 1 的最大双光子吸收截面(σ=212 GM)出现在820 nm处。从上述结果看到,化合物 1 的双光子吸收截面(σ=212 GM)不是很理想。导致化合物 1 的双光子吸收截面小的原因可能是分子中吡嗪环上的N原子所致。有机分子的双光子吸收截面受到共轭程度和分子内电荷转移等因素的影响,共轭程度越大,分子内电荷转移越强,双光子吸收截面就越大。与苯环上的C原子性质不同,吡嗪环上的N杂原子具有吸电子性质,导致吡嗪环上的电子不是均匀分布在吡嗪环上,降低了分子的整体共轭程度。
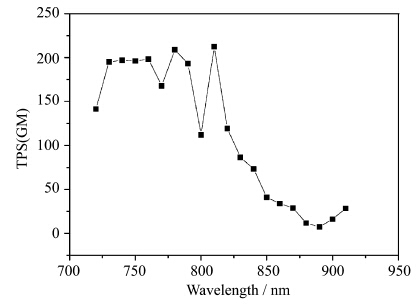 | 图4 化合物1在不同激发波长下DMSO (1×10-4mol/L)中的双光子吸收截面 Two-photon cross section (TPS) of 1 in DMSO (1×10-4mol/L) with different excitation wavelength |
| 表1 化合物1在不同溶剂中的光谱数据 Optical data of 1 in different solvents |
化合物 1 在 DMSO溶液的双光子荧光发射如图5所示。用920 nm的光激发,在595 nm处出现了一个强的荧光发射峰。与单光子荧光相比,双光子荧光发生了25 nm的红移,引起这种荧光红移的原因是溶液的再吸收[17]。通常,单光子荧光光谱在低浓度下测得,低浓度下的溶液再吸收现象可以忽略,因此荧光光谱表现为正常的发射峰。而双光子荧光光谱必须在高浓度下进行测试,在高浓度情况下,发出的荧光作为二次吸收的泵浦光重复被溶液吸收,导致荧光光谱发生红移。
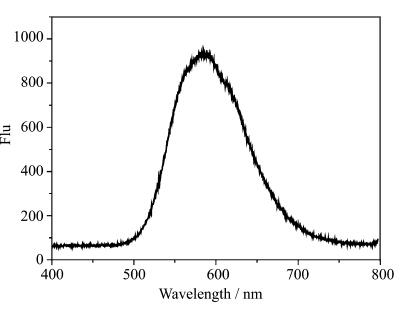 | 图5 化合物1在DMSO溶液(1×10-3mol/L) 中的双光子荧光发射光谱图 Two-photon induced fluorescence spectral of 1 in DMSO (1×10-3mol/L) λex=920 nm |
化合物 1 荧光强度随激发光功率增加而变化的情况如图6所示。从图6可以看到,当用920 nm波长的光激发时,化合物 1 的荧光强度随激发光功率的增大而明显增强,当激发光功率从16 mW增大到142 mW时(8.8倍),其荧光发射强度从9.6 a.u.增大到420.7 a.u.(43.8倍)。对于双光子诱导的荧光,一个显著的特性是荧光发射强度随激发光功率的增加而增强,且与激发光功率的平方成正比关系[18]。将图6中的荧光强度和激光功率取对数后作图,得到了如图7所示的荧光强度与激光功率关系图。从图7看出,以lgF(荧光强度取对数)为纵坐标,lgP(激光功率取对数)为横坐标作图,得到一条直线,其斜率约为1.64。荧光强度与激光功率之间很好的相关性(R2=0.99)证明 化合物 1 在920 nm波长光激发下所发射的荧光确实为双光子诱导机制。
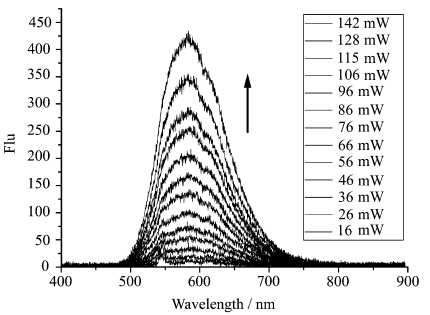 | 图6 化合物1在DMSO溶液(1×10-4mol/L)中不同激发光功率下双光子诱导荧光光谱图 Two-photon induced fluorescence spectra of 1in DMSO (1×10-4mol/L) with different excitation intensities λex=920 nm |
 | 图7 化合物1在DMSO溶液(1×10-4mol/L)中双光子诱导荧光强度与激发光功率关系图 Logarithmic plots of the dependence of two-photon induced fluorescence of 1 in DMSO (1×10-4mol/L) on pulse intensity λex=920 nm |
利用飞秒激光研究了2,5-双(对二甲氨基苯乙烯基)吡嗪双光子性质。实验结果表明,2,5-双(对二甲氨基苯乙烯基)吡嗪具有双光子吸收特性,在820 nm处的最大双光子吸收截面为212 GM。荧光性质表明,2,5-双(对二甲氨基苯乙烯基)吡嗪在近红外光(920 nm)激发下具有强荧光发射,其荧光强度随激光功率的增大而增强,且与激光功率的二次方有很好的线性关系,证明了2,5-双(对二甲氨基苯乙烯基)吡嗪在近红外光照下的发光为双光子诱导发光机制。
| [1] | Zhu H, Chen X, Jin L M, Wang Q J, Wang F, Yu S F. Amplified spontaneous emission and lasing from lanthanide-doped up-conversion nanocrystals[J]. ACS Nano, 2013, 7(12): 11420-11426. |
| [2] | Xing G, Liao Y, Wu X, Chakrabortty S, Liu X, Yeow E K L, Chan Y, Sum T C. Ultralow-threshold two-photon pumped amplified spontaneous emission and lasing from seeded CdSe/CdS nanorod heterostructures[J]. ACS Nano, 2012, 6(12): 10835-10844. |
| [3] | Yanez C O, Andrade C D, Yao S, Luchita G, Bondar M V, Belfield K D. Photosensitive polymeric materials for two-photon 3D WORM optical data storage systems[J]. ACS Applied Materials & Interfaces, 2009, 1(10): 2219-2229. |
| [4] | Xia R, Malval J-P, Jin M, Spangenberg A, Wan D, Pu H, Vergote T, Morlet-Savary F, Chaumeil H, Baldeck P, Poizat O, Soppera O. Enhancement of acid photogeneration through a para-to-meta substitution strategy in a sulfonium-based alkoxystilbene designed for two-photon polymerization[J].Chemistry Materials, 2012, 24(2): 237-244. |
| [5] | Yuan H, Zhao Y, Wu F. Two-photon acid generation systems based on dibenzylidene ketone dyes intermolecular sensitization[J].Chemistry Materials, 2012, 24(7): 1371-1377. |
| [6] | Zhao T, Yu K, Li L, Zhang T, Guan Z, Gao N, Yuan P, Li S, Yao S Q, Xu Q-H, Xu G Q. Gold nanorod enhanced two-photon excitation fluorescence of photosensitizers for two-photon imaging and photodynamic therapy[J]. ACS Applied Materials & Interfaces, 2014, 6(4): 2700-2708. |
| [7] | Amatrudo J M, Olson J P, Lur G, Chiu C Q, Higley M J, Ellis-Davies G C R. Wavelength-selective one- and two-photon uncaging of GABA[J]. ACS Chemical Neuroscience, 2014, 5(1): 64-70. |
| [8] | Arnbjerg J, Jimenez-Banzo A, Paterson M J, Nonell S, Borrell J I, Christiansen O, Ogilby P R. Two-photon absorption in tetraphenylporphycenes: Are porphycenes better candidates than porphyrins for providing optimal optical properties for two-photon photodynamic therapy[J]. The Journal of American Chemical Society, 2007, 129(16): 5188-5199. |
| [9] | Sandoval S, Yang J, Alfaro J G, Liberman A, Makale M, Chiang C E, Schuller I K, Kummel A C, Trogler W C. Europium-doped TiO2 hollow nanoshells: two-photon imaging of cell binding[J]. Chemistry Materials, 2012, 24(21): 4222-4230. |
| [10] | Parthasarathy A, Ahn H-Y, Belfield K D, Schanze K S. Two-photon excited fluorescence of a conjugated polyelectrolyte and its application in cell imaging[J]. ACS Applied Materials & Interfaces, 2010, 2(10): 2744-2748. |
| [11] | Dai Y, Ma P, Cheng Z, Kang X, Zhang X, Hou Z, Li C, Yang D, Zhai X, Lin J. Up-conversion cell imaging and pH-induced thermally controlled drug release from NaYF4:Yb3+/Er3+@ hydrogel core-shell hybrid microspheres[J]. ACS Nano, 2012, 6(4): 3327-3338. |
| [12] | Belfield K D, Andrade C D, Yanez C O, Bondar M V, Hernandez F E, Przhonska O V. New two-photon-absorbing probe with efficient superfluorescent properties[J]. Journal of Physical Chemistry B, 2010, 114(44): 14087-14095. |
| [13] | Zheng Y C, Zheng M L, Chen S, Zhao Z S, Duan X M. Biscarbazolylmethane-based cyanine: a two-photon excited fluorescent probe for DNA and selective cell imaging[J]. Journal of Materials Chemistry B, 2014, 2(16): 2301-2310. |
| [14] | Jin F, Xu D L, Zhu H Z, Yan Y, Zheng J, Zhang J, Zhou H P, Wu J Y, Tian Y P. New conjugated organic dyes with various electron donors: One- and two-photon excited fluorescence, and bioimaging[J]. Dyes and Pigments, 2014, 109: 42-53. |
| [15] | Sun C L, Liao Q, Li T, Li J, Jiang J Q, Xu Z Z, Wang X D, Shen R, Bai D C, Wang Q, Zhang S X, Fu H B, Zhang H L. Rational design of small indolicsquaraine dyes with large two-photon absorption cross section[J]. Chemical Science, 2015, 6(1): 761-769. |
| [16] | Xu C, Webb W W. Measurement of two-photon excitation cross sections of molecular fluorophores with data from 690 to 1050 nm[J]. Journal of the Optical Society of America B-Optical Physics, 13(3): 481-491. |
| [17] | Lin T, He G, Parasad P N, Tan L. Degenerate nonlinear absorption and optical power limiting properties of asymmetrically substituted stibenoid chromophores[J]. Journal of Materials Chemistry, 2004, 14(6):982-991. |
| [18] | Satapathi S, Li L, Kumar A, Huo H, Anandakathir R, Shen M, Samuelson L A, Kumar J. Strong two-photon-induced fluorescence from a highly soluble polythiophene[J]. Optics Communications, 2011, 284(14): 3612-3614. |




