21世纪以来,能源短缺和环境污染一直是人类所面临的重大挑战。一方面,人类的社会活动增加,加快了化石能源的消耗;另一方面,化石能源的燃烧造成大气中以CO2为主的温室气体排放量增加,破坏自然界碳循环的平衡,导致全球气候变暖。探索稳定地控制大气中CO2总量的方案和积极应对能源危机,成为各国政府和科学家们的重大研究课题。通过模拟自然界中植物的光合作用,在半导体催化剂作用下,利用太阳能把大气中的CO2转化为方便存储和运输的碳氢燃料,是实现碳的循环利用和开发清洁能源的一项“梦幻”工程。
自然界中植物的光合作用是植物利用太阳能将CO2和H2O转化成糖类和O2。如图 1a所示,该过程的核心是光诱导水氧化反应(PSII)产生还原型烟酰胺腺嘌呤二核苷酸磷酸(ADP)和储备能量的三磷酸腺苷(ATP),进而ADP为还原剂和ATP为能量将CO2转化为植物中的糖类(PSI)[1, 2]。过程PSII 和PSI分别为光合作用的光反应和暗反应。暗反应的主要意义在于固碳作用,即将光反应中存贮的能量和原料用于还原CO2为糖类等碳水化合物。总之,植物光合作用以太阳光作为驱动力,利用H2O为还原剂将CO2还原为碳水化合物,其本质是一个氧化还原过程。在优化条件下自然界光合作用的能量转化效率可以到达7%[3]。自然界的光合作用为实现CO2转化为碳氢燃料提供了借鉴。
类似于植物的叶子,半导体催化剂在光催化还原CO2发中扮演着重要角色。半导体材料吸收能量大于禁带宽度的光子分别在导带和价带产生自由电子和空穴,并且光生电子和空穴迁移到催化剂表面,分别进行CO2还原为碳氢燃料和H2O氧化的半反应(图 1b)。半导体材料光还原CO2转化效率取决于光捕获、光生载流子产生和分离、表面催化反应三个过程的热力学和动力学平衡。

|
图1 (a) 植物光合作用示意图;(b) 半导体材料光催化还原CO2示意图(a) Diagram of photosynthesis process of green plants and (b) schematic illustration for CO2photoreduction |
1978年,以色列科学家Halmann采用p型半导体GaP作为光电极,发现在光照下能将CO2水溶液还原为CH3OH[4]。1979年,日本东京大学Inoue等人利用WO3、TiO2、CdS、GaP、SiC等半导体材料将CO2水溶液还原为CO、CH4、CH3OH和HCOOH等多种碳氢燃料[5],从而开辟了光催化还原CO2的研究领域。虽然光催化还原CO2的研究起步较早,但CO2转化效率较低[6, 7, 8]。迄今半导体光催化还原CO2的太阳能转换效率最高只有1‰量级。因此,提高光催化还原CO2的效率是关键。可用的半导体材料主要局限于传统的光催化剂,如:TiO2、CdS、ZnS等。其中的金属硫化物,其晶格的S2-易被光生空穴氧化为S(XS + 2h+→X2++ S),这些金属硫化物需要空穴牺牲剂(如S2-、SO2-3等)来补偿电子。所以,需要开发具有高活性和选择性的新型半导体催化剂。
纳米技术的快速发展为设计半导体光催化剂提供了广阔的前景[9, 10, 11]。纳米技术能够对半导体材料进行表面积、孔隙结构、晶体暴露面、表面缺陷等进行调控,制备出具有一定结构和目标的半导体催化剂。
在过去的几年中,作者课题组在开发新型半导体材料进行光催化还原CO2的研究方面做了较为系统的工作。以d10和d0半导体氧化物为出发点,对其进行一维纳米结构调控、暴露面调控、助催化剂调控、量子限制效应调节和全固态Z型结构设计。本文主要针对这几年的研究成果和进展进行简要综述。
1 d10结构的半导体氧化物纳米材料大多数金属氧化物是由分布在元素周期表两个区域内金属离子构成,其电子构型分别为d0(Ti4+、Zr4+、Nb5+、Ta5+、V5+、Mo6+、W6+) 和d10(In3+、Ga3+、Ge4+、Sn4+、Sb5+)结构。其中,d0过渡金属离子有一个空置的d轨道,d10金属离子有一个完全占领的d轨道。d0电子结构的过渡金属氧化物一直是光催化研究领域的主体材料之一。2001年以来,Inoue组把光催化剂的研究推广到d10(In3+、Ga3+、Ge4+、Sn4+、Sb5+)电子结构的p区金属氧化物,这些金属氧化物能够光催化分解水[12, 13, 14]。与d0金属氧化物相比,d10金属氧化物的导带是由s和p轨道的杂化形成。sp杂化轨道导致导带能带弥散和激发电子迁移率高,从而有利于光催化反应[15]。作者课题组系统合成出d10半导体氧化物纳米催化剂,进行光催化还原CO2,包括有Zn2GeO4[16, 17, 18]、ZnGa2O4[19]、Cd2Ge2O6[20]、In2Ge2O7(En)[21]、Zn2SnO4[22]。
1.1 一维纳米结构调控一维纳米结构半导体包括纳米棒、纳米线、纳米管、纳米带等,已在光催化应用中得到广泛的研究[9, 10]。一维纳米结构半导体通常具有单一晶相,排除半导体材料里晶界和缺陷的可能性(通常在多晶材料作为复合中心),从而降低光生电子-空穴复合率。半导体的一维纳米结构约束电子的横向运动,也给电子提供了一个径向路径,有利于提高电子-空穴对的分离[23, 44, 45]。
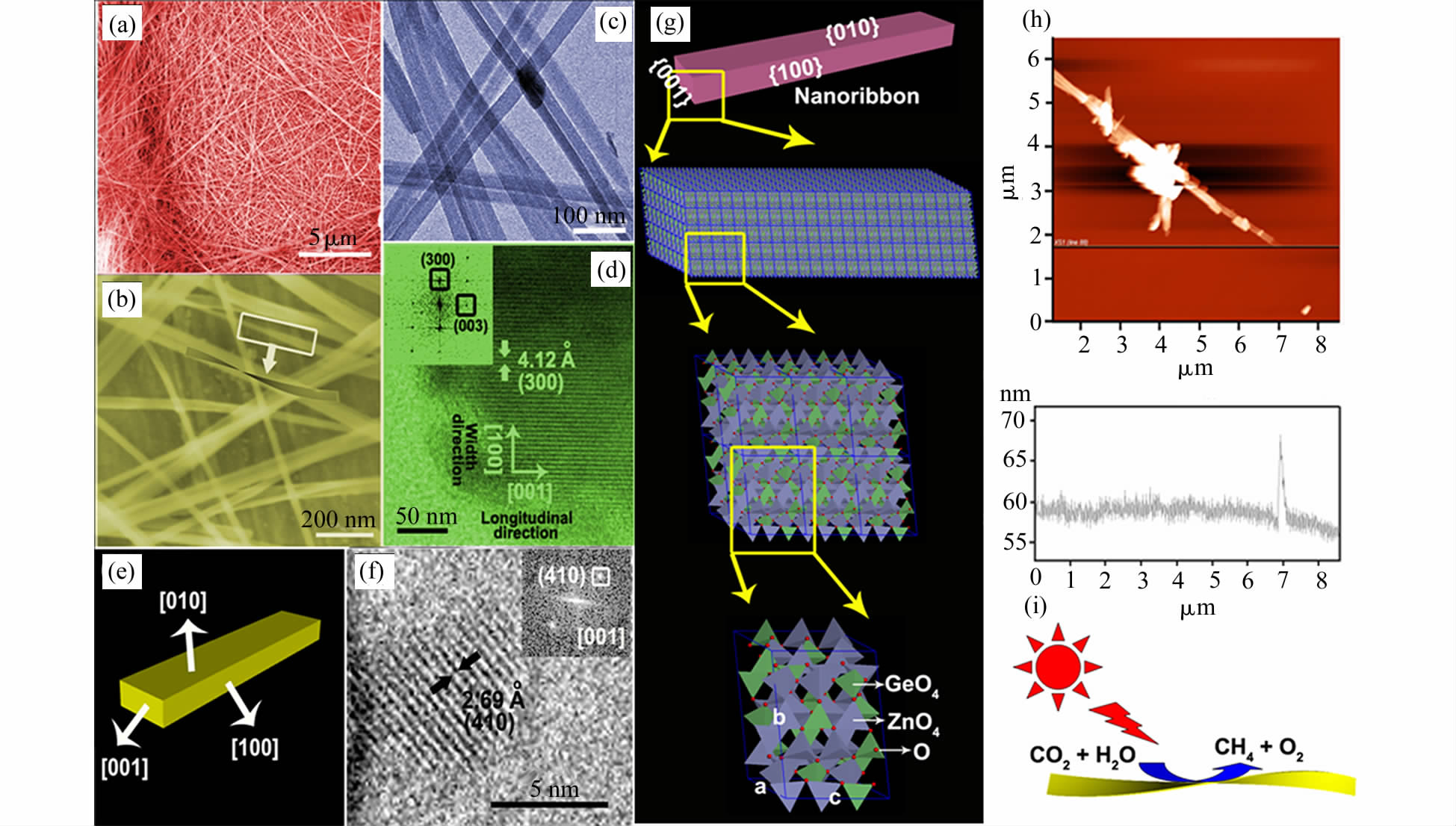
Zn2GeO4晶胞是由GeO4四面体和ZnO4四面体通过棱角的氧原子相互连接组成[26]。GeO4四面体显著扭曲导致其产生一个偶极矩(1.6D),扭曲的GeO4四面体有利于光生电子和空穴的分离。溶剂热法中常用乙二胺(En)制备低维度金属氧化物。En可以与金属离子形成稳定的螯合配位离子,从而能控制产物形貌。如图 2,作者课题组在En和H2O为溶剂体系中首次合成出数百微米长、厚度仅为~7 nm (相当于5个晶胞厚度)、长/径比高达10000的Zn2GeO4单晶纳米带[16]。Zn2GeO4纳米带的价带电位约为3.8 eV(vs. NHE),比Eo(H2O/H+) (0.82 V vs. NHE)高,而导带电位约为-0.7 eV (vs. NHE),比Eo(CO2/CH4)(-0.24 V vs. NHE)低,表明Zn2GeO4能够还原CO2和H2O生成CH4。纳米带的超长和超薄几何结构使得光生载流子可以迅速从内部迁移到催化剂表面参与光还原CO2反应。Zn2GeO4纳米带上负载Pt和RuO2助催化剂分别作为电子和空穴的富集区域,可以延长载流子寿命,进一步提高催化效率。进一步采用溶剂热法合成出直径约为2~3 nm,长度达数百纳米的In2Ge2O7(En)有机无机杂化超细纳米线[21]。相比于Zn2GeO4单晶纳米带,In2Ge2O7(En)超细纳 米线光催化还原CO2为CO,表明锗酸盐体系对CO2还原产物的选择性不同。相对于En,水合肼与金属离子形成了螯合性更强的配位离子。在水合肼和H2O混合溶剂体系中合成出一系列Cd2Ge2O6、Zn2GeO4、PbGeO3纳米线[20],其中Cd2Ge2O6纳米线的直径约为2~3 nm。Cd2Ge2O6纳米线的禁带宽度为3.9 eV,可以光催化还原CO2为CH4。
|
图2 单晶Zn2GeO4纳米带的形貌、几何纳米带结构示意图,及还原光还原CO2示意图[16] Typical SEM and TEM images,corresponding structural model,AFM image of Zn2GeO4 nanoribbon for CO2 reduction[16] |
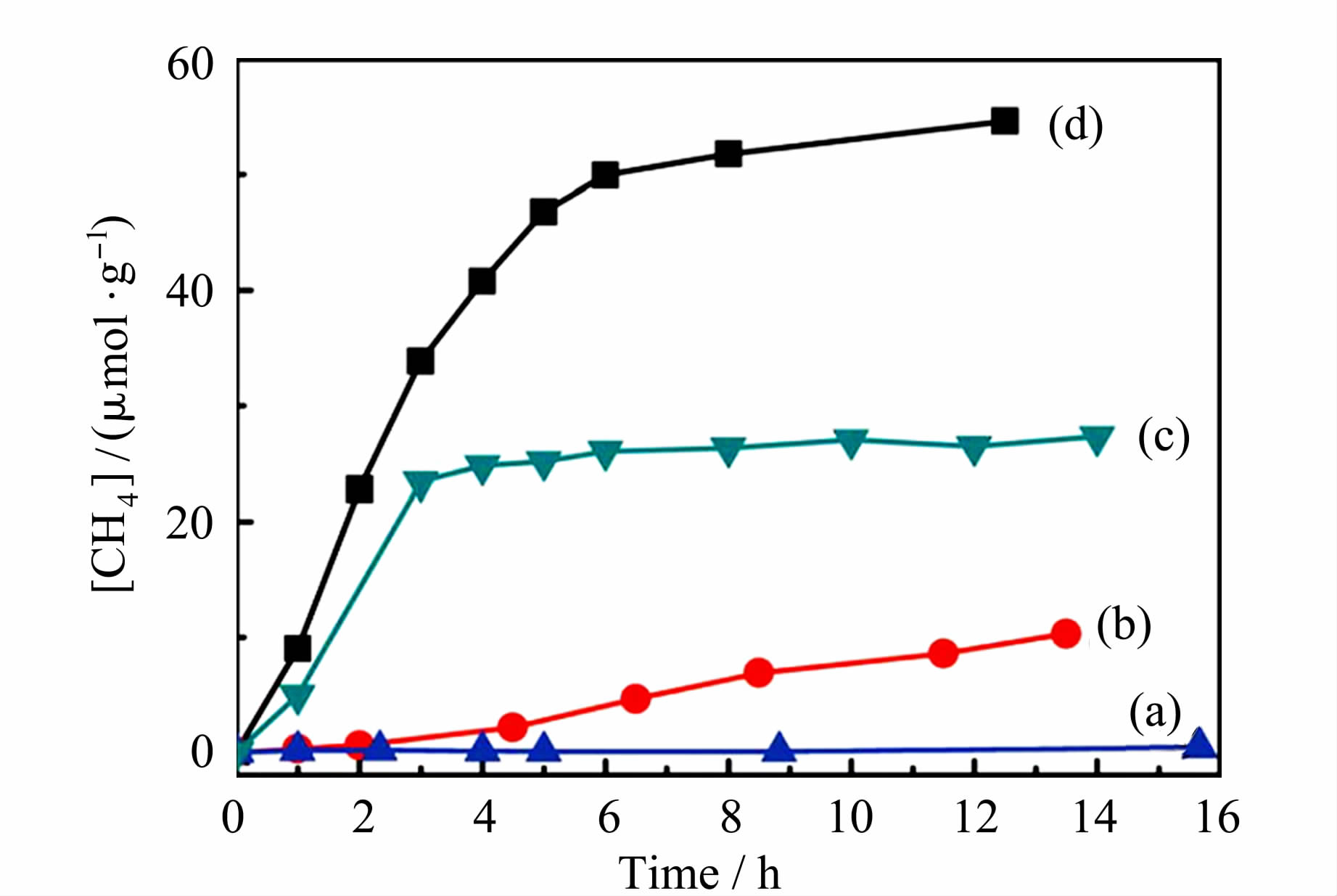
Zn2GeO4的禁带宽度为4.5 eV,只能利用太阳光的紫外部分。Zn2GeO4被氮化成黄色的Zn1.7GeN1.8O固溶体,其禁带宽度约为2.6 eV[17]。Zn1.7GeN1.8O固溶体导带底由Ge4s4p杂化轨道构成,而价带顶由O2p、N2p和Zn3d轨道组成。N2p和Zn3d的出现降低了禁带宽度。如图 3,在不负载助催化剂时,Zn1.7GeN1.8O固溶体光催化活性较低。在1% (质量分数)RuO2和1% (质量分数)Pt助催化剂负载下,Zn1.7GeN1.8O固溶体能够高效地光催化还原CO2为CH4。在波长为420±15 nm的单色光照射下,Zn1.7GeN1.8O催化剂的量子产率为0.024%。
|
图3 可见光下不同催化剂光催化还原CO2 生成CH4的量与时间的关系 (a)Zn1.7GeN1.8O,(b)负载1% Pt的Zn1.7GeN1.8O, (c)负载1% RuO2的Zn1.7GeN1.8O, (d)1% RuO2和1% Pt共负载的Zn1.7GeN1.8O[17] CH4 generation over (a) Zn1.7GeN1.8O, (b) 1% Pt-loaded Zn1.7GeN1.8O,(c) 1% RuO2-loaded Zn1.7GeN1.8O,and (d) 1% RuO2 and 1% Pt co-loaded Zn1.7GeN1.8O as a function of visible light irradiation times[17] |
半导体的光催化性能和产物选择性本质上由其表面的原子结构所决定,通过半导体暴露面调控可以调节晶体表面的原子结构。作者课题组采用En/H2O混合溶剂体系制备出大小均一和具有3D分级结构的ZnGa2O4微米花,其直径约为2 ~ 4 μm (如图 4)[19]。ZnGa2O4微米花是由{110}面暴露比例近似100%的超薄纳米片自组装形成,纳米片具有正方形或者是正六边形形状,其厚度约为6 nm,平均长度约为3 μm。3D分级结构使催化剂具有较大的比表面积,而纳米片的超薄结构也有利于载流子快速从内部迁移到表面,共同促进光催化还原CO2为CH4。进一步合成出边长为200 nm,厚度为50 nm的六边形纳米片垂直插在Zn2SnO4八面体的分级结构[22],其中纳米片以{111}面暴露为主。插片Zn2SnO4八面体在光照下能够高效地光催化还原CO2为CH4,原因为:1) Zn2SnO4八面体作为光散射中心,有利于提高光吸收和光的传播;2) 垂直纳米片提高电子传输通路,降低电子-空穴对复合;3) {111}面为活性面有利于催化反应进行。{110}晶面暴露为主的单晶纳米Zn2GeO4纳米棒也能更有效地光催化还原CO2为CO和CH4[18]。
2 d0结构的半导体氧化物纳米材料d0电子结构(Ti4、Zr4+、Nb5+、Ta5+、V5+、Mo6+、W+6)的过渡金属氧化物一直是光催化研究领域的主体材料之一。作者课题组开发出一系列d0金属氧化物纳米催化剂进行光催化还原CO2,包括TiO2[25, 26, 27, 28]、WO3[29]、Bi2WO6[30]、Fe2V4O13[31, 32]、Na2V6O16[33]、Bi6Mo2O15[34]。这些纳米材料特定的形貌有利于提高光催化还原CO2的效率。
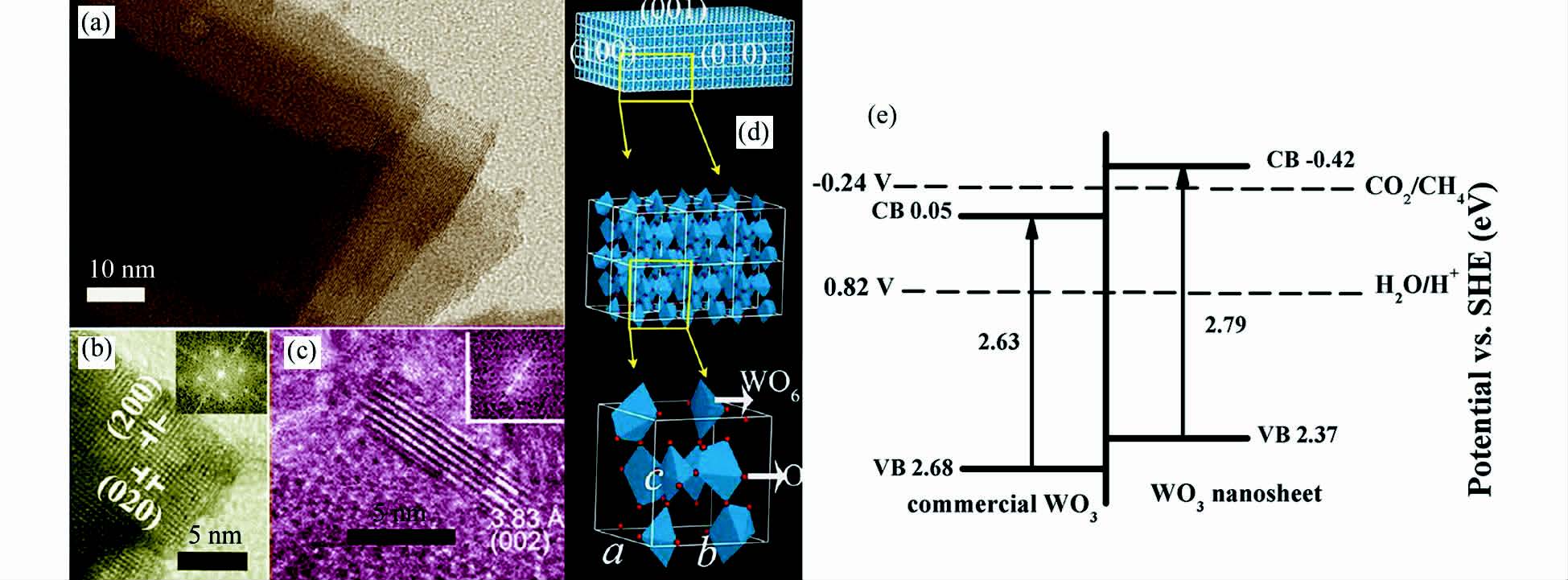
2.1 量子限制效应多数d0金属氧化物催化剂的价带位于约3 eV vs. NHE[24],虽然光生空穴具有足够强的氧化能力,但这些催化剂只能利用紫外光。WO3和Bi2WO6是可见光响应材料,其体块材料导带位置比Eo(CO2/CH4)(-0.24 V vs. NHE)高,在热力学上不能实现光催化还原CO2。如图 5,作者课题组采用操作易行的液-固电弧放电法合成出厚度仅为4~5 nm左右(相当于6个单斜晶胞厚度)的WO3超薄单晶纳米片[29]。WO3超薄纳米片由微晶沿〈100〉和〈010〉轴平行自组装形成,从而使(001)晶面暴露出来。WO3超薄纳米片具有量子尺寸效应,造成禁带宽度扩展到2.79 eV。相比于体块WO3,WO3超薄纳米片的导带位置为-0.42 V,在可见光照射下可以光催化还原CO2为CH4。同时采用水热法合成以{001}面暴露为主、厚度为~9.5 nm(相当于6个晶胞厚度)、大小均匀的Bi2WO6超薄纳米方片[30]。由于具有量子尺寸效应,Bi2WO6超薄纳米方片实现了可见光还原CO2为CH4。根据第一性原理计算表明,Bi2WO6超薄纳米方片的{001}面有利于CO2的吸附和裂解。
2.2 一维纳米结构调控大部分钒酸盐的能带结构均处于可见光波段吸收范围内,所以钒酸盐是光催化领域一个重要的材料研究体系。作者课题组采用操作易行的液-固电弧放电法合成出数百微米长,厚度仅为~5 nm的Na2V6O16·xH2O超薄单晶纳米带[33]。Na2V6O16·xH2O超薄纳米带的价带电位约为1.52 eV(vs NHE),比Eo(H2O/H+) (0.82 V vs. NHE)高,而导带电位约为-0.41 eV (vs NHE),比Eo(CO2/CH4)(-0.24 V vs. NHE)低,表明Na2V6O16·xH2O能够可见光还原CO2和H2O生成CH4。Na2V6O16·xH2O超薄纳米带的{010}面有利于电子传导到被吸附的CO2。在可见光照射(>420 nm)并负载1%(质量分数)RuO2和1%(质量分数)Pt助催化剂中,纳米带的 催化活性在第一个小时内提高30倍。直接在不锈钢丝网上垂直生长10~20 μm长,20~30 nm厚的Fe2V4O13纳米带,禁带宽度为1.83 eV,能够很好吸收可见光催化还原CO2[31]。这种在基底上生长的Fe2V4O13纳米带可以有效避免液相还原CO2过程中复杂的粉末回收过程。
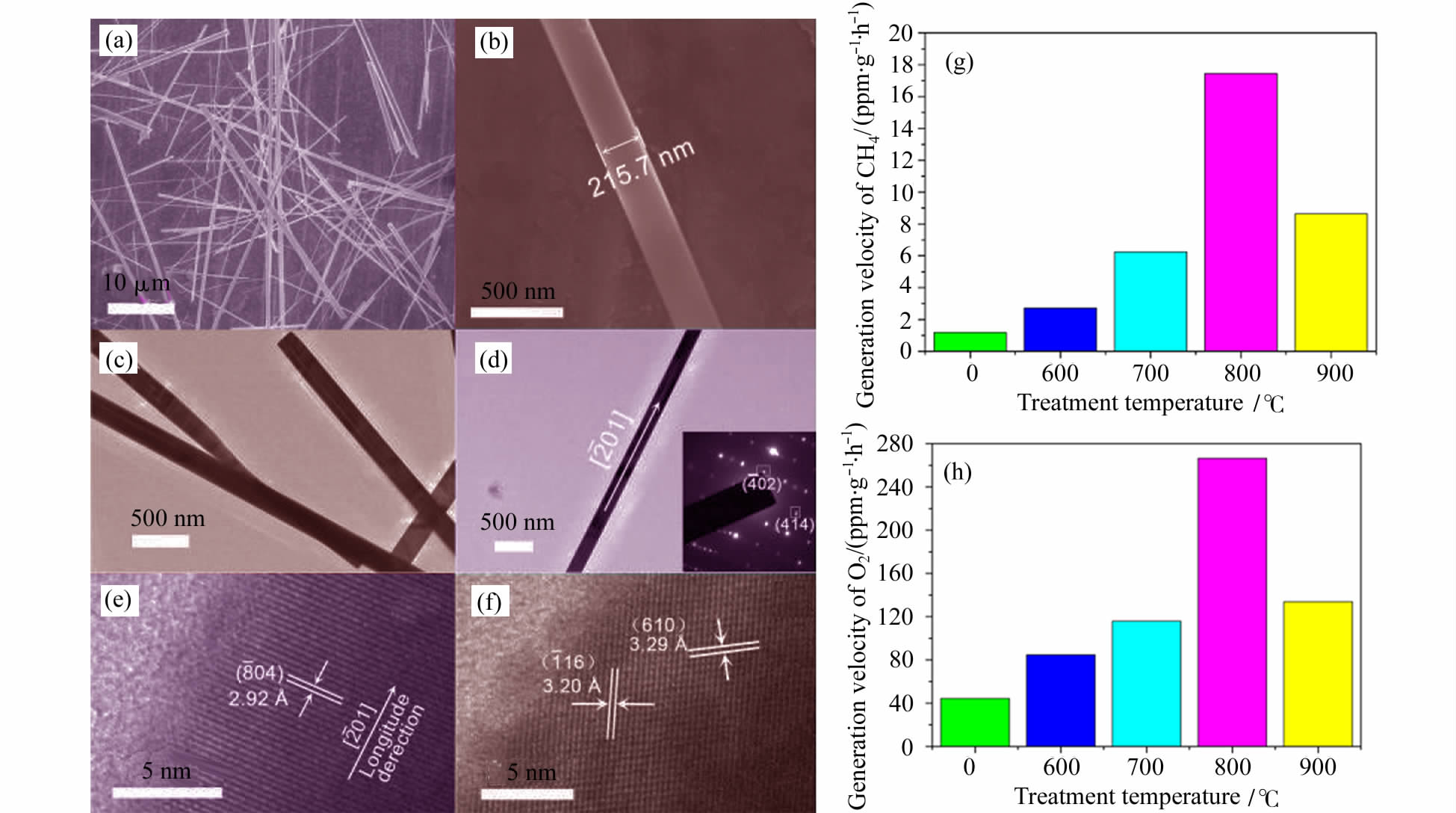
氧空位是金属氧化物的内在缺陷,其能够改变材料表面的电学和化学性质[35],半导体的表面氧空位在CO2活化过程中发挥着重要作用。斜相Bi6Mo2O15微米带(长为20~60 μm,直径为200~400 nm)在退火处理后,表面氧空位的浓度随着温度从600 ℃到800 ℃升高而增加,从而导致光催化还原CO2为CH4的性能也随之增加(如图 6)[34]。Bi6Mo2O15微米带表面氧空位可以延长光生载流子的寿命和有利于电子-空穴对的分离。然而,更高温度(900 ℃)的处理导致Bi6Mo2O15微米带光催化性能的降低,因为高温造成了其晶度的损失。类似的现象在自掺杂的SrTiO3-δ也可以观 察到[36]。SrTiO3-δ在氩气中,处理温度从1200 ℃ 到1400 ℃增加,由于氧空位和Ti3+诱导一个间接带隙的产生,使其能够吸收可见光。在优化温度为1300 ℃下,SrTiO3-δ具有最高的光催化活性,在波长为600 nm的单色光照射下其量子效率可以到0.21%。
|
图6 Bi6Mo2O15微米带的形貌和其光催化还原CO2的性能[34]Typical SEM and TEM images of Bi6Mo2O15sub-microwires and their catalytic activities of CO2 reduction[34] |
碳材料可以作为电子受体和转移体有效地阻碍光生电子-空穴对的复合,在光催化还原CO2中扮演助催化剂作用[37, 38, 39]。石墨烯是C sp2杂化的二维单层纳米片,具有独特的电学性能,如:无质
量的费米子、弹道电子传输、超高电子迁移率[47]。在光激发下,半导体中产生的光生载流子通过半导体-石墨烯界面,迁移到二维单层石墨烯,减少了电子-空穴对复合几率,可提高光催化效率。
如图 7,作者课题组采用直径为300 nm的PMMA小球为模板,用LBL法和微波辐照法合成了单层石墨烯和Ti0.91O2纳米片交替组装的G-Ti0.91O2超薄空心球。通过微波辐照可以一步还原氧化石墨烯为石墨烯和去除有机球模板[25]。G-Ti0.91O2超薄空心球光催化还原CO2为可再生燃料(CO、CH4)的效率比商用P25提高了9倍,原因为:1) Ti0.91O2片的超薄性质允许光生载流子快速转移到表面参与光还原反应;2) Ti0.91O2片和石墨烯片的紧密结合使光生电子快速转移到石墨烯,提高载流子寿命;3)空心结构能够增强光的多重散射,提高入射光的吸收。

|
图7 G-Ti0.91O2超薄空心球的形貌和光催化还原CO2示意图[25]Typical SEM and TEM imagesofG-Ti0.91O2hollow spheres for CO2 reduction[25] |
进一步采用En和H2O溶剂体系水热合成一系列含不同石墨烯比例的G-TiO2类三明治复合纳米薄片[26]。在合成过程中,氧化石墨烯被还原为石墨烯,TiO2纳米颗粒通过Ti—O—C键结合均匀紧密分散在石墨烯上,避免石墨烯的团聚。由于En作为还原剂,TiO2表面形成了丰富的Ti3+,这些Ti3+可以捕获光生电子从而阻止电子-空穴对的复合,含Ti3+的TiO2光催化还原CO2成CH4和C2H6。在石墨烯与TiO2体系中建立了电子从TiO2转移到石墨烯的通道,使电子大量聚集在石墨烯上,有利于多电子反应的进行,从而影响光催化还原CO2的产物选择性。表面Ti3+和石墨烯的协同效应有利于C—C耦合生成C2H6。该工作开启石墨烯在催化C—C偶联反应的新应用。
2.4 全固态Z型结构设计人工Z结构体系模仿绿色植物的光合作用,为光催化还原CO2转化为碳烃燃料提供了一个有效的方案,人工Z结构体系包含两种不同的半导体催化剂和可逆的氧化还原介质,通过在两种催化剂上双光子激发分别使电子/空穴具有更强的还原/氧化能力[41]。传统的溶液Z型结构体系使用的IO-3/I-、Fe3+/Fe2+等氧化还原介质。氧化还原介质会出现不必的逆反应,例如:使用IO-3/I-时,在产O2光催化剂上出现IO3-的氧化反应与产O2反应竞争空穴。固体电子介质,如Au[42]和石墨烯[43],更能有利地保证催化剂之间连续的电子传递,由催化剂-电子介质-催化剂密切接触造成。
作者课题组开发出可见光响应(λ≥420 nm) Z型光催化还原CO2体系Fe2V4O13/RGO/CdS (如图 8)[32]。在不锈钢丝网上垂直生长Fe2V4O13纳米带[37]上负载氧化石墨烯,然后加热还原氧化石墨烯为石墨烯(RGO),最后气相沉积均匀分布的CdS颗粒。瞬态吸收荧光光谱表明,Fe2V4O13的光生空穴被RGO传来的CdS光生电子复合,从而形成全固态人工Z型结构体系。CdS的光生空穴将H2O氧化释放出O2,Fe2V4O13的光生电子将CO2还原为CH4。Z型结构的形成促进了光生电荷的有效分离和传输,大幅提高了光催化性能。同时RGO与CdS复合后,CdS光腐蚀也得到了有效抑制,光催化体系的稳定性增强。

|
图8 Fe2V4O13/RGO/CdS体系的形貌和其光催化还原CO2的性能[32] Typical SEM and TEM images of Fe2V4O13/RGO/CdS system and their catalytic activities of CO2 reduction[32] |
21世纪以来,随着以CO2为主的温室气体排放量不断增加,寻求新型能源来构建低碳型社会的诉求越来越迫切。太阳能驱动转化CO2为有价值的碳氢燃料,是一种实现全球碳平衡很有前景的途径,具有巨大的潜力。当前的目标是合成有效的光催化材料来驱动氧化还原反应,实现其转换效率和选择性超过自然界光合作用。实验技术的发展为光催化材料纳米尺度调控提供了广阔前景,也为开发有效的光催化材料提供了一把钥匙。相信未来光催化还原CO2技术的大规模商业化应用并不是梦想。
| [1] | Bard A J, Fox M A.Artificial photosynthesis solar splitting of water to hydrogen and oxygen[J]. Accounts of Chemical Research, 1995, 28(3): 141-145. |
| [2] | Gagliardi C J, Westlake B C, Kent C A, Paul J J, Papanikolas J M, Meyer T J.Integrating proton coupled electron transfer (PCET) and excited states[J]. Coordination Chemistry Reviews, 2010, 254(21-22): 2459-2471. |
| [3] | Blankenship R E, Tiede D M, Barber J, Brudvig G W, Fleming G, Ghirardi M, Gunner M R, Junge W, Kramer D M, Melis A, Moore T A, Moser C C, Nocera D G, Nozik A J, Ort D R, Parson W W, Prince R C, Sayre R T. Comparing photosynthetic and photovoltaic efficiencies and recognizing the potential for improvement[J]. Science, 2011, 332(6031): 805-809. |
| [4] | Halmann M.Photoelectrochemical reduction of aqueous carbon dioxide on P-type gallium phosphide in liquid junction solar cells[J]. Nature, 1978, 275(5676): 115-116. |
| [5] | Inoue T, Fujishima A, Konishi S, Honda K. Photoelectrocatalytic reduction of carbon dioxide in aqueous suspensions of semiconductor powders[J]. Nature, 1979, 277(5698): 637-638. |
| [6] | Dhakshinamoorthy A, Navalon S, Corma A, Garcia H. Photocatalytic CO2 reduction by TiO2 and related titanium containing solids[J]. Energy & Environmental Science, 2012, 5(11): 9217-9233. |
| [7] | Habisreutinger S N, Schmidt-Mende L, Stolarczyk J K.Photocatalytic reduction of CO2 on TiO2 and other semiconductors[J]. Angewandte Chemie International Edition, 2013, 52(29): 7372-7408. |
| [8] | Tu W G, Zhou Y, Zou Z G.Photocatalytic conversion of CO2 into renewable hydrocarbon fuels: state-of-the-art accomplishment, challenges, and prospects[J]. Advanced Materials, 2014, 26(27): 4607-4626. |
| [9] | Tong H, Ouyang S X, Bi Y P, Umezawa N, Oshikiri M, Ye J H.Nano-photocatalytic materials: possibilities and challenges[J]. Advanced Materials, 2012, 24(2): 229-251. |
| [10] | Chen X B, Li C, Gratzel M, Kostecki R, Mao S S.Nanomaterials for renewable energy production and storage[J]. Chemical Society Reviews, 2012, 41(23): 7909-7937. |
| [11] | Kamat P V.Meeting the clean energy demand: nanostructure architectures for solar energy conversion[J]. Journal of Physical Chemistry C, 2007, 111(7): 2834-2860. |
| [12] | Sato J, Saito N, Nishiyama H, Inoue Y.New photocatalyst group for water decomposition of RuO2-loaded p-block metal (In, Sn, and Sb) oxides with d(10) configuration[J]. Journal of Physical Chemistry B, 2001, 105(26): 6061-6063. |
| [13] | Sato J, Kobayashi H, Inoue Y.Photocatalytic activity for water decomposition of indates with octahedrally coordinated d(10) configuration. II. Roles of geometric and electronic structures[J]. Journal of Physical Chemistry B, 2003, 107(31): 7970-7975. |
| [14] | Sato J, Kobayashi H, Ikarashi K, Saito N, Nishiyama H, Inoue Y.Photocatalytic activity for water decomposition of RuO2-dispersed Zn2GeO4 with d(10) configuration[J]. Journal of Physical Chemistry B, 2004, 108(14): 4369-4375. |
| [15] | Inoue Y.Photocatalytic water splitting by RuO2-loaded metal oxides and nitrides withd(0)-and d(10)-related electronic configurations[J]. Energy & Environmental Science, 2009, 2(4): 364-386. |
| [16] | Liu Q, Zhou Y, Kou J H, Chen X Y, Tian Z P, Gao J, Yan S C, Zou Z G.High-yield synthesis of ultralong and ultrathin Zn2GeO4nanoribbons toward improved photocatalytic reduction of CO2 into renewable hydrocarbon fuel[J].Journal of the American Chemical Society, 2010, 132(41): 14385-14387. |
| [17] | Liu Q, Zhou Y, Tian Z P, Chen X Y, Gao J, Zou Z G. Zn2GeO4 crystal splitting toward sheaf-like, hyperbranched nanostructures and photocatalytic reduction of CO2 into CH4 under visible light after nitridation[J]. Journal of Materials Chemistry, 2012, 22(5): 2033-2038. |
| [18] | Yan S C, Wan L J, Li Z S, Zou Z G.Facile temperature-controlled synthesis of hexagonal Zn2GeO4 nanorods with different aspect ratios toward improved photocatalytic activity for overall water splitting and photoreduction of CO2[J]. Chemical Communications, 2011, 47(19): 5632-5634. |
| [19] | Liu Q, Wu D, Zhou Y, Su H B, Wang R, Zhang C F, Yan S C, Xiao M, Zou Z G.Single-crystalline, ultrathin ZnGa2O4 nanosheet scaffolds to promote photocatalytic activity in CO2reduction into methane[J]. ACS Applied Materials & Interfaces, 2014, 6(4): 2356-2361. |
| [20] | Liu Q, Zhou Y, Tu W G, Yan S C, Zou Z G.Solution-chemical route to generalized synthesis of metal germanate nanowires with room-temperature, light-driven hydrogenation activity of CO2 into renewable hydrocarbon fuels[J]. Inorganic Chemistry, 2014, 53(1): 359-364. |
| [21] | Liu Q, Zhou Y, Ma Y, Zou Z G.Synthesis of highly crystalline In2Ge2O7(En) hybrid sub-nanowires with ultraviolet photoluminescence emissions and their selective photocatalytic reduction of CO2 into renewable fuel[J]. RSC Advances, 2012, 2(8): 3247-3250. |
| [22] | Li Z D, Zhou Y, Zhang J Y, Tu W G, Liu Q, Yu T, Zou Z G.Hexagonal nanoplate-textured micro-octahedron Zn2SnO4: combined effects toward enhanced efficiencies of dye-sensitized solar cell and photoreduction of CO2into hydrocarbon fuels[J]. Crystal Growth & Design, 2012, 12(3): 1476-1481. |
| [23] | Hu J T, Odom T W, Lieber C M.Chemistry and physics in one dimension: Synthesis and properties of nanowires and nanotubes[J]. Accounts of Chemical Research, 1999, 32(5): 435-445. |
| [24] | Kudo A, Miseki Y. Heterogeneous photocatalyst materials for water splitting[J]. Chemical Society Reviews, 2009, 38(1): 253-278. |
| [25] | Tu W G, Zhou Y, Liu Q, Tian Z P, Gao J, Chen X Y, Zhang H T, Liu J G, Zou Z G.Robust hollow spheres consisting of alternating titania nanosheets and graphene nanosheets with high photocatalytic activity for CO2 conversion into renewable fuels[J]. Advanced Functional Materials, 2012, 22(6): 1215-1221. |
| [26] | Tu W G, Zhou Y, Liu Q, Yan S C, Bao S S, Wang X Y, Xiao M, Zou Z G.An in situ simultaneous reduction-hydrolysis technique for fabrication of TiO2-Graphene 2D sandwich-like hybrid nanosheets: graphene-promoted selectivity of photocatalytic-driven hydrogenation and coupling of CO2 into methane and ethane[J]. Advanced Functional Materials, 2013, 23(14): 1743-1749. |
| [27] | Wang F, Zhou Y, Li P, Li H J, Tu W G, Yan S C, Zou Z G.Formation of 3D interconnectively macro/mesoporous TiO2 sponges through gelation of lotus root starch toward CO2 photoreduction into hydrocarbon fuels[J]. RSC Advances, 2014, 4(81): 43172-43177. |
| [28] | Yuan Y J, Yu Z T, Zhang J Y, Zou Z G.A copper(I) dye-sensitised TiO2-based system for efficient light harvesting and photoconversion of CO2 into hydrocarbon fuel[J]. Dalton Transactions, 2012, 41(32): 9594-9597. |
| [29] | Chen X Y, Zhou Y, Liu Q, Li Z D, Liu J G, Zou Z G.Ultrathin, single-crystal WO3nanosheets by two-dimensional oriented attachment toward enhanced photocatalystic reduction of CO2 into hydrocarbon fuels under visible light[J]. ACS Applied Materials & Interfaces, 2012, 4(7): 3372-3377. |
| [30] | Zhou Y, Tian Z P, Zhao Z Y, Liu Q, Kou J H, Chen X Y, Gao J, Yan S C, Zou Z G.High-yield synthesis of ultrathin and uniform Bi2WO6square nanoplates benefitting from photocatalytic reduction of CO2 into renewable hydrocarbon fuel under visible light[J]. ACS Applied Materials & Interfaces, 2011, 3(9): 3594-3601. |
| [31] | Li P, Zhou Y, Tu W G, Liu Q, Yan S C, Zou Z G.Direct growth of Fe2V4O13nanoribbons on a stainless-steel mesh for visible-light photoreduction of CO2 into renewable hydrocarbon fuel and degradation of gaseous isopropyl alcohol[J]. Chempluschem, 2013, 78(3): 274-278. |
| [32] | Li P, Zhou Y, Li H J, Xu Q F, Meng X G, Wang X Y, Xiao M, Zou Z G.All-solid-state Z-scheme system arrays of Fe2V4O13/RGO/CdS for visible light-driving photocatalytic CO2 reduction into renewable hydrocarbon fuel[J]. Chemical Communications, 2015, 51(4): 800-803. |
| [33] | Feng S C, Chen X Y, Zhou Y, Tu W G, Li P, Li H J, Zou Z G. Na2V6O16·xH2O nanoribbons: large-scale synthesis and visible-light photocatalytic activity of CO2 into solar fuels[J]. Nanoscale, 2014, 6(3): 1896-1900. |
| [34] | Li P, Zhou Y, Tu W, Wang R, Zhang C, Liu Q, Li H, Li Z, Dai H, Wang J, Yan S, Zou Z.Synthesis of Bi6Mo2O15 sub-microwires via a molten salt method and enhancing the photocatalytic reduction of CO2 into solar fuel through tuning the surface oxide vacancies by simple post-heating treatment[J]. CrystEngComm, 2013, 15(46): 9855-9858. |
| [35] | Campbell C T, Peden C H F.Chemistry oxygen vacancies and catalysis on ceria surfaces[J]. Science, 2005, 309(5735): 713-714. |
| [36] | Xie K, Umezawa N, Zhang N, Reunchan P, Zhang Y, Ye J.Self-doped SrTiO3-δphotocatalyst with enhanced activity for artificial photosynthesis under visible light[J]. Energy & Environmental Science, 2011, 4(10): 4211-4219. |
| [37] | Zhang C L, Zhang Q Y, Kang S F, Li B, Li X, Wang Y G.Route to mesoporous TiO2/graphitic carbon microspheres for photocatalytic reduction of CO2 under simulated solar irradiation[J]. Ecs Solid State Letters, 2013, 2(9): M49-M52. |
| [38] | Xia X H, Jia Z H, Yu Y, Liang Y, Wang Z, Ma L L.Preparation of multi-walled carbon nanotube supported TiO2 and its photocatalytic activity in the reduction of CO2 with H2O[J]. Carbon, 2007, 45(4): 717-721. |
| [39] | Liang Y T, Vijayan B K, Gray K A, Hersam M C.Minimizing graphene defects enhances titania nanocomposite-based photocatalytic reduction of CO2 for improved solar fuel production[J]. Nano Letters, 2011, 11(7): 2865-2870. |
| [40] | Tu W, Zhou Y, Zou Z.Versatile graphene-promoting photocatalytic performance of semiconductors: basic principles, synthesis, solar energy conversion, and environmental applications[J]. Advanced Functional Materials, 2013, 23(40): 4996-5008. |
| [41] | Maeda K.Z-scheme water splitting using two different semiconductor photocatalysts[J]. ACS Catalysis, 2013, 3(7): 1486-1503. |
| [42] | Tada H, Mitsui T, Kiyonaga T, Akita T, Tanaka K.All-solid-state Z-scheme in CdS-Au-TiO2 three-component nanojunction system[J]. Nature Materials, 2006, 5(10): 782-786. |
| [43] | Iwase A, Ng Y H, Ishiguro Y, Kudo A, Amal R.Reduced graphene oxide as a solid-state electron mediator in Z-scheme photocatalytic water splitting under visible light[J]. Journal of the American Chemical Society, 2011, 133(29): 11054-11057. |
| [44] | 段春阳, 王 辉, 李 凡, 张晓宏. 银纳米颗粒/聚(乙撑二氧噻吩)修饰的硅纳米线阵列的合成及可见光催化性能研究[J]. 影像科学与光化学, 2015, 33(2): 108-116. Duan C Y, Wang H, Li F,Zhang X H. Fabrication and visible light photocatalytic study of AgNPs/PEDOT decorated Si nanowires array[J]. Imaging Science and Photochemistry, 2015, 33(2): 108-116. |
| [45] | 张美林, 金 峰, 郑美玲, 刘 洁, 段宣明. 水热法生长方式对ZnO纳米棒阵列结构和性能的影响[J]. 影像科学与光化学, 2015, 33(2): 136-143. Zhang M L, Jin F, Zheng M L,Liu J,Duan X M. Effect of hydrothermal growing method on the structure and crystalline quality of ZnO nanorod array[J]. Imaging Science and Photochemistry, 2015, 33(2): 136-143. |