氢化酶 (Hydrogenases) 是一类广泛分布于自然界中的生物酶[1],可高效催化质子 (H+) 和氢气 (H2) 在生物体内的可逆转换。根据催化中心金属的不同,通常被分为[NiFe]氢化酶、[FeFe]氢化酶和单[Fe]氢化酶。其优异的催化产氢性能引起了众多金属有机合成专家的关注[2, 3, 4, 5],并希望通过人工合成金属催化中心来模拟其催化产氢过程,从而为解决能源危机寻找新的突破口。根据文献报道,近期基于FeFe氢化酶模拟物的光致产氢研究已经有所突破。2008年,孙立成小组利用Ru(bpy)2+3作为光敏剂,H2A作为电子牺牲体在可见光驱动下成功实现了催化H+转化为H2。同期,吴骊珠小组利用Re(Ⅰ) 作为光敏剂,构建了超分子体系并成功应用于人工光合成产氢[6, 7, 8];随后该小组利用量子点作为光敏剂,将这类模拟物的产氢寿命和效率都显著提升[9, 10, 11]。
相比于FeFe氢化酶,NiFe氢化酶有着独特的优点:可高效可逆催化H+和H2相互转化及良好的耐氧性[12, 13]。但是受限于合成手段的匮乏和对催化循环中间态认识的不清晰,基于NiFe氢化酶模拟物的光催化产氢体系很少被报道[14, 15, 16, 17]。最新研究发现,NiFe氢化酶完成催化循环大概要经过Ni-Sia、Ni-R和Ni-C这三个中间态。天然分离的NiFe氢化酶在含有氧气的氛围中会很快形成氧化态Ni-A或者Ni-B (图 1-a),最后经电子还原形成Ni-Sia态才可以进入催化循环。这些过程中都要经过很重要的一步:金属氢化物的形成。2010年,Ruchefuss小组和Tatsumi小组合成了以NiFe金属原子为中心的模拟物,并指出其在强酸性条件下会形成金属桥联氢化物[16, 18, 19]。Ruchefuss等在随后的研究中开发了不同配体的氢化物,并且很多都具有电催化产氢的活性[16]。2013年,Ogo小组成功开发了以NiFe原子为中心的模拟物,其在碱性条件下可以成功裂解H2生成氢化物,并且在酸性条件下可以催化质子产生氢气,完成了对NiFe氢化酶功能模拟的完善[20]。直到2014年,基于NiFe氢化酶模拟物的光致产氢体系才被首次报道[14]。作者利用Re和Ru的金属配合物作为光敏剂在有机体系中研究了催化产氢循环的机理,而水相中的光致产氢体系还未经报道。基于此,我们利用一类异核NiRu氢化酶模拟物为催化剂[21, 22],Ru(bpy)2+3为光敏剂,抗坏血酸 (H2A) 为电子牺牲体,在乙腈与水的混合溶剂中成功构建了光催化产氢体系。蓝光LEDs(450 nm,3.0 W) 光照20 min,体系的产氢TON值可高达1893,TOF为1.6 s-1 (前10 min为2.6 s-1)。
1 实验部分 1.1 仪器与试剂1HNMR:Bruker-400 核磁共振仪;质谱:Shimadzu GC/MS-QP5050A质谱仪;光源:蓝光LEDs (450 nm);电化学工作站:Princeton Appied Research Model 283 Potentiostat/Galvanostat;气相色谱法:Techcomp 7890 Ⅱ。
1.2 实验方法NiRu化合物的合成[22]
取0.453 g (0.74 mmol) [(cymene)RuCl2]2和0.834 g (1.48 mmol) Ni(pdt)(dppe) 于舒伦克瓶中,在惰性气氛保护下将干燥的DCM加入到体系中,室温搅拌4.0 h。随着反应的进行,溶液颜色逐渐加深。反应结束后利用旋转蒸发仪蒸干溶剂,柱层析进行快速分离 (乙腈∶甲醇=9∶1),得到深红色固体,产率约为50%。
1HNMR (CDCl3)∶ 7.80 (m,4H),7.50 (m,16H),7.16 (t,J=7.5 Hz,4H),5.43 (d,J=5.8 Hz,2H),5.48 (d,J= 5.8 Hz,2H),2.79 (m 1H),2.31 (m,8H),2.21 (d,J=24.3 Hz,4H),1.98 (m,2H),1.20 (d,J=7.0 Hz,6H). ESI-MS∶ m/z 835 [(cymene)Ru(Cl)(pdt)Ni(pdt)]+。
1.3 产氢实验方法取一支体积为20 mL的反应管,将适量的Ru(bpy)3Cl2和H2A加入到体系中。随后将体积比为1∶1的CH3CN和H2O的混合溶剂加入反应体系中,调节溶液pH值,通Ar 30 min。然后用注射器快速打入适量NiRu催化剂,向体系中打入1.0 mL甲烷作为内标。LEDs (450 nm,3.0 W) 作为光源进行光照,光照一定时间时利用气相色谱检测体系中的气体组成。
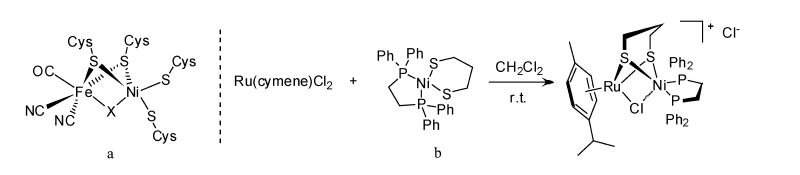
2 结果与讨论 2.1 异核NiRu氢化酶模拟物合成异核NiRu配合物参照文献报道的方法合成[21, 22]。利用Ni(dppe)(pdt) 和Ru(cymene)Cl2为原料,室温条件下在二氯甲烷中搅拌即可得到目标产物 (产率~50%),并通过核磁和高分辨质谱等手段对NiRu配合物进行了表征 (图 1b)。
|
图1 (a) NiFe氢化酶结构;(b) NiRu配合物相关合成步骤 The structure of NiFe hydrogenase and the synthesis of NiRu mimic |
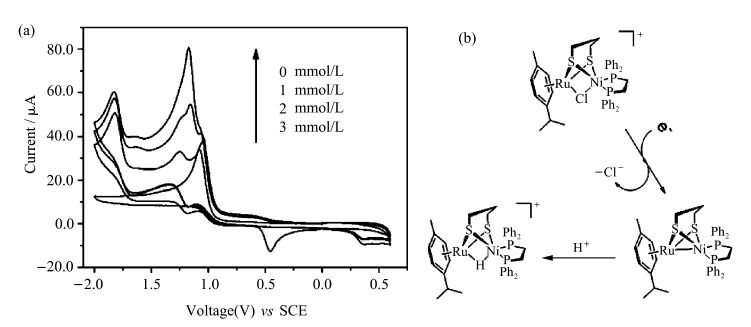
首先,电化学性质测试表明NiRu配合物在乙腈中的还原电位为-1.10 V vs SCE。向体系中分别加入1.0 mmol/L、2.0 mmol/L和3.0 mmol/L的三氟乙酸,在-1.25 vs SCE出现了新的还原峰 (图 2a)。根据文献报道[21, 22],我们将该还原峰归属为NiRu配合物对应的氢化物。如图 2b中所示,催化中心在得一个电子后失去Cl-,在H+存在条件下形成氢化物。氢化物是氢化酶模拟物在催化循环过程中一个比较重要的中间态,其可以继续得到一个电子和质子生成分子H2,从而完成整个催化循环过程。
|
图2 (a) 循环伏安法测试:不同浓度的三氟乙酸条件下浓度为1.0 mmol/L NiRu氢化酶模拟物在乙腈中的电流变化情况 (扫描速度为100 mV/s,0.1 mol/L四正丁基六氟磷酸铵作为支持电解质);(b) 电化学生成氢化物的机理 (a) Cyclic voltammetry of 1.0 mmol/L NiRu mimic in 0.1 mol/L Bu4NPF6 CH3CN with 1.0 mmol/L, 2.0 mmol/L and 3.0 mmol/L TFA,(b) electrochemical process of the formation of hydride |
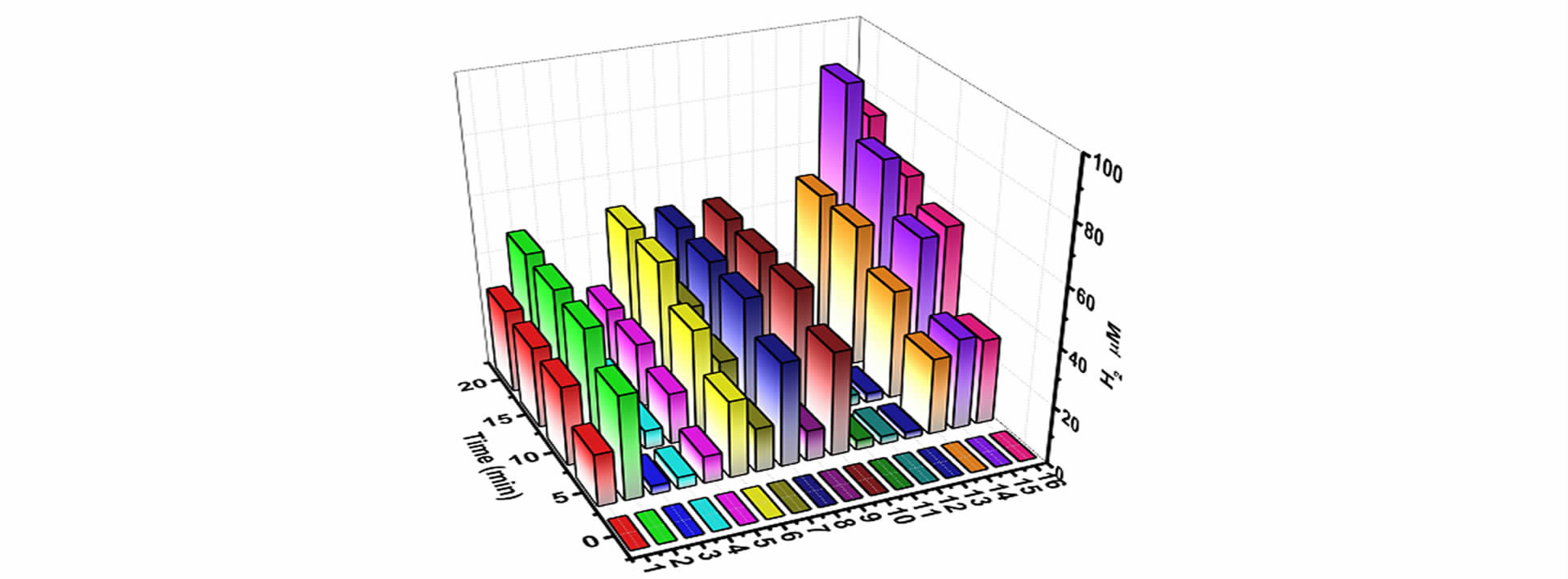
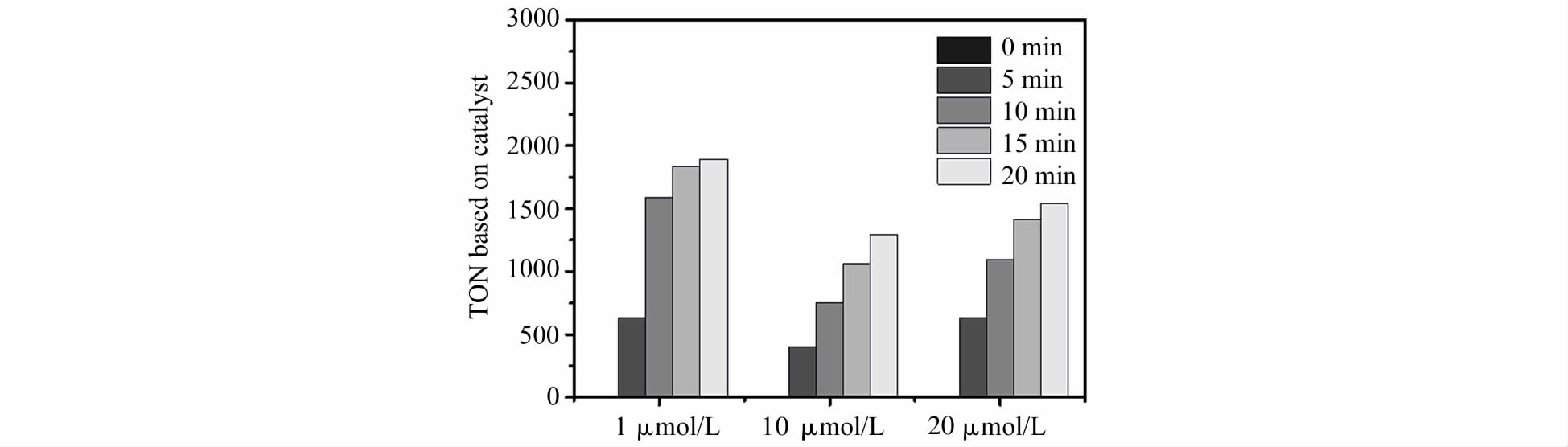
基于电化学测试得到的还原电位,选取Ru(bpy)2+3作为光敏剂。根据文献报道,抗坏血酸还原得到的Ru(bpy)+3 电位为-1.33 V vs SCE,恰好可以在室温条件下与催化剂分子发生电荷转移。因此,我们利用乙腈和水的混合溶液作为溶剂,Ru(bpy)2+3作为光敏剂,H2A作为电子牺牲体,NiRu作为产氢催化剂构建了人工光合成制氢体系。分别对溶剂组成、光敏剂浓度、电子牺牲体浓度、体系pH和催化剂浓度进行了优化 (图 3),得出产氢的最优条件为CH3CN和H2O的体积比为1∶1,pH为 4.0,Ru(bpy)2+3的浓度为0.5 mmol/L以及H2A浓度为0.1 mol/L。随着催化剂NiRu浓度的变化,我们发现体系的TON变化并不是十分明显。在最优产氢条件下,催化剂控制用量为10 μmol/L时,体系在450 nm光照射下20 min的TON值可高达1893,且前10 min 的TOF为2.6 s-1 (图 4)。
|
图3 不同条件下体系产氢量随时间变化 其中1~4的条件为:NiRu催化剂浓度为10 μmol/L,光敏剂Ru(bpy)2+3浓度为0.1 mmol/L, pH=5.0,H2A浓度为0.1 mol/L,CH3CN∶H2O分别为3∶1 (1),1∶1(2),1∶3 (3) 和1∶9 (4) 条件下H2量随光照的变化。 编号5~8为NiRu催化剂在体系中浓度为1.0 mmol/L,pH = 5.0,H2A浓度为0.1 mol/L,CH3CN∶H2O = 1∶1 (体积比), 随光敏剂Ru(bpy)2+3浓度变化1.0 mmol/L (5),0.5 mmol/L (6),0.3 mmol/L (7) 和0.1 mmol/L (8) 条件下H2随光照时间的变化。 9~12分别为NiRu催化剂在体系中浓度为10 μmol/L,光敏剂Ru(bpy)2+3为0.1 mmol/L,pH=5.0, 组成体系为CH3CN∶H2O = 1∶1 (体积比),在含有不同浓度H2A为0.2 mol/L (9),0.1 mol/L (10),0.05 mol/L (11)和0.01 mol/L (12)条件下H2随光照时间的变化。最后一组13~16为催化剂在体系中浓度为10 μmol/L,光敏剂Ru(bpy)2+3为0.1 mmol/L, H2A浓度为0.1 mol/L,组成体系为CH3CN∶H2O = 1∶1 (体积比),其中体系的pH值分别为6.0 (13),5.0 (14),4.0 (15)和3.0 (16) Photoinduced hydrogen production under different conditions 1 to 4 were carried out under a condition of NiRu 10μmol/L,Ru(bpy)2+3 0.1 mmol/L,pH=5.0,H2A 0.1 mol/L by changing volume ratio of CH3CN∶H2O from 3∶1 to 1∶9; 5 to 8 were carried out under a condition of NiRu 1.0 mmol/L,pH=5.0,H2A 0.1 mol/L, CH3CN∶H2O=1∶1 (v∶v) by changing the concentration of Ru(bpy)2+3 from 1.0 mmol/L to 0.1 mmol/L; 9 to 12 were carried out under a condition of NiRu 10 μmol/L,Ru(bpy)2+3 0.1 mmol/L,pH = 5.0,CH3CN∶H2O=1∶1 (v∶v) by changing the concentration of H2A from 0.2 mol/L to 0.01 mol/L; 13 to 16 were carried out under a condition of NiRu 10 μmol/L,Ru(bpy)2+3 0.1 mmol/L,H2A 0.1 mol/L,CH3CN∶H2O=1∶1 (v∶v) by changing pH value from 6.0 to 3.0 |
|
图4 光敏剂Ru(bpy)2+3 为0.5 mmol/L,pH = 4.0,H2A浓度为0.1 mol/L,CH3CN∶H2O = 1∶1 (体积比) 的条件下 不同催化剂浓度对光催化产氢TON值的影响 TON variation of the photoinduced hydrogen production in 0.5 mmol/L Ru(bpy)2+3,0.1 mol/L H2A and CH3CN∶H2O =1∶1 solution under pH = 4.0 with different concentration of NiRu |
本文合成了一类新型的模拟NiFe氢化酶的以NiRu为金属核心的氢化酶模拟物,我们首次成功地将其作为质子还原的催化剂建立了光催化产氢体系。最优条件下,体系可见光照20 min,基于催化剂的TON值可达1893,TOF 1.6 s-1 (前10 min TOF为2.6 s-1)。这在基于NiFe氢化酶模拟物的产氢体系中为最高值 (文献报道52 h-1)[14],且效率能与基于FeFe氢化酶模拟物的产氢体系相媲美,在后续的实验中我们将进一步深入研究其产氢机制并提高体系的稳定性。
| [1] | Lubitz W, Ogata H, Rudiger O, Reijerse E. Hydrogenases[J]. Chemical Review, 2014, 114(8): 4081-4148. |
| [2] | Simmons T R, Berggren G, Bacchi M, Fontecave M, Artero V. Mimicking hydrogenases: from biomimetics to artificial enzymes[J]. Coordination Chemical Review, 2014, 270-271: 127-150. |
| [3] | Kaur-Ghumaan S, Stein M. [NiFe] hydrogenases: how close do structural and functional mimics approach the active site[J]. Dalton Transactions, 2014, 43(25): 9392-9405. |
| [4] | Tard C, Pickett C J. Structural and functional analogues of the active sites of the [Fe]-,[NiFe]-, and [FeFe]-hydrogenases[J]. Chemical Review, 2009, 109(6): 2245-2274. |
| [5] | 李旭兵, 王晓军, 王格侠, 邢令宝, 张丽萍, 佟振合, 吴骊珠. 环双(百草枯对苯撑)-双2-萘甲酸三缩四乙二醇酯二元超分子给受体体系光诱导电子转移研究[J]. 影像科学与光化学, 2010, 28(4): 241-246. Li X B, Wang X J, Wang G X, Xing L B, Zhang L P, Tong Z H, Wu L Z. Photoinduced electron transfer in self-assembly CBPQT and N-P4-N[J]. Imaging Science and Photochemistry, 2010, 28(4): 241-246. |
| [6] | Wang W G, Wang F, Wang H Y, Si G, Tung C H, Wu L Z. Photocatalytic hydrogen evolution by FeFe hydrogenase mimics in homogeneous solution[J]. Chemistry-an Asian Journal, 2010, 5(8): 1796-1803. |
| [7] | Wang H Y, Si G, Cao W N, Wang W G, Li Z J, Wang F, Tung C H, Wu L Z. A triad FeFe hydrogenase system for light-driven hydrogen evolution[J]. Chemical Communication, 2011, 47(29): 8406-8408. |
| [8] | Wang F, Liang W J, Wang W G, Chen B, Feng K, Zhang L P, Tung C H, Wu L Z. Bis-terpyridine Os(Ⅱ) complex sensitized FeFe hydrogenase mimic systems: synthesis and photophysical study[J]. Acta Chimica Sinica, 2012, 70(22): 2306-2310. |
| [9] | Jian J X, Liu Q, Li Z J, Wang F, Li X B, Li C B, Liu B, Meng Q Y, Chen B, Feng K, Tung C H, Wu L Z. Chitosan confinement enhances hydrogen photogeneration from a mimic of the diiron subsite of [NiFe]-hydrogenase[J]. Nature Communication, 2013, 4: 2695. |
| [10] | Wang F, Liang W J, Jian J X, Li C B, Chen B, Tung C H, Wu L Z. Exceptional Poly(acrylic acid)-based artificial FeFe-hydrogenases for photocatalytic H2 production in water[J]. Angewandte Chemie International Edition, 2013, 52(31): 8134-8138. |
| [11] | Wang F, Wang W G, Wang X J, Wang H Y, Tung C H, Wu L Z. A highly efficient photocatalytic system for hydrogen production by a robust hydrogenase mimic in an aqueous solution[J]. Angewandte Chemie International Edition, 2011, 50(14): 3193-3197. |
| [12] | Fritsch J, Lenz O, Friedrich B. Structure, function and biosynthesis of O2-tolerant hydrogenases[J]. Nature Reviews Microbiology, 2013, 11(2): 106-114. |
| [13] | Simmons T R, Artero V. Catalytic hydrogen oxidation: dawn of a new iron age[J]. Angewandte Chemie International Edition, 2013, 52(24): 6143-6145. |
| [14] | Summers P A, Dawson J, Ghiotto F, Hanson-Heine M W, Vuong K Q, Stephen D E, Sun X Z, Besley N A, McMaster J, George M W, Schroder M. Photochemical dihydrogen production using an analogue of the active site of [NiFe] hydrogenase[J]. Inorganic Chemistry, 2014, 53(9): 4430-4439. |
| [15] | Barton B E, Whaley C M, Rauchfuss T B, Gray D L. Nickel-iron dithiolato hydrides relevant to the [NiFe]-hydrogenase active site[J]. Journal of the American Chemical Society, 2009, 131(20): 6942-6943. |
| [16] | Barton B E, Rauchfuss T B. Hydride-containing models for the active site of the nickel- iron hydrogenases[J]. Journal of the American Chemical Society, 2010, 132(42): 14877-14885. |
| [17] | Ohki Y, Yasumura K, Ando M, Shimokata S, Tatsumi K. A model for the CO-inhibited form of [NiFe] hydrogenase: synthesis of (CO)3Fe(μ-StBu)3Ni{SC6H3-2,6-(mesityl)2} and reversible CO addition at the Ni site[J]. Proceedings of the National Academy of Sciences of the United States of America, 2010, 107(9): 3994-3997. |
| [18] | Manor B C, Rauchfuss T B. Hydrogen activation by biomimetic NiFe-hydrogenase model containing protected cyanide cofactors[J]. Journal of the American Chemical Society, 2013, 135(32): 11895-11900. |
| [19] | Carroll M E, Barton B E, Gray D L, Mack A E, Rauchfuss T B. Active-site models for the Nickel-Iron hydrogenases: effects of ligands on reactivity and catalytic properties[J]. Inorganic Chemistry, 2011, 50(19): 9554-9563. |
| [20] | Ogo S, Ichikawa K, Kishima T, Matsumoto T, Nakai H, Kusaka K, Ohhara T. A functional -hydrogenase mimic that catalyzes electron and hydride transfer from H2[J]. Science, 2013, 339(6120): 682-684. |
| [21] | Chambers G M , Mitra J, Rauchfuss T B, Stein M. Ni(Ⅰ)/Ru(Ⅱ) model for the Ni-L state of the hydrogenases: synthesis, spectroscopy, and reactivity[J]. Inorganic Chemistry, 2014, 53(8): 4243-4249. |
| [22] | Chambers G M, Angamuthu R, Gray D L, Rauchfuss T B. Organo ruthenium-nickel dithiolates with redox-responsive nickel sites[J]. Organometallics, 2013, 32(21): 6324-6329. |




