虎杖甙,又名云杉新甙、白藜芦醇甙,提取自蓼科植物虎杖的干燥根茎和根,是其中一种天然活性成分,被广泛应用于医药和保健品方面[1, 2]。虎杖甙已被证明具有抗血小板聚集[3]、抑制肿瘤[4]、抗氧化活性[5, 6]及抗炎[7]等生理功能,还可以保护由缺糖缺氧引起的心肌细胞损伤[8, 9]。虽然虎杖甙具有保护人体健康的效果,但由于虎杖甙在水中溶解度较小,在紫外照射下易发生异构化,不稳定,导致生物利用度低,其应用受到了限制[10]。因此增大虎杖甙的溶解度和光稳定性对拓宽虎杖甙的应用范围具有重要的意义。
环糊精(CDs)是一系列由D(+)-葡萄糖单元通过α-1,4-糖苷键连接形成的环状低聚糖,具有亲水的外围和疏水的空腔[11]。它的手性疏水空腔可以提供一个尺寸和形状相对固定的手性环境[12],使其可以包合很多疏水性客体分子并使客体分子的物化性质得到改进,如提高难溶性化合物的水溶性[13, 14],不稳定化合物的光、热稳定性[15],以及药物和香味物质的控制释放等[16, 17]。其中,β-环糊精(β-CD)因其廉价、具有适中的空腔尺寸、容易形成包合物等优点,使其在包合物制备和药物载体等方面得到广泛的应用。然而,未经修饰的β-CD具有较低的水溶性( 25℃下的溶解度约为18.5 g/L),限制了其应用。近年来,各种β-CD的衍生物得到了较大范围的应用。其中,羟丙基-β-环糊精(HP-β-CD)因其水溶性好、无毒性等优点受到广泛关注[18, 19]。
本文以虎杖甙为客体分子,将通过相溶解度方法研究主客体化合物在溶液中的相互作用,通过冷冻干燥法制备虎杖甙/HP-β-CD的包结物,并采用XRD、TG、DSC、SEM等技术手段表征包合物的结构。在此基础上,考察了包合前后虎杖甙的光稳定性。
1 实验部分 1.1试剂和仪器试剂:虎杖甙(>99%,阿拉丁公司),羟丙基-β-环糊精(HP-β-CD,Mw=1380 g/mol, DS=4.2,上海西宝生物科技有限公司),其它试剂和溶剂均购于北京化工厂,溶剂使用前均经干燥处理,水溶液均使用去离子水配置。
仪器:CARY-60分光光度计(瓦里安,美国),D/MAX 2500V/PC X射线衍射仪,DTG-60AH热重分析仪(岛津,日本);TESCAN VEGA Ⅱ扫描电镜(捷克)。
1.2 制备方法 1.2.1 虎杖甙/HP-β-CD包合物的合成虎杖甙(0.6 mmol,234 mg)溶于40 mL的乙醇中,HP-β-CD(0.3 mmol,410 mg)溶于160 mL的蒸馏水中,将HP-β-CD溶液缓慢加入虎杖甙溶液中,并搅拌48 h后,旋蒸除去大部分溶剂,浓缩后的样品经0.45 μm的滤膜过滤,滤液经冷冻干燥后,所得样品即为HP-β-CD/虎杖甙包合物。
1.2.2 虎杖甙/HP-β-CD的物理混合物将HP-β-CD和虎杖甙按照摩尔比1∶1的比例称取,在玛瑙研钵中充分研磨使其混合均匀。
1.3 相溶解度称取100 mg的虎杖甙分别加入10 mL不同浓度的HP-β-CD溶液中(浓度梯度从0 mmol/L到10.0 mmol/L),在25 ℃的水浴条件下,保持120 r/min振动频率进行充分振荡,振荡时间为72 h。达到平衡后,经0.45 μm的滤膜除去不溶的虎杖甙,用紫外-可见分光光度计测定滤液中虎杖甙的含量。然后以虎杖甙溶解度为纵坐标,HP-β-CD的浓度为横坐标,绘制虎杖甙的相溶解度曲线并计算包合相平衡常数(Ks)[20]。

其中,S0表示在25 ℃时不添加环糊精的虎杖甙的溶解度,Slope为相溶解度曲线的斜率。
1.4 X-射线粉末衍射(XRD)实验条件:CuKa射线,波长为0.154056 nm,电压40 kV,电流40 mA,扫描速度4°/min,2θ范围5°~50°。
1.5 热重分析(TG)及差示扫描量热法(DSC)热重分析及差示扫描量热法的测量仪器为DTG-60AH(岛津,日本),实验条件:升温范围30~400 ℃,升温速率10 ℃/min,氮气流量70 mL/min。
1.6 扫描电子显微镜(SEM)将样品粉末均匀涂布在导电胶带上,放入喷金仪中,在20 W的真空状态下喷金30 s,使样品被涂上一层金薄膜层,之后放入扫描电镜中观察样品形貌
。 1.7 光稳定性研究用波长范围为200~400 nm的紫外灯光照浓度为6×10-5mol/L的虎杖甙、虎杖甙/HP-β-CD包合物的溶液,不同时间点取样测定吸光度,检测波长为310 nm。
2 结果与讨论 2.1 HP-β-CD对虎杖甙的识别作用包合物形成过程中,包合比是表征包合物结构的一个重要参数。同时,包合物形成常数K值既是包合作用强弱的量度,也是表征各种主体对客体分子识别作用强弱的重要参数。相溶解度法是测定环糊精与客体分子包合形成常数、包合比的一种常用方法。
图1为不同HP-β-CD浓度下虎杖甙的相溶解度图,从图中可以看出,虎杖甙在水溶液中的溶解度随HP-β-CD浓度的增加呈现一种线性的增长。基于Higuchi理论[20],表明HP-β-CD与虎杖甙形成了摩尔比为1∶1的包合物。计算得出虎杖甙与HP-β-CD的包合平衡常数为1308 mol-1·L。此外,包合作用使虎杖甙的溶解性也得到了显著提升,HP-β-CD浓度为10 mmol/L时,虎杖甙的溶解度增大了12.17倍,表明包合作用使虎杖甙的水溶性有了较大幅度提升。
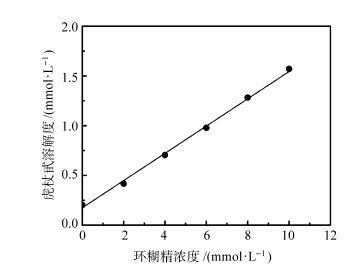 | 图1 HP-β-CD存在下虎杖甙的相溶解度曲线 Phase-solubility diagram of piceid with HP-β-CD at 25 ℃ |
X射线粉末衍射是表征主客体包合物的常用研究方法。如图2所示,A~D分别为虎杖甙(图2A)、HP-β-CD(图2B)、HP-β-CD与虎杖甙摩尔比为1∶1的物理混合物(图2C)及虎杖甙/HP-β-CD包合物(图2D)的X射线粉末衍射图。从图中可以看出,客体分子虎杖甙具有明显的晶型结构,主体分子HP-β-CD为无定型结构,物理混合物为两者混合叠加而成,而形成虎杖甙/HP-β-CD包合物后,虎杖甙的晶型结构消失了,包合后虎杖甙由包合前的晶形转变为无定型结构,证明了包合物的形成。
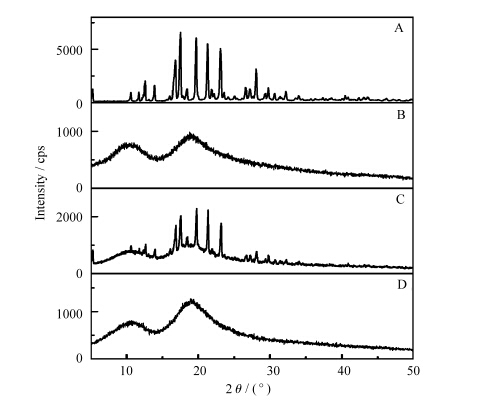 | 图2 XRD图 (A) 虎杖甙;(B) HP-β-CD;(C) HP-β-CD与虎杖甙摩尔比为1∶1的物理混合物;(D) 虎杖甙/HP-β-CD包合物 XRD patterns (A) piceid, (B) HP-β-CD, (C) piceid and HP-β-CD physical mixture, (D) piceid/HP-β-CD inclusion complex |
热重分析及差示扫描量热法也是研究包合物形成的有效方法。图3A~D分别为虎杖甙(图3A)、HP-β-CD(图3B)、HP-β-CD与虎杖甙摩尔比为1∶1的物理混合物(图3C)及虎杖甙/HP-β-CD包合物(图3D)的热重分析图。从图中看出,虎杖甙的TG曲线在270 ℃处出现下降,表示在该温度下虎杖甙发生分解,HP-β-CD的分解温度为304 ℃,虎杖甙/HP-β-CD包合物的分解温度为298 ℃。而虎杖甙与HP-β-CD物理混合物的TG图与其包合物的TG图相差不大,可能是因为虎杖甙在熔化后部分与HP-β-CD形成了包合物。以上结果表明,虎杖甙和HP-β-CD发生了包合作用,经包合后虎杖甙的热稳定性得到了提高。
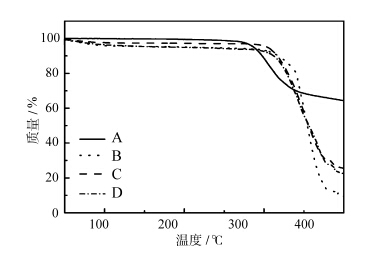 | 图3 TG图 (A) 虎杖甙;(B) HP-β-CD;(C) HP-β-CD与虎杖甙摩尔比 为1∶1的物理混合物;(D) 虎杖甙/HP-β-CD包合物 TG curves (A) piceid, (B) HP-β-CD, (C) piceid and HP-β-CD physical mixture, (D) piceid/HP-β-CD inclusion complex |
图4A~D分别为虎杖甙(图4A)、HP-β-CD(图4B)、HP-β-CD与虎杖甙摩尔比为1∶1的物理混合物(图4C)及虎杖甙/HP-β-CD包合物(图4D)的DSC图。虎杖甙在230 ℃时出现了一个吸热峰,HP-β-CD出现吸热峰的温度为323 ℃。物理混合物的DSC谱图则是虎杖甙与HP-β-CD谱图的简单叠加。而虎杖甙/HP-β-CD包合物的吸热峰则上升至354 ℃,表明主客体分子间已经形成了包合结构。这一结果进一步证明了虎杖甙和HP-β-CD之间形成了包合物。
 | 图4 DSC图 (A) 虎杖甙;(B) HP-β-CD;(C) HP-β-CD与虎杖甙摩尔比 为1∶1的物理混合物;(D) 虎杖甙/HP-β-CD包合物 DSC thermograms (A) piceid, (B) HP-β-CD, (C) piceid and HP-β-CD physical mixture, (D) piceid/HP-β-CD inclusion complex |
SEM是研究物质表面结构的一种定性分析方法。虎杖甙、HP-β-CD、物理混合物、包合物的SEM图如图5所示,虎杖甙的形貌为中等尺寸的柱状形,而HP-β-CD的形貌为球形。物理混合物中既出现了虎杖甙特有的晶体形状,也有HP-β-CD特有的形状,说明两者未发生化学反应。而对于虎杖甙/HP-β-CD的包合物,其结构为片状,尺寸和形貌与虎杖甙及HP-β-CD均不相同,以此可以进一步推测,虎杖甙和HP-β-CD之间形成了包合物。
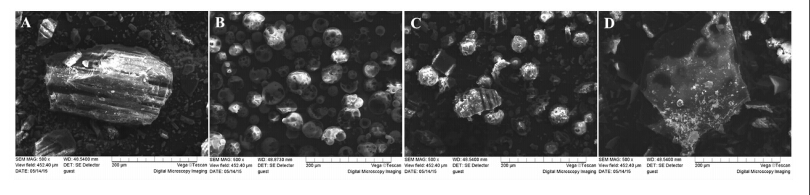 | 图5 SEM图 (A) 虎杖甙;(B) HP-β-CD;(C) HP-β-CD与虎杖甙摩尔比为1∶1的物理混合物;(D) 虎杖甙/HP-β-CD Scanning electron microphotographs (A) piceid, (B)HP-β-CD, (C) piceid and HP-β-CD physical mixture, (D) piceid/HP-β-CD inclusion complex |
虎杖甙对光特别敏感,在光照下可由反式虎杖甙异构为顺式虎杖甙(式1)。本研究测定了虎杖甙及其包合物的光稳定性,如图6A、6B所示,随着光照时间的增加,虎杖甙及其包合物在310 nm处的吸光度逐渐下降。以虎杖甙及其包合物在310 nm处的吸光度及光照时间作图,从图6C中可以看出,虎杖甙的吸光度下降较快,包合物的吸光度下降趋势与虎杖甙类似,但总体的下降值要远小于纯的虎杖甙,由此可以证明,虎杖甙被HP-β-CD包合后,其光稳定性得到了提高。其原因为虎杖甙经HP-β-CD包合后,环糊精空腔在一定程度上限制了虎杖甙的异构。
 | 式1 虎杖甙光异构示意图 The photoisomerization process of piceid |
 | 图6 (A)虎杖甙随光照时间的紫外-可见光谱图;(B)虎杖甙/HP-β-CD包合物随光照时间的紫外-可见光谱图; (C)虎杖甙及虎杖甙/HP-β-CD包合物在310 nm处随光照时间的变化图 (A) The UV-Vis spectra of piceid with the photoirradiation, (B) The UV-Vis spectra of piceid/HP-β-CD with the photoirradiation, (C) The absorbance of piceid and piceid/HP-β-CD at 310 nm with the photoirradiation time |
采用冷冻干燥法制备了虎杖甙/HP-β-CD包合物,HP-β-CD与虎杖甙形成了包合比为1∶1的包合物。XRD、TG、DSC及SEM的结果均表明虎杖甙与HP-β-CD形成了包合物,并且,经HP-β-CD包合后,虎杖甙的水溶性及热稳定性均得到有效提高。此外,光稳定性实验表明包合后虎杖甙的光稳定性也得到了有效提高。本文研究结果为虎杖甙/HP-β-CD包合物的应用提供了理论依据。
| [1] | Jensen J S, Wertz C F,O′Neill VA. Preformulation stability of trans-resveratrol and trans-resveratrol glucoside (piceid)[J].Journal of Agricultural and Food Chemistry, 2010,58(3): 1685-1690. |
| [2] | Romero-Perez A I, Ibern-Gomez M, Lamuela-Raventos R, De La Torre-Boronat M C. Piceid, the major resveratrol derivative in grape juices[J]. Journal of Agricultural and Food Chemistry, 1999,47(4): 1533-1536. |
| [3] | KirkR I, Deitch J A, Wu J,Lerea K M. Resveratrol decreases early signaling events in washed platelets but has little effect on platalet in whole blood[J]. Blood Cells Molecules Diseases, 2000,26(2): 144-150. |
| [4] | Vastano B C, Chen Y, Zhu N Q, Zhou Z G,Rosen R T. Isolation and identification of stilbenes in two varieties of polygonum[J]. Journal of Agricultural and Food Chemistry,2000, 48(2): 253-256. |
| [5] | Xing W W, Wu J Z, Jia M, Du J, Zhang H, Qin L P. Effects of polydatin from polygonum cuspidatum on lipid profile in hyperlipidemic rabbits[J]. Biomedicine & Pharmacotherapy, 2009,63(7): 457-462. |
| [6] | Kerem Z, Bilkis I, Flaishman M A,Sivan L. Antioxidant activity and inhibition of alpha-glucosidase by trans-resveratrol, piceid, and a novel trans-stilbene from the roots of Israeli Rumex bucephalophorus L[J].Journal of Agricultural and Food Chemistry, 2006,54(4): 1243-1247. |
| [7] | Labinskyy N, Csiszar A, Veress G, Stef G, Pacher P,Oroszi G, Wu J, Ungvari Z. Vascular dysfunction in aging: Potential effects of resveratrol, an anti-inflammatory phytoestrogen[J]. Current Medicinal Chemistry,2006, 13(9): 989-996. |
| [8] | Bertelli A A, Ferrara F, Diana G, Fulgenzi A, Corsi M, Ponti W, Ferrero M E, Bertelli A. Resveratrol, a natural stilbene in grapes and wine, enhances intraphagocytosisin human promonocytes: a co-factor in antiinflammatory and anticancerchemopreventive activity[J]. International Journal of Tissue Reactions, 1999,21(4): 93-104. |
| [9] | Li M H, Chen J K, Huang S S, Lee R S, Su M J. Cardioprotective effectof resveratrol, a natural antioxidant derived from grapes[J]. Cardiovascular Research, 2000, 47(3): 549-555. |
| [10] | Mathew S, Hedström M,Adlercreutz P.Enzymatic synthesis of piceid glycosides by cyclodextrin glucanotransferase[J].Process Biochemistry, 2012, 47(3): 528-532. |
| [11] | SzejtliJ. Introduction and general overview of cyclodextrin chemistry[J]. Chemical Reviews, 1998,98(5): 1743-1753. |
| [12] | 程素芳, 陈 彬, 张丽萍, 佟振合, 吴骊珠. γ-环糊精诱导的双2-萘甲酸三缩四乙二醇酯的分子内光二聚反应[J]. 影像科学与光化学, 2013,31(1): 1-9.Cheng S F, Chen B, Zhang L P,Tong Z H,Wu L Z. Intramolecular Photodimerization of 2-Naphthalene-Labeled Poly(ethyl glycol) (N-P4-N) Induced by γ-Cyclodextrin[J]. Imaging Science and Photochemistry, 2013,31(1): 1-9. |
| [13] | Yang L J, Ma S X, Zhou S Y, Chen W, Yuan M W, Yin Y Q,Yang X D. Preparation and characterization of inclusion complexes of naringenin with -cyclodextrin or its derivative[J]. Carbohydrate Polymers, 2013,98(1): 861-869. |
| [14] | Xiao C F, Li K, Huang R, He G J, Zhang J Q, Zhu L,Yang Q Y, Jiang K M, Jin Y, Lin J.Investigation of inclusion complex of epothilone A with cyclodextrins[J].Carbohydrate Polymers, 2014, 102: 297-305. |
| [15] | Blanch G P, Ruiz del Castillo M L, Caja M M, Perez-Mendez M, Sanchez-Cortes S.Stabilization of all-trans-lycopene from tomato by encapsulation using cyclodextrins[J]. Food Chemistry, 2007,105(4): 1335-1341. |
| [16] | Laura G Y, Michela L, Francesco S, Carmen O M, Alessandro C, Jose M G F. Glycoligand-targeted core-shell nanospheres with tunable drug release profiles from calixarene-cyclodextrin heterodimers[J].Chemical Communications(Cambridge, England), 2014,50(56): 7440-7443. |
| [17] | Wang K, Liu Y, Li C, Cheng S X, Zhuo R X, Zhang X Z.Cyclodextrin-responsive micelles based on poly(ethylene glycol)-polypeptide hybrid copolymers as drug carriers[J]. ACS Macro Letters, 2013,2(3): 201-205. |
| [18] | Yuan C, Jin Z Y, Xu X M, Zhuang H N, Shen W Y. Preparation and stability of the inclusion complex of astaxanthin with hydroxypropyl-β -cyclodextrin[J]. Food Chemistry, 2008, 109(2): 264-268. |
| [19] | Zoppetti G, Puppini N, Pizzutti M, Fini A, Giovani T, Comini S. Water soluble progesterone hydroxy propyl-β -cyclodextrin complex for injectable formulations[J].Journal of Inclusion Phenomena and Macrocyclic Chemistry, 2007, 57(1-4): 283-288. |
| [20] | Higuchi T, Connors K A.Phase solubility techniques[J]. Advances in Analytical Chemistry Instrumentation, 1965,4: 117-212. |




