2. 北京理工大学深圳研究院, 广东深圳 518057;
3. 深圳市博瑞汇达科技有限公司, 广东深圳 518057
2. Shenzhen Research Institute, Beijing Institute of Technology, Shenzhen 518057, Guangdong, P. R. China;
3. Boruihuida Science and Technology Ltd. Co., Shenzhen 518057, Guangdong, P. R. China
影像技术与生命科学研究的发展息息相关,随着影像处理技术的不断发展和在生物医学方面的广泛应用,必将帮助人类在生命科学领域开辟新的治疗途径。尤其是在对生物活细胞进行观测时,获取细胞在培养液中或自然状态下的形态结构、生理病理学特点,细胞周期、细胞凋亡等信息,对于早期生物医学诊断和药物的开发有着积极的意义。
数字全息[1]是一门涉及信息光学、全息学、光电子学以及数字图象处理技术的综合技术,它是一种新型的全息成像方法,以CCD等光电面阵探测器件取代传统的干板记录全息图,并由计算机对全息图进行数字模拟再现,可以同时获得物体的强度信息和位相信息,从而实现三维成像。凭借非接触、定量、三维成像等优势在医学影像方面有着越来越广泛的应用。1992年,美国研究学者Haddad等人[2]首次用数字全息的方法获得清晰可见的蛔虫细胞壁和细胞核。1999年,瑞士科学家Cuche等人[3,4],首次采用预放大菲涅耳数字全息技术,在只记录一张全息图的情况下,获得了微小物体的强度再现像和位相再现像,得到了生物细胞和组织的三维再现像,分别获得了1 nm的轴向分辨率和0.5 μm的横向分辨率。2009年,瑞士科学家Rappaz等人[5,6]釆用数字全息显微术观测了酵母细胞增殖过程中干物质的动态变化。2010年,德国Kemper[7,8,9]等人对表皮细胞的分裂过程进行观测。数字全息显微技术的发展对生物组织样本的多维度测定,得到高质量、高分辨率的实时动态图有着极大的促进作用,也必将会给生物影像处理开辟新的途径。
本文综述了数字全息技术的特点,分析总结了不同的全息显微光路,并着重从光源的角度出发,论述了不同光源结构对成像的影响以及相应的算法,最后列举了数字全息在生物医学领域方面的最新应用。
1 数字全息显微技术的特点数字全息显微技术是一种非接触、定量、三维成像技术。数字全息显微成像技术具有以下特点:
(a) 通过非接触式成像得到全息图并通过再现算法得到定量的强度和位相信息,实现三维成像,可以实时得到物体的动态图像。
(b) 在成像的分辨率方面,目前国际的先进水平全息显微镜横向分辨率可以达到亚微米,纵向分辨率可以达到 1 nm 以内,基本满足生物医学领域内细胞组织的观测成像。
(c) 它是一种非扫描式成像技术,成像速度非常快,观测范围灵活。
目前,在生物影像观测领域,已经出现的技术有激光扫描共聚焦显微镜[10]、相位相衬显微镜、电子显微镜等。
激光扫描共聚焦显微镜通过逐点采集以及计算机重构,获得特定深度下焦点内的图像,有很强的光学分层能力,但是其在焦点深度方向上的分辨率不高,焦点处光功率密度较大,对活体生物有较大干扰。
相位相衬显微镜是把光波位相变化转变为光波强度的变化,可以实现透明物体成像,但是无法定量进行三维测量。
电子显微镜需要对细胞进行导电化预处理,会对细胞的活性产生影响,无法实现动态测量。
尽管已经出现了各种各样的生物观测方法,但以近场原理和荧光处理为主的观测方法会对活性细胞产生不同程度的损伤,并且高昂的样本处理成本和有限的处理速度限制了在生物医学方面的应用。数字全息显微技术凭借其特点能够在很大程度上改善这一方面问题,在生物观测领域会有越来越广泛的应用。
2 医学影像处理的全息显微系统 2.1 数字全息显微结构数字全息显微光路按记录器件的位置可分为预放大全息光路(目前的主流)和后放大全息光路,按照记录方式可分为同轴记录和离轴记录。
为了实现仪器的小型实用化,光纤被引入了全息显微光路当中,1999年,德国科学Pedri[11]将光纤引入数字全息记录光路中,用激光二极管作为照明光波记录全息图,成功地对硬币和苍蝇进行了再现。2006年,意大利的Ferraro研究组[12]放弃了预放大同轴相移全息记录光路,改用预放大离轴菲涅尔全息光路。同年,美国的Kim研究组[13]则采用所谓的双预放大数字全息记录光路,即在参考光路中加入与物光波光路中相同的显微物镜,借此消除由物光路显微物镜引入的二次相位因子和噪声。与此同时,单波长、双波长、多波长数字全息显微记录光路,部分相干光全息显微记录光路也不断被提出。
图1所示的是典型的马赫增德尔干涉光路,属于预放大离轴透射式全息显微镜干涉光路[14]。激光器发出的光束经过准直光路形成平行光,经过分光镜分成两束光束,一路经过反射镜作为参考光束R,一路经过聚光透镜,反射镜透过物体,显微物镜收集透射光后出射物光波O和参考光波R,干涉形成全息图样,被CCD记录。
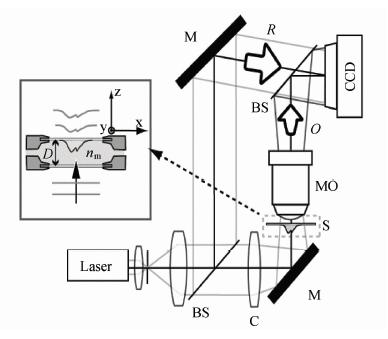 | 图1 预放大离轴透射式全息显微镜干涉光路 Interference optical path of the pre amplified off axis transmission holographic microscope |
图2所示的是典型的后放大马赫增德尔干涉光路[15]。激光器发出的光束经耦合器(显微物镜)进入光纤,经透镜准直,由分光镜将其分为两束,一束作为参考光波R,经反射镜至分光镜,另一束经反射镜照射样本,形成物光波O,与参考光波R在分光镜后形成干涉全息图,全息图再经显微物镜放大,由CCD记录。
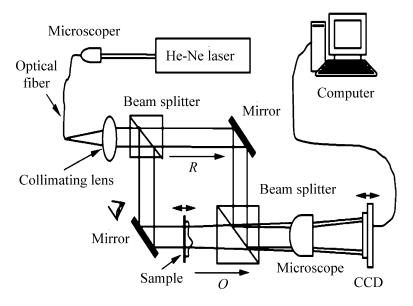 | 图2 后放大(全息图放大)离轴投射式全息显微镜光路 Hologramamplification of off-axis projection type holographic microscope optical path |
预放大记录方式是物光波先经过显微物镜放大后再与参考光干涉;后放大方式(亦可称为基于全息图放大)是物光波先与参考光干涉,后被显微透镜放大。全息图后放大方式中,再现光波要经过显微物镜后照射到全息底片上,对再现光位置精度要求较高,目前主流的方式是预放大式。但是在预放大方式中,显微物镜引入了球面误差(也称之为二次相位误差),从而使得数字再现过程变得复杂,通常需要附加位相数字校正技术,而后放大方式不会引入球面误差。
如图3所示,同轴记录光路搭建比较容易,对CCD的带宽也可以充分利用,但是会有零级像和共轭像的干扰,这两项所占的光强达到三分之二,通过位移法(例如四步全息相移)可以很好的去除零级像和共轭像,但是在实践操作中,四步相移对微位移器械的精度要求较高。
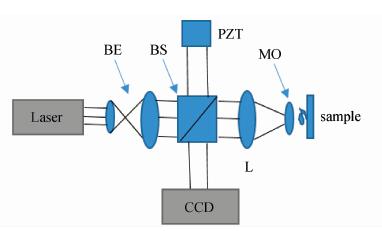 | 图3 反射式同轴数字全息显微光路 Reflective on-axial digital holographic microscopy optical path |
图4是典型的离轴全息记录光路,通过控制物光波和参考光波的夹角可以实现零级像,共轭像,再现像的分离,然后通过频域滤波法可以得到再现像,但是对CCD的分辨率产生了更高的要求。
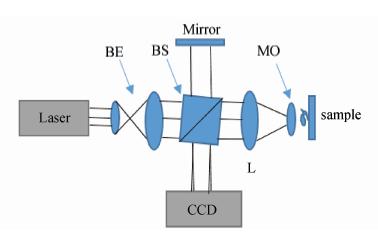 | 图4 反射式离轴数字全息显微光路 Reflective off-axial digital holographic microscopy optical path |
在数字全息显微中通常采用强相干光作为照明光源。优点是相干长度长,容易发生干涉;缺点是相干噪声大,激光的散斑噪声,强相干光在透镜之间发生多次反射产生寄生干涉条纹,这些都严重影响了全息图的成像质量。弱相干光源能有效减少这些噪声,在此背景下,对飞秒激光、白光、LED等低相干光源的研究成为了一个热点。Kim[16]完成了LED光源数字全息显微成像研究。实验结论证明了弱相干光可以有效地提高全息图的记录和重建质量。Massatsch等人[17]提出了一种基于LED 弱相干光数字全息术的层析方法。Massatsch等人[18,19]利用低相干光源逐层记录生物细胞的不同截面层信息,实现了对生物细胞的层析显微观测,还将弱相干光源数字全息显微术应用到生物组织检测,尤其是对动物的眼球进行了层析分析。
随着光程差的增大,低相干光源产生高质量的干涉条纹越来越难,导致的结果是探测深度的降低,能记录的干涉条纹区域变小,不能实现全场测量。随着双波长,多波长照明光源的不断发展,在一定程度上可以克服上述问题。双波长技术是指通过不同波长的照明光波分别得到各自包裹相位,两者包裹相位相减得到新的相位分布,通过两者波长的适当选取,可以得到足够大的合成波长。
双波长技术相比于单波长技术有突出的优势:
(a) 在相位图的测量中,轴向的无包裹范围大。通过对两个波长适当的选取,可以获得足够大的合成波长,可以测量光程变化大于一个波长的部分。
(b) 在传统的单波长光波照明时,必须经过解包裹才能得到最终的相位,大量耗时的过程对全息显微的实时性产生很大影响,而双波长光波照明时,只需要两者包裹相位相减就可以得到最终的相位,速度性能方面得到了极大的提升。
2.3 数字全息显微重建算法在重建算法方面,最核心的理论是瑞利-索末菲衍射积分原理,瑞利-索末菲衍射积分公式:
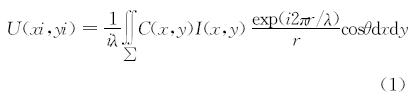
C(x,y)是再现照明光波,一般等于参考光波或者参考光波的共轭光波。I(x,y)是得到的全息图样。在经过频域滤波或者相移方法后,透射光波场在再现平面的频域成分只包含最初的物光波信息了,经由下面公式可以得到光强和位相分布:
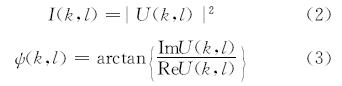
在此基础上又提出了卷积重建算法和空间角谱重建算法,三种算法都可通过快速傅里叶变换得到实时再现像。2002年,Leibling[20]提出了一种利用最小二乘法计算得到全息图物光波分布的算法。2006年,Ferraro[21]提出了横向剪切重建法。在数字全息三维物场的重建算法中,意大利研究组[22]提出了减去参考全息图再现波前的方法。瑞士研究组[23]研究将同一张全息图作为参考全息图,并提出了自动位相补偿方法。
3 全息显微在生物医学中的最新应用(a) 对观测样本的细胞数目进行定量和定性分析,通过全息显微成像技术得到的位相和强度信息可以准确进行测量。共聚焦显微镜可以通过逐点采集达到计数的目的,但是相当耗时,需要不断扫描,效率低。通过全息显微技术,理论上可以实时得到整个视场下的细胞,极大地提高了效率。P. Marqueta等[24]通过实验完成了对粘贴在细胞培养容器壁上的活细胞计数。
(b) 细胞形状,特性分析。一般情况下,癌变细胞会在形状方面发生较大改变,通过对细胞形状的观测可以提前发现早期癌变细胞,也可以发现其它病变引起的细胞受损。最近的一些研究也对动物的眼球运用全息技术进行了层析分析。
(c) 用于记录细胞分裂,融合等动态过程,数字全息显微的一个突出优点在于它的动态性,可以实时获得图像,充分观察到各个时刻,细胞的物理特征和发生的一些变化。图5所示的是用数字全息显微镜观测的老鼠皮质神经元的位相分布图[3],这对生物影像领域的研究有着极大的突破性。相应的研究已经广泛开展起来,已完成了对细胞破坏、修复、融合和分裂过程的记录,定量分析细胞的动态变化。
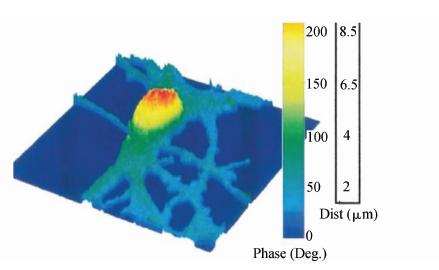 | 图5 数字全息显微镜观测的老鼠皮质神经元的位相分布图 Phase distribution map of mouse cortical neurons observed by digital holographic microscopy |
本文综述了数字全息显微技术的特性、典型全息影像显微结构、数字全息光源发展及相应的算法。列举了数字全息显微在医学影像领域中的最新应用。
数字全息显微技术是一门涉及信息光学、全息学、光电子学以及数字图象处理技术的综合成像技术,可以进行无损、定量、三维的综合测量。数字全息显微技术的发展对生物组织样本的多维度测定,得到高质量,高分辨率的实时动态图有着极大的促进作用,也必将会推动生物医学领域的进步。
数字全息显微技术虽然已经取得了很大的进步,但是在以下几个方面仍存在很大的提升空间:
(a) 数字全息显微技术的光路结构方面,目前广泛使用的离轴光路对CCD的带宽浪费严重,对分辨率的要求高,相比而言同轴光路虽然引入更多的杂光,但却可以充分利用CCD的带宽,在光路方面具有更大的改进空间。
(b) 数字全息光源方面,激光等相干光源产生的激光散斑和寄生条纹等噪声对成像质量产生了很大影响。以LED为代表的低相干光源具有更加广阔的发展潜力,配合双波长,多波长的记录方式,可以从源头克服低相干光源相干长度的缺陷问题。
(c) 数字全息显微成像算法方面,各式各样的解包裹算法取得了不断进步,解包裹过程中由于引入噪声(包括二次位相因子)的影响,必须考虑优化算法,进行自动位相补偿。随着低相干多波长全息显微技术的应用,并不需要之前复杂的解包裹算法,但是对相应的位相补偿算法提出了新的要求。在算法上,子孔径拼接技术同样可以应用在全息成像方面,可以扩大视场范围,提高分辨率。
| [1] | Goodman J W,Lwrence R W. Digital image formulation from electronically detected holograms[J]. Applied Physics Letters,1967,11(3):77-79. |
| [2] | Haddad W S,Cullen D,Solem J C. Fourier-transform holographic microscope[J]. Applied Optics,1992,31(24):4973-4978. |
| [3] | Cuche E,Marquet P, Depeursinge C. Simultaneous amplitude-contrast and quantitative phase-contrast microscopy by numerical reconstruction of Fresnel off-axis holograms[J]. Applied Optics,1999,38(34): 6994-7001. |
| [4] | Cuche E,Bevilacqua F, Depeursinge C. Digital holography for quantitative phase-contrast imaging[J]. Optics Letters,1999,24(5): 291-293. |
| [5] | Rappaz B,Marquet P,Cuche E. Measurement of the integral refractive index and dynamic cell morphometry of living cells with digital holographic microscopy[J]. Optics Express,2005,13(23):9361-9373. |
| [6] | Rappaz B,Cano E,Colomb T. Noninvasive characterization of the fission yeast cell cycle by monitoring dry mass with digital holographic microscopy[J]. Journal of biomedicaloptics,2009,14(3):034049-034049-5. |
| [7] | Carl D,Kemper B,Wernicke G. Parameter-optimized digital holographic microscope for high-resolution living-cell analysis[J].Applied Optics,2004,43(36):6536-6544. |
| [8] | Kemper B,Von B G. Digital holographic microscopy for live cell applications and inspection[J]. Applied Optics,2008,47(4): A52-A61. |
| [9] | Kemper B,Schnekenburger J,Schafer M. Investigation of living pancreas tumor cells by digital holographic microscopy[J]. Journal of Biomedical Optics,2006,11(3):034005-8. |
| [10] | Jesung P. Optically sliced micro2PIV using confocal laser scanning microscopy[J]. Experiments in Fluids,2004,37(1):105-119. |
| [11] | Pedrini G,Froning P,Tiziani H J. Shape measurement of microscopic structures using digital holograms[J]. Optics Communications,1999,164(4-6):257-268. |
| [12] | Angelis MD,NicolaS D,FinizioA. Digital holography refractive-index-profile measurement of phase gratings[J]. Applied Physics Letters,2006,88(11):111114-1-111114-3. |
| [13] | Mann C J,Kim M K. Quantitative phase-contrast microscopy by angular spectrum digital holography[J]. Biomedical Optics,2006,6090:900-900. |
| [14] | Kühn J,Charrièrea F,Colomba T. Digital holographic microscopy for nanometric quality control of micro-optical components[C]. In:SidorinY Waechter. Integrated Optics Devices Materials & Technologies XI,San Jose:2007, V4750-V4750. |
| [15] | 于瀛洁,倪萍,周文静.基于全息图放大的数字全息显微结构测量[J].光学精密工程,2008,5(5):827-831. Yu Y J,Ni P,Zhou W J.Digital holographic microscopy structure measurement based on hologram[J]. Optics and Precision Engineering,2008,5(5):827-831. |
| [16] | Warnasooriya N,Kim M K. LED-based multi-wavelength phase imaging interference microscopy[J]. Optics Express,2007,15(15):9239-9247. |
| [17] | Massatsch P,Charrière F,Cuche E,Marquet P,Depeursinge C D. Time-domain optical coherence tomography with digital holographic microscopy[J]. Applied Optics,2005,44(10):1806-1812. |
| [18] | Massatsch P .Low coherence digital holographic microscopy:application to vision in turbid media and biomedical imaging[J]. Thesis No EPFL,2003,2797:51-70. |
| [19] | Massatsch P,Charrière F,Cuche E,Marquet P,Depeursinge C D. Time-domain optical coherence tomography with digitalholographic microscopy[J]. Applied Optics,2005,44(10):1806-1812. |
| [20] | Liebling M,Blu T,Unser M. Complex-wave Retrieval from a single off-axis hologram[J]. Journal of the Optical Society of America A,2004,21(3):367-377. |
| [21] | Ferraro P ,Alferi D. Quantitative phase-contrast microscopy by a lateral shear approach to digital holographic image reconstruction[J]. Optics Letters,2006,31(10):1405-1407. |
| [22] | Kreis T M,Jüptner W. Suppression of the dc term in digital holography[J]. Optical Engineering,1997,36(8):2357-2360. |
| [23] | Colomb T,Cuche E,Charrière F. Automatic procedure for aberration compensation in digital holographic microscopy and applications to specimen shape compensation[J]. Applied Optics,2006,45(5):851-863. |
| [24] | Marqueta P,Rappazb B,Charrièrec F. Analysis of cellular structure and dynamics with digital holographic microscopy[J]. Biophotonics Optics in Life Science,2007,6633:6330-6331. |




