紫外光固化涂料是20世纪60年代开发的一种环保节能型涂料[1,2,3]。它具有低VOC排放、固化速度快(0.1~100 s)、节省能源(耗能约为热固化粉末涂料的1/10~1/5)、生产效率高、适合流水线生产、固化温度低、适合涂覆各种基材[4,5]等优点。50多年来,随着光固化技术的迅速发展,光固化涂料已广泛应用于化工、机械、通迅、轻工、电子[6,7]等领域,不仅在木材、金属、塑料、皮革、纸张[8]上得到大量使用,而且在光纤[9]、印刷线路板、电子元器件封装[10]、生物医用[11,12]等材料上得到成功应用。
紫外光固化涂料的主要成分由活性单体、预聚体和光引发剂组成。通常光固化涂料中预聚体黏度比较高,如常用的双酚A型环氧树脂(E-51)室温下黏度高达10000 mPa·s,难以进行涂装,需要用活性单体调节其黏度。活性单体按其固化机理可分为自由基型和阳离子型两类。阳离子型活性单体较自由基型活性单体在紫外光固化配方中有以下优点:1)不受氧阻聚,固化时无需惰性气体保护[13,14,15];2) 可“暗固化”,即辐照一定时间后,体系仍能继续固化,这有利于较厚材料的制备[16];3) 尺寸稳定性好,固化收缩率小,有利于制备精密部件。
目前,国内阳离子型活性单体大多以乙烯基醚类化合物为主,其主要产品有:4-羟丁基乙烯基醚(HBVE)、三甘醇二乙烯基醚(DVE-3)和1,4-环已基二甲醇二乙烯基醚(CHVE)等,但这类化合物易挥发且气味大,对环境污染较大。氧杂环丁烷是一类结构中含有四元环醚的化合物,能进行阳离子开环聚合,且这类化合物黏度低、附着力高、固化收缩率小、固化速度快、毒性低、不易挥发。因此,本文以1,4-二溴丁烷和3-乙基-3-羟甲基氧杂环丁烷为原料,四正丁基溴化铵为相转移催化剂,在碱性条件下合成了一种新型含四元环醚结构的化合物3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷,并对合成工艺及其光固化机理进行了研究。该项工作对3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷在工业生产及紫外光固化应用方面具有一定的意义。
1实验部分 1.1 主要试剂与仪器1,4-二溴丁烷,分析纯,国药集团化学试剂有限公司;四正丁基溴化铵,分析纯,国药集团化学试剂有限公司;硫酸镁,分析纯,国药集团化学试剂有限公司;无水乙醚,分析纯,国药集团化学试剂有限公司;氢氧化钾,分析纯,西陇化工股份有限公司;氢氧化钠,分析纯,西陇化工股份有限公司;3-乙基-3-羟甲基氧杂环丁烷,实验室自制,参照文献[17]方法合成。
FT-IR NICOLET380型红外光谱仪,美国热电尼高力公司;DD2 400-MR型核磁共振波谱仪,美国安捷伦公司;INTELLI-RAY400型智能控制紫外光固化机,深圳市慧烁机电有限公;NDJ-5型旋转粘度仪,上海恒平科技仪器有限公司。
1.2 合成合成反应方程式如式(1)所示。具体过程:在装有搅拌器、冷凝管和温度计的三颈烧瓶中依次加入3-乙基-3-羟甲基氧杂环丁烷、1,4-二溴丁烷、四正丁基溴化铵和适量的碱,将其溶于56 g水中,0 ℃下剧烈搅拌24 h后,向反应体系中加入200 mL乙醚和200 mL水,有机相水洗两次后用硫酸镁干燥,过滤,旋蒸出乙醚后减压蒸馏,收集132~136 ℃/8 mmHg馏分。

|
式 1 3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷的合成反应方程式 The reaction equation of 3,3′-[1,4-butanediylbis(oxymethylene)]bis[(3-ethyl)oxetane] |
将3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷和质量分数为4%的光引发剂三芳基硫鎓六氟锑酸盐(UVI-6976)搅拌均匀后涂覆在玻璃片上,放入INTELLI-RAY400型智能控制紫外光固化机进行固化。
2 结果与讨论 2.1 产物傅立叶红外光谱(FT-IR)分析利用NICOLET380型红外光谱仪测量样品波数在400~4000的傅立叶红外吸收光谱图,分辨率为2 cm-1,扫描次数为32。固态样品采用KBr压片法,液态样品将其均匀涂敷在压制好的KBr片上进行测量,产物的红外吸收光谱见图 1。

|
图 1 产物的红外光谱图 FT-IR spectra of the product |
在980、828 cm-1处的吸收峰为四元环醚C—O—C的反对称变形振动峰和对称变形振动峰,在1115 cm-1处的吸收峰为非环醚C—O—C的伸缩振动峰,在1458、1374cm-1处的吸收峰分别为甲基中C—H的反对称变形和对称变形吸收峰,在2962、2865 cm-1处的吸收峰分别为甲基中C—H的反对称伸缩振动和对称伸缩振动吸收峰,在2935 cm-1处的吸收峰为亚甲基中C—H的反对称伸缩振动吸收峰。
2.2 产物核磁共振氢谱(1HNMR)分析利用美国安捷伦公司DD2 400-MR型核磁共振波谱仪对产物进行一维氢谱测试,溶剂选用氘代氯仿。从图 2中可知,产物的核磁共振氢谱有7个峰,下面对其逐个进行分析:Ha.4.38~4.29(d,J=5.6 Hz,4H) ,Hb.4.29~4.19(d,J=4.8 Hz,4H) ,Hc.3.41(s,4H),Hd.3.37~3.27(t,J=6.8 Hz,4H) ,He.1.96~1.79(q,J=6.4 Hz,4H,CH2) ,Hf.1.68~1.56 (t,J=4.0 Hz,4H),Hg.0.83~0.70 (t,J=7.2 Hz,6H)。
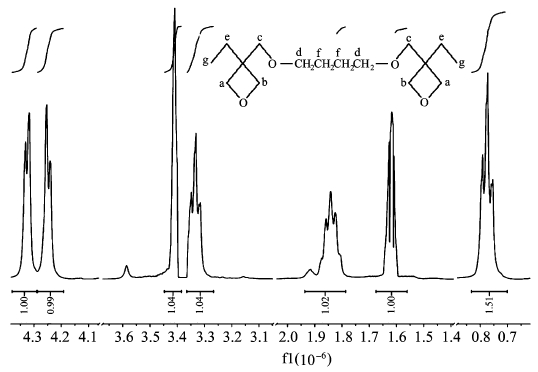
|
图 2 产物在CDCl3中的核磁共振氢谱图 The 1HNMR spectrum of the product in CDCl3 |
所测得的图谱上吸收峰为7个,峰面积比Ha∶Hb∶Hc∶Hd∶He∶Hf∶Hg=1∶1∶1∶1∶1∶1∶1.5。符合产物结构式上氢原子的种类、数目及个数比。通过红外和核磁分析可以确定所得到的产物为3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷。
2.3 投料比对反应的影响固定原料1,4-二溴丁烷用量为0.2 mol,四正丁基溴化铵2 g,1.0 mol氢氧化钾并将其溶于56 g水中,0 ℃下反应时间24 h,考察1,4-二溴丁烷与3-乙基-3-羟甲基氧杂环丁烷摩尔比对反应的影响,结果见图 3。从图中可以得出1,4-二溴丁烷与3-乙基-3-羟甲基氧杂环丁烷最佳摩尔比为1∶2.5。

|
图 3 投料比对产率的影响 Effect of 1,4-dibromobutane/OXT101 molar ratio on yield |
固定1,4-二溴丁烷用量为0.2 mol,1,4-二溴丁烷与3-乙基-3-羟甲基氧杂环丁烷摩尔比为1∶2.5,四正丁基溴化铵2 g,1.0 mol氢氧化钾并将其溶于56 g水中,0℃下反应,考察反应时间对反应的影响,结果如图 4所示。从图中可以得出,随着反应时间的增加产率逐渐增加,24 h后继续增加反应时间,产率略有下降,这可能是因为反应时间过长,体系内副反应增加所致。

|
图 4 反应时间对产率的影响 Effect of reaction time on yield |
固定1,4-二溴丁烷用量为0.2 mol,1,4-二溴丁烷与3-乙基-3-羟甲基氧杂环丁烷摩尔比1∶2.5,四正丁基溴化铵2 g,碱分别选用氢氧化钾和氢氧化钠,用量为1.0 mol,溶于56 g水中,考察不同碱对反应的影响,结果见图 5。从图中可以得出,KOH对反应的促进作用远大于NaOH,这是由于KOH比NaOH更容易使3-乙基-3-羟甲基氧杂环丁烷去质子化形成RO-,更有利于亲核反应的进行。
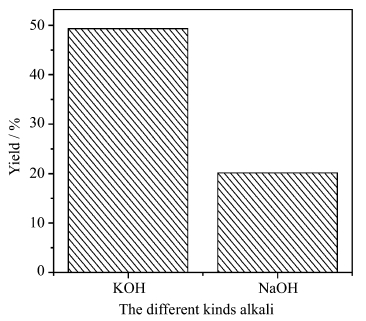
|
图 5 不同碱对产率的影响 Effect of alkalis on yield |
固定1,4-二溴丁烷用量为0.2 mol,1,4-二溴丁烷与3-乙基-3-羟甲基氧杂环丁烷摩尔比1∶2.5,四正丁基溴化铵2 g,不同摩尔数的氢氧化钾分别溶于56 g水中,0℃下反应时间24 h,考察碱的用量对反应的影响,结果见图 6。从图中可以得出,随着KOH的量的增加,产率逐渐先增加后减少,碱的最佳量为1.0 mol。

|
图 6 KOH的量对反应的影响 Effect of KOH amount on yield |
固定1,4-二溴丁烷用量为0.2 mol,1,4-二溴丁烷与3-乙基-3-羟甲基氧杂环丁烷摩尔比为1∶2.5,1.0 mol的氢氧化钾溶于56 g水中,不同量的四正丁基溴化铵在0℃下反应时间24 h,考察相转移催化剂的用量对实验的影响,结果见图 7。从图中可以看出,随着四正丁基溴化铵的增加,产率迅速增加,达到峰值后继续增加四正丁基溴化铵,产率变化不大,四正丁基溴化铵最佳用量为2 g。
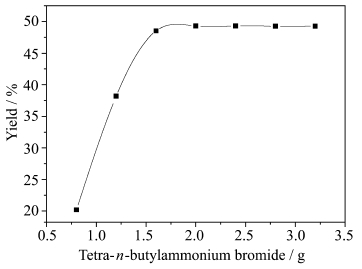
|
图 7 四正丁溴化铵的量对反应的影响 Effect of the amount of tera-n-butylammonium bromide on yield |
固定1,4-二溴丁烷用量为0.2 mol,1,4-二溴丁烷与3-乙基-3-羟甲基氧杂环丁烷摩尔比1∶2.5,四正丁基溴化铵2 g,1.0 mol的氢氧化钾溶于56 g水中,不同温度下反应时间24 h,考察不同温度对反应的影响,结果见图 8。从图 8可知,反应体系在低温下产率较好,随着温度的增加,产率逐渐下降。这是因为在温度较高和碱存在的条件下,体系中卤代烃可能会发生消去反应,从而使产率降低;同时,整个反应体系为放热反应,根据勒夏特列原理,降低温度有利于反应向产物生成的方向进行,所以低温下产率较高,但温度过低时,反应体系达不到所需的活化能,减少了有效碰撞的发生,使产率降低;因此,0℃下体系反应温度最佳。
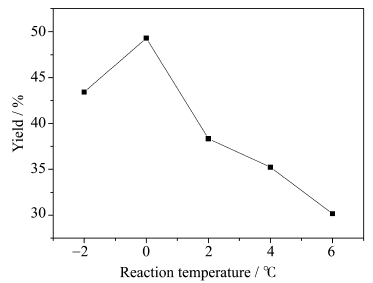
|
图 8 反应温度对产率的影响 Influence of reaction temperature on yield |
图 9是阳离子光引发剂三芳基硫鎓六氟锑酸盐(UVI-6976,4%)加入3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷中,混合体系固化前后的红外图谱。在980和828 cm-1处的吸收峰分别为四元环醚C—O—C的反对称变形振动峰和对称变形振动峰。光固化后,980和828 cm-1明显消失,并在3058 cm-1处出现—OH的特征吸出峰。
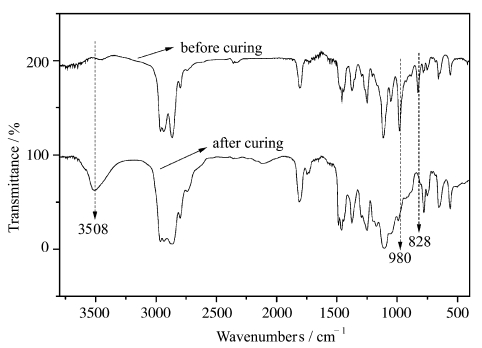
|
图 9 3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷固化前后的红外光谱图 FT-IR spectra contrast of curing before and after for 3,3′-[1,4-butanediylbis(oxymethylene)]bis[(3-ethyl)oxetane] |
可能的固化机理[18]为光引发阳子聚合,主要由链引发和链增长等反应组成,见式 2。其中,链引发是一个多级过程,在供氢化合物(RH)的存在下,紫外光使引发剂三芳基硫鎓六氟锑酸盐分解出强质子酸,如(a)、(b)、(c)所示;强质子酸进攻电子云密度较高的氧原子,形成二级鎓离子,见(d)。在引发阶段,反应速率常数k1、k2、k3、k4很大,所需活化能小,引发速率快;在链增长阶段,二级鎓离子很活泼,环上邻近的碳原子受到单体中氧原子的亲核进攻形成三级氧鎓离子,见(e),然后单体不断进攻三级氧鎓离子,一直增长下去最终形成聚合物,见(f)。
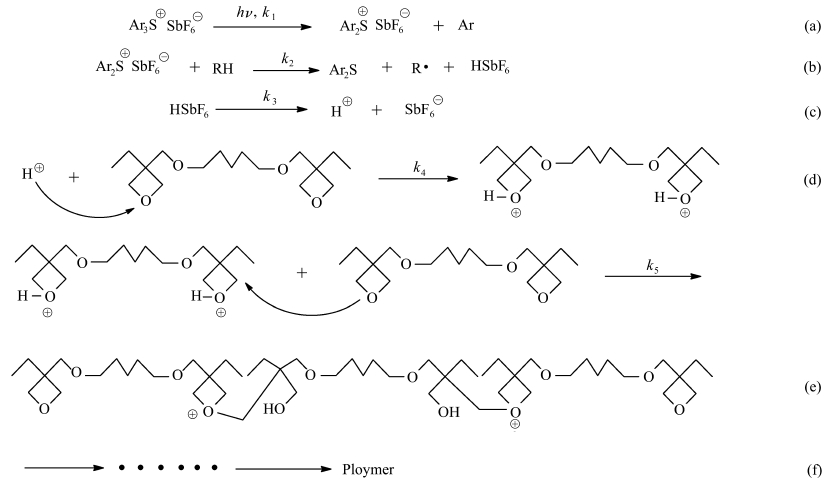
|
式 2 3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷固化机理 The curing mechanism of 3,3′-[1,4-butanediylbis(oxymethylene)]bis[(3-ethyl)oxetane] |
利用NDJ-5型旋转粘度计,参照GB/T 22235-2008《液体粘度的测定》中的测量方法与步骤,测试光敏树脂的粘度:在室温下,预先选用适当的转子和转速测量粘度,再根据测量粘度的数值调整转子和转速以使其在最佳量程范围内测量,通常每个试样至少重复两次,取其平均值。取等量的环氧树酯E-51,在室温条件下,分别加入上述实验室制备的活性单体(标记为DIOXETANE)以及工业中常用的活性单体叔丁基酚缩水甘油醚(JX-012)、苯基缩水甘油醚(JX-016)、邻甲酚缩水甘油醚(JX-017),其体系粘度随活性单体加入量的变化见表 1。
|
|
表 1 体系粘度随活性单体加入量的变化 The system viscosity change with the addition amount of reactive monomers |
由表 1可知,实验室制备的新型阳离子活性单体对环氧树脂的稀释效果较好,当添加3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷的质量百分比为7.5%时,液态体系粘度下降到5000 mPa·s,即可适用于基材涂覆,而当液态体系粘充下降到500 mPa·s时,添加的3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷质量分数仅为30.6%。3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷对环氧树脂具有良好的稀释性能,一方面可能由于其本身具有的粘度低,室温下粘度仅为23.8 mPa·s;另一方面可能与其分子中含有的四元环醚结构特性有关,四元环醚结构与环氧树脂中的三元环醚结构相似,根据相似相容原理,故而对环氧树脂稀释性能较好。通过与工业中常用的阳离子型活性单体JX-012、JX-016、JX-017对比,发现3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷的稀释性能可以与之媲美。
3 结论综上,3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷的合成最佳反应条件是:固定1,4-二溴丁烷用量为0.2 mol,1,4-二溴丁烷与3-乙基-3-羟甲基氧杂环丁烷摩尔比为1∶2.5,四正丁基溴化铵用量为2 g,KOH提供碱环境,用量为1.0 mol,在0℃下反应时间24 h。在此条件下,产率达49.3%。通过傅立叶红外光谱图和核磁共振图谱分析,3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷的结构得到确证。
通过观察3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷固化体系固化前后对红外吸收强度的变化,其固化机理可能为:在紫外光辐照下,光引发剂三芳基硫鎓六氟锑酸盐分解成强质子酸,位于四元环醚结构上的氧原子电子云密度较高,易受强质子酸的攻击发生阳离子开环聚合。
3,3′-[1,4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷的稀释性能与工业中常用的阳离子型活性单体JX-012、JX-016、JX-017相当,具有一定的工业实用价值。
| [1] | 徐国强, 胡 娜, 倪忠斌, 刘 仁, 陈明清. 紫外光固化涂料的研究进展[J]. 化学世界, 2012, 53(6): 376-380. Xu G Q, Hu N, Ni Z B, Liu R, Cheng M Q. Progress in ultraviolet curing coating[J]. Chemical World, 2012, 53(6): 376-380. |
| [2] | Decker C. Kinetic study and new applications of UV radiation curing[J]. Macromolecular Rapid Communications, 2003, 23(18): 1067-1093. |
| [3] | 雍涛, 黄笔武, 韩文娟, 谢王付, 万时策. 纳米二氧化硅对聚氨酯丙烯酸酯紫外光固化材料性能影响[J]. 南昌大学学报(工科版), 2015, 37(3): 228-233. Yong T, Huang B W, Han W J, Xie W F, Wan S C. Study on the influence of nanosilica on properties of the polyurethane acrylate UV-curing material[J]. Journal of Nanchang University(Engineering & Technology), 2015, 37(3): 228-233. |
| [4] | Golden R. Lower-emission technologies: a path to greener industry[J]. RadTech Report, 2005, 19(3): 14-18. |
| [5] | Valet A. Outdoor applications of UV curable clearcoats-a real alternative to thermally cured clearcoats[J]. Progress in Organic Coatings, 1999, 35(1-4): 223-233. |
| [6] | Kuo K H, Chiu W Y, Don T M. Synthesis of UV-curable/alkali-soluble dispersants used for black photoresist with a high loading of carbon black[J]. Journal of Applied Polymer Science, 2010, 115(3): 1803-1813. |
| [7] | 吕建波. PET光学膜紫外光固化硬涂层的制备[J]. 影像科学与光化学, 2011, 29(6): 449-455. Lü J B. The preparation of UV curable hard coatings on PET[J]. Imaging Science and Photochemistry, 2011, 29(6): 449-455. |
| [8] | Pappas S. Radiation Curing Science and Technology[M]. New York: Plenum Press, 1992. |
| [9] | Moon J H, Shul Y G, Han H S, Hong S Y, Choi Y S, Kim H T. A study on UV-curable adhesives for optical pick-up: I. Photo-initiator effects[J]. International Journal of Adhesion and Adhesives, 2005, 25(4): 301-312. |
| [10] | Moon J H, Han H S, Shul Y G, Jang D H, Ro M D, Yun D S. A study on UV-curable coatings for HD-DVD: Primer and top coats[J]. Progress in Organic Coatings, 2007, 59(2):106-114. |
| [11] | Scalera F, Corcione C E, Montagna F, Sannino A, Maffezzoli A. Development and characterization of UV curable epoxy/hydroxyapatite suspensions for stereolithography applied to bone tissue engineering[J]. Ceramics International, 2014, 40(10): 15455-15462. |
| [12] | Gaston A, Khokhar A Z, Bilbao L, S ez-Mart nez V, Corres A, Obieta I, Gadegaard N. Nanopatterned UV curable hydrogels for biomedical applications[J]. Microelectronic Engineering, 2010, 87(5-8): 1057-1061. |
| [13] | 熊磊,邓熙烺,黄笔武. 对叔丁基酚缩水甘油醚作为稀释剂紫外光固化材料的制备及性能[J]. 南昌大学学报(工科版),2015, 37(3): 209-214. Xiong L, Deng X L, Huang B W. Preparation and properties of the UV-curing material with tert-butyl phenol glycidyl ether as diluent[J]. Journal of Nanchang University(Engineering & Technology), 2015, 37(3): 209-214. |
| [14] | Sangermano M,Messori M, Rizzoli A, Grassini S. UV-cured epoxy coatings modified with perfluoropolyether-based materials[J]. Progress in Organic Coatings, 2010, 68(4): 323-327. |
| [15] | 邓冲, 谢王付, 黄笔武, 万时策, 谌伟庆, 徐钦昌, 胡开创. 氧杂环丁烷/丙烯酸酯混杂体系的光固化性能研究[J]. 影像科学与光化学, 2014, 32(3): 289-298. Deng C, Xie W F, Huang B W, Wan S C, Chen W Q, Xu Q C, Hu K C. Study on the properties of oxetane/acrylate UV-cured hybrid system[J]. Imaging Science and Photochemistry, 2014, 32(3): 289-298. |
| [16] | Sipani V, Kirsch A, Scranton A B. Dark cure studies of cationic photopolymerizations of epoxides: characterization of kinetic rate constants at high conversions[J]. Journal of Polymer Science, Part A: Polymer Chemistry, 2004, 42(17): 4409-4416. |
| [17] | 赵晓霞, 魏文珑, 常宏宏, 王志忠. 碳酸二乙酯合成3-羟甲基-3-乙基氧杂环丁烷的工艺研究[J]. 太原理工大学学报, 2008, 39(S1): 159-161. Zhao X X, Wei W L, Chang H H, Wang Z Z. Research on the technology for the synthesis of 3-ethyl-3-hydroxymethyl oxetane with diethyldicarbonate[J]. Journal of Taiyuan University of Technology, 2008, 39 (S1): 159-161. |
| [18] | Crivello J V, Liu S S. Photoinitiated cationic polymerization of epoxy alcohol monomers[J]. Journal of Polymer Science, Part A: Polymer Chemistry, 2000, 38(3): 389-401. |




