2. 国家纳米科学中心, 北京 100190
2. National Center for Nanoscience and Technology, Beijing 100190, P.R.China
头颈部肿瘤是指原发于口腔、咽腔(包括鼻咽、口咽和喉咽)、喉腔的一组相关的恶性肿瘤。据估计,2012年一年仅口腔及咽腔的恶性肿瘤全世界新发529000例,死亡292000例。在世界范围内,头颈恶性肿瘤已成为第七常见的恶性肿瘤,在造成死亡的恶性肿瘤类型里位列第九[1]。大多数的HNSCC病人的肿瘤被确诊都已发展到较晚期,造成了头颈部恶性肿瘤病人诊断后的5年生存率约为43%[2]。头颈部恶性肿瘤患者的生存率和生存质量与早期诊断密切相关。
目前,头颈部肿瘤主要通过症状、体征、内窥镜检查、影像学检查及病理检查等手段进行诊断。其中组织石蜡切片病理检查是头颈部肿瘤的“金标准”。但是,受到主观和客观的一些因素限制,病理诊断仍然存在一定的局限性和不足。一次活检的病理学诊断,只反映疾病进展中某一阶段的病理变化,有的疾病只在一定阶段才显示其特征性病变。即使在疾病进展的特征期,病理医师对具体病例疾病本质的认识程度仍然受制于标本内病变代表性的程度,如:标本尺寸过小、标本取材不当未取得典型的病变区域,或特征性信息不足。对于咽喉头颈外科而言,时常需要鉴别微小病变的良、恶性质,而病理检查对于小于1~2 mm的病变往往无能为力。另外,病理学诊断常带有不同程度的不确定性,在对交界性病变或交界性肿瘤的判断中尤为突出。病理检查还存在时效性不足的问题,常规的石蜡切片从制片到阅片需要数天时间,而一些需要进行特殊的免疫组化检查则可能需要数周。对于一些病人来说这些时间可能是弥足珍贵的。综上所述,病理检查作为目前头颈部肿瘤的“金标准”仍存在一定的局限性和不足。需要对头颈部肿瘤的诊断技术和方法进行一些更加客观、更加快速、重复性更好的改进。
目前,研究者们开始从物理学、生物力学视角分析肿瘤的发生、发展过程[3]。事实上,力学特征的变化和作用伴随着肿瘤发生、发展的全部过程。目前,研究人员已经达成共识,对肿瘤的研究不应该再忽略力学因素。刚度是指材料或结构在受力时抵抗弹性形变的能力,是使物体产生单位变形所需的外力值。刚度是肿瘤力学特性的一个重要参数。肿瘤细胞的发生[4]、增值[5]、迁移[6]过程都伴随着肿瘤细胞骨架蛋白单体的解聚与重组。细胞骨架结构状态的改变在生物力学性质上体现为细胞刚度的改变[7]。肿瘤的发生、增殖、迁移还是一个复杂的细胞和细胞微环境相互作用的过程。大量研究表明,肿瘤微环境的力学性质特别是肿瘤微环境的刚度是影响肿瘤细胞行为的重要调节因子。正是因为肿瘤细胞及组织生物力学性质的改变,使得我们可以将肿瘤细胞及组织的刚度变化作为肿瘤诊断的一项指标。
利用原子力显微镜(AFM)对肿瘤微区力学的表征和研究,已经从传统细胞水平,逐渐过渡到新鲜组织水平。有研究报道乳腺癌、子宫内膜癌、外阴癌[8]等恶性肿瘤组织均和其相应来源的非肿瘤组织存在刚度的差异,肿瘤组织核心的刚度小于其相同来源的正常组织,这种刚度差异和其病理检查结果相一致。所以肿瘤组织的力学界面,作为一个肿瘤细胞和肿瘤微环境的共同体,被认为可以提供一个供临床诊断的特殊生物医学界面。
根据既往的研究结果,肿瘤的核心组织相较正常和肿瘤旁组织刚度较低,而肿瘤旁组织则刚度增加。在肿瘤核心组织和肿瘤旁组织中存在一个软硬过渡的界面。在组织、细胞、细胞微区以及大分子层次均存在着有生物行为意义的曲率变化[8]。
综上所述,针对头颈部肿瘤组织块的原位微区力学检测有望为临床医生提供崭新的早期诊断指标,但目前尚未建立成熟的检测方法。因此,本文介绍了一套规范的临床组织块处理及AFM微区力学检测方法,并将采集的组织刚度信息,转换成刚度分布图,尝试采用刚度分布图中软硬过渡的曲线曲率对这一过渡界面进行初步分析。
1 材料与方法 1.1 仪器设备、试剂 1.1.1 仪器原子力显微镜(Aligent 5500,美国),原子力显微镜探针(CSG11/tipless NTMDT,美国),二氧化碳临界点干燥仪(CPD030 BAL-TEC,瑞士),倒置显微镜(TE2000 Nikon,日本),环境扫描电子显微镜(FEI QUANTA 200,美国),紫外固化器(KW-4AC 上海凯美特,中国)。
1.1.2 试剂氯化钠注射液(大冢制药,中国),二氧化硅小球(天津倍思乐,中国),二甲基二氯硅烷(Sigma,美国),明胶(上海阿拉丁,中国),紫外固化胶(乐丽医疗器材株式会社,日本),戊二醛(上海阿拉丁,中国),磷酸盐缓冲液(上海阿拉丁,中国),无水乙醇(上海阿拉丁,中国)。
1.2 临床样本选择北京大学第三医院耳鼻喉科接受扁桃体切除术及支撑喉镜下CO2激光会厌肿物切除术患者各一例,病理学结果由至少两名病理学专家进行诊断确认。所有检查进行前均取得了患者的知情同意。
1.3 AFM检测组织样本表观微区力学特征 1.3.1 组织样本制备对两例手术切除后的病理组织使用生理盐水冲洗5遍,放入生理盐水中。保存于4 ℃冰袋中,24 h内进行原子力显微镜测定。用眼科剪刀剪取部分较平整的表面组织,大小约5 mm×5 mm,厚度约为1~2 mm。取直径约2 cm的玻片清洗干净,烘干。将37 ℃溶解的浓度20%的明胶溶液均匀涂布于玻片上,把剪取的组织样本固定于明胶内,表面露出约0.5 mm。将玻片放到冰块上放置1~2 min,待明胶溶液凝固成胶后,加入氯化钠注射液。
1.3.2 原子力显微镜探针末端的微球修饰选取AFM微悬臂CSG11/tipless,利用镊子将其固定在AFM扫描器上,随后将扫描器安装在AFM样品台上。利用镊子挑取少许紫外固化胶并涂抹在清洁的玻璃片一侧,将些许二氧化硅小球用镊子均匀散布于玻璃片另一侧。将玻璃片固定在AFM样品台上的样品盘上,通过光学显微镜定位使AFM微悬臂恰好位于紫外固化胶的正上方。调控AFM控制软件(PicoView 1.10)使AFM微悬臂与紫外固化胶缓慢接近,直至微悬臂末端接触少量的紫外固化胶,停止逼近并上抬AFM扫描器约50 μm。选择直径约15~20 μm大小的微球使用同样的方式使之与末端粘附紫外固化胶的AFM微悬臂接触。利用紫外光固化灯照射修饰小球的针尖,直至粘结剂完全固化,微球修饰成功。利用环境扫描电镜的低真空模式对AFM悬臂末端的微球进行表征,测量微球的直径。探针硅烷化。将修饰好二氧化硅小球的微悬臂放入二甲基二氯硅烷(剥离硅烷)溶液中浸泡30 min,使小球表面疏水硅烷化。
1.3.3 组织样本表面微区力学表征AFM探针弹性常数(k)的测量: 在空气中,利用PicoViewl.l4软件计算探针k值。测量3次取均值。
敏感度测量(Sensitivity):在接触模式下,首先驱动AFM探针逼近并接触未有明胶覆盖的玻片。在倒置显微镜下调整针尖位置,设置Rate=14 μm/s, Data Points=5000后,采集力曲线,测量敏感度。多次测量,取均值。每次更换样品需重新测量敏感度。Force volume力曲线采集。驱动AFM探针逼近并接触样品,设置Force volume模式,采集力曲线。刚度计算: 利用赫兹模型,从力曲线逼近样品过程中的非线性段中提取力学信息,采用Hook定律计算出样品的杨氏模量(E)代表刚度。选取压入深度在300 nm时的杨氏模量作为参考。
1.3.4 组织样本电子显微镜成像用0.01 mol/L PBS清洗组织样本3遍,并用含5%戊二酸的磷酸盐缓冲液(pH7.2) 4 ℃固定过夜。0.01 mol/L PBS 清洗3次,每次 15 min。30%、50%、70%、85%、95%乙醇脱水各一次,无水乙醇脱水两次,每次15 min。使用CO2临界点干燥仪干燥样品。环境扫描电子显微镜低真空模式观察组织样本表面形貌。
1.4 统计及数据分析 1.4.1 统计学方法使用SPSS 20.0进行统计学分析。
1.4.2 刚度分布图用matlab制图对获得的Force volume组织刚度结果使用matlab分析,转换成刚度的平面分布图。
1.4.3 曲率分析我们从慢性炎症扁桃体组织及会厌囊肿囊壁组织各选取两张硬度分布图,使用Getdata软件从每张图中选取5处组织软硬相交的界面,每处提取20个坐标信息。按照曲率计算公式:
.jpg)
使用Orange 8.0软件对坐标信息进行曲率分析。
2 结果与讨论 2.1 组织样本环境扫描电镜表征图 1中a、b、c、d分别为慢性炎症扁桃体组织表面不同倍数的ESEM图像。此例标本表面呈现较典型的复层扁平上皮结构。在3000倍(c)及8000倍(d)可以看到扁桃体上皮细胞表面呈连续排列的微绒毛立体结构。除此之外,还能找到扁桃体表面典型的Ⅰ型微隐窝,Ⅰ型微隐窝靠近相邻上皮细胞交界处,孔径一般在4~15 μm,数量最多,是细菌、抗原等进入扁桃体的主要通道。
从图 1e、图 1f中可以看到部分组织表面覆有生物膜,研究证实反复发炎的扁桃体组织及一些正常组织均可看到生物膜存在。依附在人体内粘膜表面的细菌排列并聚合在其所生成的含水聚合物内形成生物膜。生物膜的存在使得这些细菌对宿主的防御机制和抗生素存在抵抗力。生物膜中的细菌可以被释放而导致炎症发生,所以生物膜的存在被认为可以解释顽固性的反复发作的慢性扁桃体炎的本质[9, 10]。
图 1g、图 1h为低真空模式下会厌囊肿囊壁表征像。g、h的放大倍数分别为300及2000。囊壁表面结构紊乱,可以清晰地看到紊乱倒伏的呼吸道纤毛结构,可能是炎症作用或者是手术损伤所致。电镜下缺乏呼吸道上皮的典型上皮细胞结构。

|
图 1 组织表面电镜成像 a~f. 慢性炎症扁桃体表面;g,h. 会厌囊肿囊壁 Fig 1 The electron microscopy images of tissue surface a-f: surface of the amygdala with chronic inflammation;g,h:epiglottic cyst wall |
我们使用原子力显微镜Force volume模式扁桃体组织表面共采得1280条力曲线,剔除部分影响结果的力曲线,共计1042条力曲线。会厌囊肿囊壁共计225条力曲线。使用赫兹模型计算组织的表观杨氏模量。赫兹模型是基于压痕深度计算材料刚度的模型,我们采用表观杨氏模量来代表细胞的刚度。我们选取了直径较大的二氧化硅微球平衡组织自身的异质性,减少这种异质性所带来的误差。同时二氧化硅材质可降低微球与样本表面的粘附力。赫兹模型计算组织表观杨氏模量的公式如下[11]:
.jpg)
在这里E代表杨氏模量,R代表二氧化硅微球的半径,δ代表压痕深度,测量中压痕深度选择300 nm,F代表细胞受到的力,等于微悬臂的弹性系数k与偏转绝对值ΔV以及微悬臂敏感度的乘积。υ代表泊松比,它是材料本身的属性,这里组织的泊松比选取为0.5。
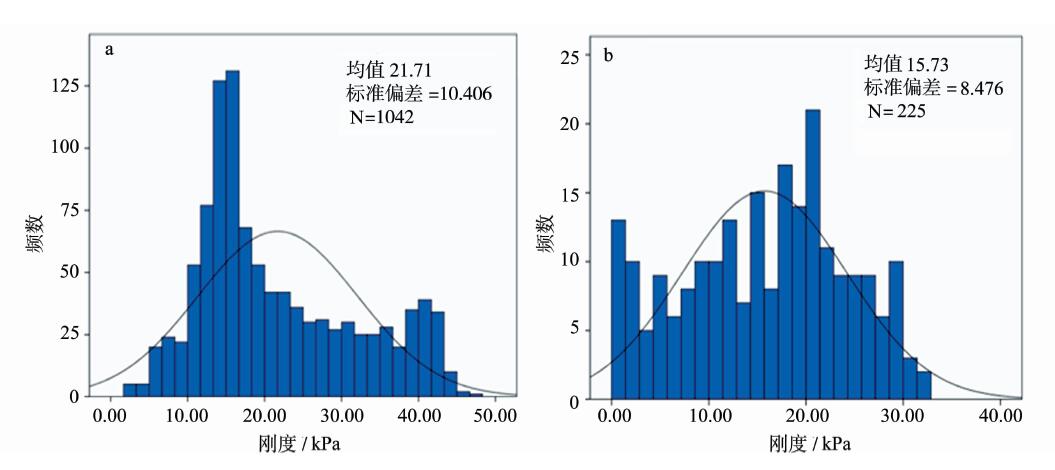
图 2 a、b分别是慢性炎症扁桃体组织及会厌囊肿囊壁组织的刚度(E)频率图。两组刚度经统计用均数±标准差表示,分别为21.71±10.41 kPa和15.73±8.476 kPa。炎性的扁桃体组织刚度频率峰值相较会厌囊肿囊壁组织较软。
|
图 2 组织表观刚度分布 a. 慢性炎症扁桃体组织表观刚度分布;b.会厌囊肿囊壁组织表观刚度分布 Fig 2 The stiffness distribution of tissues a. The stiffness distribution of surface of the amygdala with chronic inflammation; b. the stiffness distribution of surface of the epiglottic cyst wall |
组织是细胞及细胞微环境组成的复杂模型,表观刚度表现出较大的异质性。由于两组数据方差不齐,使用近似T检验,两组数据存在显著差异,P<0.05。
在既往的针对组织样本的原子力显微镜研究中,往往是简单的将样本使用胶水固定于玻片或培养皿之上,没有考虑组织样本本身所处的组织力学环境。我们使用20%的明胶对头颈部组织进行包埋,明胶是胶原部分降解的产物,是一种生物相容性很好的水凝胶体系,被广泛用于细胞培养,单独或者结合其他水凝胶体系可以用来仿生细胞外基质环境。本实验采用明胶水凝胶包埋临床样本组织提供一个仿生的组织力学环境。
在试验过程中,我们发现新鲜组织表面有粘液层的存在,使得组织表面与探针之间表现为过大的粘滞力,前期的实验往往无法使用AFM采得有效的组织样本刚度数据。因此,我们对探针进行了硅烷化处理,二氧化硅小球表面呈现疏水的特性,从而克服了组织样本表面粘滞力的影响,成功对两例临床样本进行了微区力学表征。
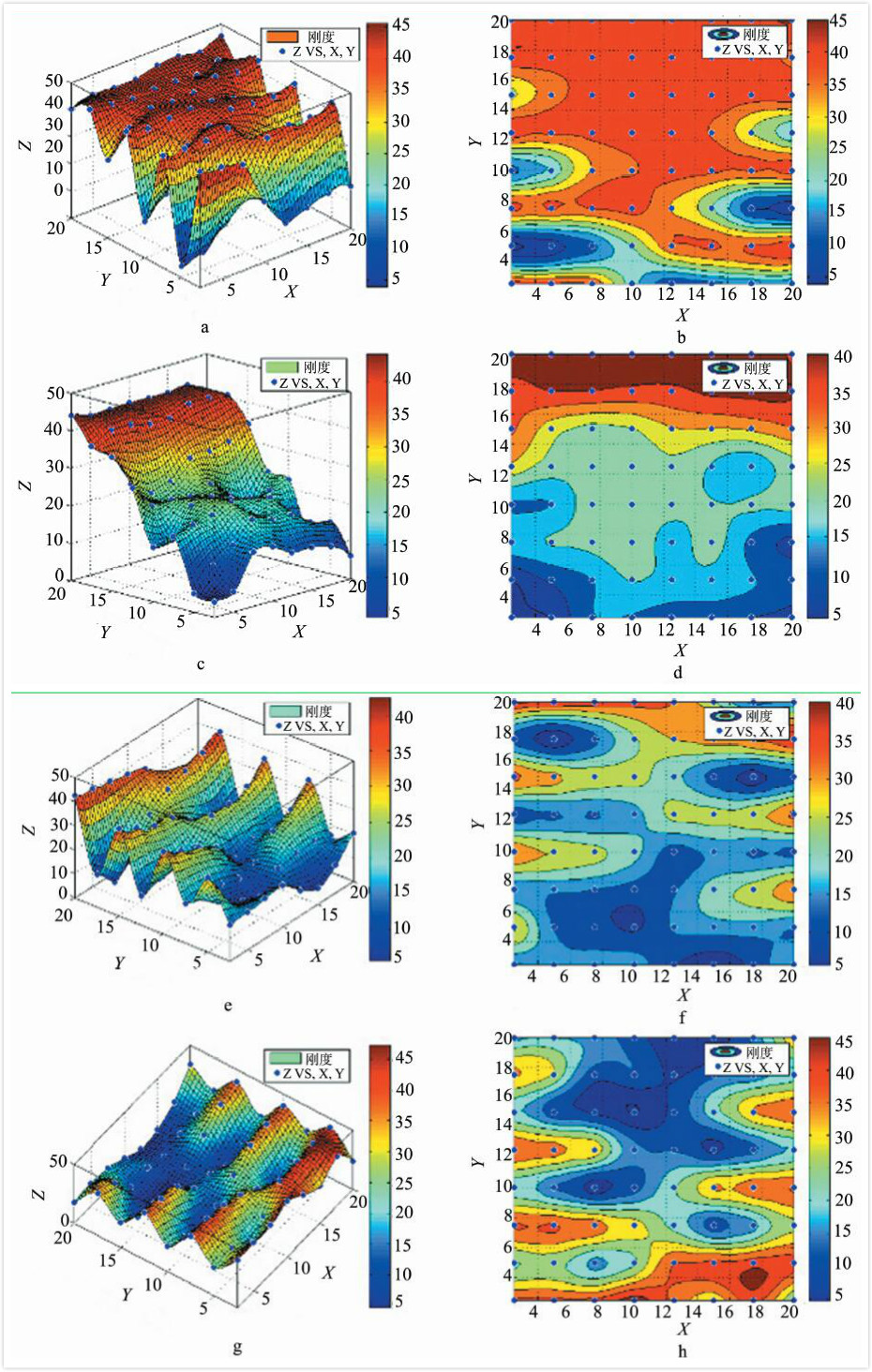
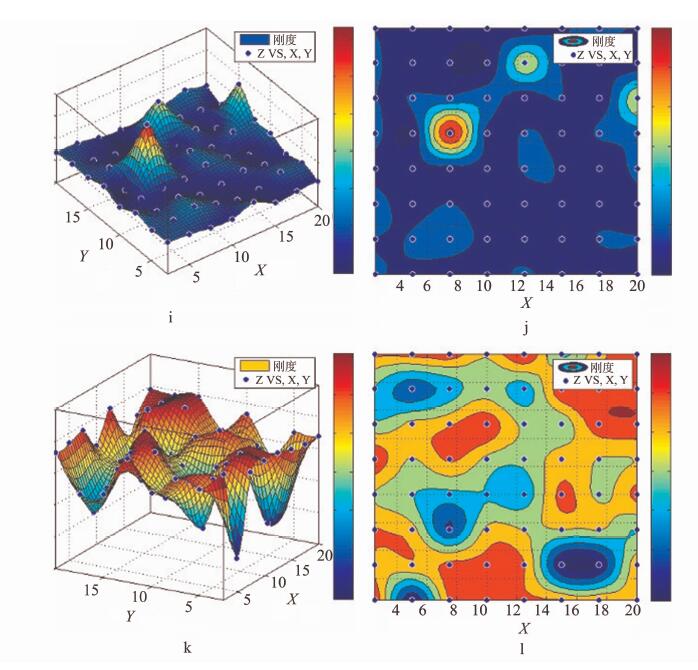
2.3 组织样本Force volume刚度分布图及初步分析选取4组扁桃体及两组会厌囊肿组织Force volume(volume=8×8)刚度结果,使用Matlab软件绘制出各组硬度的分布示意图,如图 3、图 4所示。b、d、f、h、j、l使用红色代表刚度最大,蓝色代表刚度最小。a、c、e、g、i、k使用颜色及高度代表刚度的大小,z轴越大代表刚度越大,反之亦然。可以看到不同部位采集的Force volume区域刚度分布存在着较大的异质性。
|
图 3 扁桃体组织Foce volume刚度分布图 Fig 3 Stiffness distribution of amygdala measured by Force volume |
|
图 4 会厌囊肿囊壁组织Force volume Fig 4 Force volume of epiglottic cyst wall |
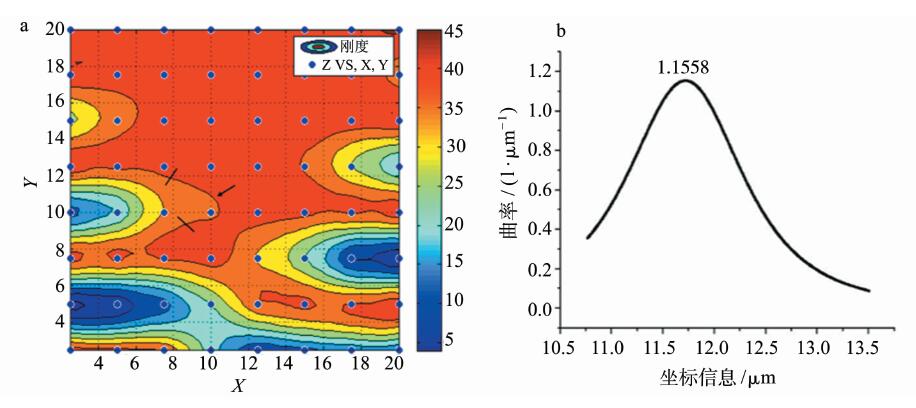
在刚度分布图的基础上,我们使用Getdata软件对软硬过渡的界面选取坐标信息进行曲率分析。使用Orange 8.0输入选取的曲线的坐标信息,使用曲率计算公式,得到该处曲线的曲率结果,如图 5b所示。该曲线弯曲程度最大的点其曲率为1.1558。使用同样的方法,我们可以获得不同组织的刚度软硬过渡界面的曲率变化分析。
|
图 5 a.Getdata选取坐标信息示意图;b. 曲率分布图 Fig 5 a. Scheme of choosing coordinates with Getdata; b. distribution of curvature |
现有针对组织样本的刚度性质研究,主要关注肿瘤和非肿瘤之间的刚度软硬的差异。但是,这种软硬差异并非肿瘤组织所特有的现象,一些炎症病变也造成现组织、细胞刚度降低,例如,肺气肿中病生理过程诱导肺泡弹性的丢失。肿瘤组织作为一个细胞和细胞微环境的复杂集合体,它的硬度变化也是复杂的。从两例组织的硬度分布图可知,组织样本的力学特性,刚度特征是较为复杂的,可能简单的软硬刚度差异并不能完整准确地描述体内组织样本的生物力学特性差异。从病理上,我们已知恶性肿瘤的生长方式往往呈浸润性生长,良性病变一般呈膨胀性生长,而良恶性病变的刚度变化分布趋势是否也存在“膨胀”/“浸润”的差异,仍在进一步研究中。我们尝试使用曲率等方法对头颈部组织的刚度分布图进行分析,建立一个客观的鉴别分析方法。
3 结论目前尚没有针对头颈部组织样本的基于原子力显微镜的微区力学表征的报道。本实验建立了头颈部组织原位力学特性的分析方法,提供了一个可供临床诊断的特殊生物医学界面。本文所建立的方法给头颈部良恶性疾病,甚至其他系统疾病提供了一个诊断研究的新思路。
本实验中我们所采集的病例数较少,因为仪器设备所限,每例标本所获得的刚度分布的面积较小,对整个组织样本的刚度分布的代表性较弱。在未来的工作中,我们需要收集更大的样本量,建立头颈部良恶性病变的硬度分布数据库。在此基础上,完善对头颈部组织刚度分布结果的深入分析。
| [1] | Stewart B, Wild C P.World Cancer Report 2014[M].Geneva: World Health Organization, 2014. |
| [2] | Wang H, Zhang G, Wu Z, Lu B, Yuan D, Li X, Lu Z.MicoRNA-451 is a novel tumor suppressor via targeting c-myc in head and neck squamous cell carcinomas[J].Journal of Cancer Research and Therapeutics, 2015, 11(6): 216. |
| [3] | Mierke C T.The fundamental role of mechanical properties in the progression of cancer disease and inflammation[J]. Reports on Progress in Physics, 2014, 77(7): 076602. |
| [4] | Frisan T, Cortes-Bratti X, Chaves-Olarte E, Stenerlöw B, Thelestam M.The haemophilus ducreyi cytolethal distending toxin induces DNA double-strand breaks and promotes ATM-dependent activation of RhoA[J]. Cellular Microbiology, 2003, 5(10): 695-707. |
| [5] | Lin W, Wang Y, Lin S, Li C, Zhou C, Wang S, Huang H, Liu P, Ye G, Shen X.Induction of cell cycle arrest by the carbazole alkaloid Clauszoline-I from Clausena vestita DD Tao via inhibition of the PKCδ phosphorylation[J]. European Journal of Medicinal Chemistry, 2012, 47: 214-220. |
| [6] | He M, Cheng Y, Li W, Liu Q, Liu J, Huang J, Fu X. Vascular endothelial growth factor C promotes cervical cancer metastasis via up-regulation and activation of RhoA/ROCK-2/moesin cascade[J]. BMC Cancer, 2010, 10(1): 170. |
| [7] | Discher D E, Janmey P, Wang Y l.Tissue cells feel and respond to the stiffness of their substrate[J]. Science, 2005, 310(5751): 1139-1143. |
| [8] | Lee K, Zhu J, Shum J, Zhang Y, Muluk S C, Chandra A, Eskandari M K, Finol E A. Surface curvature as a classifier of abdominal aortic aneurysms: a comparative analysis[J]. Annals of Biomedical Engineering, 2013, 41(3):562-576. |
| [9] | Costerton J W, Stewart P S, Greenberg E. Bacterial biofilms: a common cause of persistent infections[J]. Science, 1999, 284(5418):1318-1322. |
| [10] | Fux C, Costerton J, Stewart P, Stoodley P. Survival strategies of infectious biofilms[J]. Trends in Microbiology, 2005, 13(1):34-40. |
| [11] | Butt H J, Cappella B, Kappl M.Force measurements with the atomic force microscope: technique, interpretation and applications[J]. Surface Science Reports, 2005, 59(1):1-152. |




