2. 山西大学 化学化工学院, 山西 太原 030006
2. School of Chemisty and Chemical Engineering, Shanxi University, Taiyuan 030006, Shanxi,P.R.China
有机溶剂中的水分含量是有机溶剂质量的重要指标,它直接影响着有机溶剂的效能,对有机化学反应通常具有很大影响,甚至会决定反应的产物、产率及反应的选择性。有机溶剂中微量水分的测定最经典的方法是卡尔·费休法[1]。但该法存在试剂配制繁琐、配制条件苛刻、所用吡啶试剂有恶臭、损害操作人员健康的缺点。测定水含量的其他方法有色谱法[2]、电化学法[3, 4, 5]、光谱法[6, 7, 8, 9, 10, 11]等。其中分光光度法具有选择性好、灵敏度高、操作简便、可实现裸眼可视化识别检测的优点,但相关报道不多[6, 11]。本文以价廉易得的靛蓝(Indigo)为探针,建立了非质子有机溶剂(DMSO、THF、DMF、二恶烷及乙腈)中微量水的比色检测新方法。实验结果表明,氟离子与靛蓝分子相互作用,引起探针分子的去质子化,导致其光谱特征及溶液颜色发生变化(从蓝色变为黄绿色)。而体系中微量水的存在会影响靛蓝和F-之间的相互作用,从而改变体系的吸收光谱,并伴随溶液颜色的变化(从黄绿色变为蓝色)。因此,靛蓝-F-组合探针体系可实现对非质子有机溶剂中微量水的裸眼可视化识别检测。该方法操作简便、快速、灵敏、安全。
1 实验部分 1.1 仪器与试剂UV-2450型紫外-可见分光光度计(岛津,日本);Bruker DRX-600核磁共振仪(瑞士);KQ-2200B超声波清洗器(巩义市英峪予华仪器厂)。
靛蓝(Indigo,98%上海思域化工有限公司);二甲亚砜(天津市富宇精细化工有限公司);四丁基氟化铵(99%,J&K公司);四丁基氢氧化铵(40% 水溶液,J&K公司); 所有有机溶剂均为分析纯,通过标准方法进行干燥处理。实验用水为二次蒸馏水。
1.2 实验过程配置浓度为5×10-5 mol/L靛蓝的DMSO储备液。配置0.1 mol/L四丁基氟化铵的DMSO储备液。
氟离子滴定实验:准确移取250 μL的Indigo储备液于10 mL比色管中,并逐渐加入不同体积的氟离子储备液,加入DMSO定容至5 mL,充分震荡摇匀。然后进行紫外吸收光谱的测定。
有机溶剂中微量水含量的测定:准确移取250 μL的Indigo储备液和30 μL的氟离子储备液,逐渐加入不同体积的二次水,加入有机溶剂稀释到5 mL,充分震荡均匀,然后进行紫外吸收光谱的测定。
2 结果与讨论 2.1 F-对靛蓝紫外吸收光谱的影响在二甲亚砜中测定F-对Indigo紫外吸收的影响。从图 1可以看出,靛蓝的紫外吸收光谱在619 nm处有强的特征吸收峰,对应的是S0→S1的电子跃迁,属于π-π*跃迁。溶液呈蓝色,这与文献报道相一致[12]。随着加入F-浓度的增加,Indigo的紫外吸收在619 nm处的吸光度逐渐降低,450 nm和846 nm处的紫外吸收逐渐增强,并在500 nm和662 nm处出现了两个等吸收点,表明Indigo与F-之间形成了具有确定化学计量比的复合物。同时溶液的颜色由蓝色变为黄绿色。
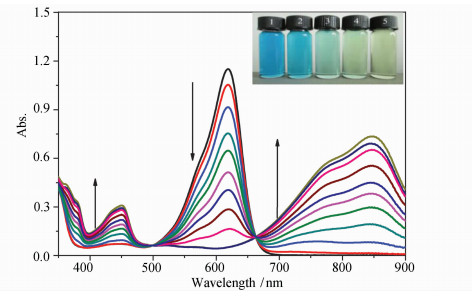 | 图1 F-对Indigo紫外吸收的影响 内插图:Indigo溶液中加入不同浓度F-后的颜色变化 The absorption changes of Indigo (50 μmol/L) with increasing concentrations of F- Inset shows photographs of 1: Indigo, 2: Indigo+F-3 equiv.), 3: Indigo+F- (6equiv.), 4: Indigo+F- (9 equiv.) and 5: Indigo+F- (12 equiv.) in DMSO [Indigo]=5×10-5 mol/L; [F-](10-5 mol/L)=0,5, 10, 17, 25, 30, 35, 40, 45, 50, 55, 60 |
通过等摩尔连续变化法测定Indigo和F-的结合比[13]。固定Indigo和F-的总浓度为2×10-4 mol/L,改变Indigo和F-的组成比例,测定体系在619 nm处吸光度的变化,结果如图 2所示。可以看出当Indigo和F-的摩尔浓度比为1∶2时体系吸光度变化最大,表明两者的结合比为1∶2。
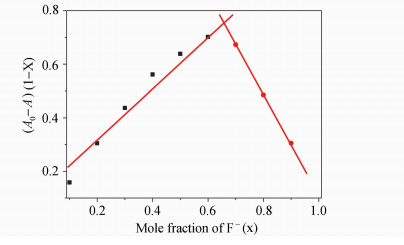 | 图2 Indigo与F-的结合比测定曲线(Indigo和F-的总浓度为2×10-4 mol/L) Job’s plot for Indigo and F- complexation in DMSO(The total concentration of Indigo and F- is 2×10-4 mol/L) |
为阐明Indigo与F-的作用机理,以DMSO-d6为溶剂,进行了核磁滴定实验(图 3)。随着F-的加入,分子中的—NH吸收峰(10.5)逐渐消失,同时苯环上氢的化学位移向高场移动。随着F-浓度的进一步增加,在化学位移16.2处出现了FHF-的特征吸收峰。结合吸收光谱的实验结果,我们推测F-的存在引起了靛蓝分子的去质子化[14],最终形成了R-和FHF-[15]。使芳环上的电荷密度增加,从而引起了芳环上的氢向高场的位移[16, 17]。作用过程如图 4所示。
 | 图3 Indigo与F- 的核磁滴定 Partial 1HNMR spectra of Indigo(5 mmol/L) in the presence of different concentrations of (CH3CH2CH2CH2)4NF in DMSO-d6 (a) Indigo only; (b) Indigo+F- (0.5 equiv.); (c) Indigo+F- (1 equiv.); (d) Indigo+F- (2 equiv.); (e) Indigo+F- (4 equiv.);(f) Indigo+F- (8 equiv.) |
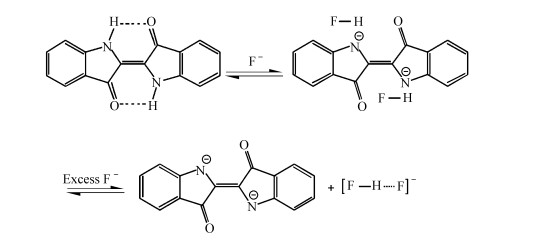 | 图4 Indigo与F-的作用机制 The binding mode between F- and Indigo |
为证实去质子化造成了靛蓝吸收光谱的位移,实验考查了微量四丁基氢氧化铵对靛蓝吸收光谱的影响。
如图 5所示,OH-和F-对靛蓝吸收光谱的影响非常相似,进一步证明了F-对Indigo的去质子化作用机制。
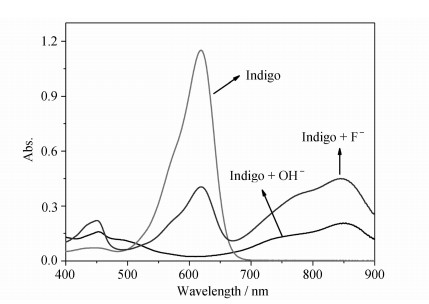 | 图5 碱及F-对Indigo紫外吸收光谱的影响 The absorption changes of Indigo (50 μmol/L) upon addition of OH- and F- (350 μmol/L) |
基于Indigo和F-的作用机理,我们推测水的加入会影响Indigo和F-之间的相互作用,从而改变体系的吸收光谱。实验结果证实了这种推测。如图 6所示,在Indigo中加入F-后,溶液由蓝色变为黄绿色,随后在溶液中逐渐加入水,溶液的颜色又逐渐恢复到蓝色。H2O对Indigo体系的紫外吸收作用刚好与F-相反。随着水的加入,Indigo-F-体系在619 nm处的吸收逐渐增加,450 nm和846 nm处的吸收逐渐降低,直至消失。当水的加入量是30 μL(总体积含量的0.6%)时,Indigo与F-体系的紫外吸收就开始恢复,由此可见体系对水的存在很敏感。因此,以Indigo-F-体系为探针有望用于有机溶剂中微量水的定量测定。其中DMSO体系的吸光强度A619和 H2O的量在0~4.0%的范围内呈现良好的线性关系(r=0.9914),检测限是0.022%。
 | 图6 H2O对Indigo-F-紫外吸收的影响 内插图: Indigo的DMSO溶液中先后加入F-及微量水后的颜色变化 The absorption changes of Indigo-F- with increasing H2O Inset shows photographs of 1: Indigo, 2: Indigo-F- (12 equiv.) and 3: Indigo-F- (12 equiv.) + H2O (4%) solution |
除DMSO外,实验还测定了二恶烷、四氢呋喃、乙腈及N,N-二甲基甲酰胺4种体系。得到了和DMSO体系相似的结果。如图 7所示,二恶烷体系的吸光强度A603和H2O的量在0~3.0%的范围内呈现良好的线性关系(r=0.9882),检测限是0.34%。THF体系的吸光强度A609和H2O的量在0~2.0%的范围内呈现良好的线性关系(r=0.9910),检测限是0.043%。乙腈体系的吸光强度A598和 H2O的量在0~1.6%的范围内呈现良好的线性关系(r=0.9867),检测限是0.015%。DMF体系的吸光强度A608和H2O的量在0~1.2%的范围内呈现良好的线性关系(r=0.9940),检测限是0.016%。由此可以实现对二恶烷、四氢呋喃、乙腈及N,N-二甲基甲酰胺中微量水的定量检测。
 | 图7 二恶烷(a)、四氢呋喃(b)、乙腈(c)及N,N-二甲基甲酰胺(d)中水含量的测定 The determination of the content of water in dioxane (a), THF(b), acetonitrile(c) and DMF(d) |
此外,实验考察了质子性溶剂甲醇对体系吸收光谱的影响。结果表明:体系中微量甲醇的存在同样会影响靛蓝和F-之间的相互作用,从而改变探针分子的光谱特性(图 8)。因此,靛蓝-F-组合探针不能用于质子性有机溶剂中微量水的检测。但该方法可用于非质子有机溶剂中微量水的定量检测,具有简便、快速、安全及可视化的优点。
 | 图8 甲醇对Indigo-F-紫外吸收的影响 The absorption changes of Indigo-F- with increasing CH3OH |
本研究以价廉易得的靛蓝-F-为组合探针,实现了对非质子有机溶剂中微量水的定量检测。氟离子的存在使靛蓝的紫外吸收光谱发生位移,同时溶液的颜色从蓝色变为黄绿色。结合核磁滴定研究了作用机理。结果表明,F-的存在造成靛蓝分子的去质子化,从而改变了探针分子的光谱特性。体系中微量水的存在影响了靛蓝和F-之间的相互作用,进而影响体系的吸收,并伴随溶液颜色的变化。因此,以靛蓝-F-为组合探针,能实现裸眼可视化识别检测非质子有机溶剂中的微量水。
| [1] | Fisher K A. A new method for the analytical determination of the water content of liquids and solids[J]. Angewandte Chemie, 1935, 48: 394-396. |
| [2] | O'Keefe W K, Ng F T T, Rempel G L. Validation of a gas chromatography/thermal conductivity detection method for the determination of the water content of oxygenated solvents[J]. Journal of Chromatography A, 2008, 1182: 113-118. |
| [3] | Casalbore-Miceli G, Chen Y S, Girotto E M, Li Y, Rinaldi A W, Yang M J, Zanelli A. Prompt responsive sensors for water detection in organic solvents[J]. Sensors and Actuators, B: Chemical, 2006, 119(2):577-582. |
| [4] | Xiao C L, Weremfo A, Wan C Y, Zhao C. Cathodic stripping determination of water in organic solvents[J]. Electroanalysis, 2014, 26: 596-601. |
| [5] | Opekara F, Tuma P. A simple impedance tester for determining the water content inorganic solvents[J]. Sensors and Actuators, B: Chemical, 2015, 220: 485-490. |
| [6] | Zhou L, Liu X H, Bai H X, Wang H J. A simple method for determining water content in organic solvents based on cobalt(II) complexes[J]. Chinese Chemical Letters, 2011, 22:189-192. |
| [7] | Sun Y, Liang X H, Wei S, Fan J, Yang X H. Fluorescent turn-on detection and assay of water based on 4-(2-dimethylaminoethyloxy)-N-octadecyl-1,8-naphthalimide with aggregation-induced emission enhancement[J]. Spectrochimica Acta, Part A: Molecular and Biomolecular Spectroscopy, 2012, 97: 352-358. |
| [8] | Trigo-López M, Muñoz A, Ibeas S, García F C, Serna F, García J M. Solid sensory polymer kit for the easy and rapid determination of the concentration of water in organic solvents and ambient humidity[J]. Sensors and Actuators, B: Chemical, 2014, 191: 233-238. |
| [9] | Niu H Y, Huang D W, Niu C G. Time-gated fluorescence sensor for trace water content determination in organic solvents based on covalently immobilized europium ternary complex[J]. Sensors and Actuators, B: Chemical, 2014, 192: 812-817. |
| [10] | Siddhartha P, Manjira M, Buddhadeb S, Somenath L, Pabitra C. Development of a rhodamine-benzimidazol hybrid derivative as a novel FRET based chemosensor selective for trace level water[J]. RSC Advances, 2014, 4: 21608-21611. |
| [11] | Park H, Chang S K. Signaling of water content in organic solvents by solvatochromism of a hydroxynaphthalimide-based merocyanine dye[J]. Dyes Pigments, 2015, 122:324-330. |
| [12] | Amat A, Rosi F, Miliani C, Sgamellotti A, Fantacci S. Theoretical and experimental investigation on the spectroscopic properties of indigo dye[J]. Journal of Molecular Structure, 2011, 993: 43-51. |
| [13] | Chen S J, Yang Y H, Wu Y, Tian H, Zhu W H. Multi-addressable photochromic terarylene containing benzothiophene-1,1-dioxide unit as ethene bridge: multifunctional molecular logic gates on unimolecular platform[J]. Journal of Materials Chemistry, 2012, 22: 5486-5494. |
| [14] | Wang S J, Zhao Y L, Zhao C X, Liu L, Yu S J. A colorimetric chemosensor for fluoride ions based on an indigo derivative[J]. Journal of Fluorine Chemistry, 2013, 156: 236-239. |
| [15] | Saravanan C, Easwaramoorthi S, Hsiow C Y, Wang K, Hayashi M, Wang L. Benzoselenadiazole fluorescent probes-near-IR optical and ratiometric fluorescence sensor for fluoride ion[J]. Organic Letters, 2014, 16: 354-357. |
| [16] | 董振明,崔欣欣,刘瑶,武旭娇. 7-(4-氯苯-10-羟基苯并喹啉的合成及对F-的识别研究[J].影像科学与光化学, 2013, 31(5): 390-395. Dong Z M, Cui X X, Liu Y, Wu X J. Synthesis of 7-(4-chlorophenyl) azo-10-hydroxybenzoquinoline and recognition of F-[J]. Imaging Science and Photochemistry, 2013, 31(5): 390-395. |
| [17] | Zhang P, Shi B B, You X M, Zhang Y M, Lin Q, Yao H, Wei T B. A highly selective and sensitive chemosensor for instant detection cyanide via different channels in aqueous solution[J]. Tetrahedron, 2014, 70: 1889-1894. |




