2. 华东理工大学 化学工程学院, 上海 200237
2. School of Chemical Engineering, East China University of Science & Technology, Shanghai 200237, P.R.China
pH值的监测和控制在化学、生物化学、细胞生物学和药物释放等领域起着重要的作用[1, 2, 3, 4, 5, 6, 7]。在生物反应器中培养细胞或组织,实时获取细胞或组织的生存状态是考察其培养质量的重要依据,其中pH是一个重要参数,直接反映了细胞或组织的生存状态[8]。现代生物技术都在尝试标准反应器和搅拌器的几何尺寸微小化,为此人们设计了可以平行操作的微型反应器[9, 10, 11]。应用于生物反应器的pH值在线监测,有电化学、光学等技术[12,13]。对于电化学监测方法而言,其安装过程相对复杂,存在费用昂贵、电极溶液可能浸入培养液等问题,而且相邻传感器之间的化学交叉影响有时无法避免[14]。聚合物pH荧光探针能够成膜并可以制作成检测器件,具有高的灵敏度,而且可明显降低对反应器的污染,因而在生物反应器的pH检测中得以应用[15, 16, 17, 18, 19]。Kermis H R等[20]率先提出光学方法测量溶解氧(DO)和pH,具有高通量筛选、非入侵性、容易集成等特征,但是响应时间接近9 min。
1,8-萘酰亚胺衍生物是一类常见的荧光化合物,具有很好的热稳定性和很高的荧光量子产率,常被用作荧光信号基团进行研究[21, 22, 23, 24]。Shen L J等[25]将长波长的萘二酰亚胺荧光基团的单体与甲基丙烯酸羟乙酯共聚得到亲水性的聚合物探针,该荧光探针在pH值4.6~8.0之间有良好的线性响应。另外,该课题组设计的以萘酰亚胺为荧光基团的另一个聚合物pH探针P(HEMA-NI)在pH值6~8范围内具有良好的响应,此范围非常适用于链霉素发酵的pH微环境[26]。但是,此聚合物膜的pH响应速率较慢,大约为4 min,不能很好地满足实时在线监测的要求。为了提高膜的响应速率,本论文在共聚物pH探针P(HEMA-NI)中引入第3种单体,进一步改进膜的性能,以达到在线监测pH值的要求。
本文将金刚烷引入聚合物链中,利用金刚烷基团是刚性基团和空间体积大的特点,试图改变聚合物的微观结构[27],减小质子进入膜的阻力。另外,聚乙二醇具有超强的亲水性,引入聚合物中能够改变膜的亲水性;同时,聚乙二醇具有良好的生物相容性,是生物医药的热门材料[28, 29, 30]。文中将亲水性PEG-MA以不同的比例引入聚合物中,以比较膜的亲水性对pH值响应速率的影响。
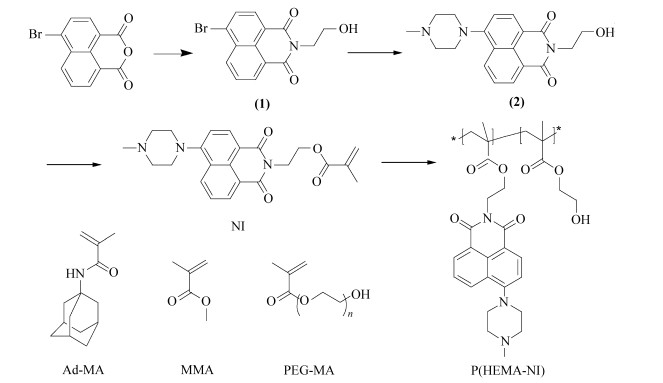 | 式1 聚合单体以及二元聚合物的合成路线 Synthesis of monomers and copolymers |
使用前,偶氮二异丁腈(AIBN)用乙醇重结晶两次,甲基丙烯酸羟乙酯(HEMA)减压重蒸提纯,二氯甲烷用分子筛除水,其它试剂和药品均为市售分析纯和化学纯,未经进一步纯化。
核磁共振氢谱采用Bruker Avance 400型核磁共振仪(德国Bruker公司),室温下测定;质谱采用Waters LCT Premier XE TOF型高分辨质谱仪(美国Waters公司)测定;紫外光谱采用VARIAN Cary 100光谱仪,荧光光谱采用VARIAN-Cary荧光光谱仪测定。纯水采用LAKECORE-S040D型超纯水器(上海涞科仪器有限公司)制备。膜的接触角采用型号JC2000C的接触角测量仪测定;膜的pH传感性能测试采用生物发酵罐样机测试系统;聚合物的分子量采用用规格型号为PL-GPC50的凝胶渗透色谱仪测定,DMF为流动相。
1.2 中间单体的合成 1.2.1 化合物1的合成在100 mL单口反应瓶中,加入4-溴-1,8-萘酐(5.0 g,18.0 mmol)、乙醇胺(10 mL,167.0 mmol)和乙酸(25 mL)。在氩气保护下,回流反应7 h。冷却,隔夜析出,固体过滤、水洗,真空干燥,得到黄色固体5.38 g,产率为93%。1HNMR(CDCl3,400 MHz): 8.67(d,J=7.6 Hz,1H),8.60(d,J=8.4 Hz,1H),8.43(d,J=7.6Hz,1H),8.06(d,J=8.0 Hz,1H),7.87(t,J= 8.0 Hz,1H),4.49(t,J=5.2 Hz,2H),4.43(d,J= 5.2 Hz,2H). HRMS cacld for C14H10NO3NaBr [M+Na]+ 341.9742,found 341.9747.
1.2.2 化合物2的合成在50 mL单口瓶中,加入化合物1(4.0 g,12.5 mmol)、N-甲基哌嗪(8 mL,64.7 mmol)和乙二醇单甲醚(10 mL)。在氩气保护下,回流反应10 h。冷却之后,缓慢滴加纯水,直至有固体析出,过夜静置,析出固体过滤,水洗,真空干燥得到固体4.0 g,产率94%。1HNMR(CDCl3,400 MHz): 8.61(dd,J1=7.2 Hz,J2=0.8 Hz,1H),8.54(d,J=8.0 Hz,1H),8.44(dd,J1=8.4 Hz,J2=1.2 Hz,1H),7.71(td,J1=8.0 Hz,J2=0.8 Hz,1H),7.24(d,J=8.0 Hz,1H),4.47(t,J=5.2 Hz,2 H),3.98(d,J=5.2 Hz,2H),3.34(t,J=5.2 Hz,4H),2.76(s,4H),2.52(d,J=5.2 Hz,1H),2.45 (s,3H). HRMS cacld for C19H22N3O3 [M+H]+ 340.1661,found 340.1668.
1.2.3 N-(2-甲基丙烯酰乙酯基)-4-(N-甲基哌嗪基)-1,8-萘酰亚胺(NI)的合成在50 mL单口瓶中,加入α-甲基丙烯酰氯(MAC,0.5 mL,5.1 mmol)、化合物2(1540 mg,4.5 mmol)、三乙胺(0.7 mL)和二氯甲烷(25 mL)。在氮气保护下,常温反应18 h。反应结束后,分别用氢氧化钠溶液(5%,质量分数)、盐酸溶液(0.05 mol/L)、纯水洗涤。有机相用无水硫酸钠干燥后,旋蒸除去二氯甲烷,柱层析(展开剂为二氯甲烷)提纯,得到的固体再次用乙醇重结晶,干燥得到固体1.1 g,产率为61%。1HNMR(CDCl3,400 MHz): 8.59 (dd,J1=8.4Hz,J2=0.8 Hz,1H),8.53 (d,J=8.0 Hz,1H),8.43(dd,J1=8.4 Hz,J2=0.8 Hz,1H),7.70(td,J1=8.0 Hz,J2=0.8 Hz,1H ),7.23(d,J=8.0 Hz,1H),6.06(s,1 H,cis-H),5.51(s,1 H,trans-H),4.55(t,J=5.2 Hz,2H ),4.49(t,J=5.2 Hz,2H ),3.32(t,J=4.4 Hz,4H),2.76(s,4H),2.52(d,J=5.2 Hz,1H),2.45 (s,3H ),1.88(s,3H ). HRMS cacld for C23H26N3O4 [M+H]+ 408.1923,found 408.1926.
1.3 金刚烷甲基丙烯酰胺(Ad-MA)的合成在250 mL三口反应瓶中,加入金刚烷胺盐酸(10 g,53 mmol)、三乙胺(14 mL ,101.0 mmol)和二氯甲烷(120 mL),量取甲基丙烯酰氯(5.1 mL,52.7 mmol)溶于二氯甲烷(30 mL)中,在0 ℃氮气保护下,使用恒压滴液漏斗缓慢滴加,约2 h滴加完成,然后常温搅拌18 h。反应结束后,依次用盐酸溶液、氢氧化钠溶液、纯水洗涤,最后用无水硫酸钠干燥,旋蒸除去溶剂。柱层析(石油醚/二氯甲烷=1/1)提纯。最后得到白色产品9.5 g,产率为82.6%。1HNMR(CDCl3,400 MHz):5.59(s,1 H,cis-H),5.24(s,1H,trans-H),2.09(s,3H),2.04(s,6H),1.92(s,3H),1.69(s,3H). HRMS cacld for C14H22NO [M+H]+ 220.1701,found 220.1704.
1.4 聚乙二醇单甲基丙烯酸酯(PEG-MA)的合成取聚乙二醇(40 mL,平均分分子量400)溶于二氯甲烷(50 mL)加入到250 mL三口瓶中,加对苯二酚做阻聚剂。将甲基丙烯酰氯(10 mL)溶于二氯甲烷(20 mL),在0 ℃氮气保护下,用恒压漏斗缓慢滴加,滴加完成后再常温反应8 h。反应结束后,减压旋蒸除去二氯甲烷,然后抽滤,得到的母液进行萃取。将母液溶于140 mL水中,用二苯醚萃取(35 mL×2)两次,水相再用二氯甲烷/正己烷(132/44 mL×2)萃取两次。将有机相中的二氯甲烷和正己烷除去,最后硅胶柱层析(二氯甲烷)除尽残留二苯醚,得到产品8 mL。1HNMR(CDCl3,400 MHz): 6.13 (s,1H,cis-H),5.58 (s,1H,trans-H),4.30 (t,J=4.0 Hz,2H),3.65 (m,28H),1.95 (s,3H).
1.5 聚合物的合成参照表 1的配比,在10 mL史莱克管内分别加入反应物和溶剂。搅拌溶解后用橡胶塞密封,在-78 ℃冻融循环3次将氧气除尽,待史莱克管恢复常温,置于65 ℃油浴中反应10 h。待反应结束后,加甲醇溶解,在乙酸乙酯中析出,反复操作3次。最后真空干燥,得到聚合物。P(HEMA-NI)的数均分子量为Mn= 390800,多分散指数PDI=1.79。
| 表1 共聚合单体以及引发剂、溶剂用量 Dosage of monomers, initiator and solvent in polymerization |
取上述聚合物各取1.0 g分别溶于1.2 mL甲醇中,稍加热、超声使其完全溶解。将配好的粘稠溶液倒于光洁平整的涂布纸上,调整涂布棒的高度来控制膜的厚度,水平匀速移动涂布棒将聚合物浓溶液拉制成膜。待溶剂自然挥发,揭下膜。用打孔机打出大小均一的圆形膜。
1.7 聚合物膜响应性能的测试用Na2HPO4·12H2O、NaH2PO4·2H2O和纯水配置pH=6和8的缓冲溶液。用双面胶将聚合物膜(图 1a)固定在生物发酵罐底部上,采用生物发酵样机测试系统(图 1b)检测聚合物膜的pH传感性能,更换发酵罐中pH值6和8的缓冲溶液,设定405 nm处激发,520 nm处检测荧光强度随pH值的变化。
 | 图1 聚合物膜P(HEMA-NI)以及生物发酵罐样机测试系统 Polymer film of P( HEMA-NI ) and test system of biological fermentation tank |
聚合选择基质(HEMA)和NI比例为1000∶1,避免因为浓度过高而导致荧光猝灭,同时也能保证在不同pH值变化下有明显的荧光强度变化。在三元共聚中,仍然以HEMA作为膜的主要基质,加入第3种单体的目的是为了改变膜的性能,提高膜的响应速率。Ad-MA和 PEG-MA的用量相对于HEMA均非常少,三元共聚仍然参照二元共聚时溶剂和引发剂的用量。二元共聚和三元共聚得到的聚合物均具有良好的成膜性能。
2.2 pH传感膜的接触角接触角是表示气固液三相相互作用的一种方法,可以用来表示固体表面的亲水性大小。通过对上述6个共聚物pH传感膜与水作用的接触角测试可以看出(表 2),相对二元聚合物而言,引入金刚烷的三元共聚物的接触角增加,膜的疏水性变强;而含有PEG单元的三元共聚物的接触角减小,能够改善膜的亲水性,并且随着共聚物中PEG单元含量的增加,膜的亲水性也增大(图 2)。
| 表2 共聚物pH传感膜的接触角 Contact angles of pH sensor films |
 | 图2 pH传感膜的接触角
Contact angles of pH sensor films (a) P(HEMA-NI); (b) P-Ad10; (c) P(PEG15) |
缓冲溶液的pH值从pH=6到8,pH传感薄膜的最大吸收波长红移,选择两条吸收光谱线的等吸收点(405 nm )处激发,可以看到随着溶液的pH值从8变到6,荧光强度发生了明显的变化(图 3)。
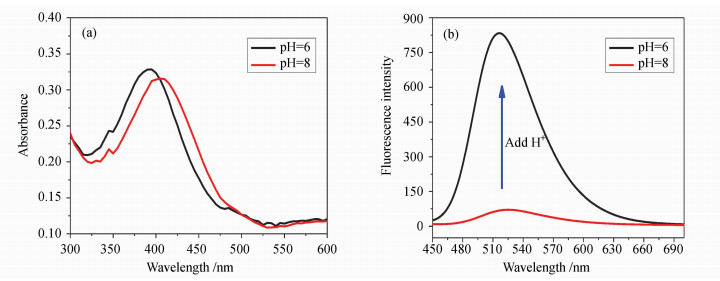 | 图3 聚合物薄膜P(HEMA-NI)在pH=6和8缓冲溶液中的吸收光谱(a)和荧光光谱(b) Absorption and fluorescence spectra of polymer film P(HEMA-NI) in the buffer solution of pH=6 and 8 |
聚合所得到的pH传感膜在弱酸条件下,与荧光基团相连的甲基哌嗪上的N原子被质子化,切断了光致电子转移(PET)从而导致荧光增强;同时在碱性条件下,由于PET作用传感膜表现荧光变弱的现象(图 4)。根据O’Shea的报道[27],芳香胺(N2和N3)只能在强酸条件下才能质子化。相对于烷基胺(N1),在弱酸条件下N2和N3由于酰亚胺的强吸电子特性很难被质子化。
 | 图4 共聚物pH荧光探针的传感机理 The sensor mechanism for polymer pH probe |
在405 nm激发下,pH=6时荧光强度为4000,而在pH=8时荧光强度下降到3500。此外,不断切换pH不同的缓冲溶液,膜对pH的响应依然保持良好的重复性。缓冲液pH值从8到6荧光强度达到平衡的时间是225 s,而相反的过程则只需要130 s(见图 5)。两者所需要响应时间有差异是因为H+渗透到膜里并使传感单元发生质子化的时间较长,而OH-进入膜内并与H+发生反应的时间较短。另外,荧光强度上升速度是先快后慢,荧光值能在几十秒迅速达到最高荧光值的80%。
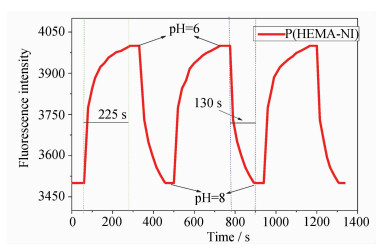 | 图5 聚合物P(HEMA-NI)膜在缓冲液中的荧光强度变化 (缓冲液pH=6或8, λex=405 nm, λem=520 nm) Fluorescence intensity of polymer P(HEMA-NI) in buffer solution (pH=6 and 8, λex=405 nm, λem=520 nm) |
金刚烷基是刚性基团,空间体积大。利用这一点,将金刚烷基团嵌入聚合物中,来减小膜的致密性,减小H+进入膜的阻力以来提高膜的响应速率。图 6是金刚烷含量不同的三个聚合物P-Ad1、 P-Ad5和P-Ad10制成的膜从pH=8到pH=6的响应速率,其中聚合物P-Ad1、 P-Ad5和P-Ad10合成时的单体配比中,金刚烷的含量分别为1%、5%和10%。
 | 图6 金刚烷含量不同的聚合物pH传感膜在缓冲液中的荧光强度变化 (缓冲液 pH=6或8, λex =405 nm,λem=520 nm) Fluorescence intensity of polymer films containing different amounts of adamantane unit in buffer solution (pH=6 and 8, λex =405 nm, λem=520 nm) |
从图 6可以看出随着聚合物中金刚烷单体含量的增加(1%、5%和10%),膜的响应时间在增加,并且达到的最大荧光强度也在下降,响应时间分别为270 s、520 s和850 s。结果表明刚性的金刚烷基团的加入并不能提高pH膜的响应速率。原因是金刚烷的强疏水性降低了膜的亲水性,阻碍了质子进入膜中,降低了pH膜的响应速率。
2.5 不同亲水性膜的三元共聚物的pH传感性能聚乙二醇是超强的亲水物质,在聚合时设计单体含量分别为10%、15%和20%。随着聚乙二醇单体比例的增加,聚合物传感膜的亲水性不断提高(见表 2),然而其在水中的溶解性同时也在提高。其中共聚物P(PEG20)制成的膜在水中会完全溶解,因此不适合用于水溶液环境下的pH检测。
当pH=8的缓冲液改为pH=6的缓冲液时,P(PEG10)传感膜的荧光强度达到平衡的时间为80 s,相反的过程达到平衡的时间则为60 s;而P(PEG15)传感膜的相应时间分别为28 s和11 s(见图 7)。测试结果表明,随着膜的亲水性增加,其pH响应速率大大提高。P(PEG15)相对于P(HEMA-NI)传感膜的响应速率分别提高了8.0和11.8倍。膜的响应速率极大提高,为pH值的在线监测提供了可能。
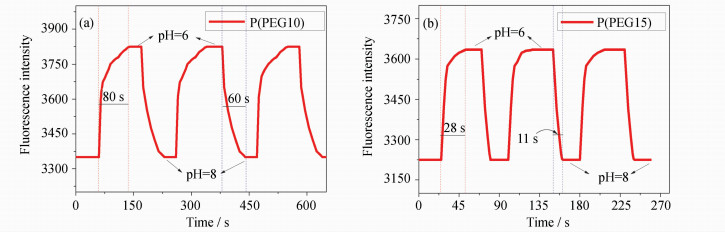 | 图7 共聚物P(PEG10)和P(PEG15) 膜在缓冲液中的荧光强度变化 (缓冲液 pH=6或8, λex =405 nm, λem=520 nm) Fluorescence intensity of copolymer P(PEG10) and P(PEG15) in buffer solution (pH=6 and 8, λex =405 nm, λem=520 nm) |
为了检验聚合物传感膜对H+的选择性,选用P(PEG15) 制备的传感膜,分别在pH = 8缓冲溶液中测试含10-6 mol/L的金属离子Fe3+、Cu2+、Pb2+、Zn2+和K+对pH传感膜荧光强度的影响,计算加入金属离子前后荧光变化比值(I/I0),如图 8所示。
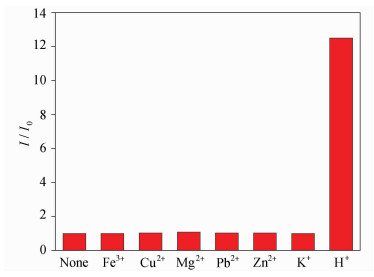 | 图8 pH传感膜对阳离子的响应性测试 Responsive tests of cations for pH sensor film |
从图 8中可以看出,金属离子加入前后,pH传感膜的荧光强度几乎不变,而加入H+后其荧光强度增加了12倍,因此pH传感膜对H+具有高度的选择性,金属离子对pH值的检测没有影响。
2.7 pH传感膜在酵母培养液中的测试为进一步测试pH传感膜的在线监测效果,将pH传感膜在发酵液中进行实验。选用酵母浸出粉胨葡萄糖培养基 (YPD),培养对象是酵母,培养温度为30 ℃。同时采用pH玻璃电极和pH传感膜在线监测培养液的pH变化(图 9)。
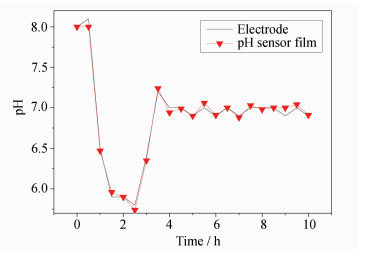 | 图9 pH传感膜和pH玻璃电极在培养液中在线监测的对比图 Online monitoring pH value in culture solution by pH sensor film and pH electrode |
随着酵母发酵的进行,pH传感膜和pH玻璃电极均可以反映发酵液的pH变化趋势,实现了共聚物pH传感膜在线实时监测发酵液的pH值。pH传感膜和玻璃电极两者测出的发酵液pH值最大相对误差为1%,实验结果表明,此 pH传感膜在生物培养中具有良好的应用前景。
3 结论将聚乙二醇引入聚合物中来改善膜的亲水性,合成了聚合物pH传感膜,测试结果表明,随着膜的亲水性提高,膜的响应速率也得到了极大的提高。此类聚合物pH传感膜在生物发酵罐样机上测试,具有良好的灵敏性和稳定性,并实现了其在发酵液中的pH值实时监测,在生物培养中拥有着潜在的应用前景。因此,对pH传感膜而言,要提高响应速率,实现在线监测,应主要着眼于改善其亲水性。
| [1] | Adhikari B,Majumdar S. Polymers in sensor applications[J]. Progress in Polymer Science, 2004, 29(7): 699-766. |
| [2] | Kwak J, Lee S. pH-Sensitive transformation of the peptidicbolaamphiphile self-assembly: exploitation for the pH-triggered chemical reaction[J]. Colloids and Surfaces B-Biointerfaces, 2014, 115: 406-411. |
| [3] | Pramod P S, Deshpande N U, Jayakannan M. Real-time drug release analysis of enzyme and pH responsive polysaccharidenanovesicles[J]. Journal of Physical Chemistry B, 2015, 119(33): 10511-10523. |
| [4] | Amendola V, Bergamaschi G, Buttafava A, Fabbrizzi L, Monzani E. Recognition and sensing of nucleoside monophosphates by a dicopper(Ⅱ) cryptate[J]. Journal of the American Chemical Society, 2010,132: 147-156. |
| [5] | Andreasson J, Pischel U. Smart molecules at work-mimicking advanced logic operations[J]. Chemical Society Reviews, 2010, 39: 174-188. |
| [6] | Poëa-Guyon S, Pasquier H, Mérola F, Morel N, Erard M. The enhanced cyan fluorescent protein: a sensitive pH sensor for fluorescence lifetime imaging[J]. Analytical and Bioanalytical Chemistry, 2013, 405(12): 3983-3987. |
| [7] | Wu M H, Lin J L, Wang J B, Cui Z F, Cui Z. Development of high throughput optical sensor array for on-line pH monitoring in micro-scale cell culture environment[J]. Biome-dical Microdevices, 2009, 11(1):265-273. |
| [8] | Razaq S, Wilkins R J, Urban J P G. The effect of extracellular pH on matrix turnover by cell of the bovine nucleuspulposus[J]. European Spine Journal, 2003, 12: 341-349. |
| [9] | Kusterer A, Kraufmann K, Arnold M, Weuster-Botz D. Fully automated single-use stirred-tank bioreactors for parallel microbial cultivations[J]. Bioprocess Biosystems Engineering, 2008, 31(3): 207-215. |
| [10] | Betts J I, Doig S D, Baganz F. Characterization and application of a miniature 10 mL stirred-tank bioreactors, sho-wing scale-down equivalence with a conventional 7 L reactor[J]. Biotechnology Progress, 2006, 22(3): 681-688. |
| [11] | Vallejos J R, Kostov Y, Ram A, French J A, Marten M R, Rao G. Optical analysis of liquid mixing in a minibioreactor[J]. Biotechnology Bioengineering, 2006, 93(5): 906-911. |
| [12] | Lin C, Lee G, Wang C, Lee H, Liao W, Chou T. Microfluidic pH-sensing chips integrated with pnenumatic fluid-control devices[J]. Biosensors Bioelectronics, 2005, 21(2): 248-256. |
| [13] | Yadavalli V K, Pishko M V. Biosensing in microfluidic channels using fluorescence polarizatio[J]. Analytical Chimical Acta, 2004, 507(1): 123-128. |
| [14] | Suzuki M, Akaguma H. Chemical cross-talk in flow-type integrated enzyme sensors[J]. Sensors and Actuators B, 2000, 64(1/3): 136-141. |
| [15] | Unciti-Broceta A, Yusop M R, Richardson P R, Walton J G A, Bradley M. A fluorescein-derived anthocyanidin-inspired pH sensor[J]. Tetrahedron Letters, 2009, 50: 3713-3715. |
| [16] | Wang W, Shaller A D, Li A D Q. Twisted perylenestereodimersreveal chiral molecular assembly codes[J]. Journal of the Amercian Chemical Society, 2008, 130(26): 8271-8279. |
| [17] | Haugland R P. The Handbook. A Guide to Fluorescent Pobes and Labeling Technologies[M]. 10th ed, Eugene Orgon: Molecular Probes Inc, 2005. |
| [18] | Vetrichelvan M, Nagarajan R, Valiyaveettil S. Carbazole-containing conjugated copolymers as colorimetric/fluorimetricsensor for iodide anion[J]. Macromolecules, 2006, 39: 8303-8310. |
| [19] | Grabchev I, Sali S, Betcheva R, Gregoriou V. New green fluorescent polymer sensors for metal cations and protons[J]. European Polymer Journal, 2007, 43(10): 4297-4305. |
| [20] | Kermis H R, Kostov Y, Harms P, Rao G. Dual excitation ratiometric fluorescent pH sensors for noninvasive bioprocess monitoring: development and application[J]. Biotechnology Progress, 2002, 18(5): 1047-1053. |
| [21] | 刘国峰,牛海军,赵平. RAFT方法合成的共聚物荧光探针以及其氟离子检测性能[J]. 影像科学与光化学, 2014, 32(2):133-140. Liu G F, Niu H J, Zhao P. Fluoride chemosensors based on fluorescent polymer via RAFT polymerization[J]. Imaging Science and Photochemistry, 2014, 32(2): 133-140. |
| [22] | 朱为宏, 李恒, 朱世琴.含萘酰亚胺单元的铕配合物合成以及其发光性能的研究[J].感光科学与光化学, 2007, 25(1):25-32. Zhu W H, Li H, Zhu S Q. Synthesis and optical properties of novel Eu(Ⅲ) complex containing naphthalimide unit[J]. Photographic Science and Photochemistry, 2007, 25(1): 25-32. |
| [23] | 王朝晖, 姚思德, 陈孔常, 田禾.萘酰亚胺及其含二茂铁二元化合物的分子间(内)三重态能量传递[J]. 感光科学与光化学, 2000, 18(1):73-76. Wang Z H, Yao S D, Chen K C, Tian H. Triplet energy transfer in novel naphthalimide-ferrocene dyad systems[J]. Photographic Science and Photochemistry, 2000, 18(1):73-76. |
| [24] | Tian H, Gan J A, Chen K C, He J, Song Q L, Hou X Y. Positive and negative fluorescent imaging induced by naphthalimide polymers[J]. Journal of Matericals Chemistry, 2002, 12(5): 1262-1267. |
| [25] | Shen L J, Lu X Y, Tian H, Zhu W H. Along wavelength fluorescent hydrophilic copolymer based on naphthalenediimide as pH sensor with broad linear responserange[J]. Macromolecules, 2011, 44: 5612-5618. |
| [26] | 沈梁钧. 基于微型生物反应器的聚合物荧光传感膜及双光子非线性材料的研究.上海:华东理工大学,2010.47-65. Shen L J. Study on polymeric fluorescent sensors for microbioreactors and two-photon absorption induced non-linear fluorescence. Shanghai: East China University of Science and Technology,2010.47-65. |
| [27] | 刘卅, 郭建维.含金刚烷聚合物的研究进展[J]. 高分子材料科学与工程, 2008, 24(7): 6-10. Liu S, Guo J W. Advance in synthesis, structure and properties polymers containing adamantane moieties[J]. Polymer Materials Science & Engineering, 2008, 24(7): 6-10. |
| [28] | Ouchi T, Ohya Y. Design of lactide copolymers as biomaterials[J]. Journal of Polymer Science A Polymer Chemistry, 2004, 42(3): 453-462. |
| [29] | 葛建华, 王迎军, 郑裕东. PLA-PEG-PLA的合成与研究[J]. 高分子材料科学与工程, 2003, 21(6): 817-820. Ge J H, Wang Y J, Zheng Y D. Synthesis and properties of copolymer of PLA-PEG-PLA[J]. Journal of Materials Science & Engineering, 2003, 21(6): 817-820. |
| [30] | McDonnell S O, O'Shea D F.Near-infrared sensing properties of dimethlyamino-substituted BF2-azadipyrromethenes[J]. Organic Letters, 2006, 8(16): 3493-3496. |




