量子点( quantum dots,QDs) 是一类由Ⅱ~Ⅵ族或Ⅲ~Ⅴ族元素所组成,能够产生荧光的半导体纳米颗粒。量子点具有荧光量子产率高、抗光漂白能力强、激发光谱宽、光稳定性好等一系列独特的光学性质[1],近几年来半导体量子点作为新型荧光探针已广泛应用于物理、化学、材料科学及电子工程学等诸多学科,并在生命科学领域中涉及多个方面,如生物传感器[2]、生物标记[3, 4, 5]及医学诊断等。最近,利用其光谱特性对抗生素类药物分子[6]、蛋白质[7,8]、DNA[9, 10, 11]等生物大分子的高灵敏度检测已有报道。因此量子点有望取代有机染料探针成为新一代的生物探针。
丝裂霉素是一种运用于临床的抗恶性肿瘤药物,它的抗癌活性好,抗癌光谱广,对食道癌、肺癌、淋巴癌等均有疗效。但由于丝裂霉素在实际应用中对骨髓毒性大、可引起肠道反应及肝肾功能障碍等,限制了临床应用[12]。因此丝裂霉素在生物体液中的应用还需要进一步的监测研究。目前,丝裂霉素的测定方法主要有紫外分光光度法[13]、高效液相色谱法[14]和毛细管电泳-安培检测法[15]。在诸多方法中,有的分析时间长,有的操作繁琐且灵敏度低,不能满足实际应用的需要,因此,建立一种快速、简单的检测丝裂霉素的方法具有重要的现实意义。
通过以上研究的启发,本研究试图建立一种基于CdSe/ZnS量子点检测丝裂霉素的新方法,我们发现CdSe/ZnS量子点的荧光强度可以通过丝裂霉素直接猝灭,基于这一观察,设计了一个简便、易于实施的荧光方法检测丝裂霉素,并将其应用于丝裂霉素注射液和生物体液样品验证。
1 实验部分 1.1 仪器量子点的形貌通过JSM-2100(日本电子)透射电镜在200 kV的高速电压下扫描获得;荧光光谱于Cary Eclipse(瓦里安公司,美国)荧光分光光度计上测定,紫外光谱通过Cary 5000(瓦里安公司,美国)紫外分光光度计进行测定,石英比色池:1 cm×1 cm;溶液pH采用PHS-3C型pH计测定。
1.2 试剂实验中所用试剂均为分析纯。丝裂霉素购于浙江海正药业股份有限公司,量子点购于武汉珈源量子点有限公司,高纯水(18.2 MΩ·cm)采用WaterPro水纯化系统(Labconco公司,美国)制作。
1.3 测定方法在一系列10 mL比色管中,加入10 μL浓度为0.08 μmol/L的CdSe/ZnS量子点溶液,500 μL PBS缓冲液(0.02 mol/L,pH7.4),以及不同浓度的丝裂霉素标准溶液,蒸馏水定容至5 mL,室温下反应10 min后进行荧光光谱分析。光谱分析条件为激发波长295 nm,激发和发射狭缝均为10 nm,扫描范围500~700 nm。
1.4 实际样品分析丝裂霉素样品来自标准注射用丝裂霉素粉末,将其溶解并稀释制备成母液(0.6 mmol/L),测试时取母液15 μL、浓度为0.02 mol/L磷酸缓冲液500 μL和浓度为0.08 μmol/L的CdSe/ZnS量子点溶液10 μL,将上述溶液用蒸馏水定容至5 mL摇匀进行测试。尿液来自健康志愿者,将其稀释100倍用于检测分析,样品不需要进一步的复杂处理。
2 结果与讨论 2.1 CdSe/ZnS量子点的表征图 1a为利用高分辨透射电镜对CdSe/ZnS量子点扫描观测显示图,从图中可以看出CdSe/ZnS量子点颗粒近球型,外观尺寸较为均匀,粒径约为3.5 nm。图 1b通过量子点荧光扫描光谱与紫外光谱显示CdSe/ZnS量子点最大激发峰位于295 nm处,而最大发射峰位于590 nm处。
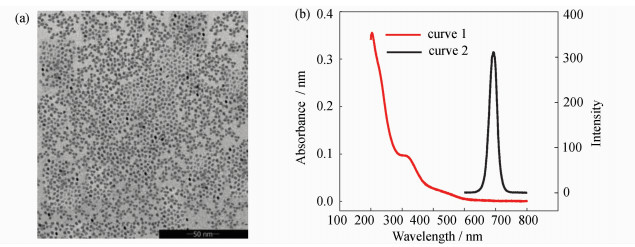 | 图1 (a)量子点的透射电镜; (b)量子点紫外吸收光谱(曲线1)与量子点发射光谱图(曲线2) (a) TEM image of CdSe/ZnS QDs;(b) UV-Vis absorption spectrum of CdSe/ZnS QDs(curve 1) and emission spectrum of CdSe/ZnS QDs (curve 2) |
为了证实CdSe/ZnS量子点测定丝裂霉素的可行性,我们首先分析了丝裂霉素对CdSe/ZnS量子点荧光强度的影响。从图 2可以看出,丝裂霉素能够有效猝灭CdSe/ZnS量子点,且猝灭程度随丝裂霉素浓度的增加而增加。
 | 图2 丝裂霉素对CdSe/ZnS量子点荧光发射光谱的影响 曲线1~8:(1) 0, (2) 1.8, (3) 6, (4) 12, (5) 24, (6) 36,(7) 48, (8) 60 μmol/L Fluorescence emission spectra of CdSe/ZnS QDs in the presence of various concentrations of mitomycin Curve1~8:(1) 0, (2) 1.8, (3) 6, (4) 12, (5) 24, (6) 36,(7) 48, (8) 60 μmol/L |
为了增强体系的稳定性和选择性,考察了溶液的pH值、反应时间、盐浓度、温度对上述体系的影响。量子点发光强度与溶液pH值密切相关。通过溶液pH对CdSe/ZnS QDs的荧光强度的影响分析显示(图 3a):当溶液pH值低于7.0或高于8.0时,CdSe/ZnS QDs荧光强度会随溶液pH值变化而明显增加,而溶液pH值介于7.0与8.0之间时,CdSe/ZnS QDs荧光相对稳定;此外,通过在不同pH值溶液中丝裂霉素对CdSe/ZnS QDs荧光猝灭影响分析显示(图 3a插图):当溶液pH在低于7.0或高于8.0时,加入丝裂霉素后,随pH值的升高,体系的荧光猝灭程度(F/F0)明显降低,而pH值在7.0~8.0时F/F0相对保持稳定。由此可知,当pH在7.0~8.0时,量子点的荧光强度以及丝裂霉素对量子点荧光猝灭的影响都相对稳定,考虑到检测体系在生物体液中应用的便捷性,选择pH7.4作为后续测定的最佳pH条件;在CdSe/ZnS量子点中加入丝裂霉素,10 min后体系荧光强度基本稳定,且在后续40 min内基本保持不变,因此,所有测定均在10 min后进行(图 3b)。从图 3c可知:NaCl在0~0.3 mmol/L范围内,体系荧光强度基本保持稳定。通过不同温度下,量子点荧光强度随温度变化的分析显示(图 3d):随温度升高,量子点的荧光强度逐渐下降,在室温(25 ℃)下量子点相对具有较强的荧光。此外,通过在25 ℃与30 ℃两种温度下丝裂霉素对量子点荧光猝灭影响发现,在25 ℃下丝裂霉素对量子点猝灭程度(F0/F)要明显高于30 ℃。说明在25 ℃下丝裂霉素对量子点荧光强度的变化更为灵敏。因此后续试验均在25 ℃下进行测定。
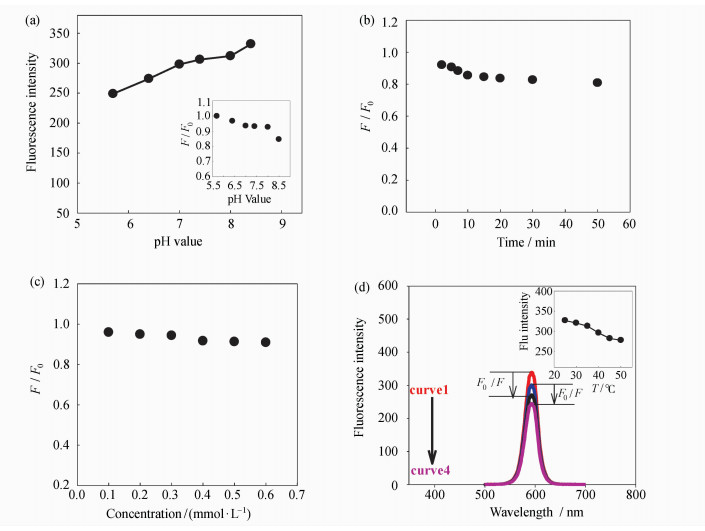 | 图3 (a) pH对量子点荧光强度的影响,插图为pH对量子点/裂霉素纳米复合物的影响;(b) 时间对CdSe/ZnS量子点/丝裂霉素纳米复合物荧光强度的影响; (c) NaCl浓度对CdSe/ZnS量子点/丝裂霉素纳米复合物荧光强度的影响;(d) 等量丝裂霉素在不同温度下对CdSe/ZnS量子点荧光强度的影响: (曲线1) 25 ℃下量子点的荧光强度;(曲线2)30 ℃下量子点的荧光强度;(曲线3)25 ℃下丝裂霉素对量子点荧光强度的影响; (曲线4) 30 ℃下丝裂霉素对量子点荧光强度的影响,插图表示不同温度对CdSe/ZnS量子点荧光强度的影响, CdSe/ZnS量子点和丝裂霉素的浓度分别为0.08 μmol/L和1.8 μmol/L (a) Effect of pH on fluorescence emission of CdSe/ZnSQDs,the inset displays the effect of temperature on fluorescence emission of CdSe/ZnSQDs after addition of mitomycin; (b) time-dependent fluorescence emission of the CdSe/ZnS QDs after addition of mitomycin;(c) effect of NaCl concentration on fluorescence emission of CdSe/ZnS QDs after addition of mitomycin;(d) effect of temperature on fluorescence emission of CdSe/ZnS QDs after addition of mitomycin: (curve1)the fluorescence intensity of quantum dots at 25 ℃,(curve 2) the fluorescence intensity of quantum dots at 30 ℃,(curve 3) at 25 ℃, the fluorescence intensity of quantum dots after addition of mitomycin,(curve 4) at 30 ℃, the fluorescence intensity of quantum dots after addition of mitomycin,the inset display the effect of temperature on fluores-cence emission of CdSe/ZnSQDs.Concentration of CdSe/ZnS QDs andmitomycin was 0.08 μmol/L and 1.8 μmol/L, respectively |
在最佳实验条件下,体系荧光强度变化程度与丝裂霉素呈良好的线性关系。如图 4所示,当丝裂霉素的浓度范围为1.8~60 μmol/L时,量子点荧光强度的变化与丝裂霉素浓度有良好的线性关系,其线性方程为F/F0 =-0.007c+0.866,相关系数R=0.996(其中c表示丝裂霉素的浓度)。方法检测限(3σ)为0.11 μmol/L,其中σ为连续测定11次不含丝裂霉素和含有1.8 μmol/L丝裂霉素体系荧光强度的标准偏差,11次平行测定的相对标准偏差为3.1%。
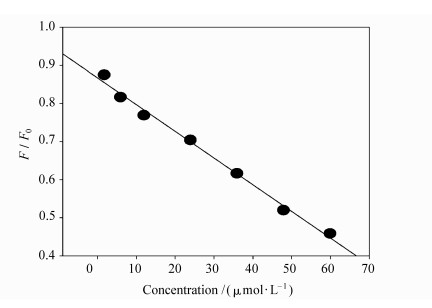 | 图4 丝裂霉素浓度与CdSe/ZnS量子点荧光强度之间的线性关系 A linear calibration plot of the quenched fluorescence signal against the concentration of mitomycin |
与目前报道的一些方法相比较(详见表 1),CdSe/ZnS量子点作为荧光探针检测丝裂霉素的方法检出限要低于方波伏安法、紫外分光光度法、高效液相色谱法;与毛细管电泳-安倍检测法相比,虽然量子点作为荧光探针的方法检出限高,但其线性范围宽,且在实际操作中,毛细管电泳-安倍检测法操作繁琐、难度大,而量子点荧光检测法分析简单、快速。因此,无论从灵敏度还是检测的简便性上均具有一定的优越性。
| 表1 检测丝裂霉素的方法对比 Comparison of the proposed method with different analytical techniques reported for detection of mitomycin |
考察了几种常见的生物体液中的离子和生物分子对体系的干扰,结果如表 2所示。在丝裂霉素浓度为1.8 μmol/L时,1000倍的Na+、350倍的K+、200倍Ca2+、200倍的谷氨酸、500倍的酪氨酸、100倍的脯氨酸、20倍的甘氨酸、500倍的牛血清蛋白、50倍的葡萄糖,以及300倍的DNA都不会对丝裂霉素的检测造成影响,表明该方法具有良好的选择性。
| 表2 外源物质的干扰 Tolerance of foreigen substances |
为进一步验证所建立方法用于实际样品分析中的可行性,对丝裂霉素注射液和尿液进行标准加标回收实验,表 3显示,在上述样品中的加标回收率介于95.2~102.2,且标准偏差小于3.5%,说明该方法具有良好的适用性。
| 表3 实际样品分析 Recovery for the detection of mitomycin in samples (n=3) |
根据上述分析,随着丝裂霉素浓度的增加,CdSe/ZnS量子点的荧光强度发生规律性的猝灭现象,一般情况下发生荧光猝灭的原因有能量转移、电子转移,以及量子点表面效应。通过监测丝裂霉素的紫外吸收光谱和量子点的激发光谱(图 5)的相互作用,可以看出丝裂霉素的紫外光谱与量子点的激发光谱没有发生重叠现象,说明丝裂霉素与量子点之间并不存在能量转移,能量转移作为量子点猝灭机制的可能性得以排除。
 | 图5 丝裂霉素的紫外吸收光谱(曲线1)和量子点的激发光谱(曲线2) UV-Vis absorption spectrum of mitomycin (curve 1), and emission spectrum of CdSe/ZnS QDs (curve 2) |
反应体系的紫外-可见吸收光谱如图 6所示,丝裂霉素在400 nm以下具有强的紫外吸收,当加入CdSe/ZnS量子点后,丝裂霉素的紫外吸收峰的强度只发生轻微的增强并没有明显的红移蓝移现象,且吸收峰的位置没有发生改变。由此表明体系并没有新的物质生成,丝裂霉素没有引起量子点聚集或大小改变,量子点表面效应的机理也可以排除。
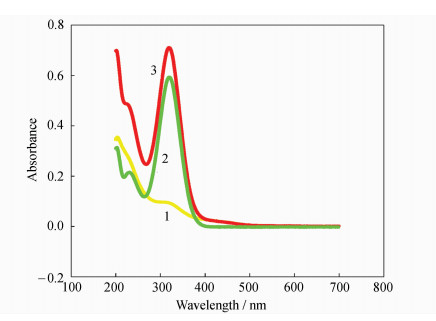 | 图6 曲线1: CdSe/ZnS量子点的紫外吸收光谱;曲线2: 丝裂霉素的紫外吸收光谱; 曲线3: CdSe/ZnS量子点与丝裂霉素混合物的紫外吸收光谱 Ultraviolet absorption spectra of CdSe/ZnS QDs (curve 1), mitomycin (curve 2 ), and the mixture of the CdSe/ZnS QDs (curve 3) with high concentration of mitomycin |
已有大量文献报道,蒽醌类合物(如阿霉素、吡揉比星等),因其分子中有醌式结构,极易获得电子,因而可作为一种电子受体,与量子点发生相互作用,并通过光诱导电子转移效应猝灭量子点荧光[17, 18, 19, 20]。丝裂霉素作为一种蒽醌类药物,含有典型的醌式结构(图 7),所以CdSe/ZnS QDs的荧光发生猝灭原因可能是量子点与丝裂霉素受到光激发后,量子点表面的电荷转移到丝裂霉素醌的结构上,使量子点电子从激发态返回基态时以光能形式释放能量受到障碍,阻止了CdSe/ZnS QDs 的电子-空穴复合,导致量子点荧光的猝灭[21,22]。
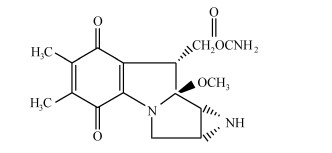 | 图7 丝裂霉素分子结构图 Molecular structure of mitomycin |
本文详细研究了量子点的最佳反应条件,发展了基于CdSe/ZnS量子点的荧光性质检测生物液中丝裂霉素的新方法,量子点的荧光强度与丝裂霉素的浓度呈良好的线性关系。在最佳实验条件下,CdSe/ZnS量子点与丝裂霉素相互作用,量子点的荧光强度随丝裂霉素浓度增加发生猝灭现象。猝灭机制为光诱导电子转移导致量子点荧光猝灭。这种检测方法操作简单、灵敏度高,对实际样品的分析具有良好的适用性。
| [1] | Lan G Y, Lin Y W, Huang Y F, Chang H T. Photo-assisted synthesis of highly fluorescence ZnSe (S) quantum dots in aqueous solution[J]. Journal of Materials Chemistry, 2007, 17(25):2661-2666. |
| [2] | Ji X, Zheng J, Rastogi V K, Cheng T C, DeFrank J J, Leblanc RM. (CdSe) ZnS quantum dots and organohosphorus hydrolase bioconjugate as biosensors for detection of paraoxon[J]. Journal of Physical Chemistry B, 2005, 109(9):3793-3799. |
| [3] | Bennett D,BlachmanM, Eisele F, Paul J, Sharpe K. Semiconductor nanocrystals as fluorescent biological labels[J]. Science, 1998, 281(5385): 2013-2016. |
| [4] | Jaiswal J K, Hedi M, Matthew M J, Simon S M. Long-term multiple color imaging of live cells using quantum dot bioconjugates[J]. Nature Biotechnology, 2003, 21(21): 47-51. |
| [5] | Goldman E R, Clapp A R, Anderson G P, Uyeda H T, Mauro J M, Medintz I L, Mattoussi H. Multiplexed toxin analysis using four colors of quantum dot fluororeagents[J]. Analytical Chemistry, 2004, 76(3):684-688. |
| [6] | He Y, Wang H F, Yan X P. Exploring Mn-doped ZnS quantum dots for the room-temperature phosphorescence detection of enoxacin in biological fluids[J]. Analytical Chemistry, 2008, 80(10):3832-3837. |
| [7] | Ding L, Zhou P J, Zhan H G, Zhao X H, Chen C, He Z Y. Systematic investigation of the toxicity interaction of ZnSe/ZnS QDs on BSA by spectroscopic and microcalorimetry techniques[J]. Chemosphere, 2013, 92(8): 892-897. |
| [8] | 焦勇,李荣霞,安文汀,李世琴,赵俊红.CdTe量子点与蛋白质相互作用的荧光猝灭效应[J].影像科学与光化学, 2014, 32(2): 181-190. Jiao Y, Li R X, An W D, Li S Q, Zhao J H. Fluorescence quenching effect of interactions between CdTe quantum dots and proteins[J]. Imaging Science and Photochemistry, 2014,32(2): 181-190. |
| [9] | Wang L L, Song J, Liu S P, Hao C X, Kuang N X, He Y Q. Reaction analysis on Yb3+and DNA based on quantum dots: the design of a fluorescence reversible off-on mode[J]. Journal of Colloid and Interface Science, 2015, 457:162-168. |
| [10] | Wang L L, Song J, Liang W J, Li Dan, Yang J D, He Y Q. Detection of DNA utilizing a fluorescent reversible change of a biosensor based on the electron transfer from quantum dots to polymyxin B sulfate[J]. Journal of Colloid and Interface Science, 2015, 448:257-264. |
| [11] | Zhang C Y, Yeh H C, Kuroki M T, Wang T H. Single quantum dot based DNA nanosensor[J]. Nature Material, 2005, 4(11):326-311. |
| [12] | Vestermark V, Havsteen H, Kamby C. Lack of effect from mitomycin c plus 5-fluorouracil in platin-resistant ovarian cancer: a phase Ⅱ study[J]. International Journal of Gynecological Cancer, 1995, 5(5):386-389. |
| [13] | 全红,胡晓玲,张琴,丁红,郭存刚.紫外分光光度法测丝裂霉素C微球的含量[J].山西医科大学学报, 2002, 2(33): 36-37. Quan H, Hu X L, Zhang Q, Ding H, Guo C G. Ultraviolet spectrophotometry measured the content of mitomycin c microspheres[J].Journal Shanxi Medical University, 2002, 2(33):36-37. |
| [14] | Hartigh J D, Vanoort W J. HPLC determination of the antitumor agent mitomycin c in hunman blood plasma[J]. Analytical ChimicaActa, 1981,127(1):47-53. |
| [15] | 张兰,何聿,陈毅挺,童萍,陈国南.毛细管电泳-安培检测法用于7-甲基鸟苷与丝裂霉素C分离监测的研究[J].色谱,2005, 23(2):138-141. Zhang L, He Y, Chen Y T, Tong P, Chen G N. Study on the simultaneous determination of 7-methylguano-sine and mitomycin c by capillary electrophoresis with amperometric detection[J]. Chinese J Chromatogr, 2005, 23(2):138-141. |
| [16] | 孙言才,屈建,刘健,杨志伟,许戈良,徐荣楠. HPLC法测定原位肝脏隔离灌注猪血浆中丝裂霉素的浓度[J].安徽医药, 2002, 6(1): 8-9. Sun Y C, Qu J, Liu J, Yang Z W, Xu G L, Xu R N. Quantitation of plasma mitomycine C content by high-performance liquid chromatography on isolated liver perfusion in vivo in pigs[J]. Anhui Medical and Pharmaceutical Journal, 2002, 6(1): 8-9. |
| [17] | Burda C, Green T C, Link S, EI-Sayed M A. Eectron shutting across the interface of CdSe nanoparticles monitored by femtosecond laser spectroscopy[J]. Journal of Physical Chemistry B, 1999, 103(11): 1783-1788. |
| [18] | Ramakrishna G, Singh A K, Palit D K, Ghosh H N. Dynamics of interfacial electron transfer from photoexcitedquinizarin(Qz) into the conduction band of TiO2 and surface states of ZrO2 nanoparticles[J]. Journal of Physical Chemistry B, 2004, 108(15): 4775-4783. |
| [19] | Kaledin A L, Lian T Q, Hill C L, Musaev D G. A hybrid quantum mechanical approach: intimate details of electron transfer between type-ⅠCdSe/ZnS quantum dots and an anthraquinone molecule[J].Journal of Physical Chemistry B, 2015, 119(24): 7651-7658. |
| [20] | 王杏乔,王丛笑,王清民,于连香,曹锡章,闵春宗,王立平.光诱导下卟啉蒽醌分子内电子转移过程的研究(Ⅰ)--荧光法[J].高等化学学报, 1997, (6): 834-839. Wang X Q, Wang C X, Wang Q M, Yu L X, Cao X Z, Min C Z, Wang L P. A study of intramolecular electron transfer process of porphyrin-anthraquinone under photoinduction (Ⅰ)-fluorescence method[J]. Chemical Journal of Chinese Universities, 1997,(6): 834-839. |
| [21] | 李萍萍, 殷鹏飞, 龚会平, 刘正清, 王晓丹, 何佑秋. CdTe/CdS量子点与丝裂霉素的相互作用及其应用[J].应用化学, 2012, 29(6): 705-710. Li P P, Yin P F, Gong H P, Liu Z Q, Wang X D, He Y Q. A study on the interactions between CdTe/CdS quantum dots with mitomycin C and its analytical application[J]. Chinese Journal of Applied Chemistry, 2012, 29(6): 705-710. |
| [22] | 闫曙光, 刘绍璞, 何佑秋. CdTe/ZnS量子点荧光可逆调控研究ctDNA与吡揉比星的相互作用[J]. 科学通报, 2011, 56(22): 1804-1811. Yan S G, Liu S P, He Y Q. Reversible control of fluorescence on CdTe/ZnS quantum dots using the interaction between pirarubicin and ctDNA[J]. Chinese Science Bulletin, 2011, 56(22): 1804-1811. |




