2. 北京化工大学 常州先进材料研究院, 江苏 常州 213000 ;
3. 常州强力光电材料有限公司, 常州 213000
2. Changzhou Institute of Advanced Materials Research, Beijing University of Chemical Technology, Changzhou 213000, Jiangsu, P. R. China ;
3. Changzhou Tronly Photoelectric Materials Co., Ltd., Changzhou 213000, Jiangsu, P. R. China
光固化是指在紫外或可见光的作用下,光敏基团吸收能量产生活性物种,使液态低聚物或单体产生交联形成固态产物的过程,在日常环境下即可固化,整个过程只需几秒就可完成,具有固化速度快、低温可操作的特点,对于那些要求低温操作的加工过程,具有很好的适用性。在过去的三十多年里,光固化吸引了众多科研者的兴趣[1-5]。20世纪60年代,德国拜耳公司成功开发出光固化木器涂料,使这个新领域得到了快速的发展[6]。目前,光固化技术主要应用在涂料、印刷油墨、胶黏剂、光刻胶、微电子、隐形眼镜、生物材料以及齿科修复材料等方面[7-12]。
光固化体系主要由光引发剂、低聚物和活性稀释剂组成。光引发剂吸收特定波长的光后产生引发体系聚合的活性物种,占整个组分的1%~5%,含量虽少,却对光固化速率及整个配方体系的经济效益有着显著的影响。低聚物指含有光固化反应基团的感光性树脂,占整个体系的30%~60%[13]。活性稀释剂通常是含有可参与交联固化反应的官能团, 因而习惯上也称为单体,占整个体系的40%~60%。调节树脂粘度是活性稀释剂的基础作用,此外,它还具有以下作用[14]:(1)它同光引发剂一起影响着光固化配方的固化速度;(2)它对体系中不同聚合度的预聚物分子具有桥梁的作用,将不同分子量的预聚物连在一起。不同官能度的单体对体系固化速度有显著影响,双官能度或多官能度活性稀释剂可形成交联网络结构;(3)它可以改善固化后涂膜的机械性能。根据光固化反应机理,按照光解产生活性物种的不同,可以将光固化分为自由基光固化、阳离子光固化和阴离子光固化。自由基光固化具有速率快、单体和引发剂种类多的特点,但存在氧气阻聚、固化体积收缩大的缺陷;阳离子光固化具有活性种存活时间长、体积收缩小、不受氧阻聚影响的特点,但是受反应过程中外界湿气的影响[15-19]。
不同于自由基光固化,阳离子光固化可用的活性稀释剂种类远没有自由基光固化所用的活性稀释剂种类丰富。本文就阳离子光固化活性稀释剂的研究进行阐述。
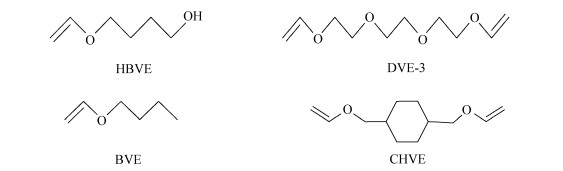
1 乙(丙)烯基醚类活性稀释剂乙烯基醚类化合物是一种高稀释效果的活性稀释剂,能显著降低体系的粘度,同时毒性和气味均较低[20, 21],但其价格较贵。目前,用于辐射固化的乙烯基醚单体主要有羟丁基乙烯基醚(HBVE)、三乙二醇二乙烯基醚(DVE-3)、1, 4-环己基二甲醇二乙烯基醚(CHVE)、丁基乙烯基醚(BVE)等,其结构式如图 1。
|
图 1 乙烯基醚单体的结构式 Fig.1 The structure of vinyl ether monomers |
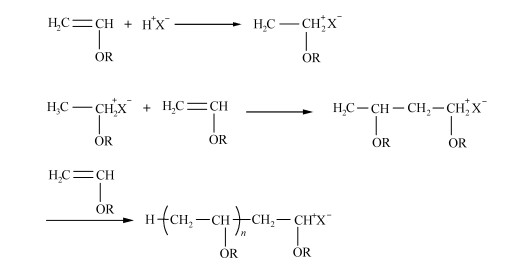
从结构上来说,乙烯基醚具有特殊的结构,分子中氧原子和双键相邻,氧原子的孤对电子可以与碳碳双键产生共轭作用,从而使双键的电子云密度增大,因此乙烯基醚的碳碳双键是富电子双键,亲核性显著增强[22]。在适当的条件下可进行多种类型的反应且反应活性高,也可按不同的机理进行反应,如能进行自由基聚合、阳离子聚合、电荷转移复合物交替共聚,因此,乙烯基醚类化合物可在多种光固化体系中应用。1-丙烯基醚单体与乙烯基醚类似,从结构上来说,1-丙烯基醚比乙烯基醚β碳上多一个甲基,增加了双键的电子云密度,提高了双键的活性,此外,这类单体的制备方法简单,可以用烯丙基异构化的方法制得[23]。以乙烯基醚为例,这类单体的阳离子引发机理如图 2[24]。
|
图 2 乙烯基醚类化合物的阳离子聚合机理 Fig.2 The mechanism of cationic polymerization of vinyl ether |
Fang等人[19, 25]合成了含硅的乙烯基醚和烯丙基醚杂化单体,这种单体不仅在可见光下具有稳定性,而且具有低粘度、低表面能(小于15 mJ·m-2)、良好的热稳定性和光固化特点,适合于纳米印刷和光刻胶方面的应用,其合成过程如图 3。

|
图 3 含硅乙烯基醚单体的合成 Fig.3 The synthesis of silicon-containing vinyl ethers monomer |
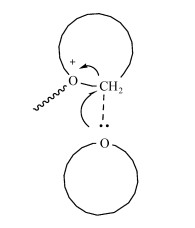
一般来说,用于阳离子光固化反应的杂环单体,其反应活性主要由3个因素决定[26, 27]:(1)杂原子的本性,如它的亲核性和与它相连的邻近碳原子的键力常数;(2)环张力;(3)空间位阻。基于以上因素,两类环醚类化合物在阳离子光固化方面得到了广泛的研究:环氧乙烷类化合物和氧杂环丁烷类化合物。环氧乙烷和氧杂环丁烷的环张力分别为27.3 kcl/mol和25.5 kcl/mol,它们的pKb值分别为7.4和3.1[28-30],尽管这两种环醚化合物具有相似的的空间位阻和环张力,但它们的碱性有明显的差别,后者的碱性明显强于前者,也意味着亲核性更强,因此有更高的反应活性,如图 4[31]。
|
图 4 亲核性反应示意图 Fig.4 Schematic illustration of nucleophilic reaction |
环氧乙烷类活性稀释剂主要分为脂肪族环氧乙烷类和脂环族环氧乙烷类,下面针对这两种活性稀释剂做逐一介绍。
2.1.1 脂肪族环氧乙烷脂肪族环氧乙烷广泛的应用在阳离子光固化体系中,其原料丰富易得,合成方法简单。双酚A环氧树脂是阳离子光固化体系中使用最多的一类树脂,其固化后可得到整体性能优异的涂层,具有广泛的应用价值。但双酚A环氧树脂在应用方面存在一个主要的问题,那就是粘度高、施工不便,对此,黄笔武等人[32, 33]以缩水甘油醚为基本骨架合成了可用于阳离子光固化配方的活性稀释剂--叔丁基酚缩水甘油醚和正丁基缩水甘油醚活性稀释剂,调节配方中活性稀释剂的百分含量,可调节体系粘度达到最佳施工条件。
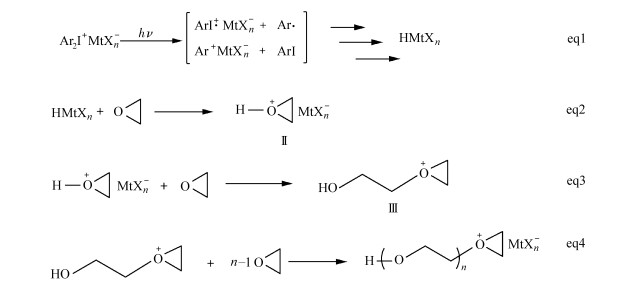
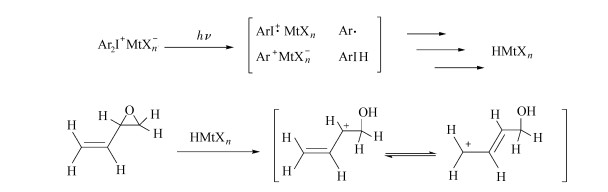
此外,与丙烯酸酯光固化体系相比,脂肪族环氧乙烷固化速率慢,不能满足特定需求的应用,这是由其聚合机理所决定的。有学者用光学高温仪(OP)[34]研究这类单体聚合时的热性能变化并从活化能的角度分析[35],提出了这类单体的阳离子开环聚合机理[36, 37],聚合过程如图 5。首先,阳离子光引发剂光解(eq1)产生超强质子酸,随后是3个暗反应步骤--质子化步骤(eq2)和阳离子开环聚合(eq3和eq4),对脂肪族环氧乙烷类的阳离子单体来说,发生阳离子光固化时具有明显的诱导期,而诱导期的形成是因为所形成的中间体--二级氧鎓盐的稳定性高,使其存活寿命相对比较长[38],因此,这类环氧乙烷类单体的阳离子光固化速率控制步骤并不是引发剂的光解步骤(eq1),而是取决于(eq2)和(eq3)。
|
图 5 环氧乙烷类阳离子光固化单体的四步聚合机理 Fig.5 Four-step mechanism for the photoinitiated cationic ring-opening polymerization of ethylene oxide |
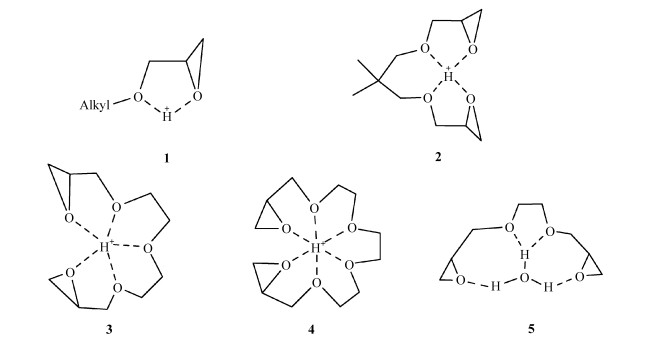
在恒定不变的外界条件下,中间体即二级氧鎓盐可长时间存在,进而降低了聚合速率,不能满足快速光固化的要求。研究发现[39]这种中间体以氢键的作用和质子酸相连接,所以引发剂产生超强质子酸后,只要给予体系微量的热,便可以打破这种以氢键作用相连的平衡而发生快速聚合[40]。此外,中间体与质子酸以氢键连接时,不同的结构也呈现出不同的稳定性,如单官能团的烷基环氧丙醚中间体不稳定,不能长时间存在,诱导期短;多官能团的烷基环氧丙醚形成的中间体稳定,可长时间存在,在一定时间内存在的中间体较多,反应中间体浓度高,一旦给予微量的热作用,便能迅速发生反应[35],不同官能团烷基环氧丙醚的中间体结构式如图 6中1~4所示。此外,这种中间体的结构也解释了水对阳离子光固化的影响,因为水合的质子酸如H3O+或H5O2+也可参与中间体的形成,影响聚合速度[41],如图 6中5所示。
|
图 6 不同烷基环氧丙醚的中间体结构式 Fig.6 The intermediate structures for different alkyl glycidylethers |
相对与脂肪族环氧乙烷单体,脂环族环氧乙烷单体的聚合速率快,无明显的诱导期。这与其聚合机理有关,脂环族环氧乙烷单体与脂肪族环氧乙烷单体有相同的聚合机理,不同的是脂环族环氧单体所形成的中间体(二级氧鎓盐(Ⅱ)和三级氧鎓盐(Ⅲ))受环张力、空间相互作用和电荷分散能力的影响,具有高度的不稳定性和活泼性,因此,这类单体的速率控制步骤通常是引发剂光解产生超强质子酸步骤(eq1)[42]。因其聚合后具有优异的附着力、良好的耐化学性和机械性能[43],设计并合成新型脂环族环氧乙烷类单体、使其有更高的聚合速率,具有很大的应用前景。
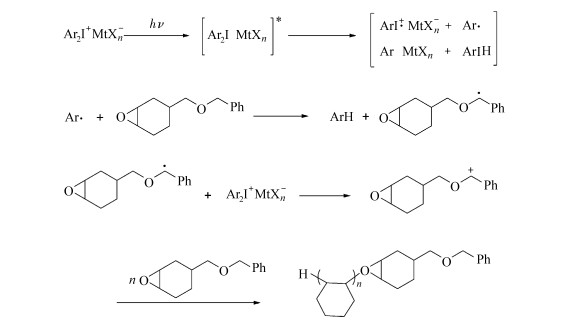
Crivello等[44, 45]设计并合成了一系列含有烯丙基醚、苄基醚、丙烯基醚和炔丙基醚的脂环族环氧化合物,结构式如图 7所示。这类单体有较高的聚合速率,是因为这些单体除进行一般的阳离子聚合外,单体中含具有活泼氢的结构单元,可以和光解产生的自由基发生反应,再进一步和碘鎓盐发生氧化还原反应,生成稳定的碳正离子引发环氧乙烷的阳离子开环聚合。以苄基醚取代的脂环族环氧乙烷为例,其机理如图 8。

|
图 7 新型脂环族环氧乙烷单体结构式 Fig.7 The monomer structures of new cycloaliphatic epoxides |
|
图 8 新型脂环族环氧乙烷单体的阳离子开环聚合机理 Fig.8 Photoinitiated cationic ring-opening polymerization of new cycloaliphatic epoxides |
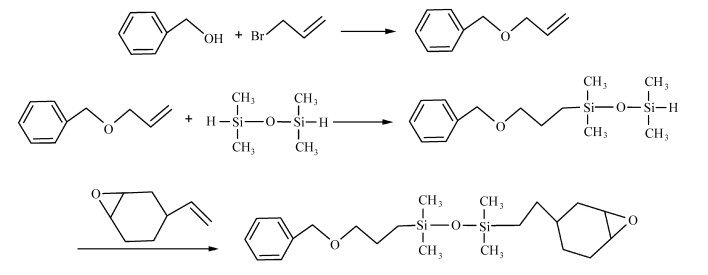
Ortiz等人[46]通过氢硅化反应合成了含硅的脂环族环氧乙烷活性单体,并在这种活性单体中引入了苄基醚,实时红外(FTIR)动力学研究表明,这类单体具有较不含苄基醚的单体更高的聚合活性,且在苯环中引入给电子基团如甲氧基时,聚合活性提高,这是由其聚合机理所决定的,甲氧基作为给电子基团,对反应形成的中间体苄基碳正离子具有稳定性,因此有利于提高聚合速率。其合成过程如图 9。
|
图 9 含硅环氧乙烷单体的合成过程 Fig.9 The synthesis of silicone-epoxy monomers |
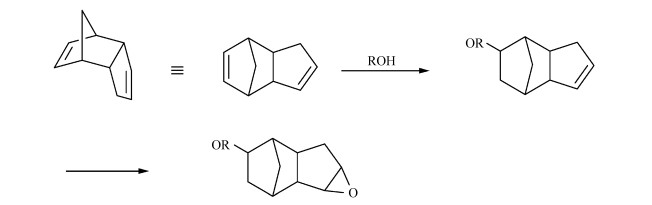
以二环戊二烯为骨架合成的阳离子光固化脂环族环氧单体具有潜在的应用价值,如,光固化防护涂层、装饰涂层、印刷油墨和胶黏剂等[47]。二环戊二烯中两个双键具有不同的反应活性,降冰片烯双键的活性显著大于环戊烯双键,因此,和醇类发生加成反应时,优先和反应活性大的降冰片烯双键发生加成反应[48]。正是基于这种选择性反应的特点,Rajaraman等设计和合成了基于二环戊二烯的一系列不同的环氧乙烷类化合物用于阳离子光固化,考虑到单体中刚性基团的存在,因此聚合后材料的机械性能和玻璃化温度也会提升。其合成原理如图 10[49]。
|
图 10 二环戊二烯环氧乙烷的合成过程 Fig.10 The synthesis of dicyclopentadiene oxide |
氧杂环丁烷是一类四元环醚的化合物,包括单官能团氧杂环丁烷、双官能团氧杂环丁烷以及改性氧杂环丁烷,相对于三元环,其环张力更小,因此更稳定、不易开环。但研究证明[50],这类化合物仍具有光敏性,可以进行阳离子开环聚合,且这类化合物粘度低、固化后膜的附着力高、固化收缩率小、固化速率快、毒性低、不易挥发[51, 52]。因此,这类单体具有一些特殊的应用,如光固化喷墨印刷涂料、胶黏剂、压敏胶和立体光刻等方面[53]。此外,氧杂环丁烷的合成过程较简单,毒性也较低[54],以3-乙基-3-羟甲基氧杂环丁烷(EHMO)、3-乙基-3-苯氧基甲基氧杂环丁烷(POX)、3,3-(氧基双亚甲基)-双-(3-乙基)氧杂环丁烷(DOX)和1, 4-双[(3-乙基-3-氧亚甲基氧杂环丁)甲基]苯(XDO)的合成为例,常见的合成方法包括以下3种[55, 56],如图 11。
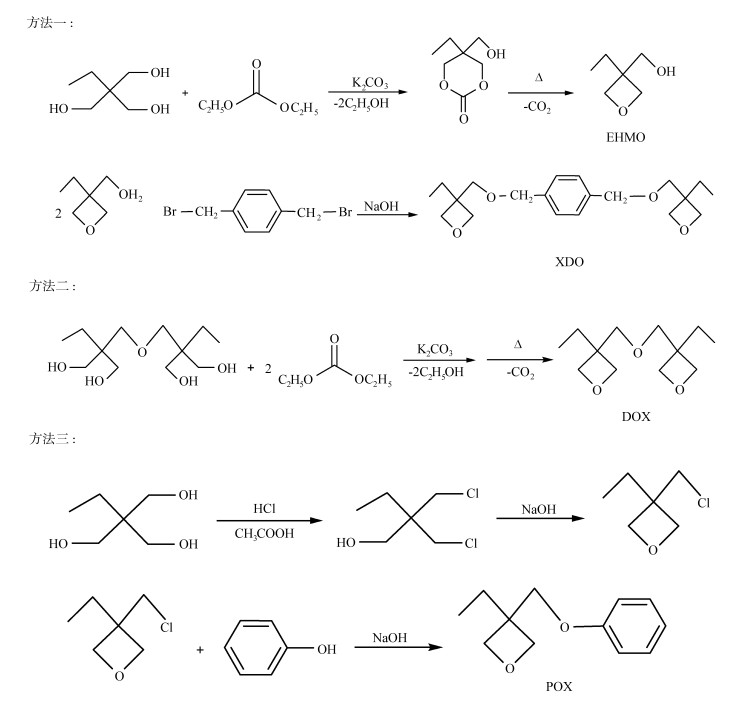
|
图 11 不同氧杂环丁烷的合成 Fig.11 The synthesis of different soxetanes |
虽然氧杂环丁烷类单体有众多优势,但其阳离子光固化速率不能达到一定要求从而限制了它的使用范围,从机理来分析,氧杂环丁烷单体同环氧乙烷单体有类似的引发机理(如图 12):首先阳离子光引发剂的光解(eq1)产生超强质子酸,随后是3个暗反应步骤:质子化步骤(eq2)和阳离子开环聚合(eq3和eq4)。形成的三级氧鎓(Ⅲ)盐具有较高稳定性,因此其明显的诱导期是整个反应的速率控制步骤[57]。
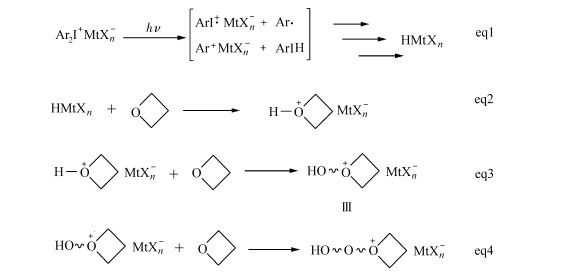
|
图 12 氧杂环丁烷的阳离子开环聚合机理[53] Fig.12 Photoinitiated cationic ring-opening polymerization of oxetanes |
诱导期的存在是影响氧杂环丁烷聚合速率低的本质原因,因此如何降低这类单体的诱导期具有重要的意义。根据聚合机理,可以从3个方面降低这类单体的诱导期[58, 59]:(1)在比较高的温度下引发光固化,借助外界作用破坏其平衡态;(2)与活泼单体共聚,如环氧乙烷或乙烯基醚类化合物,这类活泼单体可以优先聚合而释放出热量促进氧杂环丁烷单体的聚合;(3)使用自由基引发剂作为增效剂。以自由基引发剂651为例,降低这类单体诱导期主要来自于两方面:首先,651光解产生苯甲酰自由基和烷氧基自由基,苯甲酰自由基可作为还原剂和鎓盐自由基发生氧化还原反应产生碳正离子,同时可起到对鎓盐增感的作用;其次,形成的碳正离子和鎓盐光解产生的超强质子酸具有相同的效果,可引发氧杂环丁烷开环类化合物聚合。其机理如图 13。
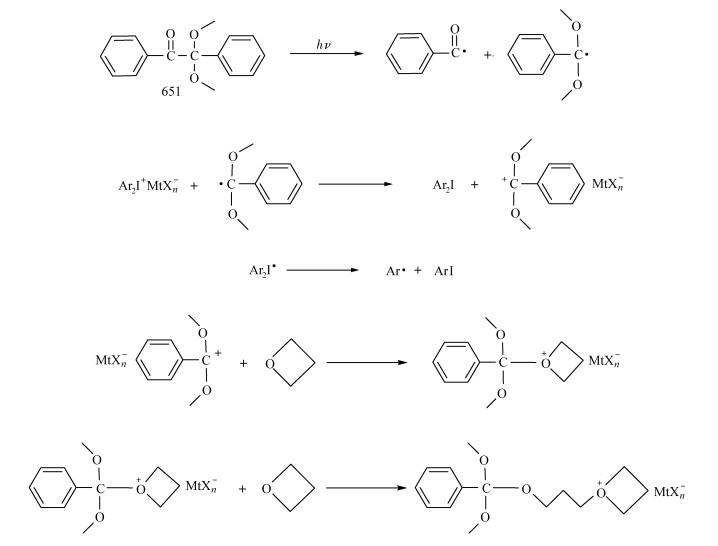
|
图 13 自由基光引发剂651作为增效剂的引发机理 Fig.13 The mechanism for free radical photoinitiator(651) as photosensitize |
最近几年,Crivello等[60, 61]设计出许多能显著降低氧杂环丁烷诱导期的化合物。将这些化合物与氧杂环丁烷共聚能显著提高氧杂环丁烷单体的聚合速率。这些化合物大致可以分为3类:(1)氧化环己烯类化合物,主要包括氧化环己烯及它的不同取代物、不同氧化程度的柠檬烯及它的不同取代物;(2)不同取代的环氧乙烷类化合物,如不同程度的烷基取代和苯基取代;(3)乙烯基环氧乙烷类化合物。这些化合物能有效降低氧杂环丁烷类化合物的诱导期,主要是由其聚合机理所决定的,以3, 4-环氧-1-丁烯(EB)为例,其机理如图 14。在质子酸的作用下EB可形成稳定的碳正离子,增加了体系中活性物种的占有率,由于共振效应和空间位阻的影响,结构不同的化合物对诱导期的效应不尽相同,它们可以急剧降低甚至是消除氧杂环丁烷的诱导期,因此具有广阔的应用前景。这种效应称为“kick-starting”,这类环氧乙烷试剂称为“kick-starting”试剂[54]。
|
图 14 EB作为“kick-starting”试剂的作用机理 Fig.14 The mechanism of "kick-starting" for EB |
体积收缩是光固化中普遍存在的问题,体积收缩主要是因为分子间的作用力由聚合前的范德华力变为共价键的形式,聚合前后原子间排列的紧密程度发生变化[62];体积收缩导致的内应力收缩可能会造成材料的一些缺陷,如微缝隙或微孔[63],这种缺陷限制了光固化在一些精确成型方面的应用,如光盘、光纤、透镜、印刷电路板[64]。在这种需求的推动下,发展低收缩率的光固化单体得到了广泛的关注。Verstegen等人[65]以双酚A为骨架合成了一系列热稳定性的氧杂环丁烷双官能度单体,其聚合后体积收缩 < 3%,远小于相同分子重量的二甲基丙烯酸单体(根据丙烯酸单体的不同,体积收缩可达6%~25%),此类化合物在精密光学部件方面具有潜在的应用价值,这些单体的结构式如图 15。
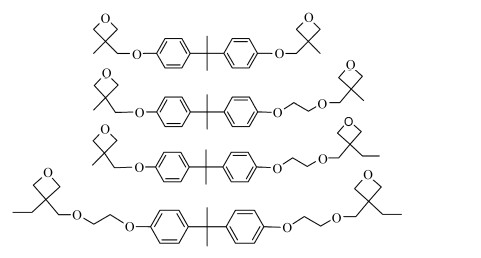
|
图 15 双酚A为骨架的氧杂环丁烷双官能度单体的结构式 Fig.15 The structure of dioxetane monomers derived from Bisphenol A |
含硅原子单体经聚合后可以赋予材料以良好的性能,如良好的热稳定性和光稳定性[66],用于木器和塑料涂层可提升抗刮伤和耐磨性,其低的表面能可用于纸张和金属涂层等,因此设计合成含硅原子的环氧类单体可用于阳离子光固化, 具有重要意义。Crivello等人[67]通过氢硅化反应设计并合成了可用于阳离子光固化的单体,通过凝胶时间和实时红外分析结果表明,此类单体在没有硅的情况下,其反应活性较同等结构的环氧乙烷高;而含硅单体较不含硅单体相比,反应活性并没有提升。以氧杂环丁烷的氢硅化反应为例,其合成过程如图 16。
Sangermano等人[68]合成了氟化的氧杂环丁烷(FOX),将其作为氧杂环丁烷单体(DOX)的共聚物用于阳离子光固化,由于氟原子的存在,玻璃化转变温度和稳定性降低,氧杂环丁烷的最终转化率也提高。此外,选择性的增加氟化单体的量,可以得到完全的疏水表面,其结构式如图 17。

|
图 16 氢硅化反应过程 Fig.16 The process of hydrosilation reaction |
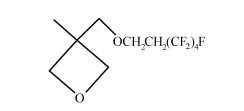
|
图 17 氟化氧杂环丁烷单体的结构式 Fig.17 The structure of fluorinated oxetane monomer |
目前,阳离子光固化研究还处于起步阶段,用于阳离子光固化的活性稀释剂种类还比较少,广泛使用的主要是环氧乙烷类和氧杂环丁烷类,其中氧杂环丁烷是近年来阳离子光固化活性稀释剂的研究热点。但两者存在一个共同的问题就是固化速率慢,本文就阳离子活性单体固化速率慢的问题进行了详细的分析并提出了一些解决方案。
近年来,光固化混杂体系的研究成为一个研究热点,通过调节合适的配比,混杂体系可同时兼具自由基和阳离子光固化的优点,满足一些特殊的应用,但目前混杂体系多是单独的自由基和阳离子配方的混合,而并没有一类活性单体能同时进行自由基和阳离子光聚合,因此开发一类新型活性稀释剂可同时进行自由基光聚合和阳离子光聚合,使得固化前后产物性能满足实际应用,将是今后的研究方向。
致谢 本研究感谢江苏省自然科学基金青年基金(BK20150272)的资助。| [1] | Sang S L, Luciani A, Månson J A E. A rheological characterisation technique for fast UV-curable systems[J]. Progress in Organic Coatings, 2000, 38 (3-4) :193–197. DOI:10.1016/S0300-9440(00)00088-6 |
| [2] | Wuertz C, Bismarck A, Springer J, K niger, R. Electrokinetic and mechanical characterization of UV induced crosslinked acrylic copolymers[J]. Progress in Organic Coatings, 1999, 37 (3) :117–129. |
| [3] | Fertier L, Koleilat H, Stemmelen M, Giani O. The use of renewable feedstock in UV-curable materials-A new age for polymers and green chemistry[J]. Progress in Polymer Science, 2013, 38 (6) :932–962. DOI:10.1016/j.progpolymsci.2012.12.002 |
| [4] | Zhang W, Dong H N, Zhang T, Guo J B, Wei J. The effect of monomer structures on photopolymerization kinetics and volume shrinkage behavior for plasma display panel barrier rib[J]. Journal of Applied Polymer Science, 2012, 125 (1) :77–87. DOI:10.1002/app.v125.1 |
| [5] |
聂俊.
光聚合技术与应用[M]. 北京: 化学工业出版社, 2009 : 1 -6.
Nie J. Photopolymerization Technology and Application[M]. Beijing: Chemical Industry Press, 2009 : 1 -6. |
| [6] |
陈用烈, 曾兆华, 杨建文.
辐射固化材料及其应用[M]. 北京: 化学工业出版社, 2003 : 22 -29.
Chen Y L, Zeng Z H, Yang J W. Application of UV-curingMaterial[M]. Beijing: Chemical Industry Press, 2003 : 22 -29. |
| [7] | Balta D K, Arsu N, Yagci Y, Jockusch S, Turro N J. Thioxanthone-anthracene:a new photoinitiator for free radical polymerization in the presence of oxygen[J]. Macromolecules, 2007, 40 (12) :4138–4141. DOI:10.1021/ma0628735 |
| [8] | Kloosterboer J G. Network Formation by Chain Crosslinking Photopolymerization and Its Applications in Electronics[M]. Springer Berlin Heidelberg: 1988 : 27 -35. |
| [9] | Urabe H, Wakasa K, Yamaki M. Application of multifunctional base monomer to dental composite resins[J]. Journal of Materials Science Materials in Medicine, 1990, 1 (3) :163–170. DOI:10.1007/BF00700877 |
| [10] | Anseth K S, Newman S M, Bowman C N. Polymeric dental composites:properties and reaction behavior of multimethacrylate dental restorations[J]. Biopolymers, 2006, 122 (1) :177–217. |
| [11] | Kristi S, Anseth, Deborah J. Polymerizations of multifunctional anhydride monomers to form highly crosslinked degradable networks[J]. Macromolecular Rapid Communications, 2001, 22 (8) :564–572. DOI:10.1002/1521-3927(20010501)22:8<564::AID-MARC564>3.0.CO;2-S |
| [12] |
徐钦昌. 3-乙基-3-羟甲基氧杂环丁烷作为活性单体的紫外光固化材料研究[D].南昌:南昌大学, 2014.
Xu Q C. Study on 3-ethyl-3-hydroxymethyl oxetane as the reactive monomer for UV-curing materials[D]. Nanchang:Nanchang University, 2014. http://cdmd.cnki.com.cn/article/cdmd-10403-1014055110.htm |
| [13] |
肖思煜. 紫外光固化涂料的发展状况[J]. 广州化工, 2005, 33 (5) :31–33.
Xiao S Y. Progress of ultraviolet curing coatings[J]. Guangzhou Chemical Industry, 2005, 33 (5) :31–33. |
| [14] |
刘岚, 陈用烈. 一种新型的光固化活性稀释剂--乙烯基醚[J]. 高分子通报, 1997 (4) :242–245.
Liu L, Chen Y L. Viny ether-a new type of reactive diluents for photocuring[J]. Polymer Bulletin, 1997 (4) :242–245. |
| [15] | Ortyl J, Popielarz R. New photoinitiators for cationic polymerization[J]. Polimery, 2012, 57 (7-8) :510–517. |
| [16] | Sangermano M, Malucelli G, Priola A, Manea M. Synthesis and characterization of acrylate-oxetane interpenetrating polymer networks through a thermal-UV dual cure process[J]. Progress in Organic Coatings, 2006, 55 (3) :225–230. DOI:10.1016/j.porgcoat.2005.11.005 |
| [17] | Sangermano M, Malucelli G, Bongiovanni R, Priola A. Photopolymerization of oxetane based systems[J]. European Polymer Journal, 2004, 40 (2) :353–358. DOI:10.1016/j.eurpolymj.2003.09.026 |
| [18] |
杨娟, 成佳辉, 任冬燕. UV固化涂料研究进展[J]. 广州化工, 2011, 39 (24) :7–8.
Yang J, Cheng J H, Ren D Y. The research development of UV curing coating[J]. Guangzhou Chemical Industry, 2011, 39 (24) :7–8. |
| [19] | Fang Y, Zou Y. Synthesis and photo-curing behaviors of silicon-containing (vinyl ether)-(allyl ether) hybrid monomers[J]. Polymer International, 2013, 62 (11) :1624–1633. |
| [20] | Sangermano M, Malucelli G, Morel F, Decker C, Priola A. Cationic photopolymerization of vinyl ether systems:influence of the presence of hydrogen donor additives[J]. European Polymer Journal, 1999, 35 (4) :639–645. DOI:10.1016/S0014-3057(98)00168-2 |
| [21] | Sangermano M, Spera S, Bongiovanni R, Priola A, Busetto C. NMR investigation of UV-cured vinyl ether networks[J]. Macromolecular Chemistry & Physics, 2000, 201 (17) :2441–2446. |
| [22] | Sugihara S, Kawamoto Y, Maeda Y. Direct radical polymerization of vinyl ethers:reversible addition-fragmentation chain transfer polymerization of hydroxy-functional vinyl ethers[J]. Macromolecules, 2016, 49 :1563–1574. DOI:10.1021/acs.macromol.6b00145 |
| [23] | Crivello J V, L hden G. The preparation of novel 1-propenyl ethers and their cationic photopolymerization[J]. Journal of Polymer Science Part A Polymer Chemistry, 1996, 34 (10) :2051–2062. DOI:10.1002/(ISSN)1099-0518 |
| [24] |
李伟, 庞玉莲, 邹应全.乙烯基醚阳离子光固化单体[C].中国辐射固化会议, 2012. 186-196.
Li W, Pang Y L, Zou Y Q. Cationic photocuring vinyl ether monomers[C]. RadTech China, 2012. 186-196. |
| [25] | Crivello J V, Jo K D. Propenyl ethers. Ⅱ. Study of the photoinitiated cationic polymerization of propenyl ether monomers[J]. Journal of Polymer Science Part A Polymer Chemistry, 1993, 31 (31) :1483–1491. |
| [26] | Sasaki H, Rudizinskt J M, Kakuchi T. Photoinitiated cationic polymerization of oxetane formulated with oxirane[J]. Journal of Polymer Science Part A Polymer Chemistry, 1995, 33 (11) :1807–1816. DOI:10.1002/pola.1995.080331107 |
| [27] | Askadskii A A, Afanas'Ev E S, Petunova M D, Barabanova A I, Goleneva L M, Kondrashchenko V I, Philippova O E. Structures and properties of nanocomposites based on a cured cycloaliphatic epoxy resin[J]. Polymer Science, 2014, 56 (3) :318–329. |
| [28] | Crivello J V, Lam J H W. Diaryliodonium salts, a new class of photoinitiators for cationic polymerization[J]. Macromolecules, 1977, 10 (6) :1307–1315. DOI:10.1021/ma60060a028 |
| [29] | Crivello J V, Lam J H W. Photoinitiated cationic polymerization with triarylsulfonium salts[J]. Journal of Polymer Science Polymer Chemistry Edition, 1996, 34 (16) :3231–3253. DOI:10.1002/(ISSN)1099-0518 |
| [30] | Sasaki H, Crivello J V. The Synthesis, characterization, and photoinitiated cationic polymerizaton of difunctional oxetanes[J]. Journal of Macromolecular Science Part A, 1992, 29 (10) :915–930. DOI:10.1080/10601329208054128 |
| [31] | Verstegen E J K, Kloosterboer J G, Lub J. Synthesis and photopolymerization of oxetanes derived from bisphenol A[J]. Journal of Applied Polymer Science, 2005, 98 (4) :1697–1707. DOI:10.1002/(ISSN)1097-4628 |
| [32] |
熊磊, 邓熙烺, 黄笔武. 对叔丁基酚缩水甘油醚作为稀释剂紫外光固化材料的制备及性能[J]. 南昌大学学报:工科版, 2015 (3) :209–214.
Xiong L, Deng X L, Huang B W. Preparation and properties of the UV-curing material with tert-butyl phenol glycidyl ether as diluent[J]. Journal of Nanchang University (Engineer & Technology Edition), 2015 (3) :209–214. |
| [33] |
黄笔武, 姜安坤, 翁子骧, 杨志宏. 正丁基缩水甘油醚的合成及作为阳离子型UV固化稀释剂的研究[J]. 精细石油化工, 2010, 27 (4) :23–26.
Huang B W, Jiang A K, Weng Z X, Yang Z H. Synthesis and properties of n-butyl glycidyl ether as cationic type UV-curing diluent[J]. Speciality Petrochemicals, 2010, 27 (4) :23–26. |
| [34] | Falk B, Vallinas S M, Crivello J V. Monitoring photopolymerization reactions with optical pyrometry[J]. Journal of Polymer Science Part A Polymer Chemistry, 2003, 41 (4) :579–596. DOI:10.1002/pola.v41:4 |
| [35] | Crivello J V. Design and synthesis of multifunctional glycidyl ethers that undergo frontal polymerization[J]. Journal of Polymer Science Part A Polymer Chemistry, 2006, 44 (21) :6435–6448. DOI:10.1002/(ISSN)1099-0518 |
| [36] | Crivello J V, Falk B, Zonca M R. Photoinduced cationic ring-opening frontal polymerizations of oxetanes and oxiranes[J]. Journal of Polymer Science Part A Polymer Chemistry, 2004, 42 (7) :1630–1646. DOI:10.1002/(ISSN)1099-0518 |
| [37] | Crivello J V. Synergistic effects in hybrid free radical/cationic photopolymerizations[J]. Journal of Polymer Science Part A Polymer Chemistry, 2007, 45 (45) :3759–3769. |
| [38] | Ryu C Y, Spencer M J, Crivello J V. Involvement of supramolecular complexes in the capture and release of protonic acids during the cationic ring-opening polymerization of epoxides[J]. Macromolecules, 2012, 45 (45) :2233–2241. |
| [39] | Crivello J V, Bulut U. Dual photoand thermally initiated cationic polymerization of epoxy monomers[J]. Journal of Polymer Science Part A Polymer Chemistry, 2006, 44 (44) :6750–6764. |
| [40] | Crivello J V. Cationic photopolymerization of alkyl glycidyl ethers[J]. Journal of Polymer Science Part A Polymer Chemistry, 2006, 44 (44) :3036–3052. |
| [41] | And U B, Crivello J V. Investigation of the reactivity of epoxide monomers in photoinitiated cationic polymerization[J]. Macromolecules, 2005, 38 (9) :3584–3595. DOI:10.1021/ma050106k |
| [42] | Crivello J V. Hybrid free radical/cationic frontal photopolymerizations[J]. Journal of Polymer Science Part A Polymer Chemistry, 2007, 45 (18) :4331–4340. DOI:10.1002/(ISSN)1099-0518 |
| [43] | Crivello J V, Ortiz R A. Design and synthesis of highly reactive photopolymerizable epoxy monomers[J]. Journal of Polymer Science Part A Polymer Chemistry, 2001, 39 (14) :2385–2395. DOI:10.1002/pola.v39:14 |
| [44] | Rajaraman S K, And W A M, Crivello J V. Novel hybrid monomers bearing cycloaliphatic epoxy and 1-propenyl ether groups[J]. Macromolecules, 1999, 32 (1) :36–47. DOI:10.1021/ma981078r |
| [45] | Crivello J V, Ortiz R A. Synthesis of epoxy monomers that undergo synergistic photopolymerization by a radical-induced cationic mechanism[J]. Journal of Polymer Science Part A Polymer Chemistry, 2001, 39 (20) :3578–3592. DOI:10.1002/(ISSN)1099-0518 |
| [46] | Ortiz R A, García G A. Synthesis of novel highly reactive silicone-epoxy monomers for cationic photopolymerizations[J]. Polymer, 2005, 46 (24) :10663–10671. DOI:10.1016/j.polymer.2005.09.049 |
| [47] | And J V C, Song S. Synthesis and cationic photopolymerization of novel monomers based on dicyclopentadiene[J]. Chemistry of Materials, 2000, 12 (12) :3674–3680. DOI:10.1021/cm000556l |
| [48] | Crivello J V, Song S. The synthesis and cationic photopolymerization of monomers based on dicyclopentadiene[J]. Journal of Polymer Science Part A Polymer Chemistry, 1999, 37 (16) :3427–3440. DOI:10.1002/(ISSN)1099-0518 |
| [49] | Rajaraman S K, And W A M, Crivello J V. Novel hybrid monomers bearing cycloaliphatic epoxy and 1-propenyl ether groups[J]. Macromolecules, 1999, 32 (1) :36–47. DOI:10.1021/ma981078r |
| [50] |
谢王付. 3-乙基-3-烯丙基甲氧基氧杂环丁烷的合成及其应用研究[D].南昌:南昌大学, 2015.
Xie W F. Study on the synthesis and application of 3-ethyl-3-allyloxymethyl oxetane[D].Nanchang:Nanchang University, 2015. |
| [51] |
邓冲, 谢王付, 黄笔武, 万时策, 谌伟庆, 徐钦昌, 胡开创.氧杂环丁烷/丙烯酸酯混杂体系的光固化性能研究[D].南昌:南昌大学, 2014.
Deng C, Xie W F, Huang B W, Wan S C, Chen W Q, Xu Q C, Hu K C. Study on the properties of oxetane/acrylate UV-cured hybrid system[D]. Nanchang:Nanchang University, 2014. http://www.cnki.com.cn/article/cjfdtotal-gkgh201403008.htm |
| [52] |
万时策, 黄笔武, 杜志鹏, 雍涛, 韩文娟. 新型阳离子光固化活性单体3, 3'-[1, 4-丁基双(氧基亚甲基)]-双-(3-乙基)氧杂环丁烷的合成[J]. 影像科学与光化学, 2016, 34 (2) :181–189.
Wan S C, Huang B W, Du Z P, Yong T, Han W J. Study on the synthesis of 3, 3、-[1, 4-butanediylbis(oxymethylene)] bis[(3-ethyl)oxetane] for the novel cationic curing monomer[J]. Imaging Science and Photochemistry, 2016, 34 (2) :181–189. |
| [53] | Vong J, Crivello J V, Bulut U. Photoactivated cationic ring-opening frontal polymerizations of oxetanes[J]. Designed Monomers & Polymers, 2005, 8 (6) :517–531. |
| [54] | Crivello J V. Investigations of the reactivity of "kick-started" oxetanes in photoinitiated cationic polymerization[J]. Journal of Polymer Science Part A Polymer Chemistry, 2015, 53 (4) :586–593. DOI:10.1002/pola.v53.4 |
| [55] |
刘安昌, 夏强, 张良, 李高峰. 阳离子光固化活性单体氧杂环丁烷的合成[J]. 武汉工程大学学报, 2010, 32 (9) :14–16.
Liu A C, Xia Q, Zhang L, Li G F. Synthesis of oxetanes for the cationic curing monomer[J]. Journal of Wuhan Institute of Technology, 2010, 32 (9) :14–16. |
| [56] | James V, Crivello J V. "Kick-Starting'" oxetane photopolymerizations[J]. Journal of Polymer Science Part A Polymer Chemistry, 2014, 52 (20) :2934–2946. DOI:10.1002/pola.27329 |
| [57] | Crivello J V. Investigation of the photoactivated frontal polymerization of oxetanes using optical pyrometry[J]. Polymer, 2005, 46 (26) :12109–12117. DOI:10.1016/j.polymer.2005.10.087 |
| [58] | Bulut U, Crivello J V. Reactivity of oxetane monomers in photoinitiated cationic polymerization[J]. Journal of Polymer Science Part A Polymer Chemistry, 2005, 43 (43) :3205–3220. |
| [59] | Crivello J V, Falk B, Zonca M R. Photoinduced cationic ring-opening frontal polymerizations of oxetanes and oxiranes[J]. Journal of Polymer Science Part A Polymer Chemistry, 2004, 42 (7) :1630–1646. DOI:10.1002/(ISSN)1099-0518 |
| [60] | Crivello J V. Vinyl epoxide accelerators for the photoin-itiated cationic polymerization of oxetane monomers[J]. Polymer, 2015, 64 :227–233. DOI:10.1016/j.polymer.2015.01.019 |
| [61] | Crivello J V. Aryl epoxides as accelerators for the photopolymerization of oxetane monomers[J]. Journal of Macromolecular Science Part A, 2015, 52 (5) :336–344. DOI:10.1080/10601325.2015.1018803 |
| [62] |
蹇钰.光聚合收缩的研究[D].北京:北京化工大学, 2013.
Jian Y. Shrinkage of photopolymerization[D]. Beijing:Beijing University of Chemical Technology, 2013. |
| [63] | Nuyken O, B hner R, Erdmann C. Oxetane photopolymerization-a system with low volume shrinkage[J]. Macromolecular Symposia, 1996, 107 (1) :125–138. DOI:10.1002/masy.v107.1 |
| [64] | Kloosterboer J G. Network Formation by Chain Crosslinking Photopolymerization and Its Applications in Electronics[M]. Springer Berlin Heidelberg: 1988 : 45 -61. |
| [65] | Verstegen E J K, Kloosterboer J G, Lub J. Synthesis and photopolymerization of oxetanes derived from bisphenol A[J]. Journal of Applied Polymer Science, 2005, 98 (4) :1697–1707. DOI:10.1002/(ISSN)1097-4628 |
| [66] | Crivello J V, Jang M. Synthesis of novel silicon-containing monomers for photoinitiated cationic polymerization[C]. ACS Symposium Series, 2009:27-36. |
| [67] | Crivello J V, Sasaki H. Synthesis and photopolymerization of silicon-containing multifunctional oxetane monomers[J]. Journal of Macromolecular Science Part A, 1993 (2-3) :173–187. |
| [68] | Sangermano M, Bongiovanni R, Malucelli G, Priola A, Thomas R R, Medsker R E, Kim Y, Kausch C M. Synthesis and cationic photopolymerization of a new fluorinated oxetane monomer[J]. Polymer, 2004, 45 (7) :2133–2139. DOI:10.1016/j.polymer.2004.01.046 |




