光固化技术因具有“5E”特点,即:节能、经济、环保、高效、适应性广,在光固化涂料、光固化油墨、立体光刻、3D打印等领域得到了广泛应用。光引发剂是光固化体系的核心组分,决定了体系的固化速率和固化程度,甚至会影响最终材料的性能。光产碱剂是一类在辐照后能产生碱性物种的光引发剂[1, 2],可催化环氧开环等聚合反应,目前已广泛用于荧光图案[3]、光刻胶[4, 5]、有机/无机杂化材料[6, 7]、导电膜等领域。
光产碱剂的引发效率一直是相关研究者的关注重点。早期的光产碱剂主要包括钴胺络合物[8]、季铵盐[9]、氨基甲酸酯[3]、肟酯[10]、α-氨基酮[11, 12]等。此类光产碱剂在光照后产生的胺基化合物碱性弱,活性较低,需要后烘。近年来报道了含多氮杂环烷类的光产碱剂,碱性活性种有1,8-二氮杂双环[5.4.0]十一-7-烯(DBU)[13]、1,5-二氮杂双环[4.3.0]壬-5-烯(DBN)[14, 15]和1,5,7-三杂氮二环[4.4.0]十一-5-烯(TBD)[16]等,多氮杂环烷碱性显著增强,可有效提高光产碱的引发效率。然而,目前大部分光产碱剂吸收在UV-B及UV-C等短波区域(<320 nm),短波诱导的光固化存在产生臭氧及辐射安全等[17]问题。最近,聂俊等[18]报道了一种高效的长波光产碱体系,该双组分体系以异丙基硫杂蒽酮为长波光敏剂,以四苯基硼酸盐为潜伏型产碱剂。在320~500 nm光源辐照下,该光产碱剂体系能有效引发巯基/环氧/丙烯酸酯的混杂光固化。然而,这种双组分引发体系存在分子间逆电子转移,影响引发活性。此外,其能量转移效率和电子转移效率易受体系粘度的影响。
本文报道了一种新型的单组分光产碱剂(TX-S-TBD,图 1),该光产碱剂以硫杂蒽酮为生色团,强碱TBD为产碱基团,通过不可逆的光致脱羧过程来有效抑制逆电子转移,提高引发活性。利用紫外吸收光谱、荧光发射光谱研究了该类化合物的光物理行为,采用稳态光解及电子自旋共振波谱等系统考察了各光解产物,最后通过实时红外探究了其光固化动力学。
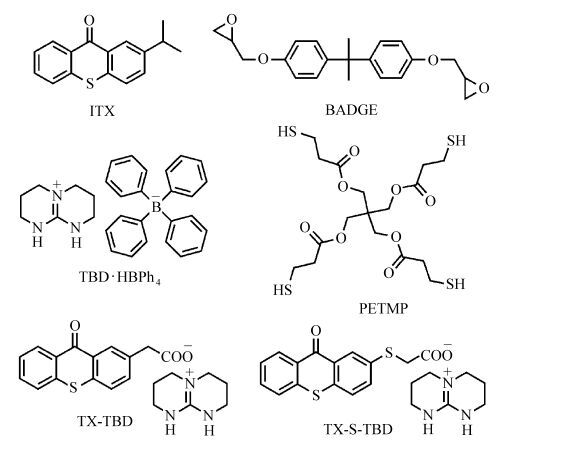
|
图 1 光产碱剂及单体结构式 Fig.1 Structures of the PBG and the monomers |
硫代水杨酸(分析纯,萨恩化学技术有限公司)、苯硫基乙酸(分析纯,梯希爱化成工业有限公司)、1,5,7-三叠氮双环(4,4,0)癸-5-烯(TBD,分析纯,北京百灵威科技有限公司)、N-叔丁基苯硝酮(PBN,分析纯,梯希爱化成工业发展有限公司)、硫酸(分析纯,国药集团化学试剂有限公司)、1,4-二氧六环(分析纯,国药集团化学试剂有限公司)、四(3-巯基丙酸)季戊四醇酯(分析纯,梯希爱化成工业有限公司)、E51环氧树脂(工业级,昆山市南亚电子有限公司)、乙腈(分析纯,国药集团化学试剂有限公司)、无水甲醇(分析纯,国药集团化学试剂有限公司)、无水乙醚(分析纯,国药集团化学试剂有限公司)、苯(分析纯,国药集团化学试剂有限公司)。
1.1.2 实验仪器和设备Nicolet6700型傅立叶变换红外光谱仪,美国赛默飞世尔科技有限公司;AVANCE Ⅲ HD 400 MHz型核磁共振仪,瑞士布鲁克公司;UPLC-TQD型超高效液相色谱串联四级杆质谱联用仪,美国沃特世公司;TU1901型紫外可见分光光度计,日本Lambda公司;CARY Eclipse型荧光分光光度计,美国瓦里安有限公司;EMXplus-10/12型电子自旋共振波谱仪,德国布鲁克科技有限公司;OmniCure S1000 UV/可见光点光源(波段:320~500 nm),加拿大EXFO公司; UV-A型紫外辐照计,北京师范大学光电仪器厂;PHS-25型数显pH计,上海仪电科学仪器股份有限公司。
1.2 合成光产碱剂TX-TBD依照文献方法合成[19],TX-S-TBD的合成路线如图 2所示。合成需在避光条件下进行。
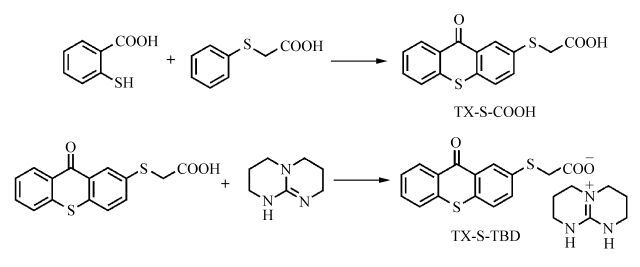
|
图 2 光产碱剂TX-S-TBD的合成路线 Fig.2 Synthetic route of TX-S-TBD |
将0.77 g(5.0 mmol)硫代水杨酸加入35 mL浓硫酸(98%)中,使其充分溶解。分批加入2.52 g(15.0 mmol)苯硫乙酸,30 min加完。室温搅拌3天,反应结束后,将反应液滴于水中,抽滤,滤饼用乙醚洗3次后溶于适量热的二氧六环,取上层清液加水析出沉淀,抽滤干燥得黄色固体粉末0.81 g,产率52.9%。
1HNMR (400 MHz,d-DMSO) :12.79 (s,1H,COOH),8.50~7.42 (m,7H,Ar-H),3.95 (s,2H,CH2-S)。
1.2.2 TX-S-TBD的合成称取0.18 g(0.62 mmol)TX-S-COOH,依次加入20 mL水和0.08 g(0.56 mmol)TBD,室温搅拌10 min。反应液离心后取上层清液,用乙酸乙酯洗至有机层无色,水层用氯仿萃取3次,真空除去氯仿得淡黄色固体粉末0.24 g,产率96.6%。
1HNMR (400 MHz,CDCl3): 8.66~7.42 (m,7H,Ar-H),3.82 (s,2H,CH2-S),3.30~3.18 (m,8H,4×N-CH2),2.42 (s,2H,2×NH),1.98~1.91 (m,4H,2×CH2). 13CNMR (101 MHz,CDCl3): 179.44 (CO),175.15 (O—CO),151.81 (NH—C—NH),137.84~126.16 (137.84,137.36,133.52,132.25,132.04,129.96,129.42,129.34,128.01,126.38,126.25,126.16,Ar—C),47.03 (N—CH2),39.32 (S—CH2),37.85 (NH—CH2),21.09 (CH2—CH2—CH2). TOF MS ES-:负离子C15H9O3S2-理论值为300.9993,实测值为300.9891[M]-;TOF MS ES+:正离子C7H14N3+理论值为140.1188,实测值为140.1192[M]+。
1.3 结构表征核磁测试采用瑞士布鲁克公司的AVANCE Ⅲ HD 400 MHz,其中TX-S-COOH测试溶剂为氘代二甲基亚砜,TX-S-TBD测试溶剂为氘代氯仿;高分辨率质谱测试采用美国沃特世公司的UPLC-TQD型超高效液相色谱串联四级杆质谱联用仪,测试溶剂为无水甲醇。
1.4 光物理测试紫外-可见吸收光谱测试采用日本Lambda公司的TU1901型紫外可见分光光度计,测试溶剂为乙腈;荧光发射光谱测试采用美国瓦里安有限公司的CARY Eclipse型荧光分光光度计,测试溶剂为乙腈。
荧光量子产率采用相对法[20],在同一设备和相同激发波长下,通过公式(1)计量。
| ${{\varphi }_{x}}={{\varphi }_{st}}\frac{{{I}_{x}}\eta _{x}^{2}{{A}_{st}}}{{{I}_{st}}\eta _{st}^{2}{{A}_{x}}}$ | (1) |
式中,I为荧光激发光谱的积分面积,η为溶剂折射率,A为吸光度。已知荧光量子产率的标准溶液脚注为st,未知溶液脚注为x。本测试中选取硫酸奎宁为标准样,其荧光量子产率为0.546[20]。样品溶剂选取乙腈,吸光度0.04~0.06,荧光激发波长为360 nm。
1.5 光解测试 1.5.1 稳态光解测试分别配制浓度为3.6×10-5 mol/L的TX-S-TBD乙腈溶液,采用OmniCure S1000 UV/可见光点光源辐照并搅拌,由UV能量计测得辐射光强为650 mW/cm2,用日本Lambda公司的TU1901型紫外可见分光光度计测试不同光照时间下的紫外可见吸收光谱。加苯酚红的光解紫外吸收测试在此方法基础上施行,测试时在比色皿中加入一滴苯酚红的乙腈饱和溶液。
1.5.2 光致脱羧测试用内径为0.5 mm的不锈钢导管连接两个2 mL的密封透明玻璃瓶,其中一瓶装有TX-S-TBD的甲醇溶液(2.0×10-2 mol/L),另一瓶为酚酞(3.1×10-3 mol/L)的碳酸钠(3.1×10-4 mol/L)水溶液。采用OmniCure S1000 UV/可见光点光源辐照,用紫外辐照计测得光强为135 mW/cm2,间歇照射,累计辐照时间为3560 s,累计能量密度为480 J/cm2。
1.5.3 光致pH变化测试配制适当浓度(约0.02 mol/L)的光产碱剂甲醇溶液,加3 mL于透明玻璃瓶中。采用OmniCure S1000 UV/可见光点光源辐照,固定UV/可见光点光源光纤与玻璃瓶的距离,并用紫外辐照计测得相应光强为132 mW/cm2。用数显pH计测得不同光照时间下的pH值。
1.5.4 电子自旋共振波谱(ESR)测试核磁管中充氮气 2 min,依次加入1 mg TX-S-TBD、2 mg N-叔丁基苯硝酮(PBN)、1 mL苯,超声10 min充分溶解,随后充氮气5 min,测试前进行光照30 s (光强4.6 W/cm2),采用电子自旋共振波谱仪测得电子自旋共振实验图谱,并用软件拟合得模拟图谱。
1.6 光聚合动力学测试实时红外测试使用的光产碱剂及单体结构如图 1所示。称取引发剂约6 mg,加入1滴无水甲醇溶解,加入配好的巯基/环氧单体混合物(PETMP/BADGE=1∶2),混合均匀得到实时红外测试样品,其中光引发剂含量为4%(质量分数)。样品涂抹于KBr盐片上,采用OmniCure S1000 UV/可见光点光源辐照,由UV-A型紫外辐照计(365 nm探测头)测得光强为142 mW/cm2,辐照固化时间1000 s,采用美国赛默飞世尔科技有限公司的Nicolet6700型傅立叶变换红外光谱仪实时监测巯基、环氧官能团的转化率。巯基峰面积区间取2602~2522 cm-1;环氧峰面积区间取924~903 cm-1。
2 结果与讨论 2.1 光产碱剂的合成新型的光产碱剂以硫杂蒽酮为生色团,因为硫杂蒽酮是一种高效的光敏剂,且其在UV-A及可见光区有较强吸收;以TBD作为产碱基团,因为其pKa约为13.5[9],碱性强,可高效催化巯基-环氧聚合。此外,生色团与强碱之间以共价键连接,形成的单组分体系有利于能量和电子转移,同时,此结构可发生不可逆的光致脱羧过程来抑制逆电子转移[21],提高光解效率。与TX-TBD相比,TX-S-TBD在芳环上引入了硫原子,可使其吸收波长发生红移。
光产碱剂的合成路线:首先硫代水杨酸与苯硫基乙酸反应生成硫杂蒽酮酸[19, 22],随后硫杂蒽酮酸与TBD在溶液中发生酸碱中和反应而得到产物。分别通过核磁氢谱、核磁碳谱和质谱证实了目标产物结构。
2.2 光物理性质图 3所示是光产碱剂TX-TBD和TX-S-TBD在乙腈溶液中的紫外吸收光谱。两种光产碱剂在250 nm附近和400 nm附近均有吸收。在250 nm附近的吸收峰源于硫杂蒽酮的π-π*跃迁,而400 nm附近的吸收峰源于羰基的n-π*跃迁。TX-TBD最大吸收峰为383 nm(表 1),而硫原子的引入使TX-S-TBD的最大吸收峰红移至401 nm,可用作可见光产碱剂。

|
图 3 TX-TBD、TX-S-TBD在乙腈溶液中的紫外吸收光谱 Fig.3 UV-Vis absorption spectra of TX-TBD and TX-S-TBD in acetonitrile |
| 表 1 光产碱剂的光物理性质数据 Table 1 Photophysical properties of the PBGs |
图 4所示是光产碱剂TX-TBD与TX-S-TBD的荧光发射光谱。硫原子的引入不仅影响光产碱剂的吸收行为,而且对荧光发射行为也有较大影响。TX-TBD最大荧光发射峰为421 nm,而TX-S-TBD的对应发射峰值红移至479 nm。此外,TX-S-TBD的荧光量子产率φ高于TX-TBD(表 1)。通常较低的荧光量子产率有利于激发单线态的电子通过系间窜跃跃迁至激发三重态,从而产生更多的活性物种引发聚合。

|
图 4 TX-TBD、TX-S-TBD在乙腈溶液中的荧光光谱 Fig.4 Fluorescence excitation and emission spectra of TX-TBD and TX-S-TBD in acetonitrile |
光产碱剂TX-S-TBD的稳态光解过程如图 5所示,随着光照时间增加,紫外吸收图谱没有发生显著变化。波长400 nm处吸收峰发生轻微蓝移,波长252 nm处吸收峰有轻微地减弱,波长270 nm处吸收峰有所增强。

|
图 5 TX-S-TBD光解紫外吸收图谱 Fig.5 UV-Vis absorption spectra of TX-S-TBD in acetonitrile upon irradiation |
我们的前期研究结果表明,硫杂蒽酮乙酸衍生物在光照下可释放CO2[21]。通过如图 6所示的实验装置可定性研究TX-S-TBD的光致脱羧行为[21]。光照前含酚酞的碳酸钠水溶液为弱碱性,因此显粉红色(图 6a),光照后溶液由粉红色变为无色(图 6b)。酸碱指示剂的颜色变化说明水溶液的酸碱性发生了变化,碱性减弱,其原因是光照后左侧瓶内TX-S-TBD释放的CO2经导管进入右侧瓶内,生成碳酸并与碳酸钠发生中和反应,使水溶液碱性降低,从而导致酸碱指示剂的颜色发生变化。

|
图 6 TX-S-TBD光照释放二氧化碳检测:(a)光照前,(b)光照后 Fig.6 Detection of CO2: (a) before and (b) after UV irradiation |
为了验证TX-S-TBD光解后可释放碱性物种,在样品溶液中加入一滴饱和的苯酚红乙腈溶液[9, 23, 24]。如图 7所示,随光照时间增加,波长575 nm处吸收峰不断增强,且溶液由浅黄色变为淡红色。575 nm的吸收为苯酚红去质子化产物的特征吸收峰,该吸收峰的出现说明TX-S-TBD在光照后可释放碱性物种,使苯酚红发生去质子化[25]。随着光照时间增加,碱性物种浓度增加,575 nm处吸收不断增强,且在辐照能量密度1625 mJ/cm2时吸收峰达到最大值。进一步增加光照时间,发现该吸收峰不断减弱直至消失,而溶液由淡红色慢慢褪至无色,该过程可能是去质子化的苯酚红发生光漂白引起的。
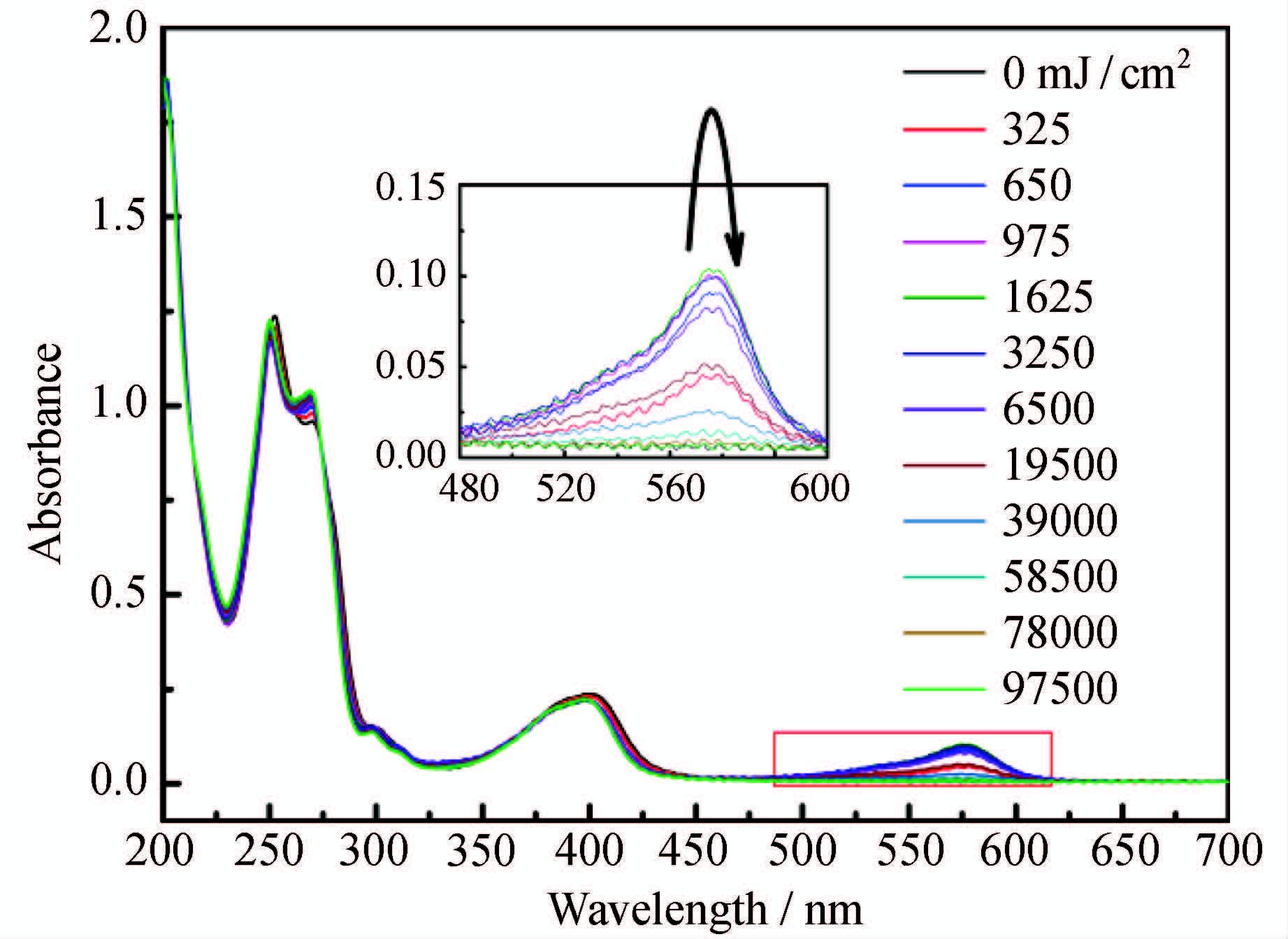
|
图 7 TX-S-TBD加苯酚红光解紫外吸收图谱 Fig.7 UV-Vis absorption spectra of TX-S-TBD solution with phenol red upon different irradiation energy |
通过光解后pH值的变化可进一步对光解后TX-S-TBD释放的碱性物种进行定量研究。如图 8所示,随着辐照能量的增加,TX-S-TBD溶液的pH值由8.0增加至10.0左右。辐照能量密度低于3960 mJ/cm-2时,pH值变化快,从8.0迅速增加到9.45;辐照能量密度为3960~22440 mJ/cm-2时,pH值变化缓慢,从9.45逐渐增加到9.98;辐照能量大于22440 mJ/cm-2后,pH值基本无变化。该结果进一步证实了TX-S-TBD光解后会产生碱性物种,随着光解的不断进行,光产碱浓度逐渐降低,pH变化速率不断下降,最后趋于平稳。
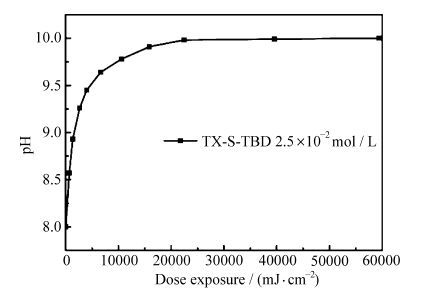
|
图 8 TX-S-TBD光解pH值变化曲线 Fig.8 pH monitoring of TX-S-TBD in methanol upon irradiation |
Yagci等[26]的研究表明,硫杂蒽酮乙酸衍生物在光致脱羧后会产生活性自由基并引发自由基聚合。为验证TX-S-TBD光解过程中自由基的生成,以PBN为捕捉剂,光照后进行ESR表征(图 9)。图中实线是实验所得图谱,其中aN =14.61 G,aH =2.91 G,可证实亚甲基自由基的存在。图中虚线是软件模拟计算所得ESR图谱,与实验所得ESR图谱一致。
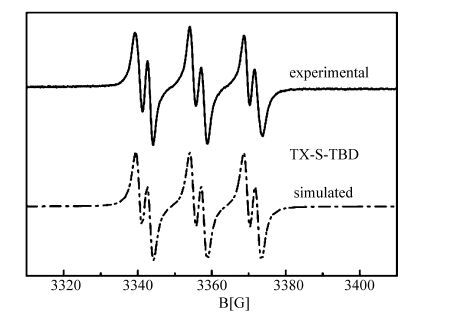
|
图 9 苯溶液中TX-S-TBD光照后的ESR模拟及实验图谱 Fig.9 Simulated ESR spectra and experimental ESR spectra of TX-S-TBD with PBN in benzene |
通过实时红外来研究所合成光产碱对巯基-环氧体系的引发活性,并与文献报道的双组分光产碱体系ITX+TBD·HBPh4[18]进行比较。图 10是不同光产碱剂(体系)引发巯基-环氧光聚合的实时红外官能团转化率曲线。3种光产碱剂(体系)均能有效引发巯基-环氧体系光聚合。其中含双组分引发体系ITX+TBD·HBPh4的配方环氧最终转化率为28%(图 10a),而含单组分引发剂TX-TBD配方相应的转化率增加至59%。TX-TBD转化率的增加源于光致脱羧机理。该不可逆过程可有效抑制逆电子转移[27],增加引发活性种的量子产率,进而提高官能团转化率。
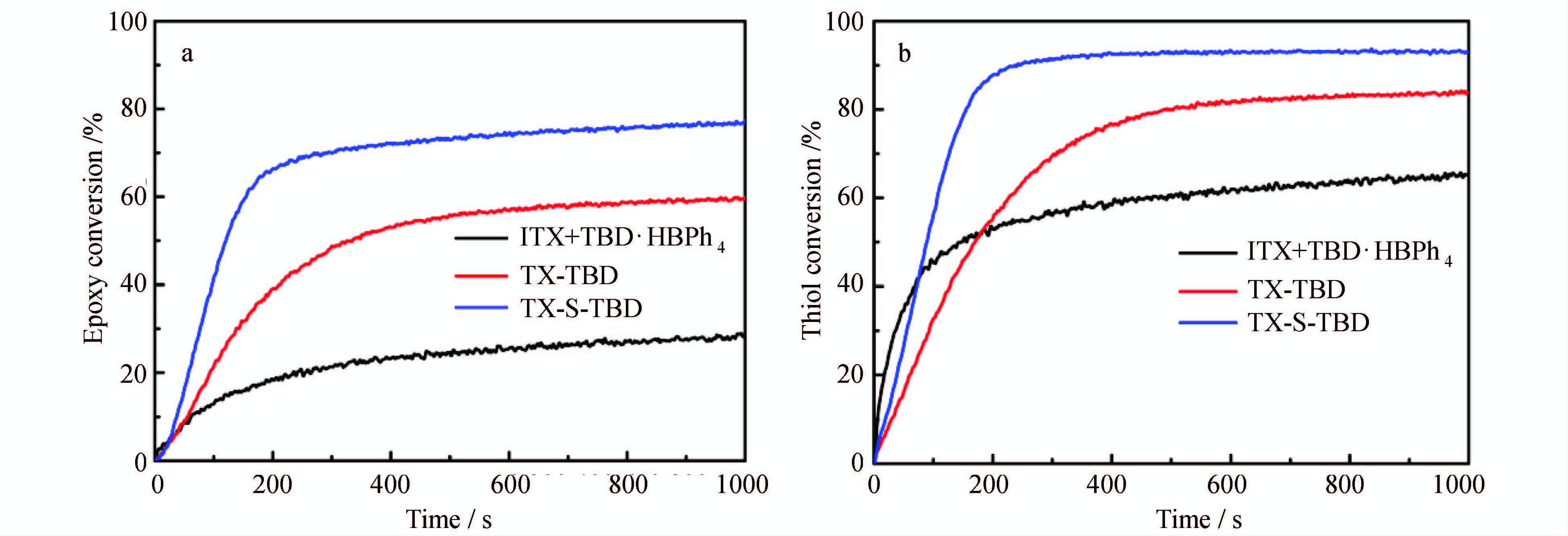
|
图 10 巯基-环氧光聚合实时红外环氧转化率曲线(a)、巯基(b)转化率曲线 Fig.10 (a)Epoxy conversion and (b)thiol conversion curves of thiol/epoxide polymerization initiated by ITX+TBD·HBPh4(black curves),TX-TBD(red curves) and TX-S-TBD(blue curves) |
与TX-TBD相比,TX-S-TBD反应速率更快,且环氧转化率进一步增加至77%。其原因可能是硫原子的引入导致TX-S-TBD的吸收波长红移,使其吸收峰与光源的发射峰更好地匹配,提高了光吸收效率,进而使反应速率和转化率增加。
3种光产碱剂(体系)的巯基转化率曲线(图 10b)的变化趋势与环氧转化率曲线(图 10a)的变化趋势基本一致,但巯基转化率均高于相应的环氧转化率。由光解研究结果可知,该类光产碱剂可既可产生强碱TBD引发巯基-环氧聚合,也可产生自由基。该自由基可夺取巯基上的氢形成巯基自由基,而巯基自由基可发生双基终止形成二硫键,导致巯基最终转化率高于环氧。
基于上述表征结果及相关文献报道[9, 28],我们提出了TX-S-TBD引发巯基-环氧聚合的机理。如图 11所示:光产碱在光照下进行分子间及分子内的夺氢,发生脱羧反应,生成亚甲基自由基并释放强碱TBD,以及二氧化碳和其他物种。强碱TBD夺取巯基上的氢原子,生成硫负离子,硫负离子进攻环氧基团,发生开环反应,进而发生逐步聚合反应[29]。
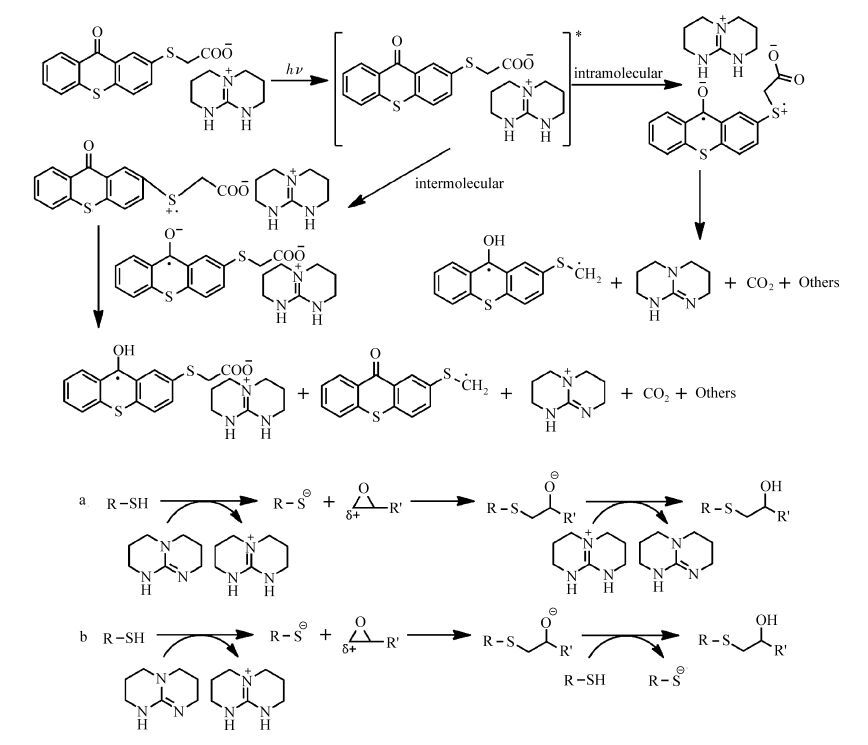
|
图 11 光产碱剂的光聚合机理 Fig.11 Proposed photopolymerizatin mechanism of the synthesized PBG |
通过两步反应成功合成了一种新型的硫杂蒽酮类光产碱剂TX-S-TBD,该光产碱剂在400 nm附近有较强吸收,可用作可见光光产碱剂。TX-S-TBD在光照后可发生光致脱羧反应,生成自由基并释放强碱。光聚合动力学研究结果表明,单组分光产碱剂TX-S-TBD能有效引发巯基/环氧光固化,与文献报道的高效光产碱体系相比,不可逆的光致脱羧机理有效抑制了逆电子转移,进而提高了引发速率和官能团转化率。
| [1] | Sasaki T, Kondo T, Noro M, Saida K, Yaguchi H, Naka Y. Photoinduced depolymerization in poly(olefin sulfone) films comprised of volatile monomers doped with a photobase generator[J]. Journal of Polymer Science Part A:Polymer Chemistry, 2012, 50 (8) :1462–1468. DOI:10.1002/pola.v50.8 |
| [2] | Chae K H, Yang U C, Lee M K. Photo-induced aminobenzoate group formation on a polymeric photobase generator bearing N-phenylcarbamate groups and its application to color imaging material[J]. Polymer, 2014, 55 (10) :2362–2368. DOI:10.1016/j.polymer.2014.03.037 |
| [3] | Chae K H, Kim Y H. Red-yellow fluorescence patterning of a polymer film containing phthalimido carbamate groups[J]. Advanced Functional Materials, 2007, 17 (17) :3470–3476. DOI:10.1002/(ISSN)1616-3028 |
| [4] | Chae K H, Cho H I, Kim Y H, Yang U C. Photo-crosslinking and negative-type micropattern formation of a polymeric photobase generator containing phthalimido carbamate groups[J]. European Polymer Journal, 2012, 48 (7) :1186–1194. DOI:10.1016/j.eurpolymj.2012.05.006 |
| [5] |
王宽, 刘敬成, 刘仁, 穆启道, 郑祥飞, 纪昌炜, 刘晓亚. 光刻胶用底部抗反射涂层研究进展[J]. 影像科学与光化学, 2016, 34 (2) :123–135.
Wang K, Liu J C, Liu R, Mu Q D, Zheng X F, Ji C W, Liu X Y. Research progress of the bottom anti-reflective coating for photoresist[J]. Imaging Science and Photochemistry, 2016, 34 (2) :123–135. |
| [6] | Chemtob A, Courtecuisse F O, Barghorn C L C, Rigolet S. Simultaneous sol-gel and anionic photopolymerization of 3-(glycidyloxypropyl)trimethoxysilane via photobase catalysis[J]. New Journal of Chemistry, 2011, 35 (9) :1803–1808. DOI:10.1039/c1nj20320g |
| [7] | Gigot A, Sangermano M, Capozzi L C, Dietliker K. In-situ synthesis of organic-inorganic coatings via a photolatent base catalyzed Michael-addition reaction[J]. Polymer, 2015, 68 :195–201. DOI:10.1016/j.polymer.2015.05.019 |
| [8] | Kutal C, Willson C G. Photoinitiated Cross-linking and image formation in thin polymer films containing a transition metal compound[J]. Journal of The Electrochemical Society, 1987, 134 (9) :2280–2285. DOI:10.1149/1.2100871 |
| [9] | Salmi H, Allonas X, Ley C, Defoin A, Ak A. Quaternary ammonium salts of phenylglyoxylic acid as photobase generators for thiol-promoted epoxide photopolymerization[J]. Polymer Chemistry, 2014, 5 (22) :6577–6583. DOI:10.1039/C4PY00927D |
| [10] | Hagiwara Y, Mesch R A, Kawakami T, Okazaki M, Jockusch S, Li Y, Turro N J, Grant Willson C. Design and synthesis of a photoaromatization-based two-stage photobase generator for pitch division lithography[J]. The Journal of Organic Chemistry, 2013, 78 (5) :1730–1734. DOI:10.1021/jo3021488 |
| [11] | Cameron J F, Willson C G, Fréchet J M J. Photogeneration of amines from α-keto carbamates:photochemical studies[J]. Journal of the American Chemical Society, 1996, 118 (51) :12925–12937. DOI:10.1021/ja954339a |
| [12] | Kura H, Oka H, Birbaum J L. Study on photobase generation from α-aminoketones:photocrosslinking of epoxides with carboxylic acids[J]. Journal of Photopolymer Science & Technology, 2000, 13 (1) :145–152. |
| [13] | Suyama K, Shirai M. Photobase generators:recent progress and application trend in polymer systems[J]. Progress in Polymer Science, 2009, 34 (2) :194–209. DOI:10.1016/j.progpolymsci.2008.08.005 |
| [14] | Li J, Liu L, Liu A. Study on synthesis and photoactivity of N-substituted diazabicyclononane derivatives with different substituents[J]. International Journal of Adhesion and Adhesives, 2015, 57 :118–124. DOI:10.1016/j.ijadhadh.2014.12.002 |
| [15] | Seubert C M, Nichols M E. Epoxy thiol photolatent base clearcoats:curing and formulation[J]. Journal of Coatings Technology and Research, 2010, 7 (5) :615–622. DOI:10.1007/s11998-010-9248-3 |
| [16] | Cao C B, Zhou C, Sun X, Gao J P, Wang Z Y. Photo-induced crosslinking of water-soluble polymers with a new photobase generator[J]. Polymer, 2010, 51 (18) :4058–4062. DOI:10.1016/j.polymer.2010.06.052 |
| [17] | Lalevée J, Blanchard N, Tehfe M A, Peter M, Morlet-Savary F, Gigmes D, Fouassier J P. Efficient dual radical/cationic photoinitiator under visible light:a new concept[J]. Polym Chem, 2011, 2 (9) :1986–1991. DOI:10.1039/c1py00140j |
| [18] | Jian Y, He Y, Sun Y, Yang H, Yang W, Nie J. Thiol-epoxy/thiol-acrylate hybrid materials synthesized by photopolymerization[J]. Journal of Materials Chemistry C, 2013, 1 (29) :4481–4489. DOI:10.1039/c3tc30360h |
| [19] | Yilmaz G, Acik G, Yagci Y. Counteranion sensitization approach to photoinitiated free radical polymerization[J]. Macromolecules, 2012, 45 (5) :2219–2224. DOI:10.1021/ma3000169 |
| [20] |
李隆弟, 张满. 溶液荧光量子产率的相对测量[J]. 分析化学, 1988, 16 (8) :732–734.
Li L D, Zhang M. Comparative method for determining fluorescence quantum yield[J]. Chinese journal of Analytical Chemistry, 1988, 16 (8) :732–734. |
| [21] | Dong X, Hu P, Zhu G, Li Z, Liu R, Liu X. Thioxanthone acetic acid ammonium salts:highly efficient photobase generators based on photodecarboxylation[J]. RSC Advances, 2015, 5 (66) :53342–53348. DOI:10.1039/C5RA09314G |
| [22] | Tar H, Sevinc Esen D, Aydin M, Ley C, Arsu N, Allonas X. Panchromatic type II photoinitiator for free radical polymerization based on thioxanthone derivative[J]. Macromolecules, 2013, 46 (9) :3266–3272. DOI:10.1021/ma302641d |
| [23] | Arimitsu K, Endo R. Application to photoreactive materials of photochemical generation of superbases with high efficiency based on photodecarboxylation reactions[J]. Chemistry of Materials, 2013, 25 (22) :4461–4463. DOI:10.1021/cm4022485 |
| [24] | Sun X, Gao J P, Wang Z Y. Bicyclic Guanidinium tetraphenylborate:a photobase generator and a photocatalyst for living anionic ring-opening polymerization and cross-linking of polymeric materials containing ester and hydroxy groups[J]. Journal of the American Chemical Society, 2008, 130 (26) :8130–8131. DOI:10.1021/ja802816g |
| [25] | Tachi H, Yamamoto T, Shirai M, Tsunooka M. Photochemical reactions of quaternary ammonium dithiocarbamates as photobase generators and their use in the photoinitiated thermal crosslinking of poly(glycidyl methacrylate)[J]. Journal of Polymer Science Part A Polymer Chemistry, 2001, 39 (9) :1329–1341. DOI:10.1002/(ISSN)1099-0518 |
| [26] | Aydin M, Arsu N, Yagci Y. One-component bimolecular photoinitiating systems[J]. Macromolecular Rapid Communications, 2003, 24 (12) :718–723. DOI:10.1002/(ISSN)1521-3927 |
| [27] | Blake J A, Gagnon E, Lukeman M, Scaiano J C. Photodecarboxylation of xanthone acetic acids:C-C bond heterolysis from the singlet excited state[J]. Organic Letters, 2006, 8 (6) :1057–1060. DOI:10.1021/ol052953d |
| [28] | Aydin M, Arsu N, Yagci Y, Jockusch S, Turro N J. Mechanistic study of photoinitiated free radical polymerization using thioxanthone thioacetic acid as one-component type II photoinitiator[J]. Macromolecules, 2005, 38 (10) :4133–4138. DOI:10.1021/ma047560t |
| [29] | Hoyle C E, Loweb A B, Bowman C N. Thiol-click chemistry:a multifaceted toolbox for small molecule and polymer synthesis[J]. Chemistry Society Reviews, 2010, 39 (4) :1355–1387. DOI:10.1039/b901979k |




