2. 南京理工大学 电子工程与光电技术学院 江苏省光谱成像与智能感知重点实验室, 江苏 南京 210094
2. Jiangsu Province Key Laboratory of Spectral Imaging and Intelligence Sense, School of Electronics and Optical Engineering, Nanjing University of Science and Technology, Nanjing 210094, Jiangsu, P. R. China
在显微成像中,当光波穿过生物细胞后,样品的强度和相位信息会被包含在透射光线中。作为光波的统计现象,数字探测器 (CCD或CMOS) 只能记录光的强度信息,而蕴含着物体结构和光学特性的相位却丢失了。传统的明场显微镜适合用于观察已染色物体和具有强吸收特性的物体,但对于未染色透明的细胞其在明场照明下光强基本不发生改变,所以采集到的图像具有较低的对比度,很难进行观察和分析。一些相位可视化的成像方法可以对未标记的生物样品进行观察,例如泽尼克相衬成像[1]、微分干涉相衬成像 (DIC)[2]等。它们能将观察样品折射率的空间差异即相位延迟转换为图像的光强信息,大大提升了这类样品在显微镜下的图像对比度,实现了对未染色细胞等弱相位物体的观测与分析。虽然这些相位可视化方法提供了有用和可靠的信息,但它们都无法得到生物样品的定量相位,从而很难进行后续的数据分析与计算。
经过数十年的发展,相位恢复与定量相位成像已经成为光学测量领域的一个重要课题。其中,最为经典的相位测量方法要属干涉检测法。传统的干涉法已经较为成熟,并引申出多个分支,例如电子散斑干涉、干涉测量、数字全息等[3-5]。虽然干涉测量法可以有效地获取相位,但干涉法往往依赖相干性较好的激光光源等,并且需要较为复杂的实验装置。此外,该方法还需对获得的相位进行解包裹,而解包裹算法一般较为复杂。相位测量中与干涉法相对应的被称为非干涉相位测量技术, 其中夏克-哈特曼波前传感器是采用几何光学原理的相位测量技术,根据CCD上的焦斑相对于微透镜光轴的偏移量,运用数学手段恢复出最终的波面。但是由于微透镜物理尺寸的限制,夏克-哈特曼波前传感器很少直接应用于相位成像与显微领域[6]。另一类非常重要的非干涉相位测量技术统称为相位恢复。相位恢复是一种由强度来恢复相位的技术,主要分为迭代法和光强传输法。相比于迭代的不确定性以及收敛可能限于局部最小值等缺点,1983年Teague提出的基于TIE的相位恢复是一种非迭代的定量相位恢复法[7]。该方法仅需要沿光轴方向采集多个平面的强度图像,就可通过数学方法直接求出物体的相位,无需任何的迭代过程。因此,已知I0和∂I/∂z求解TIE,就能唯一确定定量相位。其中,I0表示聚焦面处的光强,∂I/∂z表示轴向光强的微分。光强传输方程作为相位恢复的方法之一,因为其具有非迭代性、非干涉性, 以及无需复杂的实验装置等优点,近年来被国内外学者广泛关注。
在不加其他特殊光学元件的情况下,TIE不仅能够获取非干涉定量相位,还为生物医学中的多种计算观测方法提供了可能性。2004年,Paganin等[8]展示了X射线显微成像中人腿骨和螨虫进行泽尼克相衬成像的仿真结果。2002年,Barone-Nugent等[9]给出了一组较好的仿真DIC图像的实验结果,后续研究证明了其在部分相干光下利用TIE求解定量相位的准确性。2015年,Zuo等[10]以相空间光学理论作为切入点,基于维纳分布函数 (WDF) 将TIE推广并应用到部分相干光波场。
本文基于传统明场显微镜设计出一套显微计算成像系统,此系统将传统显微镜与计算成像相结合,不仅能够求解出生物样品的定量相位信息,还能呈现在泽尼克相衬和微分干涉相衬模式下的成像结果。实验结果证明,TIE能够得到各类生物医学样品的定量相位,为后续数据的分析与处理提供了可能性。在已知定量相位信息的基础上,泽尼克相衬和微分干涉相衬成像模式提供了更为丰富的图像信息和多样化的观察手段。
1 光强传输方程当光波在自由空间传播时,在菲涅耳区的光强与相位的关系应满足式 (1)[7]:
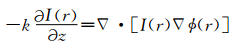
|
(1) |
其中,k=2π/λ, 表示波数;I(r) 表示聚焦面上的光强;∇表示在横向方向r上的梯度算子;ϕ(r) 表示物体的相位。TIE的左边是沿z轴方向的轴向光强微分,为了减少轴向光强微分高阶项的影响,轴向微分将采用多个平面的测量获取[11]。而方程的右边是一个二阶椭圆偏微分方程。它可以在周期或简化的齐次边界下通过快速傅里叶变换[12](FFT) 求解,也可以在非齐次Neumann边界条件下通过离散余弦变换[13](DCT) 求解。TIE最初是Teague在傍轴条件下由亥姆霍兹方程推导得到的,而Teague推导出的TIE以及他的假设都是基于单色相干光的条件,因此TIE不能直接应用于部分相干光照明。在准单色光近似下,WDF[14]应满足式 (2):
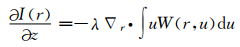
|
(2) |
其中,r和u分别表示二维空间和空间频率的矢量;∇r表示在r上的梯度函数。当满足完全相干条件,方程 (2) 可被简化成方程 (1)。部分相干光场下相位的梯度则自动与维格纳函数的一阶条件空间频率矩相关联[14],即:
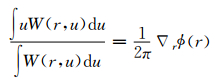
|
(3) |
方程 (2) 和 (3) 分别表示广义的光强传输方程形式和部分相干光下求解的相位。因此,不管是相干光场还是部分相干光场,定量相位都可以由TIE恢复。研究发现,无论光源大小,只要光源的分布相对于光轴是对称的,相位就可以被准确恢复[10]。
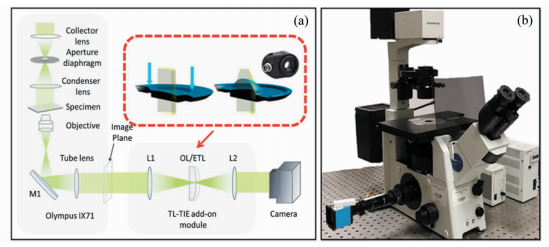
2 实验 2.1 实验装置图 1(a)展示的是实验装置以及在标准4f系统中的电控变焦透镜镜头的原理图。图 1(b)展示的是基于光强传输方程的多模式的计算显微装置。实验采用倒置的奥林巴斯IX71型显微镜。实验照明光是由显微镜内置的卤钨灯发出的白光,经过一个中心波长为550 nm,带宽45 nm的中性滤光片后产生的准单色光。该系统使用奥林巴斯相机 (Olympus UC50,分辨率2588 pixels×1960 pixels,3.4 μm/pixel) 进行图像采集。为避免手动变焦的不精确性,系统采用电控变焦透镜 (EL-C-10-30-VIS-LD,Optotune AG) 模块用于变焦。此系统通过USB接口由软件控制,在垂直于焦面的方向 (z轴) 上保证了相机采集与电控变焦透镜模块变焦的同步性。图像堆栈经过一个长工作距半复消色差物镜 (Olympus,LUCPLFLN 40×,NA=0.6) 后被相机采集。
|
图 1 (a) 实验装置和标准4f系统中电控变焦透镜的原理图;(b) 基于奥林巴斯IX71的多模式计算成像系统 Fig.1 (a) Schematic diagram of the experimental setup and the electrically tunable lens in standard 4f system; (b) Multi-mode imaging system based on OLYMPUS IX71 |
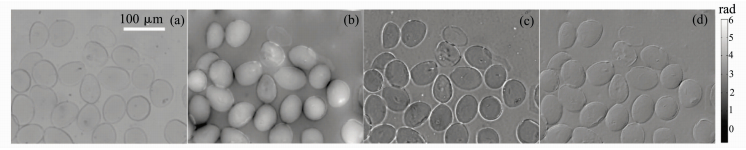
首先,测试样品为未染色的花粉粒,花粉粒的折射率大约是1.43。图 2展示的是花粉粒的多模式成像结果。花粉粒不能被视为薄相位物体,并且在其边缘伴有轻微的吸收。泽尼克相衬图像明显提高了样品的对比度,但是可以明显看到样品轮廓周围存在一圈光晕。微分干涉相衬图像虽然没有泽尼克相衬图像的对比度高,但是呈现了一种三维立体浮雕状且细节轮廓清晰。
|
图 2 未染色花粉粒的多模式成像结果 (比例尺代表100 μm) (a) 明场图像;(b) 定量相位图像;(c) 泽尼克相衬图像;(d) DIC图像 Fig.2 Results of multi-mode imaging of unstained pollen grains (scale 100 μm) (a) bright field image; (b) quantitative phase image; (c) phase contrast image; (d) DIC image |
将样品换成海拉细胞。图 3是有丝分裂时期和分裂间期细胞的实验多模式图像。图 3(a)展示的是基于TIE求解整个成像平面下海拉细胞的定量相位。当处于细胞分裂周期时,那些吸附在培养基底的细胞比周围区域的细胞具有更高的密度,例如细胞核。因此,核膜和核仁就显得更突出。在G2期结束时,视场中的3个细胞开始分裂,这是有丝分裂前细胞生命周期中的最终生长期和活性期。
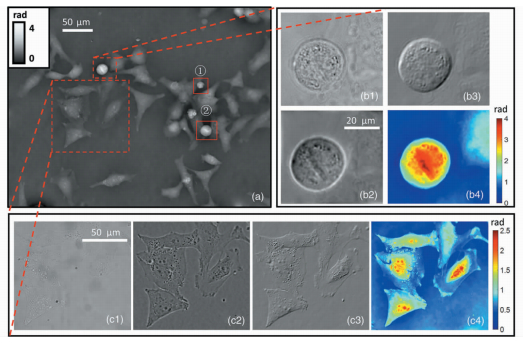
|
图 3 (a) 海拉细胞的全视场定量相位;(b)、(c) 分别包含了有丝分裂和分裂间期的明场图像、泽尼克相衬图像、DIC图像和定量相位图像 (比例尺分别代表20 μm和50 μm) Fig.3 (a) Full field quantitative phase of HeLa cells; (b)、(c) Contain bright field image, phase contrast images, DIC images and quantitative phase images during mitosis and interphase, respectively (scales representing 20 μm and 50 μm) |
选择3个细胞中最大的1个,在图中用较小红色虚线矩形标出。在实验期间,图中较大红色虚线矩形中的细胞基本不发生改变,因此可以判断这些细胞属于分裂周期中的G1期或S期,这段时间是细胞复制DNA和中心粒的阶段。图 3(b)和(c)分别是细胞有丝分裂时期和分裂间期的多模式图像。泽尼克相衬图像和微分干涉相衬图像不仅可以提供细胞的可视化信息,还能使细胞提供的信息更加丰富。图 3(b2)和(c2) 中细胞周围的光晕是典型的泽尼克相衬的特征。泽尼克相衬图像增强了物体的边缘,这就为细胞计数提供了方便。图 3(b3) 和 (c3) 展示了微分干涉相衬图像的三维浮雕效果,其中相位变化的区域三维浮雕效果尤为明显,如细胞质和细胞核。
图 4为有丝分裂阶段多模式成像系统在不同时间点的细胞图像。分裂中期或分裂前期结束时,染色体着丝点排列在赤道板上,纺锤丝附着在着丝点上并且连接着染色体与子细胞,这些现象意味着细胞在为分裂作最后的准备。当实验进行到74 min时,细胞变成椭圆形。分裂后期,细胞质均匀分布在整个细胞中,着丝点一分为二,纺锤丝牵拉染色体,每条染色体的两条姊妹染色单体
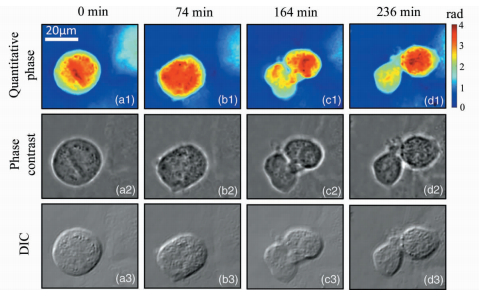
|
图 4 分裂期间海拉细胞不同时间点的图像 (a) 分裂中期或前期结束;(b) 分裂后期;(c) 细胞开始分为两部分;(d) 细胞彻底分裂成两个 Fig.4 Images of HeLa cells at different time points during division (a) metaphase or end of prophase; (b) anaphase; (c) cell begins to divide into two parts; (d) cell splits into two |
分开并向两级移动, 1.5 h之后,细胞核大致分为两部分, 新的细胞壁在分裂末期形成,标志着一个母细胞分裂成两个基本相同的子细胞。每个子细胞只包含1条染色单体,并且每一条都比母细胞的小。实验的最后阶段 (时间点为236 min),胞质分裂表明了细胞分裂周期的结束,1个母细胞分裂成2个子细胞。染色体解螺旋,进入下一个有丝分裂期。此外,泽尼克相衬图像以及DIC图像也反映了细胞分裂过程中的一些重要特性,如:图 4(d2) 中的光晕代表两个独立的子海拉细胞,完全实现了分裂;图 4(b3) 直观地展示了细胞质如何均匀分布在整个细胞中。
3 结论利用明场显微镜设计出一套基于光强传输方程 (TIE) 的多模式计算成像系统。电控变焦透镜模块抓取到图像光强堆栈后,通过计算得到定量相位图像、泽尼克相衬图像、DIC图像。此系统可以结合适当的后处理算法实现多种成像模式,并且在不改变原高成像质量的前提下,可以直接应用于传统显微镜上,操作简便且成本低廉。基于此系统给出了未染色的花粉粒的实验结果以及海拉细胞有丝分裂的动态过程。除集成了多个成像模式,TIE计算成像在生物医学领域还具有广泛的应用前景。活细胞成像的结果表明,本文提出的多模式成像系统能够有效地研究细胞动态过程,并且可应用于研究药物的有效性、细胞的移动、生物功能化纳米材料的毒性分析。
| [1] | Zernike F. How I discovered phase contrast[J]. Science, 1955, 121(121): 345–349. |
| [2] | Mcmahon P J, Barone-Nugent E D, Allman B E, NugentK A. Quantitative phase-amplitude microscopy Ⅱ:differential interference contrast imaging for biological TEM[J]. Journal of Microscopy, 2002, 206(3): 204–208. DOI:10.1046/j.1365-2818.2002.01026.x |
| [3] | Cuche E, Bevilacqua F, Depeursinge C. Digital holography for quantitative phase-contrast imaging[J]. Optics Letters, 1999, 24(5): 291. DOI:10.1364/OL.24.000291 |
| [4] | SchnarsU, JueptnerW. Digital Holography[M]. Heidelberg: Springer Berlin Heidelberg, 2005. |
| [5] | Cuche E, Marquet P, Depeursinge C. Spatial filtering for zero-order and twin-image elimination in digital off-axis holography[J]. Applied Optics, 2000, 39(23): 4070–4075. DOI:10.1364/AO.39.004070 |
| [6] |
左超, 陈钱, 孙佳嵩, AsundiA. 基于光强传输方程的非干涉相位恢复与定量相位显微成像:文献综述与最新进展[J]. 中国激光, 2016, 43(6): 219–249.
Zuo C, Chen Q, Sun J S, Asundi A. Non-interferometric phase retrieval and quantitative phase microscopy based on transport of intensity equation:a review[J]. Chinese Journal of Lasers, 2016, 43(6): 219–249. |
| [7] | Teague M R. Deterministic phase retrieval:a Green's function solution[J]. Journal of the Optical Society of America A, 1983, 73(11): 1434–1441. DOI:10.1364/JOSA.73.001434 |
| [8] | Paganin D, Gureyev T E, Mayo S C, StevensonA W, NesteretsYA I, Wilkins S W. X-ray omni microscopy[J]. Journal of Microscopy, 2004, 214(3): 315–327. DOI:10.1111/j.0022-2720.2004.01315.x |
| [9] | Barone-Nugent E D, BartyA, Nugent K A. Quantitative phase-amplitude microscopy I:optical microscopy[J]. Journal of Microscopy, 2002, 206(3): 194–203. DOI:10.1046/j.1365-2818.2002.01027.x |
| [10] | Zuo C, Chen Q, Tian L, WallerL, AsundiA. Transport of intensity phase retrieval and computational imaging for partially coherent fields:the phase space perspective[J]. Optics & Lasers in Engineering, 2015, 71: 20–32. |
| [11] | Zuo C, Chen Q, Yu Y, AsundiA. Transport-of-intensity phase imaging using Savitzky-Golay differentiation filter-theory and applications[J]. Optics Express, 2013, 21(5): 5346–5362. DOI:10.1364/OE.21.005346 |
| [12] | Nugent K A, Gureyev T E, Cookson D J, PaganinD, Barnea Z. Quantitative phase imaging using hard X rays[J]. Physical Review Letters, 1996, 77(14): 2961–2964. DOI:10.1103/PhysRevLett.77.2961 |
| [13] | Zuo C, Chen Q, Asundi A. Boundary-artifact-free phase retrieval with the transport of intensity equation:fast solution with use of discrete cosine transform[J]. Optics Express, 2014, 22(8): 9220–9244. DOI:10.1364/OE.22.009220 |
| [14] | Zuo C, Chen Q, Asundi A. Light field moment imaging:comment[J]. Optics Letters, 2014, 39(3): 654. DOI:10.1364/OL.39.000654 |




