2. 中国科学院大连化学物理研究所 分子反应动力学国家重点实验室, 辽宁 大连 116023;
3. 中国科学院大学, 北京 100049;
4. 大连理工大学 化学学院, 辽宁 大连 116024
2. State Key Laboratory of Molecular Reaction Dynamics, Dalian Institute of Chemical Physics, Chinese Academy of Sciences, Dalian 116023, Liaoning, P. R. China;
3. University of Chinese Academy of Sciences, Beijing 100049, P. R. China;
4. College of Chemistry, Dalian University of Technology, Dalian 116024, Liaoning, P. R. China
有机分子激发态的性质决定了该分子的性质与用途[1-3],例如:具有强辐射跃迁能力的S1激发态的分子可以作为荧光材料;而具有强辐射跃迁能力的T1态分子可以作为磷光材料。如果能够利用某些光物理过程或外部条件 (如化学物质或热、光照等) 来影响分子激发态的性质 (即对其进行调控),那么便可以在很大程度上改变分子本身固有的性能,开发出具有多种功能的新型有机分子。这方面最具有代表性的例子是荧光分子探针的研究[4-13]。在荧光分子探针中,往往利用分子内光诱导电子转移 (photo-induced electron transfer, PET),使发色团的荧光得到猝灭;当探针分子以某种方式与被检测物分子作用时,PET过程被抑制,荧光基团的荧光得到恢复,从而能够以荧光增强来指示被检测物的存在[4, 14]。该类分子结构设计的原则,本质上是通过合适的手段 (如PET) 来调控单重激发态的性质,获得的荧光分子探针在生物成像、小分子和离子检测方面具有重要的应用意义[15]。
近年来,有机分子三重激发态的研究,逐渐引起了人们的重视[16]。但是与荧光的研究相比,有关三重态的调控研究仍非常少见,并且远没有对有机分子单重激发态的研究那么透彻。如果能够实现对三重激发态的调控,同样可以得到非常重要的有机功能分子,并可应用于光动力治疗、上转换等领域 (图 1) [16-18]。

|
图 1 三重态光敏剂在 (a) 光动力治疗和 (b) 三重态湮灭上转换领域的应用[17, 18] Fig.1 Application of triplet photosensitizers in (a) photodynamic therapy and (b) triplet-triplet-annihilation upconversion[17, 18] |
以往对有机分子 (包括金属有机配合物) 三重态的研究大多集中于电致发光或磷光[19-21],实际上,三重激发态在很多领域都有重要的意义,如光动力治疗 (photodynamic therapy, PDT) 是一种很有发展前景的肿瘤治疗手段[17, 22],其中关键问题之一即如何实现对光敏剂产生单重态氧 (1O2) 能力的开、关的调控,从而制备具有靶向、可激活功能的光敏剂,选择性地在肿瘤部位产生单重态氧,也就是如何调控光敏剂的三重态的性质。此外,磷光配合物可用作分子探针,适用于发光寿命分析,提高检测的灵敏度[15, 24]。另外,三重态湮灭上转换 (TTA-UC) 是最近兴起的一种新的光子上转换方法[25-29],在生物成像[30, 31]、光催化、太阳能制氢[31-33]等领域具有重要的潜在应用价值 (图 2利用上转换,提高光催化剂对光源的利用率)。三重态湮灭上转换用到的三重态光敏剂,如果能控制三重态的激发态性质,则可以赋予三重态湮灭上转换体系更多的功能[34-37]。

|
图 2 三重态湮灭上转换在 (a) 生物成像及 (b) 光解水产氢中的应用[31, 32] Fig.2 Application of TTA upconversion in bioimaging and hydrogen production by photolysis of water[31, 32] |
综上所述,对有机分子的三重激发态进行调控,将是今后光化学领域重要研究内容之一。但是目前有关三重态的研究面临一些挑战,如三重态涉及的光物理过程比单重态复杂,在仪器设备上的要求比单重态要高 (需要时间分辨光谱仪,如纳秒瞬态吸收光谱仪),分子结构-性质之间的规律也很不明确。针对这些问题,本文对近年来三重激发态研究领域的部分主要进展和存在的问题进行了总结,以飨读者,并希望国内有更多的学者投身于这一极具发展前景的研究领域。
1 有机分子三重激发态的产生与其基本性质简介由于电子自旋的禁阻作用,光激发一般并不能使有机分子直接产生三重激发态的布居 (S0→T1一般为强禁阻跃迁)[38]。有机分子被光激发后,一般要经过单重态布居及随后的系间窜越 (intersystem crossing, ISC),产生三重激发态布居。由于内转换的存在,最后产生的是T1态,而不是Tn态 (n>1)。分子结构直接决定了ISC的效率高低,但是分子结构与ISC之间的关系不是很明确。对此,近期有一些综述论文[16, 39]进行了探讨,本文不作进一步讨论。由于自旋禁阻和存在较大的能级差,T1→S0态的跃迁速率会比S1→T1态的跃迁速率慢很多,故相对于单重激发态,三重激发态一般有较长的寿命 (可达μs或ms以上)。较长的激发态寿命赋予了三重态很多独特的性质,如可引发高效的分子间能量转移或电子转移过程,因而可在光敏化单线态氧的产生和光催化等领域发挥重要的作用。而单重态的寿命很短 (ns),由于溶液中分子扩散的限制,很难引发分子间的能量转移或是电子转移过程[14]。
此外,对于有机分子来说,电子构型 (分子轨道填充) 相同的S1态和T1态相比,T1态的能量总是低于S1态的能量,这是由于电子交换作用 (electron exchange) 这一量子力学效应造成的[38]。电子交换能的大小 (J) 与两个电子所在的分子轨道的重叠程度正相关,所以对于一般的具有平面大π-共轭体系的有机分子来说,其前线分子轨道的电子J值很大,造成S1和T1态的能级差较大 (该能级差为2J)。大的能级差导致了两个结果:一是S1→T1的ISC变得很困难 (一般具有大平面共轭体系的有机分子的ISC都很弱);二是T1态的能级比S1态能级显著降低。这就要求研究者采取合适的手段或分子结构设计,使有机发色团的系间窜越能够有效发生。此外,具有较低能级的T1态,很可能不会驱动分子内电子转移过程 (PET),即在荧光分子探针研究中常见的PET对单重激发态的猝灭作用,并不一定能猝灭三重态,这在研究三重态的调控时需要特别加以注意。
2 可激活的光敏剂PDT光敏剂在受到光激发时,经过系间窜越,光敏剂的三重激发态得到布居,通过分子间能量转移,将通常状态的氧 (三重态) 敏化为具有较强氧化能力的单线态氧 (1O2),从而杀死肿瘤细胞[18, 40, 41]。为了提高光动力治疗的选择性,需要使用具有靶向能力的光敏剂,即光敏剂只在肿瘤组织环境中被激活 (如通过酸性条件或是与肿瘤相关的酶),而光敏剂处于正常组织中时是非激活状态,不能敏化单线态氧,这就涉及到对光敏剂三重激发态的调控。
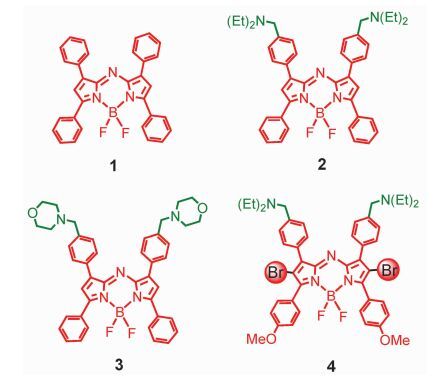
肿瘤组织是偏酸性的环境,所以可以利用酸使光敏剂得到激活[17, 42, 43],这就要求光敏剂在中性、碱性状态时三重态无布居或被猝灭。O’Shea设计了如图 3所示的分子4,使用氮杂Bodipy (化合物1为母体结构) 是由于其具有较长的吸收波长600~700 nm, 由于溴原子的存在,分子具有高效的ISC (重原子效应),引入可质子化的氨基,其目的是利用酸来调控三重态。研究发现,在酸的存在下,化合物2的荧光可增强56倍,而化合物3的荧光在酸性条件下也得到了增强。化合物4产生单线态氧的能力可增强10.6倍。未见对该系列化合物的三重激发态和PET过程的Gibbs自由能 (GCS) 的计算[44]。根据一些光谱数据及对氮杂Bodipy T1态能级的估算[45],氮杂Bodipy发色团T1态引发的PET比单重态引发的PET的驱动力小0.9 eV左右。所以,PET很可能并不是由化合物4的T1态驱动的,而是由S1态驱动的,即由S1态产生T1态 (ISC过程) 和PET过程是竞争的。飞秒瞬态吸收光谱的研究将有助于阐明该过程。
|
图 3 具有PET效应的氮杂Bodipy 1~4的分子结构 Fig.3 AzaBodipy derivatives 1-4 with PET effect |
肿瘤细胞往往与特定的酶相关联,如与肿瘤相关的成纤维细胞激活蛋白 (fibroblast activation protein,FAP)。FAP是一种内源性肽酶,可以合成该酶的肽底物,在短肽的两端分别连接光敏剂和猝灭基团 (如Black Hole Quencher,BHQ3。分子5中的偶氮基团),见图 4, 该底物分子内的短肽未被FAP切断时,光敏剂5不会产生1O2。其原因可能是由于分子内荧光共振能量转移,或是三重态能量转移。当肽底物被切断后,对光敏剂起猝灭作用的分子内能量转移终止,光敏剂在光照时即可产生1O2[46]。在靶向和可激活PDT光敏剂中,该分子结构设计方法得到了广泛的应用[47]。

|
图 4 酶激活的光动力治疗三重态光敏剂分子结构及机理示意图 Fig.4 Enzyme activated PDT triplet photosensitizer |
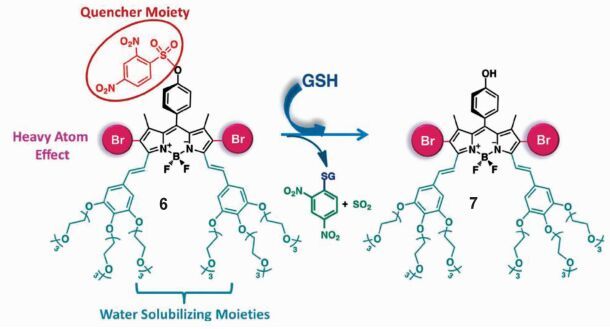
除了简单的氨基,其他基团也可以作为电子给体或受体,用于和发色团构成PET体系,达到调控三重态的目的。2, 4-二硝基苯磺酰基 (2, 4-dinitrobenzenesulfate,DNBS) 是强的电子受体,由于其磺酰胺可被巯基化合物切断,所以DNBS基团被广泛用于荧光探针的分子设计,检测巯基化合物[48-51]。人们借鉴了这种分子结构设计方法,制备了连接有DNBS基团的溴化Bodipy衍生物 (图 5),期望利用相同的机理调控光敏剂产生单重态氧的能力。实验发现,在谷胱甘肽的存在下,光敏剂6的敏化单线态氧的能力得到了很大增强[52]。但未见对调控机理进行详细研究。
|
图 5 含有DNBS基团的PET型三重态光敏剂激活前后分子结构示意图[52] Fig.5 PET based triplet photosensitizer with DNBS moiety which could be activated by thiols (or sulfhydryl compounds)[52] |
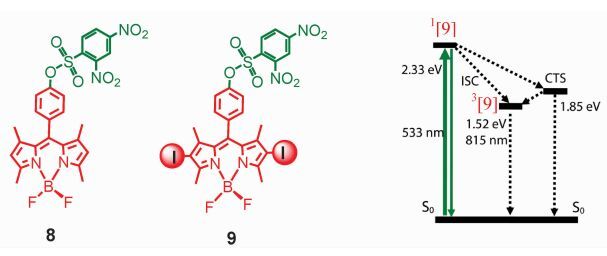
为比较DNBS对同一发色团的单重态和三重态的调控效果,我们研究了DNBS基团对化合物8的荧光和化合物9敏化单线态氧的能力的影响 (图 6) [53]。制备化合物9的目的是希望研究可用巯基化合物激活的三重态湮灭上转换体系。与母体Bodipy化合物相比,连接DNBS基团后化合物8的荧光几乎完全猝灭,表明DNBS作为电子受体,能够通过PET过程有效地猝灭Bodipy的单重激发态。但是,化合物9表现出很高的单线态氧量子产率 (ΦΔ=74%),表明其三重态并没有被PET作用猝灭。在巯基化合物的存在下,化合物8的荧光增强了近100倍,而化合物9的敏化单线态氧的能力仅略有增强 (ΦΔ=88%)。以上结果表明,对于Bodipy发色团来说,DNBS基团可通过PET作用很有效地猝灭其单重激发态 (荧光),而不能猝灭其三重激发态。我们利用纳秒瞬态吸收光谱证实了这种推测[53]。
|
图 6 利用DNBS对Bodipy单重激发态 (化合物8) 和三重激发态 (化合物9) 的猝灭[53] Fig.6 Comparison of the different quenching effect of DNBS on the singlet excited state (fluorescence 8) and the triplet state of Bodipy chromophore (9) [53] |
为了详细研究产生这种差异的原因,我们计算了PET过程的Gibbs自由能变化 (ΔGCS),以及电荷分离态 (Charge transfer state, CTS) 的能级,并分别与化合物8和9的单重态能级和三重态能级进行了比较。结果发现,CTS的能级比化合物8的S1单重态能级低,此外,ΔGCS为负值 (PET过程是热力学允许的),所以可用PET作用来解释化合物8荧光被猝灭。但对于化合物9,CTS的能级比其T1三重态能级高。如果假设以发色团的三重态驱动PET (Weller公式中的E00一项),那么ΔGCS为正值 (PET过程是热力学禁阻的)。这些结果表明,不能简单地利用荧光研究中的PET作用来猝灭相同发色团的三重态。
但是,不能排除在某些情况下PET可以猝灭三重态。有报道设计了基于磷光发射的分子探针,并证明可以利用分子间的各种作用,或是化学反应来控制磷光发射[15],但是这些文献均未对其详细的光物理过程进行研究。
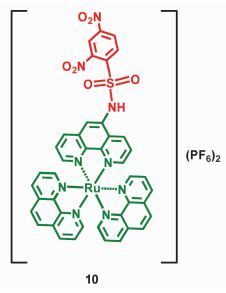
Ru (bpy)3X2[bpy= 2, 2′-bipyridine,X=Cl-、PF6-等阴离子]配合物是典型的磷光化合物,其具有辐射跃迁能力的T1态具有MLCT的特征 (金属到配体的电子转移)[54]。利用这一性质,我们在Ru (Ⅱ) 配合物分子中引入电子受体DNBS基团 (化合物10,图 7),以此来破坏MLCT跃迁的形成,使磷光猝灭。在巯基化合物的存在下,DNBS基团被切除,MLCT跃迁恢复,配合物的磷光强度增加了90倍,与分子设计的预期相符[55]。对分子轨道的初步分析表明,化合物10的LUMO位于DNBS基团上,即配合物发光的MLCT态的生成受到了抑制。但未对该化合物进行电子转移自由能的计算和飞秒瞬态吸收光谱的研究。
|
图 7 检测巯基化合物的Ru (Ⅱ) 配合物磷光探针 Fig.7 The structure of Ru (Ⅱ) metal complex phosphorescent thiol probe |
分子被激发以后,其氧化能力和还原能力会同时得到增强[38]。所以在Ru (Ⅱ) 配合物分子中引入电子给体,同样有可能猝灭三重态 (上述DNBS基团是电子受体)。袁景利等[56]设计制备了含有二氨基苯基的Ru (Ⅱ) 配合物11,用于检测一氧化氮 (图 8)。分子中的二氨基苯基基团是电子给体。在无NO时,配合物的发光很弱,而NO存在时,1, 2-二氨基基团与NO反应生成三唑结构,失去给电子能力,相应的配合物的磷光增强了16倍。但未见对猝灭机理的详细研究,特别是飞秒和纳秒瞬态吸收光谱的研究。

|
图 8 检测一氧化氮 (NO) 的Ru配合物探针 (a) 机理图 (b) 磷光猝灭图 (c) 飞秒瞬态吸收图[56] Fig.8 (a) Mechanism (b) phosphorescent quenching spectra (c) fs-TA spectra of Ru (Ⅱ) metal complex phosphorescent NO probe[56] |
为了阐明该配合物的磷光猝灭机理,并研究利用NO调控的三重态湮灭上转换 (triplet-triplet annihilation upconversion) 的可行性,我们利用纳秒和飞秒瞬态吸收光谱,对配合物的光物理过程进行了详细研究[36]。通过对母体配合物的研究发现,Ru (Ⅱ) 配合物的ISC过程是可在100 fs内完成的超快光物理过程。配合物的fs TA光谱表明,在三重态生成以后,电子转移或电荷分离态 (charge transfer state,CTS) 的形成在480 ps (1/kcs) 范围内产生,磷光发射来不及发生 (发光寿命在μs时间尺度),所以该配合物的磷光被猝灭。同时,Ru (Ⅱ) 配位中心被还原,生成了Ru (bpy)3+·物种 (在505 nm处观察到Ru (bpy)3+·的特征吸收峰)。电荷分离态在5.5 ns范围内通过电荷复合 (charge recombination),以非辐射跃迁的方式弛豫到基态 (S0态)。电荷复合的速率比电荷分离的速率慢,这是光驱动电荷分离体系的普遍特征,因为电荷复合过程一般进入了描述电子转移的Marcus理论的反转区 (inverted region)[2, 38]。在上述基础上,我们利用该配合物成功进行了NO调控的TTA上转换研究[36]。
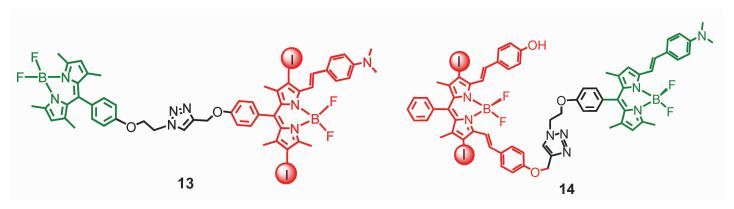
可以利用某些发色团分子内电荷转移 (intramolecular charge transfer, ICT) 的性质来调控三重态性质[57]。化合物13和14都含有不同结构的两个发色团,因此这两种化合物都是具有宽谱带可见光吸收能力的化合物[58]。在分子13中,具有大共轭体系的Bodipy单元是单重态能量受体、自旋转换单元 (因为连接有碘原子,具有ISC能力),同时其单重态能级较低。实验证明,在极性溶剂中,利用纳秒瞬态吸收光谱观察不到三重态的信号,其原因可能是ICT作用。此前已有报道[59],该单元 (不含碘原子) 的荧光在高极性溶剂中因ICT作用而被猝灭,而在非极性溶剂 (如甲苯) 中则能观察到三重态的信号,并且根据基态漂白峰 (ground state bleaching, GSB) 的位置可知三重态是位于含碘的Bodipy单元上。
加入酸使分子13中的氨基质子化后,即使在极性溶剂中,仍可以观察到三重态信号 (此时三重态仍位于大共轭Bodipy单元上),原因可能是氨基质子化后,ICT作用受到了抑制,不能再猝灭三重态。该实验结果表明,二甲氨基取代的Bodipy单元的三重态在极性溶剂中寿命很短,而质子化能使三重态寿命延长 (3.1 μs),该性质与含类似结构、不含碘取代的Bodipy化合物的荧光性质类似[59]。推测可能是分子内电荷转移猝灭了单重态和三重态,但是缺乏具体的实验证据。
对于分子14, 在极性溶剂中观察不到三重态,推测应该是二甲氨基取代Bodipy部分的三重态能级较低,会发生从含碘Bodipy部分到二甲氨基取代Bodipy单元的分子内三重态能量转移,进而由于二甲氨基取代Bodipy单元的ICT作用使三重态猝灭。而在非极性溶剂中则可以观察到三重态信号,并且三重态是位于碘取代Bodipy单元,推测此时二甲氨基取代Bodipy单元的三重态能级相对较高,不再是三重态能量受体。由此可见,利用溶剂的极性变化,并结合发色团的ICT作用,即有可能达到控制三重态性质的目的。
|
图 9 对酸有响应的Bodipy三重态光敏剂13和14 Fig.9 Acid-responsive Bodipy based triplet photosensitizer dyad |
具有三重态布居的分子,可以通过能量转移使三重态猝灭,这方面最具有代表性的例子是氧 (O2,空气中的氧分为三重态) 对有机分子三重态的猝灭[60]。其猝灭规律符合Stern-Volmer关系,可相应地获得以磷光法检测氧的分子探针,读者可参考相关文献[60-63],本文在此不作进一步讨论。
与单重激发态不同的是,不同发色团的三重态寿命差别很大,而不同发色团的单重态寿命则相近 (一般在几个ns的量级)。三重态的寿命长短对光敏剂的性能有重要影响,因为三重态寿命决定了分子间三重态能量转移、电子转移的效率。此外,与单重态研究中的FRET单向能量转移不同,在三重态的研究中,可以观察到“乒乓能量转移”(ping-pong energy transfer) 过程,即先后发生方向相反的单重态能量转移、三重态能量转移[58, 64-66]。因此,通过将具有合适激发态能级的、两个不同的发色团连接起来,可以构筑“乒乓能量转移”分子体系,改变三重态的空间布居位置 (位于不同的发色团上),改变三重态的性质,进而改变光敏剂的性质。通过“乒乓能量转移”,除了可以改变三重激发态的寿命,还可以改变光敏剂的激发态氧化还原电位 (两个性质都与发色团的结构有关),从而对光敏剂的光催化性质造成影响。
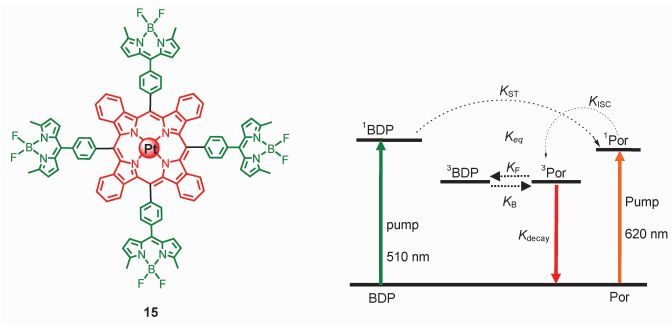
具有乒乓能量转移过程的一个代表性分子为配合物15(图 10) [65]。在该分子中,4个Bodipy单元通过C—C单键共价连接在苯并卟啉铂配合物单元上,两种发色团之间没有π-共轭作用,所以两种发色团会保持各自的光物理性质。稳态发光光谱的研究表明,化合物15的发光为苯并卟啉铂配位单元的发光 (770 nm),Bodipy单元的发光完全被猝灭,表明存在由Bodipy向苯并卟啉铂配位单元的单重态能量转移。飞秒瞬态吸收光谱研究表明,当选择性激发Bodipy单元时,由Bodipy单元向苯并卟啉铂配位单元的FRET过程的时间为1.29 ps (1/kFRET),随后,苯并卟啉铂配位单元发生超快ISC过程 (400 fs)。fs TA还表明,随后发生了由苯并卟啉铂配位单元向Bodipy单元的反向三重态能量转移,时间为99.6 ps。再经过约300 ps,建立了Bodipy单元和苯并卟啉铂配位单元的三重态平衡。纳秒瞬态吸收光谱表明,两个发色团的三重态处于快速的平衡之中,因为二者的弛豫 (T→S0) 时间相同 (67 μs)。应当指出,苯并卟啉铂配位单元本身的三重态寿命为30 μs。所以,通过乒乓能量转移,建立三重态在两个发色团上的平衡,改变了三重态的寿命。
|
图 10 具有乒乓能量转移的Bodipy-苯并卟啉铂配合物结构式及能级图[65] Fig.10 Bodipy-tetraphenyl-tetrabenzporphyrin Pt (Ⅱ) complex shows ping-pong energy transfer[65] |
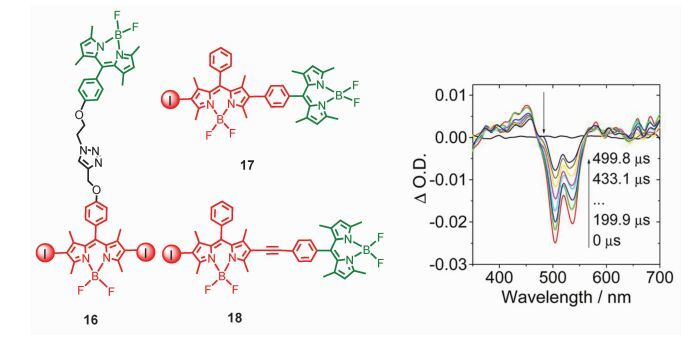
我们课题组在有机分子体系中观察到了类似的乒乓能量转移过程[67]。在化合物16、17、18中 (图 11),通过使用柔性、刚性,以及不同长度的连接链,将两个不同的Bodipy发色团连接在一起,其中一个Bodipy发色团的π-共轭体系上连接有碘原子,以确保其有高效的ISC过程,使三重激发态得到布居[68]。
|
图 11 具有乒乓能量转移的Bodipy有机体系分子结构及纳秒瞬态吸收谱图 Fig.11 Ping-pong energy transfer in Bodipy dyads: molecular structure and ns TA spectra |
稳态和瞬态光谱表明,在这些分子中存在乒乓能量转移,最终在分子中建立了快速的三重态平衡,其三重态寿命和Bodipy单元本身的寿命相比,得到了不同程度的延长。此外,我们通过纳秒瞬态吸收光谱证实,反向的三重态能量转移过程主要是分子内过程,这是因为我们在实验中发现分子间的三重态能量转移过程是一个很慢的过程 (μs时间范围),溶液中分子间过程会受溶液中分子扩散速率的限制[58]。最近,陈玉哲等[69]将类似的Bodipy单元通过氢键作用组装在一起,观察到了类似的光物理过程。可见,通过共价键或非共价键,将具有合适激发态能级的不同发色团连接在一起,构成乒乓能量转移体系,是改变分子三重态性质的独特方法,该方法在FRET研究中很难实现,目前也未见报道。
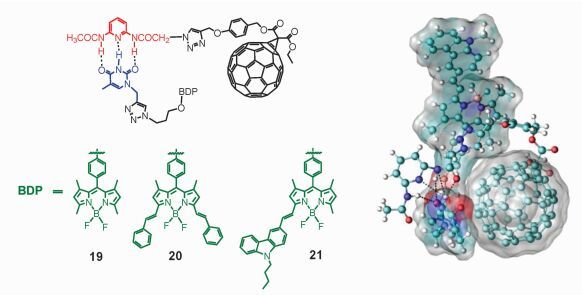
本课题组还进行了氢键连接的Bodipy-C60有机分子体系的乒乓能量转移 (图 12) 方面的研究[70, 71]。C60有一个尚未被充分研究利用的性质是具有高效的ISC (量子效率接近100%)[72],而其缺点是可见光吸收能力较弱,所以从吸收光的能力来说,C60本身并不是一种理想的光敏剂,但可以通过共价键连接吸光基团、构建C60-吸光团的二元化合物 (dyad) 来解决这个问题[73-75]。我们将具有强可见光吸收能力的Bodipy基团 (可改变其结构从而调节吸光波长、调整三重态能级) 与C60共价连接,证明其可高效产生三重激发态,并已成功用于三重态湮灭上转换、光催化有机合成反应[76-83]。
|
图 12 C60-吸光团的二元化合物氢键体系结构式及分子动力学模拟的分子构象[70] Fig.12 Hydrogen bonding in C60-Bodipy dyad: structure and one of the possible folded geometry obtained by molecular dynamics simulation[70] |
将不同的Bodipy吸光团连接在胸腺嘧啶单元上,而将1, 6-二氨基吡啶单元与C60单元连接,通过胸腺嘧啶单元与二氨基吡啶单元之间的氢键作用,可以方便地研究不同结构的Bodipy单元和C60单元组成超分子体系时,其单重态和三重态能量转移的情况 (图 12) [70]。通过一系列稳态与瞬态光谱的研究表明,当化合物19与C60单元通过氢键形成超分子组装体时,发生了由Bodipy向C60单元的单向单重态能量转移,组装体的T1态定域在C60单元上,三重态寿命为40 μs左右。而当化合物20和化合物21与C60通过氢键进行超分子组装后,发生了乒乓能量转移,即由Bodipy单元向C60单元的单重态能量转移,C60单元发生ISC,而后向Bodipy单元的反向三重态能量转移,最终超分子组装体的T1态定域在Bodipy单元上,这是由于在化合物20和化合物21中,Bodipy单元具有较大的π-共轭体系,其三重态能级比C60的三重态能级低。化合物20和化合物21的超分子组装体系三重态寿命是100~200 μs。必须指出,虽然这些超分子组装体系中Bodipy单元和C60单元之间的连接单元很长,并由饱合键构成,但二者之间的三重态能量转移的速率很高 (<10 ns)。分子动力学模拟 (molecular dynamics simulation) 表明 (图 12),两个单元在溶液中可快速地由舒展的构象变为折叠 (靠近) 的构象,三重态能量转移一般是Dexter机理,要求发色团要相互靠近。因此,快速的组装体内三重态能量转移 (intra-assembly energy transfer) 是可能的。
在以上的例子中,单重态能量受体同时起着自旋转换单元的作用 (单重态能量受体具有系间窜越能力)。如果通过分子结构设计赋予单重态能量给体ISC的能力,那么ISC将受到FRET的竞争作用。为此,我们设计了一系列具有相互竞争作用的dyad,并研究了其光物理过程[84-86]。
本课题组设计合成了含有两个不同Bodipy单元的分子22(图 13),其中含碘取代的部分是单重态能量给体,同时具有ISC能力;具有大π-共轭体系的Bodipy单元是单重态和三重态能量受体[85]。稳态和瞬态光谱研究表明,存在由碘化Bodipy单元向具有大π-共轭体系的Bodipy单元的FRET作用,但其效率不是100%,表明一部分激发态发生了ISC。此外,化合物22的三重态位于具有大π-共轭体系的Bodipy单元上 (该单元本身并不具有ISC能力),所以推测分子内还存在三重态能量转移过程。飞秒瞬态吸收光谱表明,FRET所需时间大致为14 ps,比碘化Bodipy单元的ISC快 (约120 ps)[87]。故推测在分子22中,由于快速FRET过程的存在,碘化Bodipy部分的ISC过程受到抑制。单线态氧量子效率的测定表明,化合物22的单线态氧量子效率 (19%) 低于双碘Bodipy (85%),表明ISC过程确实受到了FRET过程的抑制。经过分子内三重态能量转移后,化合物22的T1态位于具有大π-共轭体系的Bodipy单元上,其三重态寿命 (385 μs) 远长于双碘Bodipy本身 (133 μs)[85]。
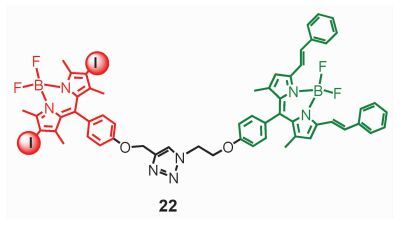
|
图 13 FRET与ISC竞争的Bodipy多元化合物 Fig.13 Bodipy dyad shows competing FRET and ISC processes |
除了使用Bodipy基团,我们还使用其他的发色团进行了具有相互竞争的FRET和ISC过程的多发色团化合物的研究,如NDI和PBI基团等[84, 86]。在分子23中 (图 14),分子两端的溴代NDI单元具有ISC能力,但是该单元同时是单重态能量给体[84]。通过稳态与瞬态吸收光谱的研究表明,该triad的三重态定域在分子中间部分的NDI单元上,说明光激发后,经历了分子内三重态能量转移。纳秒瞬态吸收光谱的研究表明,与分子间的三重态能量转移相比,分子内的三重态能量转移过程很快 (<10 ns)。化合物23的三重态寿命为276 μs,ISC单元本身的三重态寿命为60 μs, 相比之下有很大延长。该结果说明,通过三重态能量转移改变多发色团分子T1态的布居位置,可以改变三重激发态的性质 (如寿命等)。单重态氧量子产率 (ΦΔ) 的测定表明,化合物23的ΦΔ值比ISC单元本身的降低了40%左右,说明ISC受到了FRET的竞争作用。应当说明,多发色团的分子受光激发后,有时会发生光诱导电子转移 (photoinduced electron transfer, PET),或称电荷分离 (charge separation, CS),是否发生了CS以及电荷复合 (charge recombination, CR),可以通过自由能计算及fs TA进行证实。通常使用低极性溶剂 (如甲苯) 可以抑制CS的发生[84]。
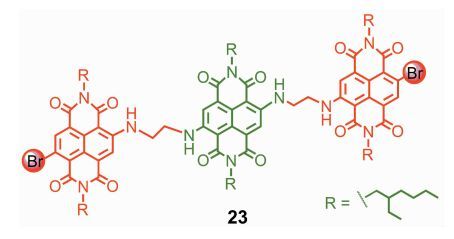
|
图 14 FRET与ISC竞争的萘酰亚胺多元化合物 Fig.14 Competition of FRET with ISC in NDI triad |
光致变色化合物早已为人们所熟知[88-92]。此类化合物受光激发时,其颜色会发生变化,实际上是伴随着分子结构的可逆变化, 其单重态能级发生了变化,导致可见吸收的变化,即颜色发生变化。可以推测,在光致变色过程中,伴随着分子结构的改变,分子的三重态能级也会发生变化。但是对后者的研究非常少,而利用这一过程设计功能分子或控制某些光物理过程的报道更少。
Cola等[93]制备了含有二噻吩乙烯 (dithienylethene, DTE) 光致变色单元的双核Ru (Ⅱ) 和Os (Ⅱ) 配合物 (图 15)。Ru (Ⅱ) 和Os (Ⅱ) 配合物具有高效的ISC能力,这些配合物的三重态可能会受到DTE单元的影响。对于双核Ru (Ⅱ) 配合物24-(o),选择性激发Ru (bpy)3配位结构单元时,经过超快ISC过程产生MLCT (metal-to-ligand-charge-transfer) 三重态,但随后发生向开环DTE单元的TTET过程,而DTE单元经过三重态路径发生光环化反应,生成闭环结构,即发生了敏化的DTE光致变色。由于TTET的存在,Ru (bpy)3单元的三重态被猝灭。而对于Os (Ⅱ) 配合物25-(o),由于Os (Ⅱ) 配位单元的三重态能级低于开环DTE单元的三重态能级,所以不会发生敏化的DTE闭环反应,Os (Ⅱ) 配位单元的三重态不会被猝灭。
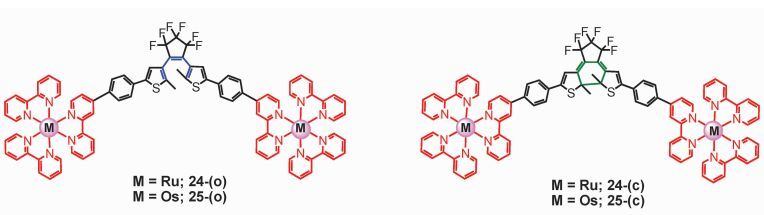
|
图 15 含有二噻吩乙烯光致变色单元的双核Ru (Ⅱ) 和Os (Ⅱ) 配合物 Fig.15 Structure of DTE-ruthenium or DTE-osmium complex |
我们利用DTE的光致变色对双碘Bodipy/苝体系的TTA上转换进行了可逆的光调控,实现了利用光照控制上转换在“开”“关”两个状态之间的可逆转换[94](图 16)。DTE开环结构的三重态能级约为1.97 eV,其闭环结构的三重态能级约为1.23 eV,而双碘Bodipy的三重态能级 (1.69 eV)、三重态能量受体/发光分子苝的三重态能级 (1.53 eV),二者均位于DTE开环体、闭环体三重态能级之间,所以我们推测,DTE开环结构不会猝灭双碘Bodipy和苝的三重态,TTA上转换可以进行;而DTE的闭环结构则会猝灭双碘Bodipy和苝的三重态,TTA上转换被抑制,即利用DTE单元的光致变色过程 (即光控三重态能级变化) 可以实现对TTA上转换的控制。稳态与瞬态光谱证明DTE对苝三重态的猝灭是主要的调控通道[94]。
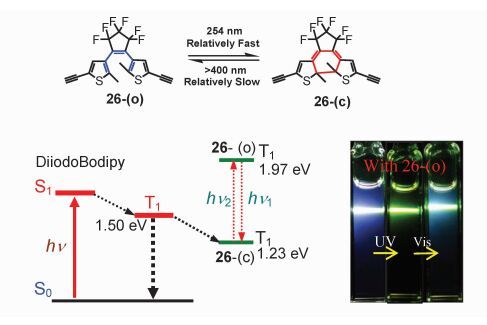
|
图 16 DTE对双碘Bodipy三重态的调控机理图及上转换照片[94] Fig.16 Switch of triplet state of diiodo-Bodipy using DTE via intermolecular TTET[94] |
此外,我们还将DTE与双碘Bodipy[95]、Bodipy单元[95, 96]或9, 10-二苯基蒽结构单元[97]共价连接,利用DTE的开环、闭环光反应,对Bodipy的单重态、三重态、二苯基蒽的单重态进行控制,从而实现对TTA上转换的调控 (图 17和图 18)。在双发色团分子中,往往会同时发生多种光物理过程,例如:闭环体的DTE和双碘Bodipy连接时,可能同时存在从双碘Bodipy单元到DTE单元的FRET和三重态能量转移过程[95]。在9, 10-二苯基蒽单元和DTE构成的三元化合物 (triad) 中,闭环DTE能够同时以FRET、分子内三重态-三重态能量转移、光诱导电子转移3种机理实现对TTA上转换的调控[97]。
|
图 17 DTE对双碘Bodipy单重态三重态的调控 Fig.17 Switch of singlet or triplet state of diiodo-Bodipy using DTE |
|
图 18 DTE对9, 10-二苯基蒽单重态的调控 Fig.18 Switch of singlet state of DPA using DTE |
对含光致变色单元的体系进行研究时有两点需要注意:一是光稳态的存在 (绝大多数光致变色体系,在双稳态之间的转化不可能达到100%),使溶液中多个光物理过程是并存的;二是起到猝灭作用的能量受体 (光致变色化合物的双稳态之一) 必须具有足够的动力学稳定性,否则, 体系的“开”“关”状态不能持续很久,如上面提到的DTE闭环体的光开环量子效率只有4.5%,作为能量受体,既使存在"敏化"作用,仍具有足够的动力学稳定性,从而保证上转换“关”状态的持续存在[94]。
5 三重态调控与单重态调控的差异人们对单重激发态的调控已经积累了相当的经验,例如,对荧光进行调控最常见的方法是PET。但是初步的研究表明,不能简单地把荧光研究中的规律和经验应用于三重态的调控。原因之一是,对于同一种发色团,特别是具有大π-共轭体系的发色团,其T1态的能级比S1态的能级往往低很多,其驱动电荷分离的能力弱很多 (由于Gibbs自由能的变化)。下面介绍我们在工作发现的三重态和单重态不同的猝灭规律。
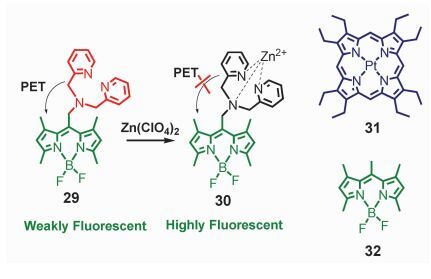
分子BDP-DPA是典型的基于PET机理的荧光分子探针结构类型,PET作用猝灭了荧光 (图 19)。通过与Zn2+离子的络合PET被抑制,Bodipy基团的荧光发生恢复[98]。在PET猝灭Bodipy单元单重态 (荧光) 的同时,三重态是否被PET过程猝灭了?研究结果表明,Bodipy发色团的三重态并没有被PET作用所猝灭[99]。BDP-DPA分子在和Zn2+络合后,其荧光量子效率增加了约3倍。由于BDP-DPA分子结构中不含重原子,没有ISC能力,不能利用光激发使三重态得到布居,所以为了使BDP-DPA分子的三重态得到布居,我们使用了分子间三重态敏化的方法,采用PtOEP (分子31) 做为光敏剂,通过激发PtOEP,利用分子间三重态能量转移使BDP-DPA的三重态得到布居。利用纳秒瞬态吸收光谱研究BDP-DPA的三重态信号的O.D.值、三重态寿命,并与相同实验条件下的BDP的信号进行对比[99], 发现二者结果相近,说明在BDP-DPA分子中,虽然单重态 (S1态) 被PET作用猝灭了 (表现为荧光被猝灭),但是T1态并没有被PET猝灭。对由Bodipy单重态以及三重态驱动的PET过程的Gibbs自由能 (ΔGCS) 计算表明,单重态驱动PET的ΔGCS值为负值 (根据溶剂的极性大小,ΔGCS值在-0.09 eV~-1.05 eV范围),表明单重态驱动PET是热力学允许的过程。而对Bodipy三重态驱动的PET过程的Gibbs自由能 (ΔGCS) 计算表明,三重态驱动PET的ΔGCS值为正值 (根据溶剂的极性大小,ΔGCS值在+0.64 eV~+0.18 eV范围),表明三重态驱动PET是热力学禁阻的过程,即三重态不会被PET猝灭。
|
图 19 PET型锌离子荧光分子探针 Fig.19 Zn2+ selective sensor via PET mechanism |
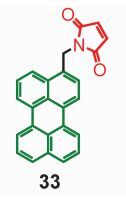
以上规律并不局限于Bodipy发色团,我们在含其他发色团的分子中发现了同样的结果。例如,苝是一种在TTA上转换中经常使用的三重态受体 (同时是TTA上转换中的发光分子,annihilator/emitter),为了对以苝作为三重态受体的上转换体系进行调控,我们在苝发色团上连接了马来酰亚胺基团,该基团在荧光分子探针中用作电子受体,利用其和巯基的加成反应,达到选择性检测巯基化合物的目的。此处分子结构设计的出发点是,利用巯基化合物和马来酰亚胺基团的加成反应,通过控制延迟荧光发射,达到控制上转换的目的[37]。
实验表明,和巯基化合物发生加成反应后PET过程终止,化合物33(见图 20) 的荧光量子效率增强了100倍以上。但是利用分子间三重态敏化, 使化合物33的三重态得到布居后发现,在荧光被PET猝灭的同时,化合物33的三重态寿命并没有发生变化,同时,通过纳秒瞬态吸收光谱中的光密度值判断,其三重态也没有被猝灭。化合物33的性质清楚表明其单重态 (荧光) 能够有效地被PET调控,但是该分子的三重态并不能被PET所猝灭。ΔGCS值和电荷分离态能级计算也表明,化合物33的单重态可以驱动PET (即单重态可以被PET猝灭),但是三重态却不能驱动PET,即三重态不能被PET猝灭[37]。
|
图 20 PET调控上转换受体苝-马来酰亚胺化合物 Fig.20 Thiol-activatable maleimide-perylene complex |
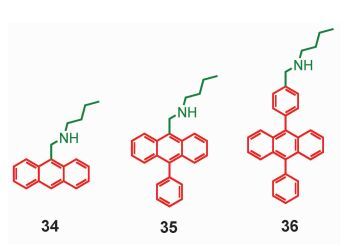
利用蒽发色团观察到了类似的规律[100]。分子34、35、36存在不同程度的PET作用 (图 21),所以蒽单元的荧光在34和35分子中被猝灭,但在36分子中并没有被猝灭。利用分子和 (Boc)2O的反应可以抑制PET使荧光恢复。但是相同条件下的纳秒瞬态吸收光谱表明,在化合物34和35中,三重态并没有被PET所猝灭,这与荧光性质不同。
|
图 21 PET调控蒽类衍生物的单重态 Fig.21 Anthracene complex with PET effect |
综上,对Bodipy、苝、蒽3种发色团的研究表明,发色团的单重激发态可以被PET猝灭,但是三重激发态却不能被PET猝灭。该实验结果及其揭示的规律,对有机分子激发态的研究及有机功能分子的设计具有一定的意义,例如在设计可被外部条件激活的PDT试剂时,需考虑到PET是不是真正具有调控分子三重态性质的能力,从而提高分子结构设计的成功率。
6 结论与展望对分子的激发态性质进行控制可赋予分子诸多功能,具有代表性的例子是荧光分子探针的设计,即利用与被检测物的作用,通过某种机理 (如光诱导电子转移、PET) 实现对单重激发态的控制。类似地,如果能够控制分子的三重态性质,那么将有望制备多种具有新颖性质的分子,如可激活的PDT光敏剂、磷光分子探针与标识试剂,以及可控的三重态湮灭上转换等等。现有研究结果表明,三重态的调控规律与单重态的调控规律有所不同,如发色团的单重激发态 (荧光) 往往可以被光诱导电子转移 (PET) 所猝灭,但相同发色团的三重态并不能被PET所猝灭。本文总结的研究结果及所进行的分析讨论,将对该领域的后续研究起到一定的促进作用。
致谢 感谢国家自然科学基金委 (21273028, 21473020, 21673031, 21421005)、教育部 (SRFDP-20120041130005)、长江学者创新团队 (IRT_132206) 和大连理工大学 (DUT16TD25, DUT15ZD224, DUT2016TB12) 的资助。| [1] |
吴世康.
超分子光化学导论[M]. 北京: 科学出版社, 2005.
Wu S K. Introduction to Supramolecular Photochemistry[M]. Bejing: Science Press, 2005. |
| [2] |
樊美公, 佟振合.
分子光化学[M]. 北京: 科学出版社, 2013.
Fan M G, Tong Z H. Molecular Photochemistry[M]. Beijng: Science Press, 2013. |
| [3] |
姜月顺.
光化学[M]. 北京: 化学工业出版社, 2005.
Jiang Y S. Photochemistry[M]. Beijng: Chemical Industry Press, 2005. |
| [4] | Silva A P D, Gunaratn H Q, Gunnlaugsson T, Huxley A J, McCoy C P, Rademacher J T, Rice T E. Signaling recognition events with fluorescent sensors and switches[J]. Chemical Reviews, 1997, 97(5): 1515–1566. DOI:10.1021/cr960386p |
| [5] | Qu Y, Hua J L, Tian H. Colorimetric and ratiometric red fluorescent chemosensor for fluoride ion based on diketopyrrolopyrrole[J]. Organic Letters, 2010, 12(12): 3320–3323. |
| [6] | Wang S S, Liu H, Mack J, Tian J W, Zou B, Lu H, Li Z F, Jiang J X, Shen Z. A BODIPY-based 'turn-on' fluorescent probe for hypoxic cell imaging[J]. Chemical Communications, 2015, 51(69): 13389–13392. DOI:10.1039/C5CC05139H |
| [7] | Tang B, Yin L L, Wang X, Chen Z Z, Tong L L, Xu K H. A fast-response, highly sensitive and specific organoselenium fluorescent probe for thiols and its application in bioimaging[J]. Chemical Communications, 2009, 22(35): 5293–5295. |
| [8] | Yu X T, Jia X, Yang X L, Liu W S, Qin W W. Synthesis and photochemical properties of BODIPY-functionalized silica nanoparticles for imaging Cu2+ in living cells[J]. RSC Advances, 2014, 4(45): 23571–23579. DOI:10.1039/C4RA03183K |
| [9] | Liu Z P, He W J, Guo Z J. Metal coordination in photoluminescent sensing[J]. Chemical Society Reviews, 2013, 42(4): 1568–1600. DOI:10.1039/c2cs35363f |
| [10] | Jiang X D, Su Y J, Yue S, Li C, Yu H F, Zhang H, Sun C L, Xiao L J. Synthesis of mono-(p-dimethylamino) styryl-containing BOPHY dye for a turn-on pH sensor[J]. RSC Advances, 2015, 5(22): 16735–16739. DOI:10.1039/C4RA15914D |
| [11] | Cheng T Y, Xu Y F, Zhang S Y, Zhu W P, Qian X H, Duan L P. A highly sensitive and selective off-on fluorescent sensor for Cadmium in aqueous solution and living cell[J]. Journal of the American Chemical Society, 2008, 130(48): 16160–16161. DOI:10.1021/ja806928n |
| [12] | Yu H B, Xiao Y, Jin L J. A lysosome-targetable and two-photon fluorescent probe for monitoring endogenous and exogenous nitric oxide in living cells[J]. Journal of The American Chemical Society, 2012, 134(42): 17486–17489. DOI:10.1021/ja308967u |
| [13] | Li H L, Fan J L, Wang J Y, Tian M Z, Du J J, Sun S G, Sun P P, Peng X J. A fluorescent chemodosimeter specific for cysteine: effective discrimination of cysteine from homocysteine[J]. Chemical Communications, 2009, 45(39): 5904–5906. |
| [14] | Lakowicz J R. Principles of Fluorescence Spectrosopy[M]. 2nd ed. New York: Kluwer Academic, 1999. |
| [15] | Zhao Q, Li F Y, Huang C H. Phosphorescent chemosensors based on heavy-metal complexes[J]. Chemical Society Reviews, 2010, 39(8): 3007–3030. DOI:10.1039/b915340c |
| [16] | Zhao J Z, Wu W H, Sun J F, Guo S. Triplet photosensitizers: from molecular design to applications[J]. Chemical Society Reviews, 2013, 42(12): 5323–5351. DOI:10.1039/c3cs35531d |
| [17] | Tian J W, Ding L, Xu H J, Shen Z, Ju H G, Jia L, Bao L, Yu J S. Cell-specific and pH-activatable rubyrin-loaded nanoparticles for highly selective near-infrared photodynamic therapy against cancer[J]. Journal of the American Chemical Society, 2013, 135(50): 18850–18858. DOI:10.1021/ja408286k |
| [18] | Wilke B M, Castellano F N. Photochemical upconversion: a physical or inorganic chemistry experiment for undergraduates using a conventional fluorimeter[J]. Journal of Chemical Education, 2013, 90(6): 786–789. DOI:10.1021/ed300142z |
| [19] | Gu X, Fei T, Zhang H Y, Xu H, Yang B, Ma Y G, Liu X D. Tuning the emission color of Iridium (Ⅲ) complexes with ancillary ligands: a combined experimental and theoretical study[J]. European Journal of Inorganic Chemistry, 2009, 16: 2407–2414. |
| [20] | Liu Y, Ye K Q, Fan Y, Song W F, Wang Y, Hou Z M. Amidinate-ligated Iridium (Ⅲ) bis (2-pyridyl) phenyl complex as an excellent phosphorescent material for electroluminescence devices[J]. Chemical Communications, 2009, 25(25): 3699–3701. |
| [21] | Zhang J, Zhao F C, Zhu X J, Wong W K, Ma D, Wong W Y. New phosphorescent Platinum (Ⅱ) schiff base complexes for pholed applications[J]. Journal of Materials Chemistry, 2012, 22(32): 16448–16457. DOI:10.1039/c2jm32266h |
| [22] | Yang Y C, Guo Q L, Chen H C, Zhou Z K, Guo Z J, Shen Z. Thienopyrrole-expanded BODIPY as a potential NIR photosensitizer for photodynamic therapy[J]. Chemical Communications, 2013, 49(38): 3940–3942. DOI:10.1039/c3cc40746b |
| [23] | Kamkaew A, Lim S H, Lee H B, Kiew L V, Chung L Y, Burgess K. BODIPY dyes in photodynamic therapy[J]. Chemical Society Reviews, 2013, 42(1): 77–88. DOI:10.1039/C2CS35216H |
| [24] | Yan T, Yang H R, Sun H B, Liu S J, Wang J X, Zhao Q, Liu X M, Xu W J, Li S B, Wei H. Rational design of an "off-on" phosphorescent chemodosimeter based on an Iridium (Ⅲ) complex and its application for time-resolved luminescent detection and bioimaging of cysteine and homocysteine[J]. Chemistry-A European Journal, 2013, 19(4): 1311–1319. DOI:10.1002/chem.201203137 |
| [25] |
伍晚花, 郭颂, 赵建章. 三重态-三重态湮灭上转换的研究进展[J]. 中国科学:化学, 2012, 10: 1381–1398.
Wu W H, Guo S, Zhao J Z. Research progress of triplet-triplet annihilation upconversion[J]. Science China: Chemistry, 2012, 10: 1381–1398. |
| [26] |
张幸林, 杨会然, 孙会彬, 刘淑娟, 赵强, 黄维. 基于三线态-三线态湮灭的能量上转换[J]. 化学进展, 2012, 10: 1880–1889.
Zhang X L, Yang H R, Sun H B, Liu S J, Zhao Q, Huang W. The triplet-triplet annihilation upconversion[J]. Progress in Chemistry, 2012, 10: 1880–1889. |
| [27] | Zhao J Z, Ji S M, Guo H M. Triple-triplet annihilation based upconversion: from triplet sensitizers and triplet acceptors to upconversion quantum yields[J]. RSC Advances, 2011, 1(1): 937–950. |
| [28] | Xun Z Q, Zeng Y, Chen J P, Yu T J, Zhang X H, Yang G Q, Li Y. Pd-porphyrin oligomers sensitized for green-to-blue photon upconversion: the more the better?[J]. Chemistry-A European Journal, 2016, 22(25): 8654–8662. DOI:10.1002/chem.v22.25 |
| [29] | Wang B, Sun B, Wang X M, Ye C Q, Ding P, Liang Z Q, Chen Z G, Tao X T, Wu L Z. Efficient triplet sensitizers of Palladium (Ⅱ) tetraphenylporphyrins for upconversion-powered photoelectrochemistry[J]. Journal of Physical Chemistry C, 2015, 118(3): 1417–1425. |
| [30] | Askes S H C, Mora N L, Harkes R, Koning R I, Koster. B, Schmidt. T, Kros A, Bonnet S. Imaging the lipid bilayer of giant unilamellar vesicles using red-to-blue light upconversion[J]. Chemical Communications, 2015, 51(44): 9137–9140. DOI:10.1039/C5CC02197A |
| [31] | Liu Q, Yin B, Yang T S, Yang Y C, Shen Z, Yao P, Li F Y. A general strategy for biocompatible, high-effective upconversion nanocapsules based on triplet-triplet annihilation[J]. Journal of the American Chemical Society, 2013, 135(13): 5029–5037. DOI:10.1021/ja3104268 |
| [32] | Khnayzer R S, Blumhoff J, Harrington J A, Haefele A, Deng F, Castellano F N. Upconversion-powered photoelectrochemistry[J]. Chemical Communications, 2011, 48(2): 209–211. |
| [33] | Lissau J S, Gardner J M, Morandeira A. Photon upconversion on dye-sensitized nanostructured ZrO2 films[J]. Journal of Physical Chemistry C, 2014, 115(46): 23226–23232. |
| [34] | Mahmood Z, Toffoletti A, Zhao J Z, Barbon A. Photoswitching of triplet-triplet annihilation upconversion with photo-generated radical from hexaphenylbiimidazole[J]. Journal of Luminescence, 2017, 183: 507–512. DOI:10.1016/j.jlumin.2016.11.064 |
| [35] | Cui X N, Zhao J Z, Karatay A, Yaglioglu H G, Hayvali M, Küçüköz B. A Ru (bipyridine)3[PF6]2 complex with a rhodamine unit-synthesis, photophysical properties and application in acid-controllable triplet-triplet annihilation upconversion[J]. European Journal of Inorganic Chemistry, 2016, 32: 5079–5088. |
| [36] | Xu K J, Zhao J Z, Moore E G. Photo-induced electron transfer in a diamino-substituted Ru (bpy)3[PF6]2 complex and its application as a triplet photosensitizer for nitric oxide (NO)-activated triplet-triplet annihilation upconversion[J]. Photochemical & Photobiological Sciences Official Journal of the European Photochemistry Association & the European Society for Photobiology, 2016, 15(8): 995–1005. |
| [37] | Mahmood Z, Zhao J Z. Thiol-activatable triplet-triplet annihilation upconversion with maleimide-perylene as the caged triplet acceptor/emitter[J]. Journal of Organic Chemistry, 2015, 81: 587–594. |
| [38] | Turro N J, Ramamurthy V, Scaiano J C. Principles of Molecular Photochemistry: An Introduction[M]. University Science Books, 2009. |
| [39] | Marian C M. Spin-orbit coupling and intersystem crossing in molecules[J]. Wiley Interdisciplinary Reviews Computational Molecular Science, 2012, 2(2): 187–203. DOI:10.1002/wcms.83 |
| [40] |
高源, 乔光明, 李娜, 禚林海, 唐波. 光敏剂在癌症诊断和治疗中的研究新进展[J]. 分析化学, 2011, 39(12): 1926–1931.
Gao Y, Qiao G M, Li N, Zhuo L H, Tang B. New research progress of photosensitizer in diagnosis and treatment of cancer[J]. Analytical Chemistry, 2011, 39(12): 1926–1931. |
| [41] |
俞开潮, 程红, 金玲. 光动力治疗用酞菁类光敏剂的合成研究进展[J]. 影像科学与光化学, 2003, 21(2): 138–146.
Yu K C, Cheng H, Jing L. Research progress in synthesis of phthalocyanine photosensitizers for photodynamic therapy[J]. Imaging Science and Photochemistry, 2003, 21(2): 138–146. DOI:10.7517/j.issn.1674-0475.2003.02.138 |
| [42] | Erbascakmak S, Akkaya E U. Cascading of molecular logic gates for advanced functions: a self-reporting, activatable photosensitizer[J]. Angewandte Chemie International Edition, 2013, 52(43): 11364–11368. DOI:10.1002/anie.v52.43 |
| [43] | Jiang X J, Lo P C, Yeung S L, Fong W P, Ng D K P. A pH-responsive fluorescence probe and photosensitiser based on a tetraamino silicon phthalocyanine[J]. Chemical Communications, 2010, 46(18): 3188–3190. DOI:10.1039/c000605j |
| [44] | Mcdonnell S O, Hall M J, Allen L T, Byrne A, Gallagher W M, O'Shea D F. Supramolecular photonic therapeutic agents[J]. Journal of the American Chemical Society, 2005, 127(47): 16360–16361. DOI:10.1021/ja0553497 |
| [45] | Angelo D Q, Nino R, Emilia S. Structures and electronic absorption spectra of a recently synthesised class of photodynamic therapy agents[J]. Chemistry (Weinheim an der Bergstrasse, Germany), 2006, 12(26): 6797–6803. |
| [46] | Lo P C, Chen J, Stefflova K, Warren M S, Navab R, Bandarchi B, Mullins S, Tsao M, Cheng J D, Zheng G. Photodynamic molecular beacon triggered by fibroblast activation protein on cancer-associated fibroblasts for diagnosis and treatment of epithelial cancers[J]. Journal of Medicinal Chemistry, 2009, 52(2): 358–368. DOI:10.1021/jm801052f |
| [47] | Kamkaew A, Burgess K. Double-targeting using a Trkc ligand conjugated to dipyrrometheneboron difluoride (BODIPY) based photodynamic therapy (PDT) agent[J]. Journal of Medicinal Chemistry, 2013, 56(19): 7608–7614. DOI:10.1021/jm4012142 |
| [48] | Jiang W, Fu Q Q, Fan H Y, Ho J, Wang W. A highly selective fluorescent probe for thiophenols[J]. Angewandte Chemie International Edition, 2007, 46(44): 8445–8448. DOI:10.1002/(ISSN)1521-3773 |
| [49] | Chen X Q, Zhou Y, Peng X J, Yoon J Y. Fluorescent and colorimetric probes for detection of thiols[J]. Chemical Society Reviews, 2010, 41(42): 2120–2135. |
| [50] | Guo H M, Jing Y Y, Yuan X L, Ji S M, Zhao J Z, Li X H, Kan Y Y. Highly selective fluorescent OFF-ON thiol probes based on dyads of BODIPY and potent intramolecular electron sink 2, 4-dinitrobenzenesulfonyl subunits[J]. Organic & Biomolecular Chemistry, 2011, 9(10): 3844–3853. |
| [51] | Shao J Y, Sun H Y, Guo H M, Ji S M, Zhao J Z, Wu W T, Yuan X L, Zhang C L, James T D. A highly selective red-emitting fret fluorescent molecular probe derived from BODIPY for the detection of cysteine and homocysteine: an experimental and theoretical study[J]. Chemical Science, 2011, 3(4): 1049–1061. |
| [52] | Simsek T I, Pir C F, Cansen Y D, Rengul C A, Akkaya E U. Near-IR absorbing BODIPY derivatives as glutathione-activated photosensitizers for selective photodynamic action[J]. Chemistry, 2014, 20(49): 16088–16092. DOI:10.1002/chem.v20.49 |
| [53] | Zhang C S, Zhao J Z, Cui X N, Wu X Y. Thiol-activated triplet-triplet annihilation upconversion: study of the diffe-rent quenching effect of electron acceptor on the singlet and triplet excited states of Bodipy[J]. Journal of Organic Chemistry, 2015, 80(11): 5674–5686. DOI:10.1021/acs.joc.5b00557 |
| [54] | Campagna S, Puntoriero F, Nastasi F, Bergamini G, Balzani V. Photochemistry and Photophysics of Coordination Compounds: Ruthenium[M]. Springer Berlin Heidelberg, 2007: 117-214. |
| [55] | Ji S M, Guo H M, Yuan X L, Li X H, Ding H D, Gao P, Zhao C X, Wu W T, Wu W H, Zhao J Z. A highly selective OFF-ON red-emitting phosphorescent thiol probe with large stokes shift and long luminescent lifetime[J]. Organic Letters, 2010, 12(12): 2876–2879. DOI:10.1021/ol100999j |
| [56] | Zhang R, Ye Z Q, Wang G L, Zhang W Z, Yuan J L. Development of a Ruthenium (Ⅱ) complex based luminescent probe for imaging nitric oxide production in living cells[J]. Chemistry-A European Journal, 2010, 16(23): 6884–891. DOI:10.1002/chem.200903267 |
| [57] | Huang L, Yang W B, Zhao J Z. Switching of the triplet excited state of Styryl 2, 6-diiodo-BODIPY and its application in acid-activatable singlet oxygen photosensitizing[J]. Journal of Organic Chemistry, 2014, 79(21): 10240–10255. DOI:10.1021/jo5019014 |
| [58] | Cui X N, Zhang C S, Xu K J, Zhao J Z. Application of singlet energy transfer in triplet state formation: broadband visible light-absorbing triplet photosensitizers, molecular structure design, related photophysics and applications[J]. Journal of Materials Chemistry C, 2015, 3(34): 8735–8759. DOI:10.1039/C5TC01401H |
| [59] | Baruah M, Qin W W, Flors C, Hofkens J, Vallée R A L, Beljonne D, Auweraer M V D, Borggraeve W M D, Boens N. Solvent and pH dependent fluorescent properties of a dimethylaminostyryl borondipyrromethene dye in solution[J]. Journal of Physical Chemistry A, 2006, 110(18): 5998–6009. DOI:10.1021/jp054878u |
| [60] | Feng Y, Cheng J H, Zhou L, Zhou X G, Xiang H F. Ratiometric optical oxygen sensing: a review in respect of material design[J]. Analyst, 2012, 137(21): 4885–4901. DOI:10.1039/c2an35907c |
| [61] | Ji S M, Wu W H, Wu W T, Song P, Han K L, Wang Z G, Liu S S, Guo H M, Zhao J Z. Tuning the luminescence lifetimes of ruthenium (Ⅱ) polypyridine complexes and its application in luminescent oxygen sensing[J]. Journal of Materials Chemistry, 2010, 20(10): 1953–1963. DOI:10.1039/b916468e |
| [62] | Wu W H, Wu W T, Ji S M, Guo H M, Song P, Han K L, Chi L N, Shao J Y, Zhao J Z. Tuning the emission properties of cyclometalated platinum (Ⅱ) complexes by intramolecular electron-sink/arylethynylated ligands and its application for enhanced luminescent oxygen sensing[J]. Journal of Materials Chemistry, 2010, 20(43): 9775–9786. DOI:10.1039/c0jm01794a |
| [63] | Wu W H, Sun J F, Ji S M, Wu W T, Zhao J Z, Guo H M. Tuning the emissive triplet excited states of platinum (Ⅱ) Schiff base complexes with pyrene, and application for luminescent oxygen sensing and triplet-triplet-annihilation based upconversions[J]. Dalton Transactions, 2011, 40(43): 11550–11561. DOI:10.1039/c1dt11001b |
| [64] | Yarnell J E, Deaton J C, McCusker C E, Castellano F N. Bidirectional "Ping-Pong" energy transfer and 3000-fold lifetime enhancement in a Re (Ⅰ) charge transfer complex[J]. Inorganic Chemistry, 2011, 50(16): 7820–7830. DOI:10.1021/ic200974h |
| [65] | Whited M T, Djurovich P I, Roberts S T, Durrell A C, Schlenker C W, Bradforth S E, Thompson M E. Singlet and triplet excitation management in a bichromophoric near-infrared-phosphorescent BODIPY-benzoporphyrin pla-tinum complex[J]. Journal of American Chemical Society, 2011, 133(1): 88–96. DOI:10.1021/ja108493b |
| [66] | Lazarides T, McCormick T M, Wilson K C, Lee S, McCamant D W, Eisenberg R. Sensitizing the sensitizer: the synthesis and photophysical study of Bodipy-Pt (Ⅱ)(diimine)(dithiolate) conjugates[J]. Journal of American Chemical Society, 2011, 133(2): 350–364. DOI:10.1021/ja1070366 |
| [67] | Zhang C S, Zhao J Z, Wu S, Wang Z L, Wu W H, Ma J, Guo S, Huang L. Intramolecular RET enhanced visible light-absorbing Bodipy organic triplet photosensitizers and application in photooxidation and triplet-triplet annihilation upconversion[J]. Journal of American Chemical Society, 2013, 135(28): 10566–10578. DOI:10.1021/ja405170j |
| [68] | Wu W H, Guo H M, Wu W T, Ji S M, Zhao J Z. Organic triplet sensitizer library derived from a single chromophore (BODIPY) with long-lived triplet excited state for triplet-triplet annihilation based upconversion[J]. Journal of Organic Chemistry, 2011, 76(17): 7056–7064. DOI:10.1021/jo200990y |
| [69] | Ma Y Z, Xiao H Y, Yang X F, Niu L Y, Wu L Z, Tung C H, Chen Y Z, Yang Q Z. Bidirectional singlet and triplet energy transfer via the 2-ureido-4[J]. Journal of Physical Chemistry C, 2016, 120(30): 16507–16515. DOI:10.1021/acs.jpcc.6b05437 |
| [70] | Guo S, Xu L, Xu K J, Zhao J Z, Betül Küçüköz, Karatay A, Yaglioglu H G, Hayvalid M, Elmali A. Bodipy-C60 triple hydrogen bonding assemblies as heavy atom-free triplet photosensitizers: preparation and study of the singlet/triplet energy transfer[J]. Chemical Science, 2015, 6(7): 3724–3737. DOI:10.1039/C4SC03865G |
| [71] | Wang Z J, Zhao J Z, Guo S. Triplet-triplet energy transfer study in hydrogen bonding systems[J]. Chimia, 2015, 69(9): 524–529. DOI:10.2533/chimia.2015.524 |
| [72] | Arbogast J W, Darmanyan A P, Foote C S, Rubin Y, Diederich F N, Alvarez M M, Anz S J, Whetten R L. Photophysical properties of sixty atom carbon molecule (C60)[J]. Journal of Physical Chemistry, 1991, 95(1): 11–12. DOI:10.1021/j100154a006 |
| [73] | Feng K, Yu M L, Wang S M, Wang G X, Tung C H, Wu L Z. Photoinduced triplet-triplet energy transfer in a 2-ureido-4 (1H)-pyrimidinone-bridged, quadruply hydrogen-bonded ferrocene-fullerene assembly[J]. ChemPhysChem, 2013, 14(1): 198–203. DOI:10.1002/cphc.201200818 |
| [74] | Liu J Y, El‐Khouly M E, Fukuzumi S, Ng D K P. Photoinduced electron transfer in a distyryl BODIPY-fullerene dyad[J]. Chemistry-An Asian Journal, 2011, 6(1): 174–179. DOI:10.1002/asia.201000537 |
| [75] | Ziessel R, Allen B D, Rewinska D B, Harriman A. Selective triplet-state formation during charge recombination in a fullerene/Bodipy molecular dyad (Bodipy= borondipyrromethene)[J]. Chemistry-A European Journal, 2009, 15(30): 7382–7393. DOI:10.1002/chem.v15:30 |
| [76] | Wu W H, Zhao J Z, Sun J F, Guo S. Light-harvesting fullerene dyads as organic triplet photosensitizers for triplet-triplet annihilation upconversions[J]. The Journal of Organic Chemistry, 2012, 77(12): 5305–5312. DOI:10.1021/jo300613g |
| [77] | Huang L, Yu X R, Wu W H, Zhao J Z. Styryl Bodipy-C60 dyads as efficient heavy-atom-free organic triplet photosensitizers[J]. Organic Letters, 2012, 14(10): 2594–2597. DOI:10.1021/ol3008843 |
| [78] | Yang P, Wu W H, Zhao J Z, Huang D D, Yi X Y. Using C60-Bodipy dyads that show strong absorption of visible light and long-lived triplet excited states as organic triplet photosensitizers for triplet-triplet annihilation upconversion[J]. Journal of Materials Chemistry, 2012, 22(38): 20273–20283. DOI:10.1039/c2jm34353c |
| [79] | Huang D D, Zhao J Z, Wu W H, Yi X Y, Yang P, Ma J. Visible-light-harvesting triphenylamine ethynyl C60-BODIPY dyads as heavy-atom-free organic triplet photosensitizers for triplet-triplet annihilation upconversion[J]. Asian Journal of Organic Chemistry, 2012, 1(3): 264–273. DOI:10.1002/ajoc.v1.3 |
| [80] | Guo S, Sun J F, Ma L H, You W Q, Yang P, Zhao J Z. Visible light-harvesting naphthalenediimide (NDI)-C60 dyads as heavy-atom-free organic triplet photosensitizers for triplet-triplet annihilation based upconversion[J]. Dyes and Pigments, 2013, 96(2): 449–458. DOI:10.1016/j.dyepig.2012.09.008 |
| [81] | Huang L, Cui X N, Therrien B, Zhao J Z. Energy-funneling-based broadband visible-light-absorbing Bodipy-C60 triads and tetrads as dual functional heavy-atom-free organic triplet photosensitizers for photocatalytic organic reactions[J]. Chemistry-A European Journal, 2013, 19(51): 17472–17482. DOI:10.1002/chem.201302492 |
| [82] | Huang L, Zhao J Z. C60-Bodipy dyad triplet photosensitizers as organic photocatalysts for photocatalytic tandem oxidation/[J]. Chemical Communications, 2013, 49(36): 3751–3753. DOI:10.1039/c3cc41494a |
| [83] |
黄灵, 赵建章. 具有强可见光吸收的富勒烯-Bodipy衍生物作为光催化剂在硫醚光催化氧化中的应用[J]. 影像科学与光化学, 2014, 32(5): 471–483.
Huang L, Zhao J Z. Fullerene-Bodipy dyads and triad showing strong visible light absorption as photocatalysts in photocatalytic oxidation of sulfides[J]. Imaging Science and Photochemistry, 2014, 32(5): 471–483. DOI:10.7517/j.issn.1674-0475.2014.05.471 |
| [84] | Wu S, Zhong F F, Zhao J Z, Guo S, Yang W B, Fyles T. Broadband visible light-harvesting naphthalenediimide (NDI) triad: study of the intra-/intermolecular energy/electron transfer and the triplet excited state[J]. The Journal of Physical Chemistry A, 2015, 119(20): 4787–4799. DOI:10.1021/acs.jpca.5b01448 |
| [85] | Wang Z J, Xie Y, Xu K J, Zhao J Z, Glusac K D. Diiodobodipy-styrylbodipy dyads: preparation and study of the intersystem crossing and fluorescence resonance energy transfer[J]. The Journal of Physical Chemistry A, 2015, 119(26): 6791–6806. DOI:10.1021/acs.jpca.5b03463 |
| [86] | Mahmood Z, Xu K J, Kücüköz B, Cui X N, Zhao J Z, Wang Z J, Karatay A, Yaglioglu H G, Hayvali M, Elmali A. Diiodobodipy-perylenebisimide dyad/triad: preparation and study of the intramolecular and intermolecular electron/energy transfer[J]. The Journal of Organic Chemistry, 2015, 80(6): 3036–3049. DOI:10.1021/jo502899p |
| [87] | Sabatini R P, McCormick T M, Lazarides T, Wilson K C, Eisenberg R, McCamant D W. Intersystem crossing in halogenated Bodipy chromophores used for solar hydrogen production[J]. The Journal of Physical Chemistry Letters, 2011, 2(3): 223–227. DOI:10.1021/jz101697y |
| [88] | Tan W J, Zhang Q, Zhang J J, Tian H. Near-infrared photochromic diarylethene iridium (Ⅲ) complex[J]. Organic letters, 2009, 11(1): 161–164. DOI:10.1021/ol802580m |
| [89] | Wu Y, Xie Y S, Zhang Q, Tian H, Zhu W H, Li A D Q. Quantitative photoswitching in bis (dithiazole) ethene enables modulation of light for encoding optical signals[J]. Angewandte Chemie International Edition, 2014, 53(8): 2090–2094. DOI:10.1002/anie.201309915 |
| [90] |
吕光磊, 刘克印, 孟路燕, 易涛. 二芳乙烯荧光开关材料及其应用进展[J]. 影像科学与光化学, 2014, 32(1): 28–42.
Lu G L, Liu K Y, Meng L Y, Yi T. Development and application of diarylethene based fluorescent switch[J]. Imaging Science and Photochemistry, 2014, 32(1): 28–42. DOI:10.7517/j.issn.1674-0475.2014.01.028 |
| [91] | Pu S Z, Tong Z P, Liu G, Wang R J. Multi-addressable molecular switches based on a new diarylethene salicylal Schiff base derivative[J]. Journal of Materials Chemistry C, 2013, 1(31): 4726–4739. DOI:10.1039/c3tc30804a |
| [92] | Li B, Wang J Y, Wen H M, Shi L X, Chen Z N. Redox-modulated stepwise photochromism in a ruthenium complex with dual dithienylethene-acetylides[J]. Journal of the American Chemical Society, 2012, 134(38): 16059–16067. DOI:10.1021/ja3076204 |
| [93] | Jukes R T F, Adamo V, Hartl F, Belser P, Cola L D. Photochromic dithienylethene derivatives containing Ru (Ⅱ) or Os (Ⅱ) metal units. Sensitized photocyclization from a triplet state[J]. Inorganic Chemistry, 2004, 43(9): 2779–2792. DOI:10.1021/ic035334e |
| [94] | Cui X N, Zhao J Z, Zhou Y H, Ma J, Zhao Y L. Reversible photoswitching of triplet-triplet annihilation upconversion using dithienylethene photochromic switches[J]. Journal of the American Chemical Society, 2014, 136(26): 9256–9259. DOI:10.1021/ja504211y |
| [95] | Ma J, Cui X N, Wang F, Wu X Y, Zhao J Z, Li X W. Photoswitching of the triplet excited state of diiodobodipy-dithienylethene triads and application in photo-controllable triplet-triplet annihilation upconversion[J]. The Journal of Organic Chemistry, 2014, 79(22): 10855–10866. DOI:10.1021/jo5018662 |
| [96] | Xu K J, Zhao J Z, Cui X N, Ma J. Photoswitching of triplet-triplet annihilation upconversion showing large emission shifts using a photochromic fluorescent dithienylethene-Bodipy triad as a triplet acceptor/emitter[J]. Chemical Communications, 2015, 51(10): 1803–1806. DOI:10.1039/C4CC09202C |
| [97] | Xu K J, Zhao J Z, Cui X N, Ma J. Switching of the triplet-triplet-annihilation upconversion with photoresponsive triplet energy acceptor: photocontrollable singlet/triplet energy transfer and electron transfer[J]. The Journal of Physical Chemistry A, 2015, 119(3): 468–481. DOI:10.1021/jp5111828 |
| [98] | Wu Y K, Peng X J, Guo B C, Fan J L, Zhang Z C, Wang J Y, Cui A J, Gao Y L. Boron dipyrromethene fluorophore based fluorescence sensor for the selective imaging of Zn (Ⅱ) in living cells[J]. Organic & Biomolecular Chemistry, 2005, 3(8): 1387–1392. |
| [99] | Mahmood Z, Zhao J Z. The unquenched triplet excited state of the fluorescent OFF/ON Bodipy-derived molecular probe based on photo-induced electron transfer[J]. Photochemical & Photobiological Sciences, 2016, 15(11): 1358–1365. |
| [100] | Xu K J, Zhao J Z, Escudero D, Mahmood Z, Jacquemin D. Controlling triplet-triplet annihilation upconversion by tuning the PET in aminomethyleneanthracene derivatives[J]. The Journal of Physical Chemistry C, 2015, 119(42): 23801–23812. DOI:10.1021/acs.jpcc.5b05325 |




