水凝胶是一类以水为分散介质的凝胶,具有高度水合以及溶胀不溶解的三维交联网络结构[1]。由于其化学结构和力学特征的多样性,水凝胶可以高度拟合生物组织的微环境,为细胞或组织的生长提供一个有效的载体或支架材料,在生物医学领域具有广阔的应用前景[2-4]。特别是在组织工程和再生医学领域,水凝胶产品具有多种不同的功能应用,它们可以被用来填充缺损、传递生物活性分子和细胞组织、移植细胞、再生血管和器官等。
随着生物材料科学和组织工程领域的发展,研究者逐渐认识到周围基质的物理化学性质对于细胞行为的影响,如细胞周边的基质硬度、表面形貌和生长因子等环境变化会影响细胞的生长、代谢、分化、迁移等生理活动。因此,利用水凝胶人工构建仿生3D细胞外基质具有重大的生物和医学意义,特别是对细胞生物学的基础研究,如干细胞的诱导分化、神经细胞的信号传导、药物筛选的器官模型的构建,以及作为细胞载体用于组织工程与再生医学等应用均具有不可估量的价值。
近年来,为了实现水凝胶微环境的构筑,光作为一种有效的控制手段已经被应用于水凝胶的构筑及微环境性质调控中。与其它控制手段相比,光调控具有得天独厚的优势,包括时空可控、非直接侵入、低生物毒性等。总之,基于细胞微环境对于细胞命运的影响,可通过光调控技术时空可控地改变材料的物理化学性质,实现细胞在生物材料表面或内部的培养,并实时观察引导细胞生理过程,这已经成为现代生物学研究一种新的潮流。本文简要介绍了水凝胶的分类、制备及其应用情况,着重介绍通过光化学反应构筑水凝胶、调控水凝胶的物理化学性质,及其在生物医药领域的应用。
1 水凝胶简介水凝胶是一类以水为分散介质的高分子网络体系,性质柔软,但又能保持一定的形状与机械强度,具有较高含水率。由于水凝胶具有优越的保水性、良好的生物相容性和可降解性,在生物医药领域得到了广泛应用。
1.1 水凝胶分类水凝胶具有多种分类方法。根据水凝胶交联方式的不同,水凝胶通常分为两大类:物理交联水凝胶和化学交联水凝胶。物理交联水凝胶主要通过高分子链间的缠结或者非共价键,如离子作用、氢键和亲疏水相互作用等形成,这些高分子链间的物理交联点并不是永久的连接点,具有动态特征,但是足以维持水凝胶在水中的完整性。1960年,Lim和Wichterle[5]首次合成的甲基丙烯酸羟乙酯水凝胶属于离子效应型物理交联水凝胶。化学交联水凝胶通过高分子链间的共价键交联形成,形成的水凝胶同物理交联水凝胶相比具有更好的稳定性。根据原料来源的不同,水凝胶可以分为天然水凝胶和人工合成水凝胶。天然水凝胶主要是来自于动植物体内的天然高分子凝胶,主要有透明质酸钠[6, 7]、壳聚糖[8-10]、胶原、琼脂糖、海藻酸钠[11, 12]和羧甲基纤维素钠等。而人工合成的水凝胶则是利用化学反应制备的高分子聚合物。根据水凝胶尺寸又可以将水凝胶分为宏观尺寸的整体水凝胶和微观尺寸的微凝胶,在微凝胶中,尺寸处于纳米级别的水凝胶又被称作纳米凝胶。根据对外界刺激应答的情况,水凝胶又分为传统水凝胶和环境敏感型水凝胶,环境敏感水凝胶又可进一步分为热、光、pH、磁等智能响应水凝胶。
1.2 水凝胶制备水凝胶的制备主要有化学交联和物理交联两种方法。其中化学交联容易进行化学修饰,可以根据实际需求对水凝胶的分子量、链段结构等性能进行调控,进而实现对水凝胶的力学性能和降解性等性质的调控。
化学交联一般包含两种成胶方式,一是自由基引发交联过程,二是高分子链上的活性官能团之间反应形成共价键,完成交联过程。第一类交联方法在热或光的作用下产生自由基引发聚合反应,具有操作简单性、原料容易制备等优势,被广泛用于水凝胶的制备。但是该方法面临自由基毒性和氧气阻聚等问题[13-15]。第二类交联方法通过高分子功能基团之间的化学反应实现交联,一般需要对高分子进行功能基团的修饰,或者选择具有特定功能基团的高分子链作为构建骨架,如采用聚乙二醇作为构建水凝胶的材料时,常常需在其末端进行氨基、羟基、巯基、乙烯基等功能基团的修饰[16]。
1.3 水凝胶应用水凝胶作为一种新兴发展的工程材料,因其优越的保水性、良好的生物相容性和可降解性等优势,在众多领域均有应用:在农业方面,利用水凝胶的保水性能对干涸的植物进行灌溉[17];在医学领域,水凝胶可作为药物载体,实现药物的靶向释放[18-22],也可作为伤口敷料,起到止血隔离、保护伤口和促进伤口愈合的作用[23-26];在细胞生物学领域,水凝胶可以高度模拟生物组织细胞外基质的特性,作为细胞生长支架材料[27, 28]。近几年,水凝胶还被应用到电学领域,利用水凝胶在通电条件下的体积变化将水凝胶作为微流阀来控制微流体设备的开和关[29]。
2 光化学反应构筑水凝胶光化学材料,顾名思义,是指材料在光源照射下吸收光能后,发生了某种化学变化,从而引起材料在宏观或微观上的变化,并同时赋予材料某种特定的能与“光”直接相关的功能或作用。如单分子反应中的电离、分解和异构[30, 31], 生物分子反应中的环加成[32, 33], 以及分子间的电子转移等,皆可在光的激发下发生[34]。通过调整光照时间、光源激发波长或光强,可以精确控制材料特定区域吸收的光子数,从而达到时间空间的控制性,这种精确控制性是其它手段,如温度控制技术无法达到的[35-38]。因此,利用光化学反应可以实现水凝胶的精确构筑。
2.1 光引发自由基聚合交联光引发聚合反应是指光引发剂在紫外或可见光照下吸收光能后,引发单体进行的链锁聚合反应,快速形成高度交联的聚合物网络。光聚合反应本质上是在一定的光源照射下,光引发剂引发具有化学活性的物质从液态变为固态的链式反应。一旦光照引发反应开始,反应便以很快的速度进行下去。
根据反应机理区分,光聚合反应可以分为自由基光聚合反应和阳离子光聚合反应。目前应用于构筑生物材料的一般是自由基光聚合反应。自由基光聚合反应速度快,几乎不受温度限制,活性自由基一旦产生就能迅速引发聚合,但如果在聚合进行过程中将光源切断,则聚合速率就会迅速下降。然而,自由基光聚合反应对氧气特别敏感,非常容易发生氧阻聚。由于交联过程很容易受氧气阻聚,导致水凝胶的厚度受到限制,只能做到薄层。而且光引发剂在光照下产生的自由基活性物种会使蛋白或DNA中的磷脂质类和脂质类物质发生过氧化,破坏其分子结构,导致对细胞或生物组织产生很大的毒副作用[39-41],尤其是用于构建原位包裹细胞载体时。2005年,Johns Hopkins大学的Elisseeff教授[42]系统研究了光引发剂2-羟基-4′-(2-羟乙氧基)-2-甲基苯丙酮(I2959) 在紫外光照下对不同细胞系的细胞毒性,结果证明,除光引发剂的浓度对细胞毒性有影响外,该体系对细胞类型也有很高的选择性,对于细胞繁殖速率比较快的人SV40转染成骨细胞(hFOB)、人胚胎生殖细胞(LVEC)系毒性比较大,对于细胞繁殖速率比较慢的细胞系毒性会相对小很多。
尽管自由基聚合反应存在上述缺点,但是自由基聚合反应由于具有光控性、操作简单性、原料容易制备等优势,仍然被广泛应用于构筑三维水凝胶细胞载体以及组织工程和再生医学领域中。
2.2 光引发thiol-ene交联虽然传统的光引发聚合反应操作简单,但是光引发剂的添加极大地限制了其在生物医药材料领域的应用。光控thiol-ene反应相对于传统的光引发聚合反应来讲,其反应聚合过程是逐步增长式链增长的过程,而不是链锁式聚合过程[43-46], 所以在thiol-ene反应体系中只需加入少量的光引发剂就可以实现快速高效的交联,而且该体系对氧气敏感度也比较小。光引发thiol-ene反应除了具有点击化学的特征外,还兼具时空可控性,即可以通过调整光强、光照时间和光剂量对反应进行控制。
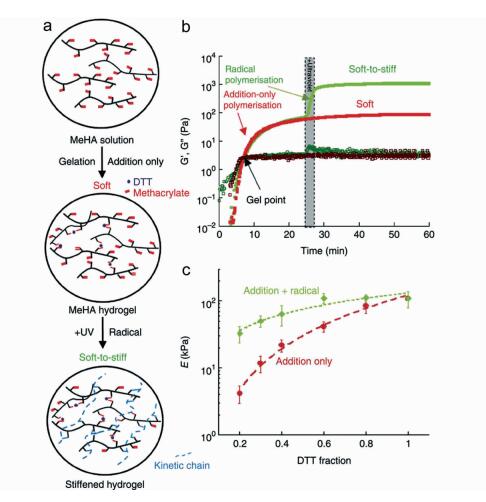
Anseth课题组[47]利用thiol-ene光引发交联反应制备了一类水凝胶(图 1)。他们首先制备了降冰片烯修饰的四臂聚乙二醇,利用基因工程技术合成了胰蛋白酶可降解的多肽,可以提供活性巯基供体,将Lithiumphenyl-2, 4, 6-trimethyl-benzoylphosphinate(LAP)作为光引发剂。在365 nm光源照射下快速成胶,通过控制光照时间实现了凝胶强度的可控增长。随后,将初步成胶的体系再次浸泡于含有LAP光引发剂和罗丹明染料标记的多肽,利用传统光刻蚀的方法实现水凝胶的可控标记。通过原位包裹细胞测试发现细胞的存活率为95%。但是,thiol-ene交联反应机制仍属于光引发自由基交联机制,光引发剂的量和光剂量的控制对整个生物体系的细胞相容性是至关重要的。
|
图 1 光引发thiol-ene交联反应机理[47] Fig.1 General mechanism for radical, step-growth thiol-ene polymerization[47] |
光调控点击反应在生物材料领域中应用广泛,利用各种高效的光调控点击反应来构筑水凝胶,可以得到高效、简单、时空可控和生物相容性的水凝胶。如Bowman课题组[48]利用光调控的炔/叠氮反应构筑水凝胶材料,首次研究了光引发的铜催化的炔/叠氮反应的反应机理,并通过小分子反应模型证实了光引发与化学方法引发的反应速率相当,通过合成多炔和多叠氮的聚乙二醇,在I2959光引发剂引发下聚合成胶,并用光刻蚀的方法验证了成胶的时空可控性。
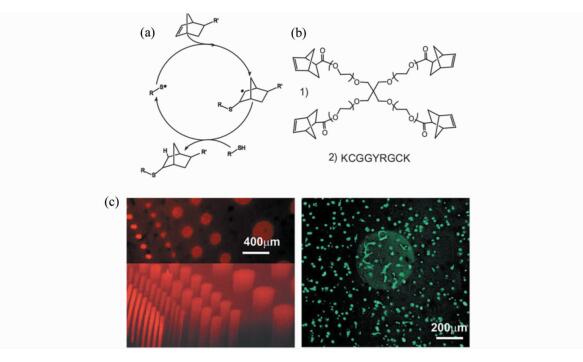
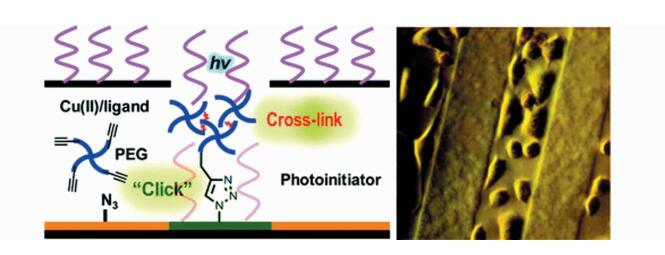
此外,Muir课题组[49]通过在基片表面修饰叠氮功能基团,利用炔与叠氮的点击反应,在基片上实现了不同宽度和厚度的图案化水凝胶的制备,并且该水凝胶可以对成纤维细胞L929进行有效的粘附,从而实现细胞在聚合物膜上的空间可控粘附(图 2)。但是这类反应除了添加光引发剂之外,还需要使用铜作为催化剂,铜对细胞和生物组织具有一定生物毒性。
|
图 2 基于光引发的炔/叠氮环加成自由基交联反应时空可控制备水凝胶[49] Fig.2 Photoinitiated Alkyne-Azide click and radical cross-linking reactions for the patterning of PEG hydrogels[49] |
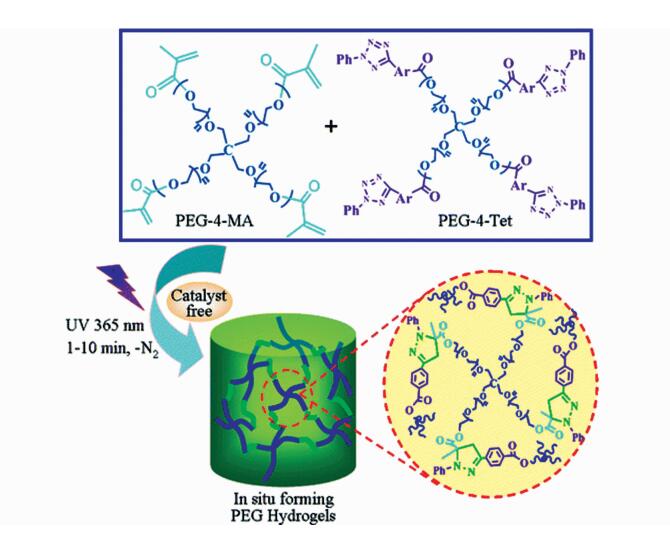
Zhong课题组[50]利用光调控的四唑/烯点击反应构筑光响应的水凝胶体系(图 3)。他们首先分别合成了四唑基团和甲基丙烯酸酯基团修饰的四臂聚乙二醇,然后在365 nm光源照射下,四唑基团与甲基丙烯酸酯基团之间发生点击反应,脱掉一分子氮气,引发水溶液交联成胶。通过原位流变仪验证了光致成胶快速,通过传统光刻蚀的方法验证了成胶的时空可控性,通过凝胶与细胞共孵实验验证了该类水凝胶材料良好的细胞相容性,还通过凝胶包裹蛋白进行蛋白的缓释, 证明该类水凝胶材料可以缓慢释放蛋白且不会影响其活性。反应体系无需加铜催化剂和光引发剂,避免了小分子催化剂和光引发剂带来的生物毒性,而且环加成产物还具有荧光发射,方便检测。但是从实验结果可以看出,能够达到快速成胶的水凝胶溶液浓度都比较大,使得该类反应光调控成胶和构筑细胞外基质面临很大挑战。
|
图 3 基于光激活的四唑/烯点击反应原位构筑水凝胶[50] Fig.3 In situ forming hydrogels based on catalyst-free and bioorthogonal "Tetrazole-Alkene" photoclick reaction[50] |
为了解决自由基引发带来的氧气阻聚和自由基毒性问题,非自由基的原位自发式偶合反应提供了制备水凝胶的新途径。常用的偶合反应包括巯基和马来酰亚胺[51]、叠氮环辛炔[52]、醛基和氨基[53]等偶合反应(图 4)。但是该类反应是自发式的,体系存在组分一接触就交联的问题,缺乏可控性。本课题组一直致力于基于光扳机的光化学反应研究,光扳机可以在光的激发下释放被保护的活性基团,如巯基、氨基、羧基等。于是在此基础上,我们提出了一种全新的水凝胶构筑方式,即光致偶合原位交联水凝胶。在该方法中,首先制备一种活性基团处于被光扳机分子保护状态的水凝胶单体,然后在特定波长照射下激发光扳机发生化学剪切反应,原位释放出活性基团,随后其进一步同另外一种活性官能团发生偶合反应形成交联,实现水凝胶的制备。相比于传统的光引发交联成胶体系,该光致成胶方法具备精确的光时空可控和计量可控的优势,并且,不需要加入任何光引发剂,成胶过程不涉及自由基反应,从而避免了交联过程中产生自由基所带来的细胞毒性。
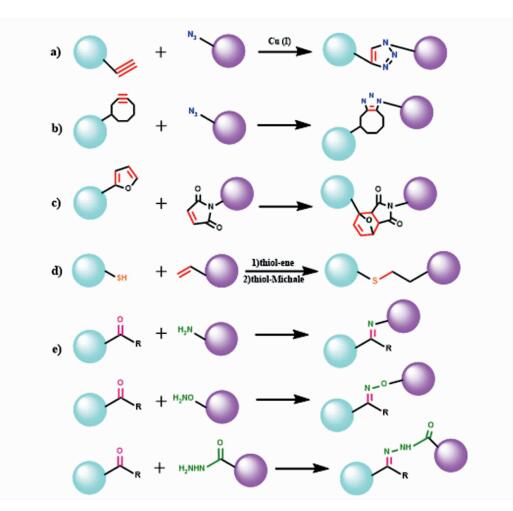
|
图 4 偶合反应制备水凝胶 Fig.4 Chemical Crosslinking for hydrogel formation |
2014年, 本课题组[54]报道了利用大环香豆素保护巯基的光扳机分子,通过光致巯基-迈克尔加成反应构筑水凝胶, 如图 5所示。香豆素保护巯基的环状分子单体与甲基丙烯酸酯聚乙二醇单体共聚得到光敏组分,然后与马来酰亚胺修饰的聚合物(如四臂聚乙二醇或者葡聚糖)共混后得光敏水凝胶前体溶液。在单光子或双光子激发下,光敏组分发生光剪切反应释放活性巯基,进而与另一组分中的马来酰亚胺发生巯基-迈克尔加成反应,原位光交联构筑水凝胶。这两步光剪切-偶合交联过程均不涉及自由基过程,具有优异的细胞相容性。原位细胞包裹实验结果充分表明,无论是自由基敏感型还是非敏感型细胞均表现出优异的细胞存活率。同时,该方法保留了光优异的时空可控性优势,可以通过光照时间、强度和位置的调节实现水凝胶制备过程的高精度控制。此外,该体系还具备以下显著特征,如:1) 活性巯基是原位产生的,避免了巯基易氧化的问题;2) 因为香豆素分子的环状设计,整个光解反应过程中无小分子副产物的释放;3) 可实现800 nm双光子激发,彻底规避紫外光潜在毒性问题。
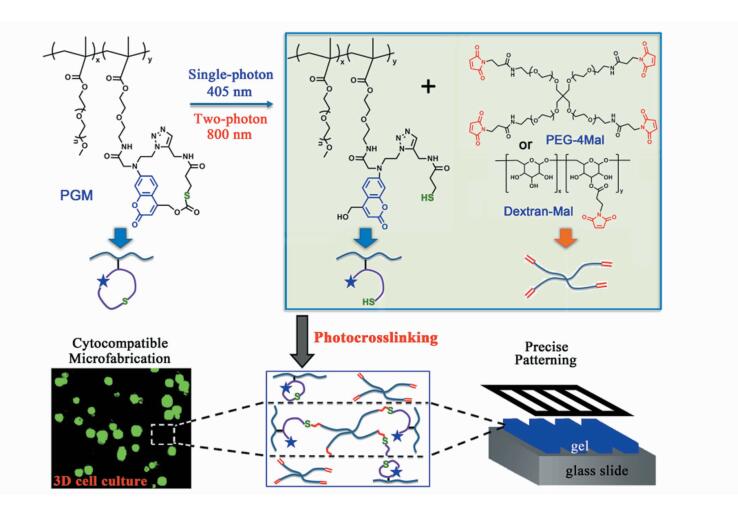
|
图 5 光致巯基-迈克尔加成制备非自由基光控水凝胶体系[54] Fig.5 Photo-uncaged-thiol Michael addition hydrogel in radical-free photocrosslinking hydrogel[54] |
本课题组[55]又利用螺噻喃分子可光可逆异构原位生成巯基的性质,构建了基于螺噻喃光生成巯基的光偶合交联水凝胶体系(图 6)。在该体系中,螺噻喃在365 nm光照下发生光致异构反应,原位产生芳香巯基,进而同马来酰亚胺发生偶合反应,制得水凝胶。该制备方法同样具备光控巯基-迈克尔加成水凝胶制备方法的细胞相容性、时空可控性、交联过程洁净等优势。此外,由于光致异构化分子螺噻喃开环释放的巯基可以在可见光照下重新生成保护巯基的闭环状态,所以该方法可以通过往复可逆的方式,快速便捷地实现水凝胶可控程序化后功能修饰,这是当前任何水凝胶体系所不能实现的性质。
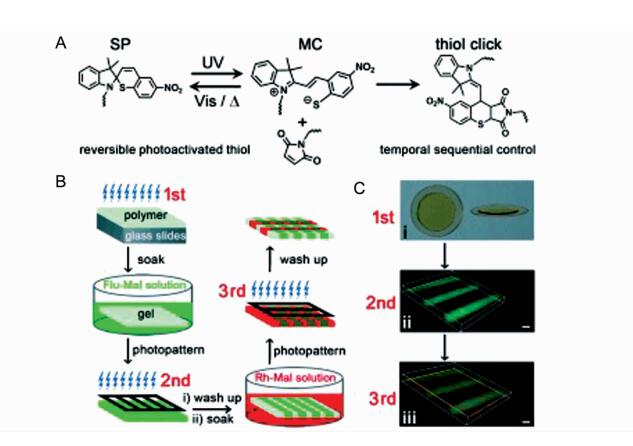
|
图 6 基于螺噻喃光可逆释放巯基的巯基-迈克尔加成反应制备水凝胶[55] Fig.6 The reversibly photoactivated thiol-Michael addition reaction based on spirothiopyran[55] |
之后,本课题组[56]借助邻硝基苄醇分子,提出光控释放醛基的生物大分子与含有氨基的高分子进行偶联反应,实现光致席夫碱交联构筑水凝胶(图 7)。首先合成了可光响应产生醛基的邻硝基苄基光板机分子,再通过光板机分子上的氨基与透明质酸上的羧基的缩合反应,将光扳机分子修饰到天然高分子透明质酸上。功能化修饰后的透明质酸水溶液,在365 nm光照射下,产生的醛基与带有氨基的高分子交联构筑水凝胶。该方法相比传统的自由基光交联,原位包裹于其中的细胞存活率从30%提高到95%,表现出优异的生物相容性。更为重要的是,基于光致醛基-氨基偶联反应可以同步实现胶层与组织表面的氨基共价键连,达到二者一体化整合的目的,有效突破了传统意义上的“柔弱”水凝胶无法实现在生物组织中固定的外科难题。该光原位凝胶技术可用于创面组织的封闭隔离,还可以为干细胞提供优异的支架,用于再生医学,为推动“光偶联反应”的临床转化带来了曙光。
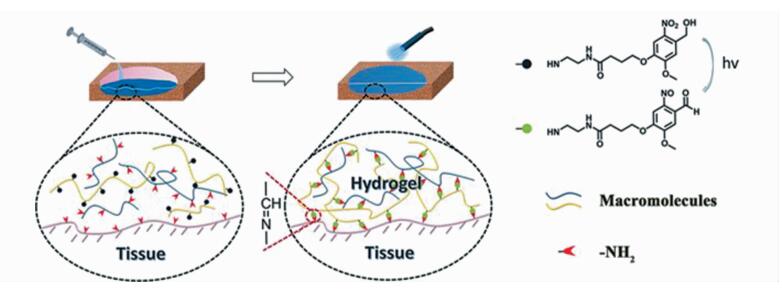
|
图 7 硝基苄醇光致亚胺偶联实施创面原位凝胶与组织一体化整合[56] Fig.7 Phototriggered-imine-crosslinking (PIC) mechanism and structure characterization of HA-NB[56] |
水凝胶可以高度拟合生物组织的微环境,利用光调控反应的时空可控性,可以在水凝胶中定点引入某些特定的功能分子,从而推测不同的功能分子对于实际生物体内细胞行为的影响,以及组织工程领域中引导细胞命运变化的工具[57-60]。
3.1 光调控生物分子粘附人工合成的聚合物和非动物来源的生物聚合物材料,缺少促进细胞-基质之间联系的具有生物活性的因子[61]。利用光剪切反应,通过光扳机的光解,控制大分子主链的断裂和降解,时空可控地识别和定位生长因子,在光降解水凝胶、光调控高分子自组装等方面均取得了重要成果[62-68]。
Anseth课题组[69]利用邻硝基苄基光扳机修饰的聚乙二醇,制备了光可降解的水凝胶,并原位包裹细胞。通过单光子或双光子技术对水凝胶实施光剪切刻蚀,得到局部降解的三维水凝胶体系,实现了光调控细胞在水凝胶中的迁移,并初步研究了细胞与水凝胶之间的相互作用(图 8)。
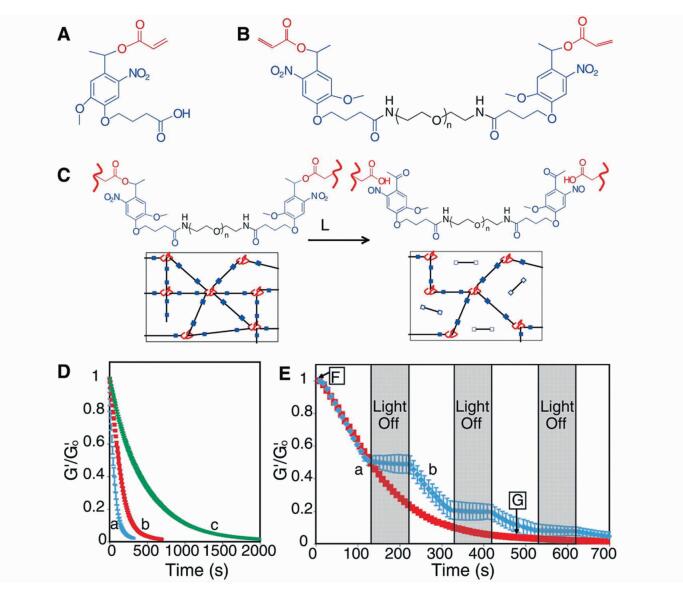
|
图 8 邻硝基苄基苯修饰的丙烯酸酯制备光降解水凝胶[69] Fig.8 The o-nitrobenzene photocage acrylic monomer for photocrosslinking hydrogel[69] |
Shoichet课题组[70]利用光照邻硝基苄基释放的巯基,将马来酰亚胺修饰的生物分子固定到琼脂糖水凝胶上,随后对水凝胶上特定的位置用紫外光照射,琼脂糖与生物分子发生反应,形成一定的图案。光固定生物分子的过程见图 9。激光辐射强度随着材料的厚度而减弱,得到的带有功能分子的水凝胶,呈现出一定的梯度信号。但是该方法必须使用深紫外的激光,对生物分子具有很大的光毒性。

|
图 9 光固定生物分子的过程示意图[70] Fig.9 The general strategy to create adhesive biochemical channels in hydrogel matrices uses the chemical modification strategy[70] |
Anseth课题组[71]利用可见光激发的thiol-ene反应在水凝胶上固定功能分子(图 10)。他们首先利用四环辛炔修饰的聚乙二醇与双叠氮和烯键共同修饰的多肽之间发生的点击反应,完成水凝胶的构筑。然后,利用邻硝基苄基作为桥键,连接功能性生物分子与裸露的巯基分子,以enosin-Y作为光引发剂,可见光激发下发生thiol-ene反应,将生物分子连接到水凝胶上,当再次用紫外光照射该体系时,邻硝基苄基光扳机发生光剪切,上一步连接在水凝胶上的生物分子可以再次脱落下来。即通过两次不同波长的照射,实现功能性生物分子在水凝胶上的先固定又脱落的过程。

|
图 10 用于构筑水凝胶及固定的多肽的结构式[71] Fig.10 The base photodegradable acrylic monomer was used to synthesize[71] |
García课题组[72]开发了一种含有RGD肽的水凝胶,RGD肽链作为信号,通过调控RGD肽链的生物活性,实现细胞在新组织上的粘附和生长(如图 11)。他们首先将保护分子连接在RGD肽上,实现RGD“失活”,当紫外光照射在水凝胶上,保护分子脱落,RGD生物活性恢复。随后,研究人员将这种水凝胶植入到小鼠的伤口中。实验分为两组,一组植入水凝胶后立刻接受UV光照,另外一组植入水凝胶7天或14天后才接受UV光照。结果表明,不论何时照射,水凝胶附近细胞都能较好地生长。移植水凝胶后立即激活RGD肽的小鼠,免疫系统会识别移植物,发生排斥反应,结果水凝胶被瘢痕组织包围。而移植水凝胶几天后才激活RGD肽的小鼠,机体免疫反应要弱得多,水凝胶能够更好地溶入小鼠组织。
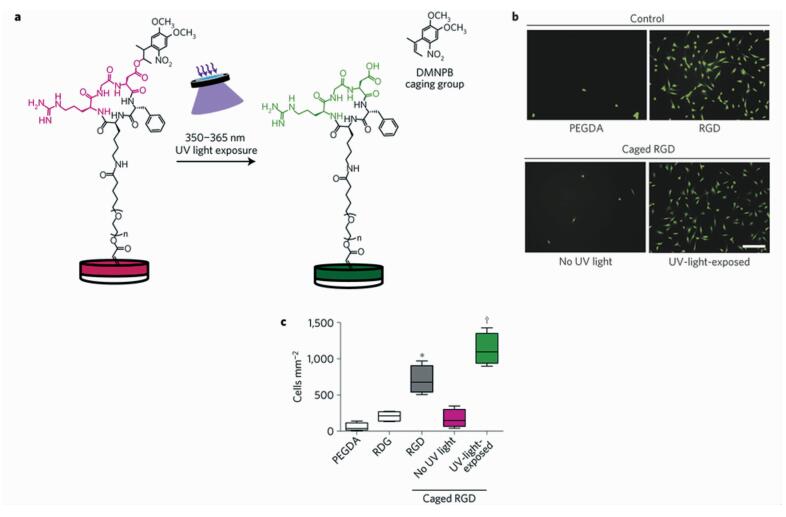
|
图 11 光调控保护的RGD肽修饰的水凝胶[72] Fig.11 Light-triggered activation of cell adhesion activity of caged RGD peptide on hydrogels[72] |
基于静电吸附作用,本课题组[73]利用香豆素保护的赖氨酸甜菜碱两性离子,与乙烯基吡咯烷酮聚合构筑了一种新型的光敏水凝胶(图 12)。该水凝胶在光照前由于阳离子季铵盐的存在,对负电性蛋白(pI<7) 实现静电吸附,在紫外光365 nm照射下,香豆素保护基团离去,水凝胶从一种阳离子粘附状态转变为一种两性离子的抗粘附状态,实现原位蛋白的释放或抗粘附。利用这种水凝胶,可以通过改变光照条件实现水凝胶表面未修饰蛋白精确的时间、空间、剂量可控的固定,进而利用固定蛋白的调控作用,调控水凝胶表面细胞粘附,改变细胞培养环境,从而影响细胞行为。
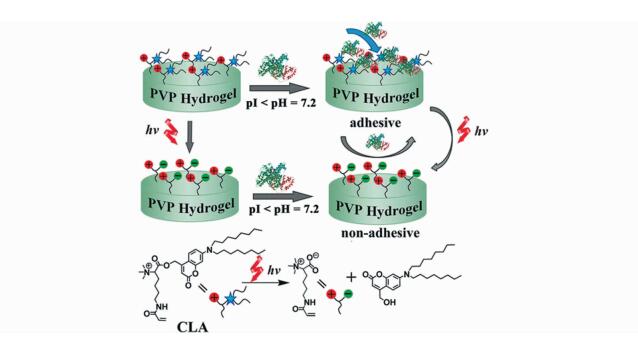
|
图 12 光控水凝胶电荷变化对于蛋白固定的调控[73] Fig.12 Schematic illustration of protein immobilization by phototriggered charge change on hydrogel[73] |
尽管细胞微环境中的生长因子对于细胞命运的影响是相对直观的,但是基质硬度对细胞命运的影响也不能忽略。人间充质干细胞是否分化为脂肪或骨细胞很大程度上取决于它们所粘附的基质材料的硬度。
Anseth课题组[74]为了研究干细胞能否存储“过去”生长的环境,以及这种记忆对于它们自身命运的影响,设计合成了一种光可控硬度的水凝胶材料(图 13)。该类水凝胶可通过光降解反应发生软化,这使研究人员能够改变培养基质的硬度,且无需分离及转移细胞至新环境。他们首先将干细胞在相对硬的水凝胶上进行培养并培养数天,然后,用365 nm紫外光照射水凝胶,使水凝胶硬度发生变化。通过对比试验发现,人间充质干细胞置于坚硬的物质上培育一段时间,它们会偏向分化为骨细胞命运,而在较软表面上培育的细胞,则最终遵从分化成脂肪细胞的命运。
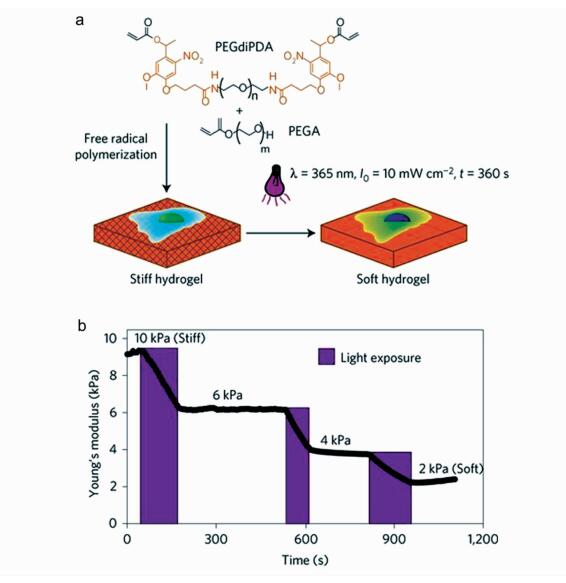
|
图 13 光可调基质模量对于YAP和RUNX2因子激活的影响[74] Fig.13 Influence of phototunable substrate modulus on YAP and RUNX2 activation[74] |
Guvendiren课题组[75]利用一种在光照下由软变硬的水凝胶,研究基质硬度对于细胞增殖和分化的影响(如图 14),具体过程如下:将人骨间充质干细胞与甲基丙烯酸酯修饰的透明质酸共培养,随后加入二硫苏糖醇,利用迈克尔加成反应,生成初步的软凝胶;加入光引发剂,在紫外光照射下,甲基丙烯酸酯基团发生自由基聚合反应,使凝胶的硬度变大。通过光调控这一凝胶硬度变大的过程,研究者发现人骨间充质干细胞会随着培养基质硬度变化而改变。
4 总结与展望水凝胶因独特而优越的保水性、良好的生物相容性和可降解性等优势,可模拟细胞生长微环境。利用光化学反应可以时空可控地制备满足不同研究需求的水凝胶,也可光调控水凝胶中生物因子的分布与基质材料的硬度,有利于加深我们对于细胞如何从微环境中接受信息并发生相应行为过程的理解。尽管在这些领域中取得了重大的进展,但是仍面临许多挑战[76-79]:首先,为了提升对于细胞微环境的调控,需要引入各种可触发的光反应基团,光反应基团的释放所带来的生物相容性问题不容小觑;其次,该领域的工作仍停留于简单的细胞-多肽或蛋白粘附验证实验,对于活体内的应用与功能实现还没有很好地进行系统研究,毕竟生物体系要比体外培养体系复杂的多;第三,尽管多种的生物图案化技术已经实现应用,但是大都不能实现浓度梯度构建,而浓度梯度对于理解和指导组织形成至关重要[80]。因此,新型有效生物正交光反应体系的构建、多种蛋白因子的梯度固定与释放、水凝胶内部物理化学性质的精确调控,甚至新的光学技术的研发,都将引领水凝胶构筑3D细胞微环境研究的进一步发展。毫无疑问,这些方法的创新将加速水凝胶生物材料在细胞生物学和组织工程学领域的应用与发展。
| [1] | Ratner B D, Hoffman A S. Synthetic hydrogels for biomedical applications[J]. Advanced Drug Delivery Reviews, 1976, 54(1): 3–12. |
| [2] | Seliktar D. Designing cell-compatible hydrogels for biomedical applications[J]. Science, 2012, 336(6085): 1124–1128. DOI:10.1126/science.1214804 |
| [3] | Klouda L, Mikos A G. Thermoresponsive hydrogels in biomedical applications[J]. European Journal of Pharmaceutics and Biopharmaceutics, 2008, 68(1): 34–45. DOI:10.1016/j.ejpb.2007.02.025 |
| [4] | Tomme S, Storm G, Hennink W. In situ gelling hydrogels for pharmaceutical and biomedical applications[J]. International Journal of Pharmaceutics, 2008, 335(1-2): 1–18. |
| [5] | Wichterle O, Lim D. Hydrophilic gels for biological use[J]. Nature, 1960, 185(4706): 117–118. DOI:10.1038/185117a0 |
| [6] | Park Y D, Tirelli N, Hubbell J A. Photopolymerized hyaluronic acid-based hydrogels and interpenetrating networks[J]. Biomaterals, 2003, 24(6): 893–900. DOI:10.1016/S0142-9612(02)00420-9 |
| [7] | Baier L J, Bivens K A, Jr P C, Schmidt C E. Photo-crosslinked hyaluronic acid hydrogels: natural, biodegrad-able tissue engineering scaffolds[J]. Biotechnology and Bioengineering, 2003, 82(5): 578–589. DOI:10.1002/(ISSN)1097-0290 |
| [8] | Obara K, Ishihara M, Fujita M. Photocrosslinkable chitosan hydrogel containing fibroblast growth factor-2 stimulates wound healing in healing-impaired db/db mice[J]. Biomaterials, 2003, 24(20): 3437–3444. DOI:10.1016/S0142-9612(03)00220-5 |
| [9] | Ono K, Ishihara M, Yura H. Photocrosslinkable chitosan: an effective adhesive with surgical applications[C]. International Congress Series, 2001, 1223(1223): 251-257. |
| [10] | Tsuda Y, Hattori H, Tanaka Y. Ultraviolet light-irradiated photocrosslinkable chitosan hydrogel to prevent bone formation in both rat skull and fibula bone defects[J]. Journal of Tissue Engineering & Regenerative Materials Research, 2013, 7(9): 720–728. |
| [11] | Jeon O, Bouhadir K H, Mansour J M, Alsberg E. Photocrosslinked alginate hydrogels with tunable biodegradation rates and mechanical properties[J]. Biomaterials, 2009, 30(14): 2724–2730. DOI:10.1016/j.biomaterials.2009.01.034 |
| [12] | Jeong S I, Jeon O, Krebs M D. Biodegradable photo-crosslinked alginate nanofibre scaffolds with tuneable physical properties, cell adhesivity and growth factor release[J]. European Cells & Materials, 2012, 24(7): 331–343. |
| [13] | Willianms C, Malik A, Kim T, Manson P N, Elisseeff J H. Variable cytocompatibility of six cell lines with photoinitiators used for polymerizing hydrogels and cell encapsulation[J]. Biomaterials, 2005, 26(11): 1211–1218. DOI:10.1016/j.biomaterials.2004.04.024 |
| [14] | Mironi-Harpaz I, Wang D, Venkatraman S, Seliktar D. Photopolymerization of cell-encapsulating hydrogels: crosslinking efficiency versus cytotoxicity[J]. Acta Biomaterialia, 2012, 8(5): 1838–1848. DOI:10.1016/j.actbio.2011.12.034 |
| [15] | Shenoy R, Bowman C. Mechanism and implementation of oxygen inhibition suppression in photopolymerizations by competitive photoactivation of a singlet oxygen sensitizer[J]. Macromolecules, 2010, 43(19): 7964–7970. DOI:10.1021/ma1012682 |
| [16] | Drury L, Mooney J. Hydrogels for tissue engineering: scaffold design variables and applications[J]. Biomaterials, 2003, 24(24): 4337–4351. DOI:10.1016/S0142-9612(03)00340-5 |
| [17] | Abedi-Koupai J, Sohrab F, Swarbrick G. Evaluation of hydrogel application on soil water retention characteristics[J]. Journal of Plant Nutrition, 2008, 31(2): 317–331. DOI:10.1080/01904160701853928 |
| [18] | Leach J B, Schmidt C E. Characterization of protein release from photocrosslinkable hyaluronic acid-polyethylene glycol hydrogel tissue engineering scaffolds[J]. Biomaterials, 2005, 26(2): 125–135. DOI:10.1016/j.biomaterials.2004.02.018 |
| [19] | Quick D J, Anseth K S. DNA delivery from photocrosslinked PEG hydrogels: encapsulation efficiency, release profiles, and DNA quality[J]. Journal of Controlled Release, 2004, 96(2): 341–351. DOI:10.1016/j.jconrel.2004.01.021 |
| [20] | Kundu J, Poole-Warren L A, Martens P, Kundu S C. Silk fibroin/poly(vinyl alcohol) photocrosslinked hydrogels for delivery of macromolecular drugs[J]. Acta Biomaterialia, 2012, 8(5): 1720–1729. DOI:10.1016/j.actbio.2012.01.004 |
| [21] | Zhang W, Zhou X, Liu T, Ma D, Xue W. Supramolecular hydrogels co-loaded with camptothecin and doxorubicin for sustainedly synergistic tumor therapy[J]. Journal of Materials Chemistry B, 2015, 3(10): 2127–2136. DOI:10.1039/C4TB01971G |
| [22] | Lin Z, Gao W, Hu H, Ma K. Novel thermo-sensitive hydrogel system with paclitaxel nanocrystals: high drug-loading, sustained drug release and extended local retention guaranteeing better efficacy and lower toxicity[J]. Journal of Controlled Release, 2014, 174(1): 161–170. |
| [23] | Yang Y, Zhang J, Liu Z, Lin Q. Tissue-integratable and biocompatible photogelation by the imine crosslinking reaction[J]. Advanced Materials, 2016, 28(14): 2724–2730. DOI:10.1002/adma.201505336 |
| [24] | Tran N Q, Joung YK, Lih E, Park K D. In situ forming and rutin-releasing chitosan hydrogels as injectable dressings for dermal wound healing[J]. Biomacromolecules, 2011, 12(8): 2872–2880. DOI:10.1021/bm200326g |
| [25] | Ishihara M, Ono K, Sato M, Nakanishi K. Acceleration of wound contraction and healing with a photocrosslinkable chitosan hydrogel[J]. Wound Repair & Regeneration, 2001, 9(6): 513–521. |
| [26] | Obara K, Ishihara M, Ishizuka T, Fujita M. Photocrosslinkable chitosan hydrogel containing fibroblast growth factor-2 stimulates wound healing in healing-impaired db/db mice[J]. Biomaterials, 2003, 24(20): 3437–3444. DOI:10.1016/S0142-9612(03)00220-5 |
| [27] | Tibbitt M W, Anseth K S. Hydrogels as extracellular matrix mimics for 3D cell culture[J]. Biotechnology and Bioengineering, 2009, 103(4): 655–663. DOI:10.1002/bit.v103:4 |
| [28] | Burdick J A, Murphy W L. Moving from static to dynamic complexity in hydrogel design[J]. Nature Communication, 2012, 3(4): 1269–1277. |
| [29] | Xue B, Qin M, Cao Y, Luo D J, Li Y, Jiang Q, Wu J H, Wang W. Electrically controllable actuators based on supramolecular peptide hydrogels[J]. Advanced Functional Materials, 2016, 26(48): 9053–9062. DOI:10.1002/adfm.v26.48 |
| [30] | Brieke C, Rohrbach F, Gottschalk A, Mayer G, Heckel A. Light-controlled tools[J]. Angewandte Chemie International Edition, 2012, 51(34): 8446–8476. DOI:10.1002/anie.201202134 |
| [31] | Brumer P, Shapiro M. Control of unimolecular reactions using coherent light[J]. Chemical Physics Letters, 1986, 126(6): 541–546. DOI:10.1016/S0009-2614(86)80171-3 |
| [32] | Assion A, Baumert T, Bergt M, Brixner T, Kiefer B, Seyfried V, Strehle M, Gerber G. Control of chemical reactions by feedback-optimized phase-shaped femtosecond laser pulses[J]. Science, 1998, 282(5390): 919–922. DOI:10.1126/science.282.5390.919 |
| [33] | Wang M L, Han K L, He G Z. Product rotational polarization in photo-initiated bimolecularreactions A+BC:dependence on the character of the potential energy surface for different mass combinations[J]. The Journal of Physical Chemistry A, 1998, 102(50): 10204–10210. DOI:10.1021/jp981738u |
| [34] | Crim F F. Bond-selected chemistry: vibrational state control of photodissociation and bimolecular reaction[J]. The Journal of Physical Chemistry, 1996, 100(31): 12725–12734. DOI:10.1021/jp9604812 |
| [35] | Yagci Y, Jockusch S, Turro N J. Photoinitiated polymerization: advances, challenges, and opportunities[J]. Macromolecules, 2010, 43(15): 6245–6260. DOI:10.1021/ma1007545 |
| [36] | Wang Y, Song W, Hu WJ, Lin Q. Fast alkene functionalization in vivo by photoclick chemistry: HOMO lifting of nitrile imine dipoles[J]. Angewandte Chemie International Edition, 2009, 48(29): 5330–5333. DOI:10.1002/anie.200901220 |
| [37] | Orski S V, Poloukhtine A A, Arumugam S, Mao L, Popik W, Locklin J. High density orthogonal surface immobilization via photoactivated copper-free click chemistry[J]. Journal of the American Chemical Society, 2010, 132(32): 11024–11026. DOI:10.1021/ja105066t |
| [38] | Poloukhtine A A, Mbua N E, Wolfert M A, Bnoos G J, Popik V V. Selective labeling of living cells by a photo-triggered click reaction[J]. Journal of the American Chemical Society, 2009, 131(43): 15769–15776. DOI:10.1021/ja9054096 |
| [39] | Atsumi T, Murata J, Kamiyanagi I, Fujisawa S, Ueha T. Cytotoxicity of photosensitizers camphorquinone and 9-fluorenone with visible light irradiation on a human submandibular-duct cell line in vitro[J]. Archives of Oral Biology, 1998, 43(1): 73–81. DOI:10.1016/S0003-9969(97)00073-3 |
| [40] | Moan J, Berg K, Kvam E. Intracecellular location of photosensitizers[J]. Novartis Foundation Symposia, 1989, 146(1): 95–107. |
| [41] | Terakado M, Yamazaki M, Tsujimoto Y, Kawashima T, Nagashima K. Lipid peroxidation as a possible cause of benzoyl peroxide toxicity in rabbit dental pulp-a microsomal lipid peroxidation in vitro[J]. Journal of Dental Research, 1984, 63(6): 901–905. DOI:10.1177/00220345840630061801 |
| [42] | Williams C G, Malik A N, Kim T K, Manson P N, Elisseeff J H. Variable cytocompatibility of six lines with photoinitiators used for polymerizing hydrogels and cell encapsulation[J]. Biomaterials, 2005, 26(11): 1211–1218. DOI:10.1016/j.biomaterials.2004.04.024 |
| [43] | Kim Y A, Ramirez D M C, Costain W J, Johnston L J, Bittman R. A new tool to assess ceramide bioactivity: 6-bromo-7-hydroxycoumarinyl-caged ceramide[J]. Chemical Communications, 2011, 47(32): 9236–9238. DOI:10.1039/c1cc12345a |
| [44] | Xi W, Krieger M, Kloxin C J, Bowman C N. A new photoclick reaction strategy: photo-induced catalysis of the thiol-Michael addition via a caged primary amine[J]. Chemical Communications, 2013, 49(40): 4504–4506. DOI:10.1039/C3CC41123K |
| [45] | Lin Q, Bao C, Cheng S, Yang Y, Zhu L. Target-activated coumarin phototriggers specifically switch on fluorescence and photocleavage upon bonding to thiol-bearing protein[J]. Journal of the American Chemical Society, 2012, 134(11): 5052–5055. DOI:10.1021/ja300475k |
| [46] | Stenzel M H, Davis T P, Fane A G. Honeycomb structured porous films prepared from carbohydrate based polymers synthesized via the RAFT process[J]. Journal of Materials Chemistry, 2003, 13(9): 2090–2097. DOI:10.1039/b304204a |
| [47] | Fairbanks B D, Schwartz M P, Halevi A E, Nuttelman C R, Bowman C N, Anseth K S. A versatile synthetic extracellular matrix mimic via thiol-norbornene photopolymerization[J]. Advanced Materials, 2009, 21(48): 5005–5010. DOI:10.1002/adma.200901808 |
| [48] | Adzima B J, Tao Y, Kloxin C J, DeForest C A, Anseth K S, Bowman C N. Spatial and temporal control of the alkyne-azide cycloaddition by photoinitiated Cu(Ⅱ) reduction[J]. Nature Chemistry, 2011, 3(3): 256–259. |
| [49] | Chen R T, Marchesan S, Evans R A, Styan K E, Such G K, Postma A, McLean K M, Muir B W, Caruso F. Photoinitiated alkyne-azide click and radical cross-linking reactions for the patterning of PEG hydrogels[J]. Biomacromolecules, 2012, 13(3): 889–895. DOI:10.1021/bm201802w |
| [50] | Fan Y, Deng C, Cheng R, Meng F, Zhong Z. In situ forming hydrogels via catalyst-free and bioorthogonal "tetrazole-alkene" photo-click chemistry[J]. Biomacromolecules, 2013, 14(8): 2814–2821. DOI:10.1021/bm400637s |
| [51] | Phelps E A, Enemchukwu N O, Fiore V F, Sy J C, Murthy N, Sulchek T A, Barker T H, Garcia A J. Maleimide cross-linked bioactive PEG hydrogel exhibits improved reactionkinetics and cross-linking for cell encapsulation and in situ delivery[J]. Advanced Materials, 2012, 24(1): 64–70. DOI:10.1002/adma.201103574 |
| [52] | Zheng J, Callahan L A S, Hao J, Guo K, Wesdemiotis C, Weiss R A, Becker M L. Strain-promoted crosslinking of PEG-based hydrogels via copper-free cycloaddition[J]. ACS Macro Letters, 2012, 1(8): 1071–1073. DOI:10.1021/mz3003775 |
| [53] | Grover G N, Lam J, Nguyen T N, Segura T, Maynard H D. Biocompatible hydrogels by oxime click chemistry[J]. Biomacromolecules, 2012, 13(10): 3013–3017. DOI:10.1021/bm301346e |
| [54] | Liu Z, Liu T, Lin Q, Bao C, Zhu L. Spatiotemporally controllable and cytocompatible approach builds 3D cell culture matrix by photo-uncaged-thiol Michael addition reaction[J]. Advanced Materials, 2014, 26(23): 3912–3917. DOI:10.1002/adma.201306061 |
| [55] | Liu Z, Liu T, Lin Q, Bao C, Zhu L. Sequential control over thiol click chemistry by a reversibly photoactivated thiol mechanism of spirothiopyran[J]. Angwandte Chemie International Edition, 2015, 54(1): 174–178. DOI:10.1002/anie.201409097 |
| [56] | Yang Y, Zhang J, Liu Z, Lin Q, Liu X, Wang Y, Zhu L. Tissue-integratable and biocompatible photogelation by the imine crosslinking reaction[J]. Advanced Materials, 2016, 28(14): 2724–2730. DOI:10.1002/adma.201505336 |
| [57] | Kloxin A M, Kloxin C J, Bowman C N, Anseth K S. Mechanical properties of cellularly responsive hydrogels and their experimental determination[J]. Advanced Materials, 2010, 22(31): 3484–3494. DOI:10.1002/adma.200904179 |
| [58] | Lutolf M P, Raeber G P, Zisch A H, Tirelli N, Hubbell J A. Cell-responsive synthetic hydrogels[J]. Advanced Materials, 2003, 15(11): 888–892. DOI:10.1002/adma.200304621 |
| [59] | Hahn M S, Miller J S, West J L. Three-dimensional biochemical and biomechanical patterning of hydrogels for guiding cell behavior[J]. Advanced Materials, 2006, 18(20): 2679–2684. DOI:10.1002/(ISSN)1521-4095 |
| [60] | Trappmann B, Gautrot J E, Connelly J T, Strange D G T, Li Y, Oyen M L, Cohen Stuart M A, Boehm H, Li B J, Vogel V, Spatz J P, Watt F M, Hunk W T S. Extracellular-matrix tethering regulates stem-cell fate[J]. Nature Materials, 2012, 11(7): 642–649. DOI:10.1038/nmat3339 |
| [61] | Zhu J. Bioactive modification of poly(ethylene glycol) hydrogels for tissue engineering[J]. Biomaterials, 2010, 31(17): 4639–4646. DOI:10.1016/j.biomaterials.2010.02.044 |
| [62] | Huang Q, Bao C, Ji W, Wang Q, Zhu L. Photocleavable coumarin crosslinkers based polystyrene microgels: phototriggered swelling and release[J]. Journal of Materials Chemistry, 2012, 22(35): 18275–18282. DOI:10.1039/c2jm33789d |
| [63] | Azagarsamy M A, McKinnon D D, Alge D L, Anseth K S. Coumarin-based photodegradable hydrogel: design, synthesis, gelation, and degradation kinetics[J]. ACS Macro Letters, 2014, 3(6): 515–519. DOI:10.1021/mz500230p |
| [64] | Kloxin A M, Tibbitt M W, Kasko A M, Fairbairn J A, Anseth K S. Tunable hydrogels for external manipulation of cellular microenvironments through controlled photodegradation[J]. Advanced Materials, 2010, 22(1): 61–66. DOI:10.1002/adma.v22:1 |
| [65] | Guo Q, Wang X, Tibbitt M W, Anseth K S, Montell D J, Elisseeff J F. Light activated cell migration in synthetic extracellular matrices[J]. Biomaterials, 2012, 33(32): 8040–8046. DOI:10.1016/j.biomaterials.2012.07.013 |
| [66] | Wong D Y, Griffin D R, Reed J, Kasko A M. Photodegradable hydrogels to generate positive and negative features over multiple length scales[J]. Macromolecules, 2010, 43(6): 2824–2831. DOI:10.1021/ma9023679 |
| [67] | Lv C, Wang Z, Wang P, Tang X. Photodegradable polyurethane self-assembled nanoparticles for photocontrollable release[J]. Langmuir, 2012, 28(25): 9387–9394. DOI:10.1021/la301534h |
| [68] | Measey T J, Gai F. Light-triggered disassembly of amyloid fibrils[J]. Langmuir, 2012, 28(34): 12588–12592. DOI:10.1021/la302626d |
| [69] | Kloxin A M, Kasko A M, Salinas C N, Anseth K S. Photodegradable hydrogels for dynamic tuning of physical and chemical properties[J]. Science, 2009, 324(5923): 59–63. DOI:10.1126/science.1169494 |
| [70] | Luo Y, Shoichet M S. A photolabile hydrogel for guided three-dimensional cell growth and migration[J]. Nature Materials, 2004, 3(4): 249–253. DOI:10.1038/nmat1092 |
| [71] | DeForest C A, Anseth K S. Photoreversible patterning of biomolecules within click-based hydrogels[J]. Angewandte Chemie International Edition, 2012, 51(8): 1816–1819. DOI:10.1002/anie.v51.8 |
| [72] | Lee T T, García J R, Paez J I, Singh A, Phelps E A, Weis S, Shafiq Z, Shekaran A, Del Campo A, García A J. Light-triggered in vivo activation of adhesive peptides regulates cell adhesion, inflammation and vascularization of biomaterials[J]. Nature Materials, 2014, 14(3): 352–360. DOI:10.1038/nmat4157 |
| [73] | Ming Z, Ruan X, Bao C, Lin Q, Yang Y, Zhu L. Micropatterned protein for cell adhesion through phototriggered charge change in a polyvinylpyrrolidone hydrogel[J].Advanced Functional Materials, 2017, DOI:10.1002/adfm.201606258. |
| [74] | Yang C, Tibbitt M W, Basta L, Anseth K S. Mechanical memory and dosing influence stem cell fate[J]. Nature Materials, 2014, 13(6): 645–652. DOI:10.1038/nmat3889 |
| [75] | Guvendiren M, Burdick J A. Stiffening hydrogels to probe short-and long-term cellular responses to dynamic mechanics[J]. Nature Communications, 2012, 3(4): 792–781. |
| [76] | DeForest C A, Anseth K S. Photoreversible patterning of biomolecules within click-based hydrogels[J]. Angewandte Chemie, 2011, 51(8): 1816–1819. |
| [77] | Griffin D R, Kasko A M. Photo-selective delivery of model therapeutics from hydrogels[J]. ACS Macro Letters, 2012, 1(11): 1330–1334. DOI:10.1021/mz300366s |
| [78] | Azagarsamy M A, Anseth K S. Wavelength-controlled photocleavage for the orthogonal and sequential release of multiple proteins[J]. AngewandteChemie, 2013, 52(51): 13803–13807. |
| [79] | DeForest C A, Anseth K S. Cytocompatible click-based hydrogels with dynamically tunable properties through orthogonal photoconjugation and photocleavage reactions[J]. Nature Chemistry, 2011, 3(12): 925–931. DOI:10.1038/nchem.1174 |
| [80] | Kloxin A M, Kloxin C J, Bowman C N, Anseth K S. Mechanical properties of cellularly responsive hydrogels and their experimental determination[J]. Advanced Materials, 2010, 22(31): 3484–3494. DOI:10.1002/adma.200904179 |