制备具有诊疗一体化的功能纳米材料用于癌症的治疗,对人类的安全和社会的发展具有极其重要的意义[1-3]。一方面,就诊断模式而言,不同的成像模式有各自的优缺点。例如,荧光成像具有灵敏度高、操作简便、响应迅速等优点,但是在空间分辨率和穿透深度上仍表现出较大的缺陷,因而限制了其在活体成像中的应用;光声成像则通过探测由热辐射产生声子,可以达到较深的穿透深度和较好的空间分辨率[4-6]。因此,很多研究者设计两种成像模式相结合的功能探针,兼具荧光成像的高灵敏性高特异性与光声成像的穿透深度[7-9]。另一方面,在现有治疗方法中,光动力疗法和光热疗法凭借其选择性好、准确度高、痛苦程度小和毒副作用低等优势而逐渐成为新型疗法[10-12]。但是,肿瘤组织因细胞快速增殖导致大量消耗营养成分和氧气,使得肿瘤部位呈现出缺氧的微环境[13, 14],也正因如此,使光敏剂到达肿瘤部位后,因氧气浓度降低导致光动力效果减弱。而光热治疗是利用光敏剂吸收的光能转化成热能,使癌细胞在高热环境下死亡的方法[15]。因此,制备具有光动力和光热协同效应的多功能纳米材料引起了广大科研工作者的研究兴趣[16, 17]。但是,目前报道的这类多功能纳米材料,绝大多数是将具有不同功能的材料结合在一起,形成一个杂交体系[18-27],这种体系存在着一些不可忽视的问题[28, 29]。因此,制备集多种成像模式和治疗方法于一体的单一结构的纳米材料作为光诊疗试剂具有重要的意义。
近年来,将共轭聚合物制备成纳米尺寸的聚合物纳米颗粒(polymer nanoparticles, PNPs)引起了广泛的研究热潮[30-32]。聚合物纳米颗粒是指由有机共轭聚合物分散水中形成的,尺寸在1~100 nm范围内的纳米粒子,通常由两亲包裹分子与疏水型的聚合物通过疏水-亲水相互作用形成,也包括由离子型的聚合物在水中发生团聚形成的纳米颗粒[33]。聚合物纳米颗粒具有光学性质特殊、结构多样、表面易修饰和生物相容性好等优点,被广泛应用于光电器件、生物成像、传感与检测、载药和治疗等领域[34-36]。
本文主要围绕聚合物纳米颗粒的制备方法、性质结构和表面修饰等方面,重点介绍聚合物纳米颗粒作为光诊疗剂在荧光成像、光声成像,以及光动力和光热治疗领域的研究进展,最后对发展基于共轭聚合物纳米颗粒的光诊疗剂所面临的机遇与挑战进行了探讨。
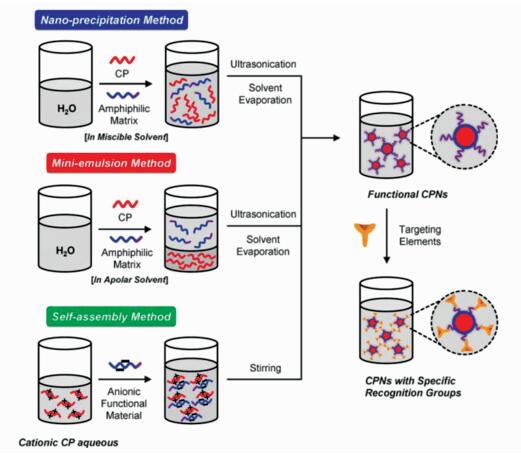
2 聚合物纳米颗粒的制备方法目前,制备聚合物纳米颗粒的方法主要有纳米沉淀法、微乳液法和自组装法(图 1)。
2.1 纳米沉淀法(Nano-precipitation method)纳米沉淀法,也叫再沉淀法。将疏水性的共轭聚合物溶解在能与水互溶“良溶剂”中,然后在剧烈搅拌或者超声分散的作用下,将含有共轭聚合物的有机相溶液迅速注入“不良溶剂”中。由于共轭聚合物在两种溶剂中的溶解性存在巨大差异,在良溶剂中以舒展形式存在的共轭聚合物,一旦进入不良溶剂中就会发生聚集,形成纳米颗粒。再通过旋转蒸发仪或者氮吹等方式除去有机溶剂,最终获得稳定且分散均匀的共轭聚合物纳米颗粒水溶液。
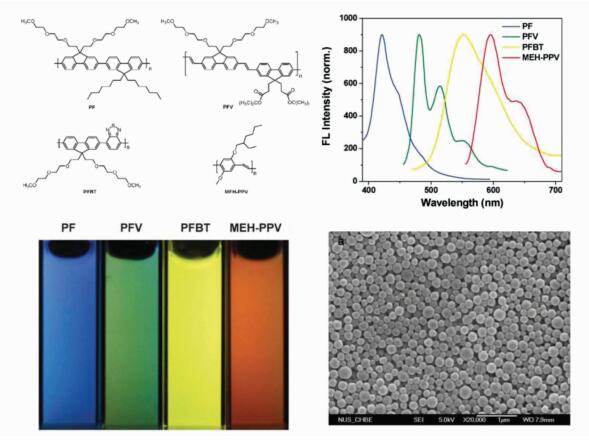
McNeill等[37, 38]将3种不同的聚合物PDHF、MEH-PPV和PFPV(图 2),通过再沉淀法制备出具有荧光性能的纳米粒子水溶液,利用透射电子显微镜和扫描荧光显微镜对得到的3种聚合物纳米颗粒进行表征,结果表明通过纳米沉淀法制备出的聚合物纳米颗粒具有良好的稳定性和水溶性。

|
图 2 a)聚合物PDHF、MEH-PPV和PFPV的结构式[38]; b)聚合物纳米颗粒的TEM图[37];c)聚合物纳米颗粒的AFM图[38] Fig.2 a) The structures of polymer PDHF, MEH-PPV, and PFPV[38]; b) TEM picture of PNPs[37]; c) AFM picture of PNPs[38] |
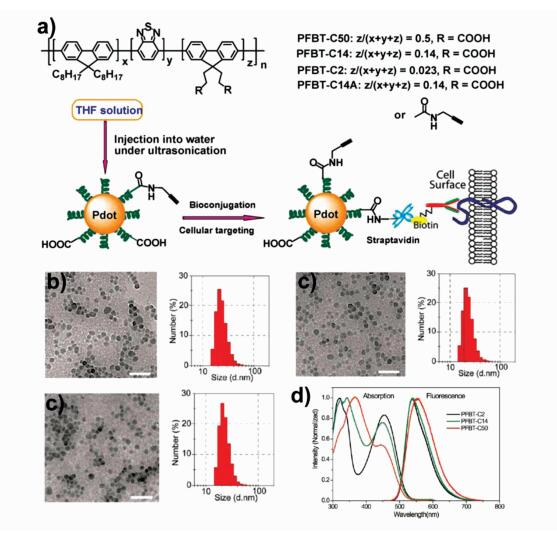
2012年,Chiu等[39]首先制备出一系列侧链含有不同羧基含量的聚合物PFBT,并通过纳米沉淀法将其制备成聚合物纳米颗粒(图 3)。随后,他们研究了聚合物中羧基含量的高低对形成纳米颗粒的稳定性的影响。结果表明:聚合物侧链上亲水基团的含量高低会对聚合物的稳定性产生重要的影响。聚合物的侧链上含有较少的亲水基团,制成的纳米颗粒具有更好地稳定性,更适合用来进行生物成像。
|
图 3 Chiu等人利用纳米沉淀法制备表面含有羧基的聚合物纳米颗粒[39] Fig.3 PNPs containing carboxyl groups on the surface prepared by Chiu through nano-precipitation method[39] |
与纳米沉淀法不同,微乳液法选用的是不能与水互溶的有机溶剂溶剂,如二氯甲烷等。而且微乳液法还必须加入额外的表面活性剂作为稳定剂,以防止形成的乳液发生聚集。首先将共轭聚合物溶解在有机溶剂中,然后注入到含有表面活性剂的水溶液中。在超声的条件下,含有聚合物的有机相会分散到水相中形成乳液,随后通过旋蒸等方式除去溶液中的有机溶剂,与此同时,水相中的表面活性剂会与聚合物相互作用形成纳米颗粒。
2002年, Landfester等[40]以十二烷基磺酸钠(SDS)作为表面活性剂, 利用微乳液法合成了一系列粒径100 nm左右的聚合物纳米颗粒(图 4)。随后,他们将这些聚合物纳米颗粒通过旋涂法制备成薄膜,并对其在光电器件方面的应用进行了初步的研究。

|
图 4 Landfester等通过微乳液法制备的聚合物纳米颗粒的TEM和AFM[40] Fig.4 The TEM and AFM pictures of PNPs prepare by Landfester through mini-emulsion method[40] |
Liu等[41]利用聚乳酸-羟基乙酸共聚物(PLGA)作为表面活性剂,通过微乳液法制备出粒径在240~270 nm范围内的多色共轭聚合物纳米颗粒,这些纳米粒子的发射光谱已覆盖整个可见光区域(图 5)。
|
图 5 Liu等人通过微乳液法制备出的多色聚合物纳米颗粒[41] Fig.5 Multi-colour emissive PNPs prepared by Liu through mini-emulsion method[41] |
自组装法是将带有相反电荷的共轭聚合物和共组装材料分别溶解或者分散在水中,剧烈搅拌下将二者按照一定比例混合,经简单的高速离心得到功能化的聚合物纳米颗粒。
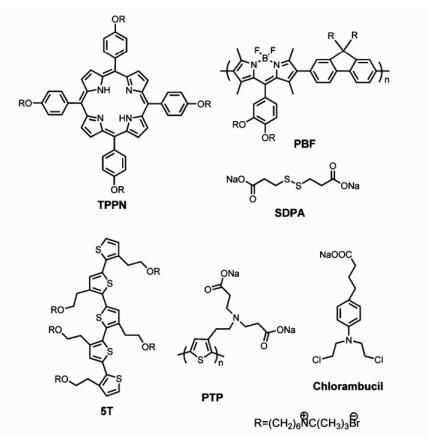
Wang等利用阳离子的聚合物和阴离子的功能分子,通过自组装法制备多种多功能的聚合物纳米颗粒(图 6)。2009年,他们将一种水溶性的聚噻吩(PT)和阴离子的卟啉(TPPN)通过静电相互作用制备出具有抗菌作用的聚合物纳米颗粒[42]。为了提高抗癌效果,他们将一种阳离子型的噻吩寡聚物(5T)和一种广泛使用的阴离子型抗癌药物chlorambucil,通过自组装法制备出新型聚合物纳米颗粒[43]。随后,他们又在剧烈搅拌的条件下, 将一种阴离子的二钠盐(SDPA)加到PBF中,通过高速离心得到一种尺寸为100 nm的聚合物纳米颗粒,实验证明该纳米颗粒具有光响应的靶向抗肿瘤活性[44]。
|
图 6 TPPN、PBF、SDPA、5T、PT和chlorambucil的结构式[42, 43] Fig.6 The structures of TPPN, PBF, SDPA, 5T, PT, and chlorambucil[42, 43] |
材料的稳定性主要包括光稳定性和胶体稳定性。
共轭聚合物纳米颗粒与有机小分子荧光染料相比,具有优异的光稳定性。据文献报道,普通有机小分子染料的光漂白量子效率一般在10-4~10-6范围内[45],而Wu等[46]制备出荧光共轭聚合物纳米粒子,通过光漂白动力学法测出其光漂白量子效率在10-7~10-10间,表现良好的光稳定性。此外,由于侧链存在大量的发色团,Marcus等制备出的荧光聚合物纳米颗粒,克服了传统有机荧光染料和半导体金属量子点的闪烁(blink)现象,这一结果有利于聚合物纳米颗粒用来长时间跟踪生物内的某一过程[47-49]。
聚合物纳米颗粒在水中表现出优良的胶体稳定性,其水溶液在4 ℃的条件下存放数月没有出现聚集或沉淀的现象。造成这种优异的胶体稳定性的具体机理目前尚不清楚,但可以确定的是,聚合物纳米颗粒在水溶液中的稳定性与其表面状态密切相关。Kee等[50]认为,在聚合物纳米颗粒制备过程中,纳米颗粒的表面发生部分氧化,从而产生亲水性氧化位点,这是疏水性性共轭聚合物能在水溶液中稳定存在的主要原因。Zeta电位实验表明,他们制备出的聚合物纳米颗粒的表面显负电(-40 mV),表面电荷密度为1.39×10-2~1.70×10-2 cm-2。红外光谱、X射线光电子能谱和元素分析进一步证明了表面缺陷位点的存在。此外,聚合物纳米颗粒的胶体稳定性也受所采用的聚合物分子结构的影响。Chiu等[39]制备了一系列含有不同亲水性侧链(羧酸根)的聚芴类纳米颗粒,结果表明,亲水性侧链含量高的聚合物所形成纳米颗粒的结构比较疏松且不稳定,亲水性侧链所占比重较小的聚合物能够形成稳定密实结构的纳米颗粒,有助于减少细胞标记时的非特异性作用力。
4 聚合物纳米颗粒的生物相容性生物相容性是纳米材料在实际应用中一个不可忽视的问题,它直接决定了纳米粒子能否应用于生物体系。近年来,很多课题组对聚合物纳米颗粒的生物相容性进行了系统的研究。Moon等[51]研究了用疏水的聚合物PPE制备出粒径约为97 nm的聚合物纳米颗粒的生物毒性。他们将不同浓度的纳米颗粒孵育到BHK细胞中,然后在不同时间用Cell Titer-Glo测定试剂盒(检测ATP作为代谢活性细胞的指示剂)对活细胞进行定量。结果显示,即使在高浓度的聚合物纳米颗粒(264 μm)的条件下孵育一周,BHK细胞仍表现出高存活率,表明该聚合物纳米粒子极低的毒性。Chiu等[52]通过将聚合物纳米颗粒与金属半导体量子点(Qdots)进行对比,进一步对其生物毒性作了全面系统的研究。他们将小鼠巨噬细胞RAW264.7分别孵育聚合物纳米颗粒和Qdots,首先从体外水平测试了两种颗粒的生物毒性(细胞存活率等),然后通过检测细胞的还原应激性来深入研究两种颗粒的细胞毒性。结果显示,在相同条件下,聚合物纳米颗粒的荧光强度大约是Qdots的10倍,而且聚合物纳米颗粒引起的细胞死亡率更低、应激更小,证明聚合物纳米颗超低的生物毒性,有望应用于在生物医学等领域。
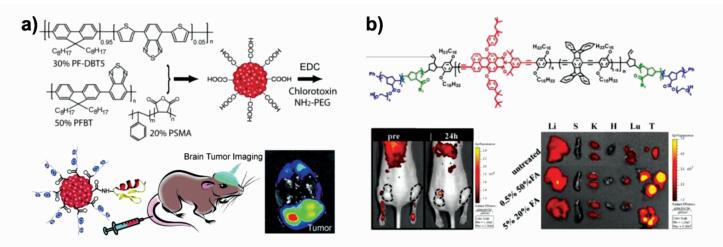
5 聚合物纳米颗粒的应用 5.1 荧光成像近年来,研究人员更倾向于制备具有深红或者近红外发射的聚合物纳米颗粒用于荧光成像。与发射波长处于短波区的聚合物纳米颗粒相比,有深红或者近红外发射的聚合物纳米颗粒,能克服杂散光的吸收与散射,以及生物自发荧光等问题引起的干扰。Chiu等[53]合成了荧光量子产率高达0.56,最大发射波长位于650 nm的聚合物纳米颗粒(PFBT),然后通过共价偶联法在表面修饰上肿瘤细胞的靶向基团氯霉素(CTX)。通过尾静脉注射到ND2:SmoA1转基因小鼠体内后,此纳米颗粒PFBT-CTX在24 h内成功突破小鼠的血脑屏障,并特异性地对小鼠脑部肿瘤进行标记(见图 7a)。
|
图 7 a)连有氯霉素(CTX)的聚合物纳米颗粒用于ND2:SmoA1转基因小鼠的脑部荧光成像[53];b)具有深红发射的聚合物的结构, 及其静脉注射24 h后小鼠肿瘤部位和主要器官的荧光成像照片[54] Fig.7 a) Schematic illustration of the preparation of Pdot-CTX bioconjugates and the subsequent in vivo imaging in ND2:SmoA1 mice[53]; b) Chemical structure of a far-red emitting multiblock polymer used for the preparation of folate-functionalized nanoparticles (upper image); whole-animal fluorescence imaging of tumor-bearing NCR nude mice pre-injection and at 24 h after injection with folate-functionalized nanoparticles (left-bottom corner); whole-animal fluorescence imaging of harvested organs/tumors at 24 h post-injection of the folate-functionalized nanoparticles (right-bottom corner)[54] |
Swager等[54]合成了用叶酸功能化的多色聚合物纳米颗粒(λex= 465 nm,λem= 620 nm),然后将这些纳米颗粒静脉注入种有KB肿瘤(叶酸过表达受体)的裸鼠体内。结果发现,在注射24 h内,叶酸功能化的聚合物纳米颗粒能够富集在肿瘤部位(图 7b)。对小鼠主要器官进行荧光成像分析可知,肿瘤部位的荧光强度远远超过其他器官组织。此外,通过对实验组小鼠进行长达8天的监测,聚合物纳米颗粒没有明显的毒性和生物体组织的异常积累,说明聚合物纳米颗粒是一种具有良好生物相容性的活体荧光探针。
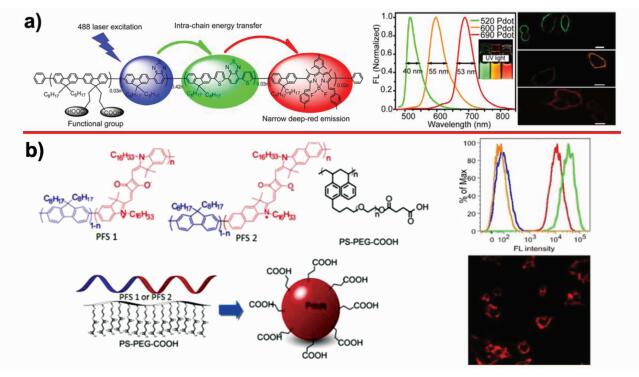
为了制备具有较窄半峰宽的聚合物纳米颗粒,Chiu等[55, 56]合成了一系列基于方酸和氟硼二吡咯染料的聚合物纳米颗粒(Squaraine-based and BODIPY-based Pdots)。与先前报到的聚合物纳米颗粒相比,这些聚合物纳米颗粒的半峰宽减小了1.5~2倍(仅40~70 nm)。并且,通过巧妙的设计,这类聚合物纳米颗粒的发射光谱可以从可见光红移至近红外区域,成功用于细胞成像(图 8)。
|
图 8 a)基于氟硼二吡咯染料的聚合物结构,及其制备成多色聚合物纳米颗粒的荧光光谱和细胞成像图[56];b)基于方酸染料的聚合物纳米颗粒的制备过程,及其细胞成像图[55] Fig.8 a) The structures of BODIPY-based polymer and fluorescence spectra, specific cellular targeting of BODIPY-based PNPs bioconjugates[56]; b) The process of squaraine-based PNPs preparation, bioconjugation, and cellular labeling[55] |
共轭聚合物具有很强的吸光能力、宽吸收范围等特点,常用于制备有机发光二极管、太阳能电池和场效应晶体管等。一些课题组将此类聚合物制备成纳米颗粒并对其在光声成像方面进行了研究。
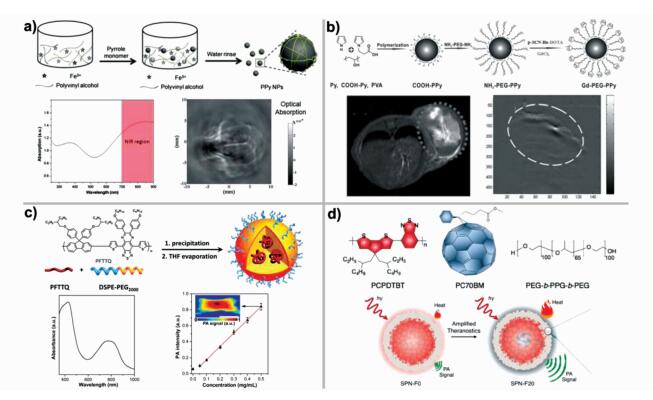
Dai等[57, 58]通过氧化聚合的方法制备出粒径约为46 nm的聚吡咯纳米颗粒,该纳米颗粒在近红外700~900 nm区域表现出良好的吸收。实验发现,此纳米颗粒能够进行深度光声成像,成像深度达4.3 cm(图 9a)。随后,他们将聚吡咯纳米颗粒的表面修饰上钆离子,成功实现了光声和磁共振双模式成像(图 9b)。
|
图 9 a)聚吡咯纳米颗粒的制备过程, 及其吸收光谱和小鼠脑部的光声成像图[57];b)表面修饰钆离子的聚吡咯纳米颗粒, 及其磁共振成像和光声成像图[58];c) PFTTQ的结构和制备方法, 及其吸收光谱和光声信号[59];d) SPNs纳米颗粒的结构示意图和PET诱导的增强型光声成像[60] Fig.9 a) Preparation of PPy PNPs and absorption spectrum and photoacoustic imaging of a mouse brain[57]; b) Fabrication process of Gd-PEG-PPy PNPs and NMR and PA imaging[58]; c) The structure and preparation process of PFTTQ PNPs and its absorption and PA spectra[59]; d) Schematic illustration of chemical structures of SPNs and the mechanism of PET-induced enhanced PA imaging[60] |
通过设计强电子给体(donor)和受体(accepter)结构,可以制备出具有窄带隙的刚性共轭聚合物,将聚合物的吸收扩展到近红外区域。根据此原理,Liu等[59]设计合成了一种D-A结构的聚合物,该聚合物在600~1000 nm具有强烈的吸收,他们通过纳米沉淀法将其制备成具有良好水溶性的聚合物纳米颗粒(PFTTQ), 活体实验表明,通过尾静脉注入小鼠体内后,此纳米颗粒可以在脑部进行光声成像(图 9c)。Pu等[60]将富勒烯掺杂在聚合物PCPDTBT中并溶于THF,用纳米沉淀法制成粒径约为50 nm的纳米颗粒SPNs。根据光诱导电子转移的机制,掺杂的富勒烯能够有效猝灭共轭聚合物的荧光。活体成像实验表明,当富勒烯的掺杂量为20%时,纳米颗粒的光声成像效果得到最大程度的提高,趋于饱和(图 9d)。此工作提出了一种新颖的制备具有光声增强效应的成像试剂的方法。
5.3 生物传感与检测在生物体的新陈代谢中,氧含量、离子、pH等都起着至关重要的作用。生物体内氧含量的高低通常与一些病理状况有关,如肿瘤[61]和类风湿性关节炎[62]等。通过掺杂对氧气敏感的金属有机磷光染料,可以实现聚合物物纳米颗粒对氧气的检测。McNeill等[63]将金属卟啉掺杂到PFO(图 10a)中,形成可以检测氧含量的聚合物纳米颗粒。当体系的氧浓度逐渐升高时,对氧气分子敏感的金属卟啉产生的磷光会被氧气分子猝灭,导致其在650 nm处的磷光逐渐减弱。当向体系中充入氮气时,氧气含量逐渐降低,金属卟啉在650 nm处的磷光逐渐增强。此外,该探针还能用于检测细胞中的氧含量。
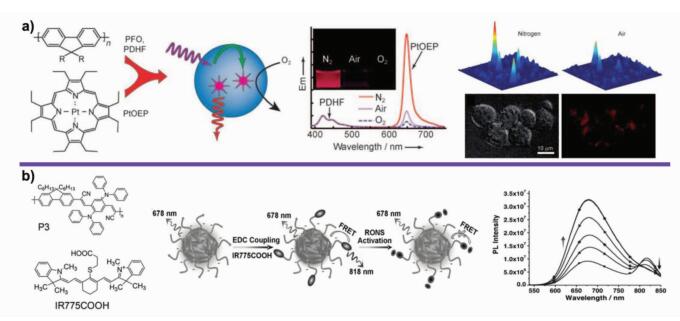
|
图 10 a)金属卟啉掺杂聚芴形成的聚合物纳米颗粒作为氧气传感器,用于检测溶液和细胞中的氧含量[63];b) IR775COOH掺杂P3形成的聚合物纳米颗粒,用于检测RONS[67] Fig.10 a) Porphyrin doped PNPs-based activatable probes for photoluminescence ratiometric sensing of oxygen in solution and cell[63]; b) IR775COOH doped P3-based activatable probes for fluorescence ratiometric imaging of RONS[67] |
活性氧氮物种(RONS)虽然是生物体代谢过程的副产物,但是他们在组织中含量的高低是许多疾病的标志,如细菌感染[64]、心血管疾病[65]和关节炎[66]等。Rao等[67]合成了一种基于聚合物纳米颗粒的近红外比率荧光探针。他们将一种对RONS敏感的菁染料衍生物(IR775COOH)掺入PCFDP中,形成聚合物纳米颗粒(SPN-P3)。由于PCFDP与IR775COOH之间存在荧光共振能量转移,SPN-P3探针在678 nm和818 nm有两个荧光峰。当加入RONS后,IR775COOH会与其发生反应,导致818 nm处的荧光逐渐猝灭,678 nm处的荧光逐渐增强。实验表明,SPN-P3探针只对过氧亚硝酸根、次氯酸根和羟基自由基有响应,对其他的RONS没有响应(图 10b)。
生物体内pH的平衡对体内的稳定性有重大影响。由于聚合物本身存在放大效应,当环境的pH变化时,聚合物的能量会通过FRET机制传递给染料,从而引起整个纳米颗粒的荧光发生颜色或强度的变化。Chiu等[68]利用羧基荧光素琥珀酰亚胺酯对所处环境pH敏感的特点,将荧光素连接在聚合物纳米颗粒的表面,通过FRET机制引起的荧光变化实现了溶液及细胞中pH的检测(图 11)。
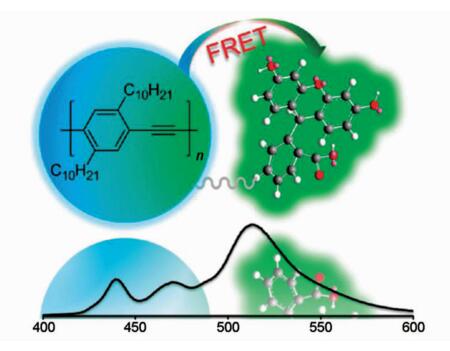
|
图 11 基于FRET机制利用荧光素掺杂的聚合物纳米颗粒检测pH[68] Fig.11 Fuorescein doped PNPs-based activatable probes for fluorescence sensing of pH[68] |
2005年,Whitten等[69]发现在可见光照射下,阳离子PPE衍生物可以包裹并杀死革兰氏阴性大肠杆菌和革兰氏阳性炭疽芽孢杆菌。这项工作开创了用共轭聚合物进行光动力治疗的先河。随后,Whitten等[70-72]通过合成不同的共轭聚合物来研究其抗菌的机制, 认为:① 带正电荷共轭聚合物可以通过静电和疏水相互作用有效地捕获带负电荷的微生物病原体;② 共轭聚合物在光的刺激下会产生单重态氧等活性氧物种;③ 活性氧物种损伤病原体的膜并杀死病原体。
为了提高产生活性氧物种的能力,人们通常将共轭聚合物与光敏剂通过静电相互作用或共价偶联的方式进行结合,以促进共轭聚合物和光敏剂之间发生有效的能量转移。为了减少光敏剂从聚合物上脱落,Wu等[73]合成了一种侧链带有氧杂环丁烷的聚合物do-PFDTBT,而氧杂环丁烷分子之间发生光交联反应可使形成的聚合物纳米颗粒更加致密,减少内部的光敏剂分子Ce6发生泄漏和脱落。在520 nm激光的激发下,聚合物和光敏剂之间发生有效的能量传递,从而实现PDT过程(图 12)。
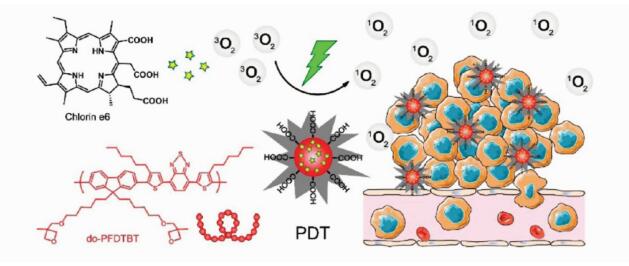
|
图 12 Ce6掺杂do-PFDTBT形成的Pdots及其光动力示意图[73] Fig.12 Preparation and photodynamic effect of the Ce6-doped Pdots[73] |
Huang等[74]采用另外一种掺杂方式,即将Pt (Ⅱ)卟啉直接引入共轭聚合物的骨架,克服了光敏剂泄漏或脱落的问题。由于Pt (Ⅱ)卟啉分子本身是一个对氧气敏感的结构,因此,他们制备出的Pdots不仅能通过寿命成像来检测溶液中的氧气含量,还能在氧气充足的条件下进行PDT(图 13)。

|
图 13 主链上含有Pt(Ⅱ)卟啉的聚芴类聚合物通过自组装形成的聚合物纳米颗粒, 及其作为O2传感器和PDT的示意图[74] Fig.13 Chemical structures of Pt(Ⅱ) porphyrin doped polyfluorene-based polymer, self-assembly, O2 sensing, and PDT mechanisms of phosphorescent Pdots[74] |
除了光动力治疗,聚合物纳米颗粒在光热治疗方面也有广泛的应用。最近的研究表明,在近红外有较强吸收的有机共轭高分子,如聚吡咯[75, 76]、聚苯胺[77, 78]和聚噻吩[79]等,在光热治疗的应用中表现出巨大的优势。与其他有机光热材料相比,聚合物纳米颗粒具有光稳定性好、光热转化效率高等优点;与无机光热材料相比,聚合物纳米颗粒具有毒性低、易修饰等优点。因此,基于聚合物纳米颗粒的光热试剂受到研究者的广泛关注。
Dai等[80]采用水相分散聚合的方法成功合成了分散均匀、胶体稳定性和光稳定性优异的聚吡咯纳米颗粒。与金纳米棒相比,该纳米颗粒表现出更高的光热转换效率。在近红外光的刺激下,孵育此纳米颗粒的细胞的死亡率能达到80%以上,证明该聚吡咯纳米颗粒可有效地应用于光热治疗。
另外,一些常用于有机电子的导电聚合物,如聚(3,4-乙烯二氧噻吩)-聚苯乙烯磺酸(PEDOT/PSS)等,也被用于光热试剂的研究中。Liu等[79]通过层层自组装的修饰方法,先在带负电的PEDOT/PSS表面修饰上带正电的聚烯丙胺盐酸盐高分子和带正电的聚丙烯酸,然后用氨基化的聚乙二醇修饰(图 14)。通过表面化学修饰后的PEDOT/PSS在生理条件下具有良好的稳定性,通过小鼠的尾静脉注射后, 在肿瘤部位有明显的富集,通过光热治疗,在较低的激光功率作用下肿瘤被完全消除,并且没有复发现象。
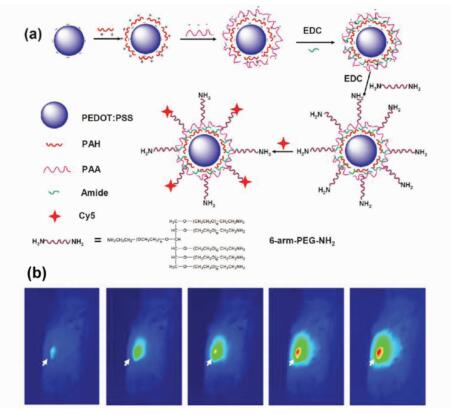
|
图 14 聚乙二醇修饰的PEDOT/PSS用于体内光热治疗[79] Fig.14 Fabrication process of PEDOT:PSS-PEG and its application of PTT[79] |
Pu等[81]将TRPV1抗体连接在具有光热效应的聚合物纳米颗粒的表面(SPNsbc),用其作为调节剂控制神经元中热敏离子通道,从而实现钙离子进入细胞。在808 nm激光的辐照下,聚合物纳米颗粒能迅速升温并把热量传递到膜表面,使TRPV1的离子打开,从而调控钙离子的释放(图 15)。此工作为调控细胞内离子的进出提供了一种新策略。

|
图 15 用于制备SPNsbc的聚合物结构及其控制钙离子通道的示意图[81] Fig.15 Schematic illustration of synthesis of SPNs and SPNsbc, and SPNsbc controlled photothermal activation of Ca2+ channels in neurons[81] |
Liu等将一种近红外吸收的聚合物PFTTQ通过纳米再沉淀的方法,制备聚合物纳米颗粒PFTTQ NPs[82],其在近红外光的刺激下能够有效杀死癌细胞。活体实验证明,该纳米颗粒可有效应用于光热治疗。
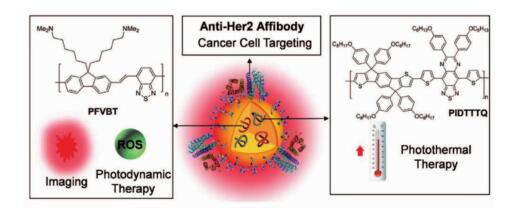
随后,他们利用同样的方法,将分别具有光热性质和光动力效应的两种聚合物制备成纳米颗粒,成功实现了两种治疗方式的结合(图 16)。该纳米颗粒具有60.4%的单重态氧效率和47.6%的光热转换效率。通过表面修饰靶向分子后,该纳米颗粒能够特异性识别癌细胞,并成功实现在活体实验中光动力和光热的协同治疗[83]。
6 具有光诊疗功能的聚合物纳米颗粒研究新进展光诊疗功能是指材料在外加光源的刺激下,能同时实现诊断和治疗,以达到精确的诊断结果和最佳的治疗效率。聚合物纳米颗粒凭借其独特的结构和优异性能等诸多优点被广泛应用于荧光、光声成像,以及光热、光动力等领域,展现出诱人的前景。目前,基于聚合物纳米颗粒作为多功能的光诊疗剂,绝大多数是将传统的光敏剂通过静电相互作用负载或亲水疏水作用,包裹在聚合物纳米颗粒的表面或内部,形成一个杂交体系。聚合物纳米颗粒只是作为吸光材料,通过能量传递过程敏化光敏剂分子。这样的复合杂交体系存在一些不可忽视的问题,如复合材料的性能变差;生理条件下稳定性差,一旦进入复杂的生物体内环境,这种材料就可能会发生材料的脱落与分散,造成材料的失效和复杂的药物动力学代谢。因此,制备集多种成像模式和治疗方法于一体的单一结构的聚合物纳米颗粒作为光诊疗试剂具有重要的意义。
我们课题组曾利用“功能前驱体结构控制合成”方法设计合成了聚噻吩季铵盐衍生物PT2(结构见图 17a)为碳源,制备了表面带正电荷的水溶性近红外发光的碳点,该碳点在模拟太阳光或激光照射下可高效产生单重态氧[84]。在实验过程中,我们发现前驱物PT2在800 nm脉冲激光器的激发下能发出荧光, 因此,我们预期该前驱物PT2可以用于制备双光子光敏剂。基于上述背景,我们通过纳米沉淀的方法将PT2制备成聚合物纳米颗粒PNPs(图 17b)[85]。该PNPs具有良好的水溶性、优异的稳定性和生物相容性。此外,该PNPs不仅在单光子条件下能高效产生单重态氧,而且在双光子条件下也能有效产生1O2,并在生物组织模拟液中能达到2100 μm的成像检测深度。更重要的是,该PNPs能特异性进入细胞的溶酶体,大大提高光动力过程对肿瘤细胞的杀伤。该PNPs是一种集双光子荧光和双光子光动力治疗于一体的新型光敏剂。
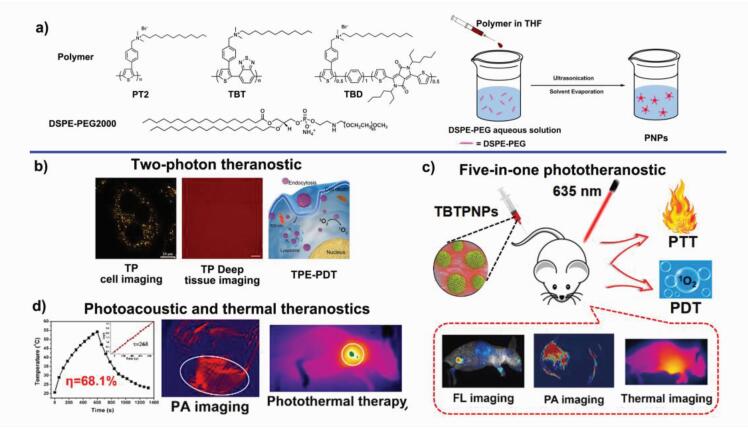
|
图 17 a)聚合物PT2、TBT和TBD的结构,以及PNPs的制备过程[85-87];b)由PT2制备的PNPs作为双光子诊疗剂[85];c)由TBT制备的PNPs作为“五合一”功能的诊疗剂[86];d)由TBD制备的PNPs作为光声成像介导的光热诊疗剂[87] Fig.17 a) The structures of PT2, TBT and TBD, and fabrication process of PNPs[85-87]; b) PNPs made from PT2 as two-photon theranostic[85]; c) PNPs made from TBT as "five-in-one" phototheranostic[86]; d) PNPs made from TBD as photoacoustic and thermal theranostics[87] |
考虑到由PT2制备的PNPs的荧光峰在590 nm,处于可见光区域,还有很大的提升空间。为了制备具有近红外发射的聚合物纳米颗粒,我们选取了两种具有强烈吸电子能力的发色团苯并噻二唑(BT)和吡咯并吡咯二酮(DPP),通过将其与具有给电子能力的噻吩基团偶联,制备具有D-A或者D-π-A结构的共轭聚合物。我们预期,通过吸电子基团的引入,新制备聚合物的吸收和发射都会有明显的红移,从而可以用长波长的激光作为激发光,实现多模态成像介导的治疗。
因此,我们将PT2中的噻吩单体与BT通过Suzuki偶联反应制备了聚合物TBT(结构见图 17a)[86]。与PT2相比,TBT的吸收和发射均出现了明显的红移,并且其发射峰位于690 nm,处于近红外区域。随后,我们通过纳米沉淀法将TBT制备成具有良好水溶性的聚合物纳米颗粒TBTPNPs(图 17c)。在4 ℃条件下,TBTPNPs能够在生理盐水(PBS)和细胞培养液(DMEM)中稳定保存60天以上,说明其具有良好的生理稳定性。在635 nm激光的辐照下,TBTPNPs能够同时表现出光动力(单重态氧效率为40%)和光热(光热转换效率为37.1%)的协同效应。活体荧光和光声成像表明,尾静脉注射到小鼠体内后,TBTPNPs可以通过实体瘤的高通透性和滞留效应(EPR)富集在肿瘤部位。在活体治疗的实验中,小鼠肿瘤部位的温度还可以通过热成像图来进行实时检测。治疗后的小鼠在长达40天内没有发生肿瘤的复发与死亡,主要器官组织也没有出现任何炎症与不良反应。因此,TBTPNPs是一种集荧光、光声和热成像,以及光动力和光热效应5种功能于一体的新型光诊疗剂。
随后,我们将PT2中的单体与DPP,通过Suzuki偶联反应合成出具有D-π-A结构的共轭聚合物TBD(结构见图 17a),并通过纳米沉淀法将其制备成聚合物纳米颗粒TBDPNPs[87]。除了具有先前报道的优异特性,如水溶性好、稳定性高和低毒性外,TBDPNPs具有较宽的吸收光谱(470~800 nm)。在671 nm的激发下,TBDPNPs表现出优异的光热性质,光热转换效率高达68.1%,超出了绝大多数已经报道的光热试剂。活体光声实验表明,通过尾静脉注射后,该纳米颗粒可通过EPR效应在肿瘤部位富集。并且,在激光光照下,小鼠肿瘤部位的温度能在3 min内迅速升温至50 ℃,实现对肿瘤的高效杀伤。通过对小鼠主要器官的组织切片进行分析可知,TBDPNPs的毒副作用可以忽略。因此,具有超高光热转换效率的TBDPNPs可以作为光声成像介导的光热诊疗剂(图 17d)。
7 总结与展望聚合物纳米颗粒凭借其优异的光学性质、良好的稳定性、低生物毒性而被广泛应用于成像、检测和治疗等领域。但是,作为一类新兴的材料,它还处于研究的初级阶段,还需要进行长期深入的研究。首先,虽然聚合物纳米颗粒具有较低的暗毒性和良好的生物相容性,但是他们在生物体内的分布和代谢情况仍然不清楚,详细深入地研究聚合物纳米颗粒进入活体后,在各个器官的分布和排出体外的半衰期,是将其应用到生物医学领域急需解决的一个问题;其次,聚合物纳米颗粒作为光热或光动力试剂,可在激光光照下产生热或活性氧物种杀死癌细胞,但这种被动激发的模式具有一定的风险性,一旦含有这些纳米颗粒的正常细胞暴露在激光下就会引起正常组织的损伤。因此,设计合成具有相应活性响应(如:利用肿瘤细胞中酸性环境进行pH响应,利用生物体内酶的专一性进行酶响应)的聚合物纳米颗粒作为光诊疗剂,可以大大拓展其在生物领域中的应用。
| [1] | Ng K K, Zheng G. Molecular interactions in organic nanoparticles for phototheranostic applications[J]. Chemical Reviews, 2015, 115(19): 11012–11042. DOI:10.1021/acs.chemrev.5b00140 |
| [2] | Zhang P C, Hu C H, Ran W, Meng J, Yin Q, Li Y P. Recent progress in light-triggered nanotheranostics for cancer treatment[J]. Theranostics, 2016, 6(7): 948–968. DOI:10.7150/thno.15217 |
| [3] | Lim E K, Kim T, Paik S, Haam S, Huh Y M, Lee K. Nanomaterials for theranostics: recent advances and future challenges[J]. Chemical Reviews, 2014, 115(1): 327–394. |
| [4] | Li K, Liu B. Polymer-encapsulated organic nanoparticles for fluorescence and photoacoustic imaging[J]. Chemical Society Revivews, 2014, 43(18): 6570–6597. DOI:10.1039/C4CS00014E |
| [5] | Lee S Y, Jeon S I, Jung S, Chung I J, Ahn C H. Targeted multimodal imaging modalities[J]. Advanced Drug Delivery Reviews, 2014, 76: 60–78. DOI:10.1016/j.addr.2014.07.009 |
| [6] | Smith B R, Gambhir S S. Nanomaterials for in vivo imaging[J]. Chemical Reviews, 2017, 117(3): 901–986. DOI:10.1021/acs.chemrev.6b00073 |
| [7] | Huynh E, Leung B Y, Helfield B L, Shakiba M, Gandier J A, Jin C S, Master E R, Wilson B C, Goertz D E, Zheng G. In situ conversion of porphyrin microbubbles to nanoparticles for multimodality imaging[J]. Nature Nanotechnology, 2015, 10(4): 325–332. DOI:10.1038/nnano.2015.25 |
| [8] | Kuo W S, Chang C N, Chang Y T, Yang M H, Chien Y H, Chen S J, Yeh C S. Gold nanorods in photodynamic therapy, as hyperthermia agents, and in near-infrared optical imaging[J]. Angewandte Chemie International Edition, 2010, 122(15): 2771–2775. |
| [9] | Rieffel J, Chen F, Kim J, Chen G, Shao W, Shao S, Chitgupi U, Hernandez R, Graves S A, Nickles R J. Hexamodal imaging with porphyrin-phospholipid-coated upconversion nanoparticles[J]. Advanced Materials, 2015, 27(10): 1785–1790. DOI:10.1002/adma.201404739 |
| [10] | Elsabahy M, Heo G S, Lim S-M, Sun G, Wooley K L. Polymeric nanostructures for imaging and therapy[J]. Chemical Reviews, 2015, 115(19): 10967–11011. DOI:10.1021/acs.chemrev.5b00135 |
| [11] | Chen G, Roy I, Yang C, Prasad P N. Nanochemistry and nanomedicine for nanoparticle-based diagnostics and therapy[J]. Chemical Reviews, 2016, 116(5): 2826–2885. DOI:10.1021/acs.chemrev.5b00148 |
| [12] | Lucky S S, Soo K C, Zhang Y. Nanoparticles in photodynamic therapy[J]. Chemical Reviews, 2015, 115(4): 1990–2042. DOI:10.1021/cr5004198 |
| [13] | Chen Q, Feng L, Liu J, Zhu W, Dong Z, Wu Y, Liu Z. Intelligent albumin-MnO2 nanoparticles as pH-/H2O2-responsive dissociable nanocarriers to modulate tumor hypoxia for effective combination therapy[J]. Advanced Materials, 2016, 28(33): 7129–7136. DOI:10.1002/adma.201601902 |
| [14] | Bertout J A, Patel S A, Simon M C. The impact of O2 availability on human cancer[J]. Nature Review Cancer, 2008, 8(12): 967–975. DOI:10.1038/nrc2540 |
| [15] | Jaque D, Maestro L M, Del Rosal B, Haro-Gonzalez P, Benayas A, Plaza J, Rodriguez E M, Sole J G. Nanoparticles for photothermal therapies[J]. Nanoscale, 2014, 6(16): 9494–9530. DOI:10.1039/C4NR00708E |
| [16] | Cheng L, Wang C, Feng L, Yang K, Liu Z. Functional nanomaterials for phototherapies of cancer[J]. Chemical Reviews, 2014, 114(21): 10869–10939. DOI:10.1021/cr400532z |
| [17] | Yang X, Yang M X, Pang B, Vara M, Xia Y N. Gold nanomaterials at work in biomedicine[J]. Chemical Reviews, 2015, 115(19): 10410–10488. DOI:10.1021/acs.chemrev.5b00193 |
| [18] | Deng X R, Chen Y Y, Cheng Z Y, Deng K R, Hou Z Y, Liu B, Huang S S, Jin D Y, Lin J. Rational design of a comprehensive cancer therapy platform using temperature-sensitive polymer grafted hollow gold nanospheres: simultaneous chemo/photothermal/photodynamic therapy triggered by a 650 nm laser with enhanced anti-tumor efficacy[J]. Nanoscale, 2016, 8(12): 6837–6850. DOI:10.1039/C5NR08253F |
| [19] | Lin J, Wang S J, Huang P, Wang Z, Chen S H, Niu G, Li W W, He J, Cui D X, Lu G M. Photosensitizer-loaded gold vesicles with strong plasmonic coupling effect for imaging-guided photothermal/photodynamic therapy[J]. ACS Nano, 2013, 7(6): 5320–5329. DOI:10.1021/nn4011686 |
| [20] | Wang J, Zhu G, You M, Song E, Shukoor M I, Zhang K, Altman M B, Chen Y, Zhu Z, Huang C Z. Assembly of aptamer switch probes and photosensitizer on gold nanorods for targeted photothermal and photodynamic cancer therapy[J]. ACS Nano, 2012, 6(6): 5070–5077. DOI:10.1021/nn300694v |
| [21] | Wang S J, Huang P, Nie L M, Xing R J, Liu D B, Wang Z, Lin J, Chen S H, Niu G, Lu G M. Single continuous wave laser induced photodynamic/plasmonic photothermal therapy using photosensitizer-functionalized gold nanostars[J]. Advanced Materials, 2013, 25(22): 3055–3061. DOI:10.1002/adma.v25.22 |
| [22] | Hong G S, Diao S, Antaris A L, Dai H J. Carbon nanomaterials for biological imaging and nanomedicinal therapy[J]. Chemical Reviews, 2015, 115(19): 10816–10906. DOI:10.1021/acs.chemrev.5b00008 |
| [23] | Tian B, Wang C, Zhang S, Feng L Z, Liu Z. Photothermally enhanced photodynamic therapy delivered by nano-graphene oxide[J]. ACS Nano, 2011, 5(9): 7000–7009. DOI:10.1021/nn201560b |
| [24] | Yan X F, Hu H, Lin J, Jin A J, Niu G, Zhang S L, Huang P, Shen B Z, Chen X Y. Optical and photoacoustic dual-modality imaging guided synergistic photodynamic/photothermal therapies[J]. Nanoscale, 2015, 7(6): 2520–2526. DOI:10.1039/C4NR06868H |
| [25] | Bhaumik J, Mittal A K, Banerjee A, Chisti Y, Banerjee U C. Applications of phototheranostic nanoagents in photodynamic therapy[J]. Nano Research, 2015, 8(5): 1373–1394. DOI:10.1007/s12274-014-0628-3 |
| [26] | Li Y P, Lin T Y, Luo Y, Liu Q Q, Xiao W C, Guo W C, Lac D, Zhang H Y, Feng C H, Wachsmann-Hogiu S. A smart and versatile theranostic nanomedicine platform based on nanoporphyrin[J]. Nature Communications, 2014, 5: 4712. DOI:10.1038/ncomms5712 |
| [27] | Song X J, Chen Q, Liu Z. Recent advances in the development of organic photothermal nano-agents[J]. Nano Research, 2015, 8(2): 340–354. DOI:10.1007/s12274-014-0620-y |
| [28] | Lv G X, Guo W S, Zhang W, Zhang T B, Li S Y, Chen S Z, Eltahan A S, Wang D L, Wang Y Q, Zhang J, Wang P C, Chang J, Liang X J. Near-infrared emission CuInS/ZnS quantum dots: all-in-one theranostic nanomedicines with intrinsic fluorescence/photoacoustic imaging for tumor phototherapy[J]. ACS Nano, 2016, 10(10): 9637–9645. DOI:10.1021/acsnano.6b05419 |
| [29] | Hu J, Tang Y A, Elmenoufy A H, Xu H B, Cheng Z, Yang X L. Nanocomposite-based photodynamic therapy strategies for deep tumor treatment[J]. Small, 2015, 11(44): 5860–5887. DOI:10.1002/smll.201501923 |
| [30] | Feng L H, Zhu C L, Yuan H X, Liu L B, Lv F T, Wang S. Conjugated polymer nanoparticles: preparation, properties, functionalization and biological applications[J]. Chemical Society Revivews, 2013, 42(16): 6620–6633. DOI:10.1039/c3cs60036j |
| [31] | Yu J, Rong Y, Kuo C T, Zhou X H, Chiu D T. Recent advances in the development of highly luminescent semiconducting polymer dots and nanoparticles for biological imaging and medicine[J]. Analytical Chemistry, 2017, 89(1): 42–56. DOI:10.1021/acs.analchem.6b04672 |
| [32] | Lyu Y, Pu K Y. Recent advances of activatable molecular probes based on semiconducting polymer nanoparticles in sensing and imaging[J]. Advanced Science, 2017, 4(5): 1600481. |
| [33] | Wu C F, Chiu D T. Highly fluorescent semiconducting polymer dots for biology and medicine[J]. Angewandte Chemie International Edition, 2013, 52(11): 3086–3109. DOI:10.1002/anie.201205133 |
| [34] | Zhu C L, Liu L B, Yang Q, Lv F T, Wang S. Water-soluble conjugated polymers for imaging, diagnosis, and therapy[J]. Chemical Reviews, 2012, 112(8): 4687–4735. DOI:10.1021/cr200263w |
| [35] | Chan Y H, Wu P J. Semiconducting polymer nanoparticles as fluorescent probes for biological imaging and sensing[J]. Particle & Particle Systems Characterization, 2015, 32(1): 11–28. |
| [36] | Pu K Y, Chattopadhyay N, Rao J H. Recent advances of semiconducting polymer nanoparticles in in vivo molecular imaging[J]. Journal of Controlled Release, 2016, 240: 312–322. DOI:10.1016/j.jconrel.2016.01.004 |
| [37] | Szymanski C, Wu C F, Hooper J, Salazar M A, Perdomo A, Dukes A, McNeill J. Single molecule nanoparticles of the conjugated polymer MEH-PPV, preparation and characterization by near-field scanning optical microscopy[J]. Journal of Physical Chemistry B, 2005, 109(18): 8543–8546. DOI:10.1021/jp051062k |
| [38] | Wu C F, Szymanski C, Cain Z, McNeill J. Conjugated polymer dots for multiphoton fluorescence imaging[J]. Journal of the American Chemical Society, 2007, 129(43): 12904–12905. DOI:10.1021/ja074590d |
| [39] | Zhang X J, Yu J B, Wu C F, Jin Y H, Rang Y, Ye F M, Chiu D T. Importance of having low-density functional groups for generating high-performance semiconducting polymer dots[J]. ACS Nano, 2012, 6(6): 5429–5439. DOI:10.1021/nn301308w |
| [40] | Landfester K, Montenegro R, Scherf U, Guntner R, Asawapirom U, Patil S, Neher D, Kietzke T. Semiconducting polymer nanospheres in aqueous dispersion prepared by a miniemulsion process[J]. Advanced Materials, 2002, 14(9): 651–655. DOI:10.1002/(ISSN)1521-4095 |
| [41] | Li K, Pan J, Feng S S, Wu A W, Pu K Y, Liu Y, Liu B. Generic strategy of preparing fluorescent conjugated-polymer-loaded poly (DL-lactide-co-glycolide) nanoparticles for targeted cell imaging[J]. Advanced Functional Materials, 2009, 19(22): 3535–3542. DOI:10.1002/adfm.v19:22 |
| [42] | Xing C F, Xu Q L, Tang H W, Liu L B, Wang S. Conjugated polymer/porphyrin complexes for efficient energy transfer and improving light-activated antibacterial activity[J]. Journal of the American Chemical Society, 2009, 131(36): 13117–13124. DOI:10.1021/ja904492x |
| [43] | Yang G M, Liu L B, Yang Q, Lv F T, Wang S. A multifunctional cationic pentathiophene: synthesis, organelle‐selective imaging, and anticancer activity[J]. Advanced Functional Materials, 2012, 22(4): 736–743. DOI:10.1002/adfm.201101764 |
| [44] | Chong H, Nie C Y, Zhu C L, Yang Q, Liu L B, Lv F T, Wang S. Conjugated polymer nanoparticles for light-activated anticancer and antibacterial activity with imaging capability[J]. Langmuir, 2012, 28(4): 2091–2098. DOI:10.1021/la203832h |
| [45] | Eggeling C, Widengren J, Rigler R, Seidel C A M. Photobleaching of fluorescent dyes under conditions used for single-molecule detection: evidence of two-step photolysis[J]. Analytical Chemistry, 1998, 70(13): 2651–2659. DOI:10.1021/ac980027p |
| [46] | Wu C F, Bull B, Szymanski C, Christensen K, McNeill J. Multicolor conjugated polymer dots for biological fluorescence imaging[J]. ACS Nano, 2008, 2(11): 2415–2423. DOI:10.1021/nn800590n |
| [47] | Galland C, Ghosh Y, Steinbrück A, Sykora M, Hollingsworth J A, Klimov V I, Htoon H. Two types of luminescence blinking revealed by spectroelectrochemistry of single quantum dots[J]. Nature, 2011, 479(7372): 203–207. DOI:10.1038/nature10569 |
| [48] | Hoogenboom J P, Hernando J, van Dijk E M, van Hulst N F, García-Parajó M F. Power-law blinking in the fluorescence of single organic molecules[J]. ChemPhysChem, 2007, 8(6): 823–833. DOI:10.1002/(ISSN)1439-7641 |
| [49] | Tang J, Marcus R. Mechanisms of fluorescence blinking in semiconductor nanocrystal quantum dots[J]. Journal of Chemical Physics, 2005, 123(5): 054704. DOI:10.1063/1.1993567 |
| [50] | Clafton S N, Beattie D A, Mierczynska-Vasilev A, Acres R G, Morgan A C, Kee T W. Chemical defects in the highly fluorescent conjugated polymer dots[J]. Langmuir, 2010, 26(23): 17785–17789. DOI:10.1021/la103063p |
| [51] | Moon J H, McDaniel W, MacLean P, Hancock L F. Live-cell-permeable poly (p-phenylene ethynylene)[J]. Angewandte Chemie International Edition, 2007, 46(43): 8223–8225. DOI:10.1002/(ISSN)1521-3773 |
| [52] | Ye F, White C C, Jin Y, Hu X, Hayden S, Zhang X, Gao X, Kavanagh T J, Chiu D T. Toxicity and oxidative stress induced by semiconducting polymer dots in RAW264.7 mouse macrophages[J]. Nanoscale, 2015, 7(22): 10085–10093. DOI:10.1039/C5NR01857A |
| [53] | Wu C F, Hansen S J, Hou Q, Yu J B, Zeigler M, Jin Y H, Burnham D R, McNeill J D, Olson J M, Chiu D T. Design of highly emissive polymer dot bioconjugates for in vivo tumor targeting[J]. Angewandte Chemie International Edition, 2011, 50(15): 3430–3434. DOI:10.1002/anie.201007461 |
| [54] | Ahmed E, Morton S W, Hammond P T, Swager T M. Fluorescent multiblock pi-conjugated polymer nanoparticles for in vivo tumor targeting[J]. Advanced Materials, 2013, 25(32): 4504–4510. DOI:10.1002/adma.v25.32 |
| [55] | Wu I C, Yu J, Ye F, Rong Y, Gallina M E, Fujimoto B S, Zhang Y, Chan Y H, Sun W, Zhou X H. Squaraine-based polymer dots with narrow, bright near-infrared fluorescence for biological applications[J]. Journal of the American Chemical Society, 2015, 137(1): 173. DOI:10.1021/ja5123045 |
| [56] | Rong Y, Wu C F, Yu J B, Zhang X J, Ye F M, Zeigler M, Gallina M E, Wu I C, Zhang Y, Chan Y H. Multicolor fluorescent semiconducting polymer dots with narrow emissions and high brightness[J]. ACS Nano, 2013, 7(1): 376. DOI:10.1021/nn304376z |
| [57] | Zha Z B, Deng Z J, Li Y Y, Li C H, Wang J R, Wang S M, Qu E Z, Dai Z F. Biocompatible polypyrrole nanoparticles as a novel organic photoacoustic contrast agent for deep tissue imaging[J]. Nanoscale, 2013, 5(10): 4462–4467. DOI:10.1039/c3nr00627a |
| [58] | Liang X H, Li Y Y, Li X D, Jing L J, Deng Z J, Yue X L, Li C H, Dai Z F. PEGylated polypyrrole nanoparticles conjugating gadolinium chelates for dual-modal MRI/photoacoustic imaging guided photothermal therapy of cancer[J]. Advanced Functional Materials, 2015, 25(9): 1451–1462. DOI:10.1002/adfm.v25.9 |
| [59] | Liu J, Geng J L, Liao L D, Thakor N, Gao X H, Liu B. Conjugated polymer nanoparticles for photoacoustic vascular imaging[J]. Polymer Chemistry, 2014, 5(8): 2854–2862. DOI:10.1039/c3py01587d |
| [60] | Lyu Y, Fang Y, Miao Q Q, Zhen X, Ding D, Pu K Y. Intraparticle molecular orbital engineering of semiconducting polymer nanoparticles as amplified theranostics for in vivo photoacoustic imaging and photothermal therapy[J]. ACS Nano, 2016, 10(4): 4472–4481. DOI:10.1021/acsnano.6b00168 |
| [61] | Harris A L. Hypoxia-a key regulatory factor in tumour growth[J]. Nature Reviews Cancer, 2002, 2(1): 38–47. DOI:10.1038/nrc704 |
| [62] | Mapp P, Grootveld M, Blake D. Hypoxia, oxidative stress and rheumatoid arthritis[J]. British Medical Bulletin, 1995, 51(2): 419–436. DOI:10.1093/oxfordjournals.bmb.a072970 |
| [63] | Wu C F, Bull B, Christensen K, McNeill J. Ratiometric single-nanoparticle oxygen sensors for biological imaging[J]. Angewandte Chemie International Edition, 2009, 48(15): 2741–2745. DOI:10.1002/anie.200805894 |
| [64] | Fang F C. Antimicrobial reactive oxygen and nitrogen species: concepts and controversies[J]. Nature Reviews Microbiology, 2004, 2(10): 820–832. DOI:10.1038/nrmicro1004 |
| [65] | Libby P, Ridker P M, Hansson G K. Progress and cha-llenges in translating the biology of atherosclerosis[J]. Nature, 2011, 473(7347): 317–325. DOI:10.1038/nature10146 |
| [66] | Bauerova K, Bezek S. Role of reactive oxygen and nitrogen species in etiopathogenesis of rheumatoid arthritis[J]. General Physiology and Biophysics, 2000, 18: 15–20. |
| [67] | Pu K Y, Shuhendler A J, Rao J H. Semiconducting polymer nanoprobe for in vivo imaging of reactive oxygen and nitrogen species[J]. Angewandte Chemie International Edition, 2013, 52(39): 10325–10329. DOI:10.1002/anie.201303420 |
| [68] | Chan Y-H, Wu C F, Ye F M, Jin Y H, Smith P B, Chiu D T. Development of ultrabright semiconducting polymer dots for ratiometric pH sensing[J]. Analytical Chemistry, 2011, 83(4): 1448–1455. DOI:10.1021/ac103140x |
| [69] | Lu L, Rininsland F H, Wittenburg S K, Achyuthan K E, McBranch D W, Whitten D G. Biocidal activity of a light-absorbing fluorescent conjugated polyelectrolyte[J]. Langmuir, 2005, 21(22): 10154–10159. DOI:10.1021/la046987q |
| [70] | Chemburu S, Corbitt T S, Ista L K, Ji E, Fulghum J, Lopez G P, Ogawa K, Schanze K S, G. Whitten D. Light-induced biocidal action of conjugated polyelectrolytes supported on colloids[J]. Langmuir, 2008, 24(19): 11053–11062. DOI:10.1021/la8016547 |
| [71] | Corbitt T S, Ding L, Ji E, Ista L K, Ogawa K, Lopez G P, Schanze K S, Whitten D G. Light and dark biocidal activity of cationic poly (arylene ethynylene) conjugated polyelectrolytes[J]. Photochemical & Photobiological Sciences, 2009, 8(7): 998–1005. |
| [72] | Zhou Z, Corbitt T S, Parthasarathy A, Tang Y, Ista L K, Schanze K S, Whitten D G. "End-only" functionalized oligo (phenylene ethynylene) s: synthesis, photophysical and biocidal activity[J]. Journal of Physical Chemistry Letter, 2010, 1(21): 3207–3212. DOI:10.1021/jz101088k |
| [73] | Chang K W, Tang Y, Fang X F, Yin S Y, Xu H, Wu C F. Incorporation of porphyrin to pi-conjugated backbone for polymer-dot-sensitized photodynamic therapy[J]. Biomacromolecules, 2016, 17(6): 2128–2136. DOI:10.1021/acs.biomac.6b00356 |
| [74] | Zhou X B, Liang H, Jiang P F, Zhang K Y, Liu S J, Yang T S, Zhao Q, Yang L J, Lv W, Yu Q. Multifunctional phosphorescent conjugated polymer dots for hypoxia imaging and photodynamic therapy of cancer cells[J]. Advanced Science, 2016, 3(2): 1500155. DOI:10.1002/advs.201500155 |
| [75] | Chen M, Fang X L, Tang S H, Zheng N F. Polypyrrole nanoparticles for high-performance in vivo near-infrared photothermal cancer therapy[J]. Chemical Communications, 2012, 48(71): 8934–8936. DOI:10.1039/c2cc34463g |
| [76] | Yang K, Xu H, Cheng L, Sun C Y, Wang J, Liu Z. In vitro and in vivo near-infrared photothermal therapy of cancer using polypyrrole organic nanoparticles[J]. Advanced Materials, 2012, 24(41): 5586–5592. DOI:10.1002/adma.201202625 |
| [77] | Abel S B, Molina M A, Rivarola C R, Kogan M J, Barbero C A. Smart polyaniline nanoparticles with thermal and photothermal sensitivity[J]. Nanotechnology, 2014, 25(49): 495602. DOI:10.1088/0957-4484/25/49/495602 |
| [78] | Zhou J, Lu Z G, Zhu X J, Wang X J, Liao Y, Ma Z F, Li F. NIR photothermal therapy using polyaniline nanoparticles[J]. Biomaterials, 2013, 34(37): 9584–9592. DOI:10.1016/j.biomaterials.2013.08.075 |
| [79] | Cheng L, Yang K, Chen Q, Liu Z. Organic stealth nanoparticles for highly effective in vivo near-infrared photothermal therapy of cancer[J]. ACS Nano, 2012, 6(6): 5605–5613. DOI:10.1021/nn301539m |
| [80] | Zha Z B, Yue X L, Ren Q S, Dai Z F. Uniform polypy-rrole nanoparticles with high photothermal conversion efficiency for photothermal ablation of cancer cells[J]. Advanced Materials, 2013, 25(5): 777–782. DOI:10.1002/adma.201202211 |
| [81] | Lyu Y, Xie C, Chechetka S A, Miyako E, Pu K Y. Semiconducting polymer nanobioconjugates for targeted photothermal activation of neurons[J]. Journal of the American Chemical Society, 2016, 138(29): 9049–9052. DOI:10.1021/jacs.6b05192 |
| [82] | Geng J L, Sun C Y, Liu J, Liao L D, Yuan Y Y, Thakor N, Wang J, Liu B. Biocompatible conjugated polymer nanoparticles for efficient photothermal tumor therapy[J]. Small, 2015, 11(13): 1603–1610. DOI:10.1002/smll.v11.13 |
| [83] | Feng G X, Fang Y, Liu J, Geng J L, Ding D, Liu B. Multifunctional conjugated polymer nanoparticles for image-guided photodynamic and photothermal therapy[J]. Small, 2017, 13(3): 1602807. DOI:10.1002/smll.v13.3 |
| [84] | Ge J C, Lan M H, Zhou B J, Liu W M, Guo L, Wang H, Jia Q Y, Niu G L, Huang X, Zhou H Y, Meng X M, Wang P F, Lee C S, Zhang W J, Han X D. A graphene quantum dot photodynamic therapy agent with high singlet oxygen generation[J]. Nature Communications, 2014, 5: 4596. |
| [85] | Guo L, Ge J C, Liu Q, Jia Q Y, Zhang H Y, Liu W M, Niu G L, Liu S, Gong J R, Hackbarth S, Wang P F. Versatile polymer nanoparticles as two-photon-triggered photosensitizers for simultaneous cellular, deep-tissue imaging, and photodynamic therapy[J]. Advanced Healthcare Materials. DOI:10.1002/adhm.201601431 |
| [86] | Guo L, Niu G L, Zheng X L, Ge J C, Liu W M, Jia Q Y, Zhang P P, Zhang H Y, Wang P F. Single near-infrared emissive polymer nanoparticle as a versatile phototheranostic[J]. Advanced Science. DOI:10.1002/advs.201700085 |
| [87] | Guo L, Liu W M, Niu G L, Zhang P P, Zheng X L, Jia Q Y, Zhang H Y, Ge J C, Wang P F. Polymer nanoparticles with high photothermal conversion efficiency as robust photoacoustic and thermal theranostics[J]. Journal of Mate-rials Chemistry B, 2017, 5(15): 2832–2839. DOI:10.1039/C7TB00498B |