早在20世纪初,意大利化学家Ciamician G就指出光化学拥有广阔的发展前景,能够解决化学合成中的能源消耗和环境污染两大难题[1]。可见光催化凭借操作简单、反应条件温和以及绿色环保的特性,自20世纪70年代起就被人们所关注,并在有机合成中逐渐得到应用。近几年可见光催化在该领域引起了一股研究热潮,取得了突破性的进展,成为了有机合成中的一种重要手段[2-7]。
可见光催化剂在大多数可见光催化反应中扮演核心角色——吸收光子并活化底物分子或反应中间体。可见光催化剂主要分为金属络合物和有机共轭分子等两类[8, 9]。金属络合物光催化剂主要是Ru(Ⅱ)、Ir(Ⅲ)等过渡金属与联吡啶(bpy)、联吡嗪(bpz)、联嘧啶(bpm)及它们的衍生物络合而成的, 如[Ru(bpy)3]Cl2、fac-Ir(ppy)3等。有机共轭分子光催化剂主要是一些感光的天然色素和染料,如eosin Y、rose bengal等(图 1)。另外一些半导体材料也可以被用于有机光催化反应中,如TiO2[10]、量子点(QDS)[11]、石墨烯氮化碳材料(g-C3N4)[12]等。
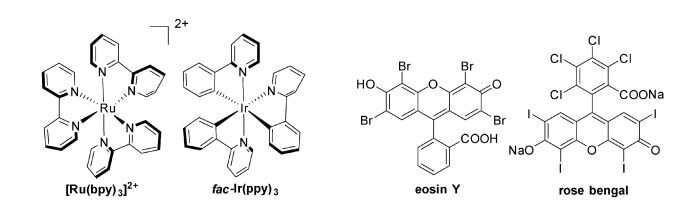
|
图 1 一些代表性光催化剂的结构式 Fig.1 Typical structure of photocatalysts |
氧气作为天然丰度最大的绿色氧化剂,与可见光催化相结合,极大地促进了绿色化学的发展。氧气在可见光催化反应中主要以活性氧的形态(1O2,O2·-等)与底物或者其他反应中间体作用,最终形成产物的部分结构或以H2O2、H2O的形式留在溶液中,后处理过程简单、方便,不会对环境造成任何污染。这种理想氧化剂的优越性已经引起了化学家们的广泛关注,为有机合成提供了一种新的选择方案。
1 可见光诱导需氧氧化历程根据反应的历程不同,可见光诱导需氧氧化反应可分为电子转移过程和能量转移过程,其中电子转移过程又可以分为氧化猝灭循环和还原猝灭循环(图 2),在可见光照射下,光催化剂由基态变成激发态的PC*,若进一步被还原成PC·-则为还原猝灭,而被氧化成PC·+则为氧化猝灭。图中S为电子供体,O2为电子受体,通过单电子循环过程使光催化剂回到基态,完成催化循环,促使反应能够顺利进行并得到所需的产物。
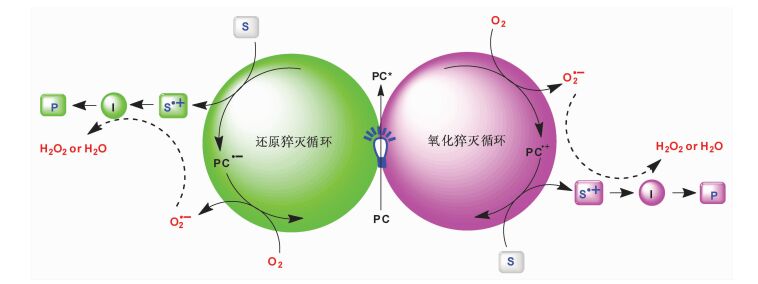
|
图 2 可见光诱导需氧氧化电子转移途径 Fig.2 Electron-transfer process of visible-light driven aerobic oxidation |
可见光诱导需氧氧化反应的另一途径——能量转移过程见图 3。光催化剂在可见光照射下,从HOMO激发一个电子到LUMO,然后进一步系间窜越给出一个相对长寿命的三重激发态。处于三重激发态的光催化剂将能量传递给基态的氧气,得到活化的单线态氧气,随后单线态氧气与底物作用生成产物或反应中间体。另一方面,光催化剂将能量传递给氧气后回到基态,进而开始新的催化循环。本文主要就我们课题组近年来在可见光诱导需氧氧化领域取得的成果以及反应的机理进行阐述。
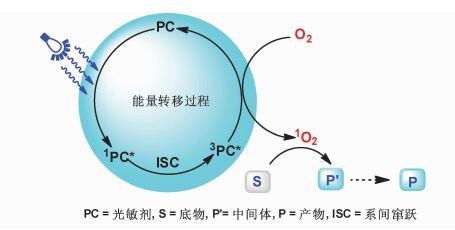
|
图 3 可见光诱导需氧氧化能量转移途径 Fig.3 Energy-transfer process of visible-light driven aerobic oxidation |
研究表明白藜芦醇及其类似物都有非常好的生物活性,如:抗癌作用、抗菌作用、抗炎作用以及对心血管的保护作用等,并且白藜芦醇及其类似物的低聚物具有与它们相似的生理活性和保健功能,甚至有些低聚物的生物活性比它们的单体还要优越[13]。由于这些低聚物的天然丰度很低,极大限制了对其潜在价值的进一步研究。因此,此类低聚物的仿生合成引起了化学家们的广泛关注,随之一些通过单电子金属氧化剂催化、酶-H2O2体系催化等合成白藜芦醇及其类似物低聚物的反应被发现和拓展。
2011年Selke课题组[14]报道了一例白藜芦醇在可见光催化的需氧氧化条件下的反应。他们使用亚甲基蓝作为光催化剂,可见光照射下亚甲基蓝被激发后与氧气经能量传递产生单线态氧,后者与白藜芦醇发生[4+2]环加成反应形成过氧化物,最终生成植物抗菌素桑辛素M(图 4)。
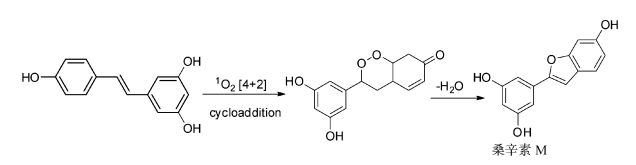
|
图 4 单线态氧与白藜芦醇反应 Fig.4 The reaction of singlet oxygen with resveratrol |
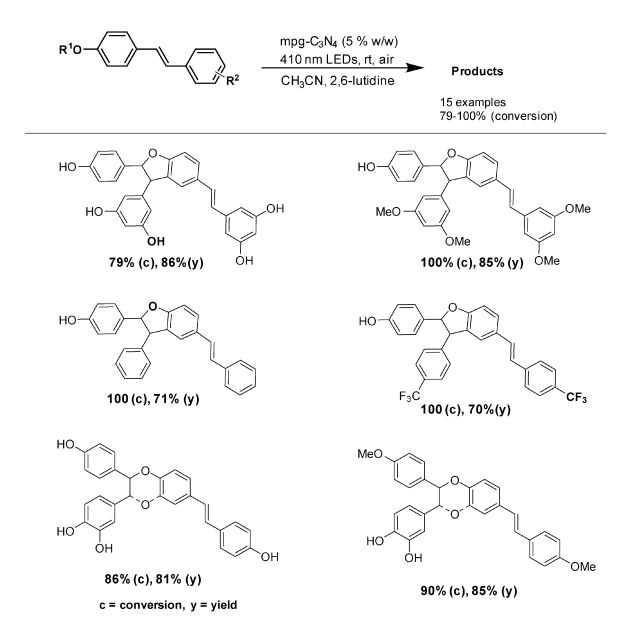
2014年,我们课题组使用mpg-C3N4作为光催化剂、氧气作为氧化剂,在可见光催化下实现了白藜芦醇及其类似物的氧化偶联,在温和条件下简便、高效、环保地实现了白藜芦醇及其类似物的二聚[15](图 5)。mpg-C3N4具有很大的比表面积(200 m2/g)并且其表面具有一些含氮基团,能有效地吸附氧气。mpg-C3N4最长吸收大于400 nm,可被可见光激发,其激发态导带的电位为-1.3 V(vs. NHE),和氧气发生电子转移产生超氧自由基阴离子的驱动力较大,能有效地抑制单线态氧的产生,避免了之前报道的单线态氧与白藜芦醇发生[2+2]环加成反应形成过氧化物。
|
图 5 白藜芦醇及其类似物的氧化偶联 Fig.5 Oxidative coupling of resveratrol and its analogues |
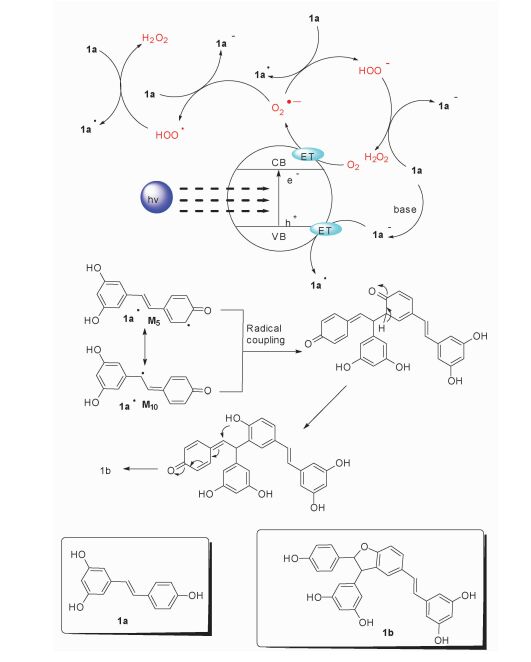
我们通过一系列杂合实验探究了反应途径,其结果证明了白藜芦醇的偶联反应机理为双自由基的偶联(图 6)。mpg-C3N4在可见光照射下,价带中的电子被激发跃迁到导带,形成空穴电子对。随后mpg-C3N4导带中的电子转移给氧气分子,产生超氧自由基阴离子O2·-。超氧自由基阴离子从白藜芦醇中得到质子后提取氢原子或者反之,都得到1a·并生成H2O2。自由基1a·通过电子的离域形成M5和M10两种共振结构。M5和M10发生自由基的偶联,随后通过烯醇式互变异构和分子内的亲核加成反应得到最终产物1b。此外,体系中碱2, 6-lutidine的加入可促使1a-以较高的浓度存在,从而更有利于白藜芦醇将电子转移给mpg-C3N4空的价带并生成关键中间体1a·。
|
图 6 白藜芦醇氧化偶联机理 Fig.6 Mechanism of oxidative coupling of resveratrol |
1, 4-二氢吡啶(1, 4-DHPs)是一类治疗心血管疾病的极其重要的药物,例如硝苯地平、非洛地平、尼莫地平被广泛地用于治疗高血压、心绞痛等疾病[16]。同时,1, 4-DHPs在有机合成中通过氧化芳构化能够合成各种取代的吡啶化合物。
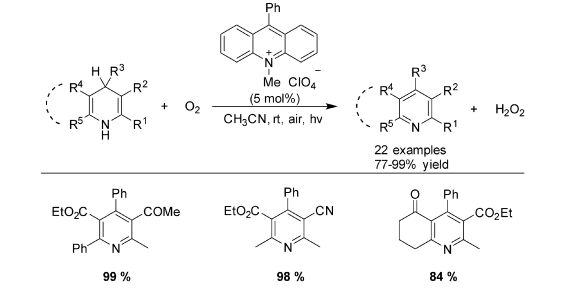
早在1970年,Mitsunobu等[17]报道了在氧气或者氮气条件下光照1, 4-DHPs芳构化反应没有区别。然而,Memarian等[18]发现氧气可以加速1, 4-DHPs芳构化的反应速率,影响反应的历程。2007年刘有成研究组[19]使用9-苯基-10-甲基吖啶高氯酸盐作为光敏剂,氧气作为氧化剂,在室温下高效地实现了1, 4-DHPs氧化芳构化(图 7)。
|
图 7 不对称1, 4-DHPs芳构化 Fig.7 Aromatization of unsymmetrical 1, 4-DHPs |
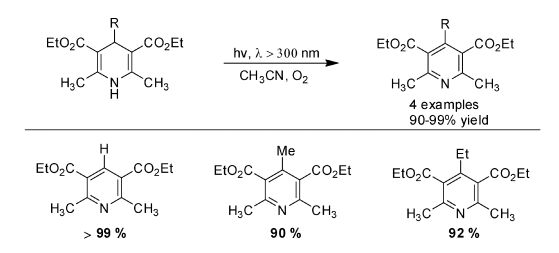
2010年吴骊珠课题组[20]利用1, 4-DHPs在紫外区域有很强的吸收这一特性,在空气或者氧气条件下,使用波长大于300 nm的光直接激发1, 4-DHPs,得到了芳构化的产物。光谱学和电化学证明了光诱导下1, 4-DHPs分子将电子转移给氧气分子,并且ESR捕截实验检测到体系中有超氧自由基阴离子生成(图 8)。
|
图 8 1, 4-DHPs芳构化 Fig.8 Aromatization of 1, 4-DHPs |
这些发现激发了我们课题组对于氧气条件下光催化芳构化反应的研究兴趣。我们之前已经证明TBA-eosin Y在光催化交叉脱氢偶联(CDC)反应中是非常理想的光催化剂,在可见光激发下O2与TBA-eosin Y作用产生超氧自由基阴离子而不是单线态氧[21]。我们使用TBA-eosin Y为光催化剂、K2CO3为添加剂,在空气条件下实现了1, 4-DHPs可见光催化芳构化反应[22](图 9)。
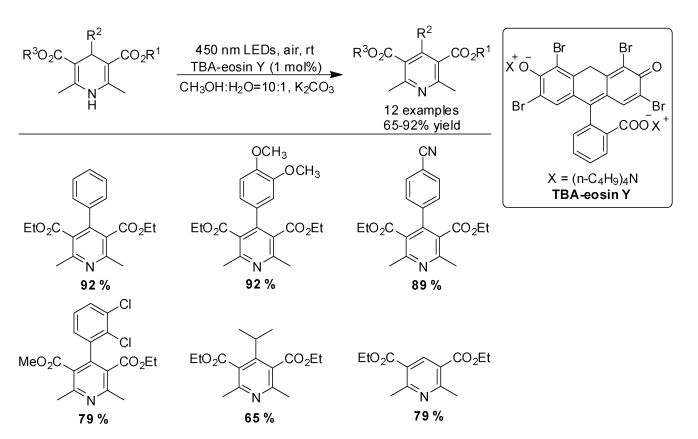
|
图 9 4, 4-DHPs氧化芳构化 Fig.9 Oxidative aromatization of 1, 4-DHPs |
可见光诱导1, 4-DHPs芳构化的反应机理如下(图 10):首先, K2CO3的存在促进了1, 4-DHP (2a)的解离,得到氧化电位较低的2a-。电子从2a-转移到三线态的3EY*,生成EY·-和2a·,随后氧气氧化EY·-完成催化循环,光催化剂重新回到基态并且得到超氧自由基阴离子O2·-。2a·进一步被体系中的3EY*或者O2·-氧化生成2a+,最后脱去H+得到芳构化产物2b。显然,体系中碱的加入对可见光诱导需氧氧化反应中电子转移途径更加有利,从而提高了需氧氧化反应的选择性。
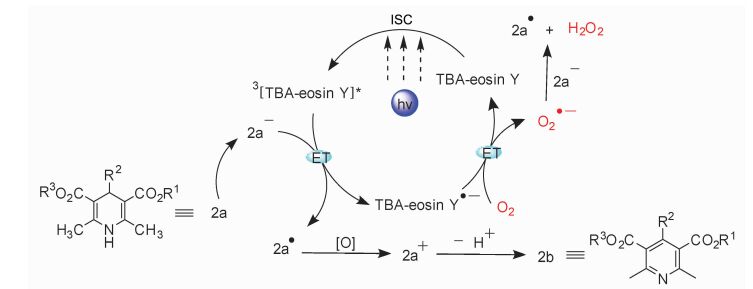
|
图 10 可见光诱导1, 4-DHPs氧化机理 Fig.10 Mechanism of visible-light-driven oxidative of 1, 4-DHPs |
我们课题组使用这种策略还成功地实现了不同取代基1, 4-二氢嘧啶(DHPMs)的芳构化反应,以较好的收率得到了2-取代嘧啶[23](图 11)。为了展示这种策略的实用性,底物3a在1 g规模的基础上以太阳光作为光源实现了高效的芳构化反应——光照4 h内即可得到产率为86%的3b。
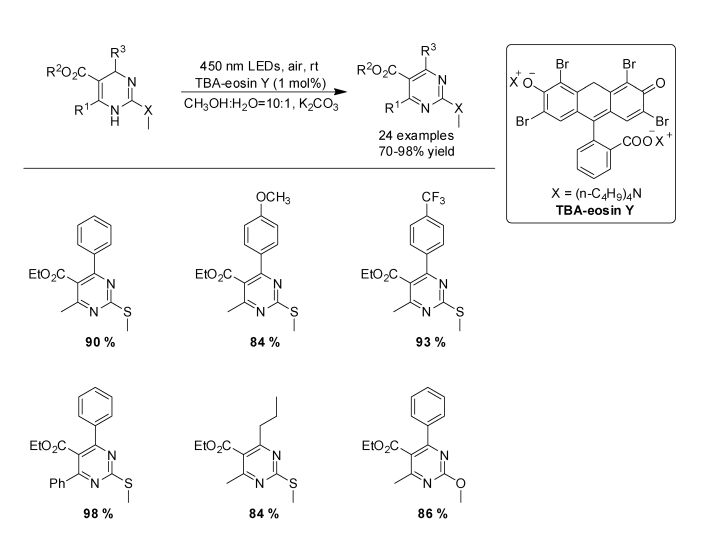
|
图 11 可见光诱导氧化合成2-取代嘧啶 Fig.11 Visible-light-driven oxidative synthesis of 2-substituted pyrimidine |
结合电化学数据及ESR和闪光光解研究,我们较为清晰地阐明了该可见光催化的需氧氧化的机理(图 12):在碱K2CO3的作用下,DHPMs(3a)被离解得到更强电子供体形式的3a-。从3a-到3EY*之间有效的电子转移抑制了3EY*与分子氧之间的能量转移,因此单线态氧的产生和它的相关副反应被减弱。随后EY·-和分子氧进行单电子转移,生成超氧自由基阴离子O2·-和基态的TBA-eosin Y。从3a-到EY*之间电子转移产生的3a·进一步被3EY*或者O2·-氧化,最后脱去H+得到产物3b。
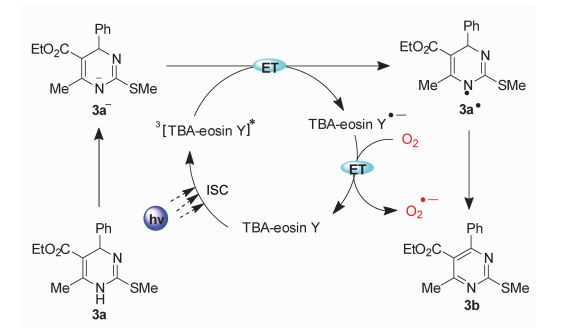
|
图 12 可见光诱导合成2-取代嘧啶机理 Fig.12 Visible-light-driven synthetic mechanism of 2-substituted pyrimidine |
随着对此类可见光催化需氧氧化反应的理解,我们用相似的策略实现了2-取代的酚亚胺的氧化环化,合成了2-取代的苯并恶唑(图 13)。我们通过对反应底物的大量拓展,充分证明了这种合成策略具有广泛的适用性。
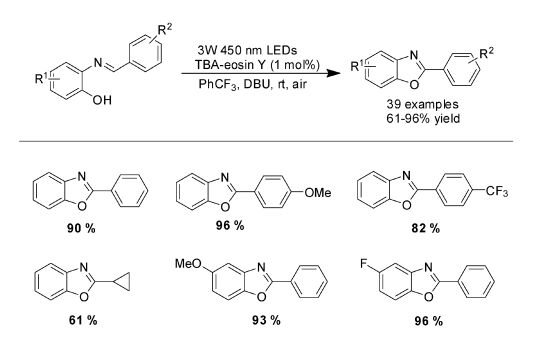
|
图 13 可见光诱导需氧氧化合成2-取代的苯并恶唑 Fig.13 Visible-light-driven aerobic oxidative synthesis of 2-substituted benzoxazole |
基态的氧气处于三线态并且具有双自由基的特性,因此它能够与可见光氧化产生的碳自由基进行偶联形成过氧自由基,随后经过氢原子提取过程或者单电子转移和质子提取过程产生过氧化物,最后消除一分子水得到羰基化合物(图 14)。近年来随着可见光催化的兴起,可见光诱导需氧氧化被成功地用于羰基的构筑[24-27]。
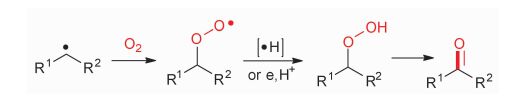
|
图 14 氧气和碳自由基的偶联过程 Fig.14 The coupling process of oxygen with carbon-centered radicals |
2004年Fukuzumi等[28]发现9-均三甲苯基-10-甲基吖啶高氯酸盐(Mes-Acr+)的电子转移态与自然界光合反应中心的电子转移态相比,具有更长的寿命和更高的能量以及非常出色的电子转移能力。Mes-Acr+具有很强的氧化能力(Ered* = 2.08 V vs. SCE),因此被广泛地用于各种光催化反应[29-33]。2016年王磊研究组[34]报道了空气条件下可见光催化氧化苯乙烯环化合成4-芳基四氢萘酮。体系中有副产物醛生成,这与Fukuzumi报道的超氧自由基阴离子与烯烃氧化产生的自由基阳离子偶联产生醛是一致的[35]。同年我们课题组报道了用Mes-Acr+作为光催化剂,以芳基烯烃和羧酸为原料进行可见光诱导需氧氧化合成α-酰氧基酮[36](图 15)。反应中亦观测到超氧自由基阴离子与烯烃自由基阳离子反应产生的醛。为了抑制O2·-引起的副反应,有必要对体系中的O2·-进行清除。Abdel-Wahab研究组报道了百里醌(TQ)是O2·-有效的清除剂[37],我们在体系中加入TQ后,显著地提高了反应产率。
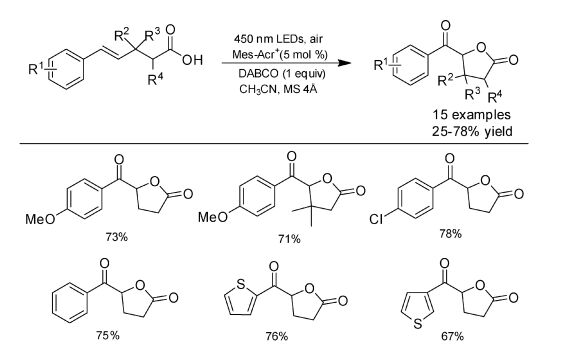
|
图 15 可见光诱导烯烃羧酸的氧化酰氧基化 Fig.15 Visible-light-driven oxo-acyloxylation of olefin acids |
该光催化氧化合成α-酰氧基酮的反应机理阐述如图 16所示:激发态的光催化剂氧化底物4a的双键成自由基阳离子A,在碱的作用下形成的羧酸负离子进攻烯烃自由基阳离子,生成的自由基B被氧气捕获得到过氧自由基C。过氧自由基C可以直接提取氢原子或者得到一个电子后再提取氢质子生成过氧化物D, 最后脱去一分子H2O得到目标产物4b。还原态的光催化剂被氧气或者过氧自由基C氧化回到基态,进行下一次催化循环。通过自由基捕获实验和密度泛函理论计算的结果表明,如果底物含有难以氧化的双键,那么氧化产生羧基自由基的途径也是可能的。
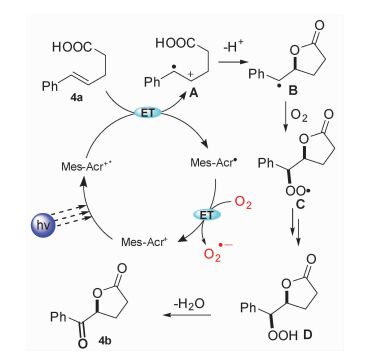
|
图 16 α-氧化酰氧基化机理 Fig.16 The mechanism of α-oxo-acyloxylation |
综上所述,可见光诱导的需氧氧化反应已经成为实现有机转化中绿色而强大的手段,是可见光催化的重要组成部分。毋庸置疑,利用可见光催化需氧氧化可发展更多新的反应和策略,进一步丰富有机合成方法。当然,可见光诱导需氧氧化仍然面临一些问题和挑战,例如如何抑制反应体系中的副反应、如何更清楚合理地解释反应机理、如何让光催化体系更加廉价高效以及如何将有价值的反应扩大至工业化生产等。对这些问题和挑战的研究将极大地推动可见光诱导需氧氧化的发展。
致谢 感谢国家自然科学基金委员会项目(21572090) 和中央高校基本科研基金(lzujbky-2017-k05) 为本论文的研究提供资金支持。| [1] | Ciamician G. The photochemistry of the future[J]. Science, 1912, 36: 385–394. DOI:10.1126/science.36.926.385 |
| [2] | Narayanam J M R, Stephenson C R J. Visible light photoredox catalysis:applications in organic synthesis[J]. Chemical Society Review, 2011, 40: 102–113. DOI:10.1039/B913880N |
| [3] | Xuan J, Xiao W J. Visible light photoredox catalysis[J]. Angewandte Chemie International Edition, 2012, 51: 6828–6838. DOI:10.1002/anie.201200223 |
| [4] | Xi Y M, Yi H, Lei A W. Synthetic applications of photoredox catalysis with visible light[J]. Organic & Biomolecular Chemistry, 2013, 11: 2387–2403. |
| [5] | Prier C K, Rankic D A, MacMillan D W C. Visible light photoredox catalysis with transition metal complexes:applications in organic synthesis[J]. Chemical Review, 2013, 113: 5322–5363. DOI:10.1021/cr300503r |
| [6] | Lang X J, Zhao J C, Chen X D. Cooperative photoredox catalysis[J]. Chemical Society Review, 2016, 45: 3026–3038. DOI:10.1039/C5CS00659G |
| [7] | Ravelli D, Protti S, Fagnoni M. Carbon-carbon bond forming reactions via photogenerated intermediates[J]. Chemical Review, 2016, 116: 9850–9913. DOI:10.1021/acs.chemrev.5b00662 |
| [8] | Romero N A, Nicewicz D A. Organic photoredox catalysis[J]. Chemical Review, 2016, 116: 10075–10166. DOI:10.1021/acs.chemrev.6b00057 |
| [9] | Skubi K L, Blum T R, Yoon T P. Dual catalysis strategies in photochemical synthesis[J]. Chemical Review, 2016, 116: 10035–10074. DOI:10.1021/acs.chemrev.6b00018 |
| [10] | Lang X J, Ma W H, Chen C C, Ji H W, Zhao J C. Selective aerobic oxidation mediated by TiO2 photocatalysis[J]. Accounts of Chemical Research, 2014, 47: 355–363. DOI:10.1021/ar4001108 |
| [11] | Li X B, Li Z J, Gao Y J, Meng Q Y, Yu S, Weiss R G, Tung C H, Wu L Z. Mechanistic insights into the interface-directed transformation of thiols into disulfides and molecular hydrogen by visible-light irradiation of quantum dots[J]. Angewandte Chemie International Edition, 2014, 53: 2085–2089. DOI:10.1002/anie.201310249 |
| [12] | Wang Y, Wang X C, Antonietti M. Polymeric graphitic carbon nitride as a heterogeneous organocatalyst:from photochemistry to multipurpose catalysis to sustainable chemistry[J]. Angewandte Chemie International Edition, 2012, 51: 68–89. DOI:10.1002/anie.201101182 |
| [13] | Jang M, Cai L, Udeani G O, Slowing K V, Thomas C F, Beecher C W W, Fong H H S, Farnsworth N R, Kinghorn A D, Mehta R G, Moon R C, Pezzuto J M. Cancer chemopreventive activity of resveratrol, a natural product derived from grapes[J]. Science, 1997, 275: 218–220. DOI:10.1126/science.275.5297.218 |
| [14] | Celaje J A, Zhang D, Guerrero A M, Selke M. Chemistry of trans-resveratrol with singlet oxygen:[2+2] addition, [4+2] addition, and formation of the phytoalexin moracin M[J]. Organic Letters, 2011, 13: 4846–4849. DOI:10.1021/ol201922u |
| [15] | Song T, Zhou B, Peng G W, Zhang Q B, Wu L Z, Liu Q, Wang Y. Aerobic oxidative coupling of resveratrol and its analogues by visible light using mesoporous graphitic carbon nitride (mpg-C3N4) as a bioinspired catalyst[J]. Chemistry-A European Journal, 2014, 20: 678–682. DOI:10.1002/chem.v20.3 |
| [16] | Zhang Z Q, Ji S J, Lu J, Yang J M. A mild and efficient synthesis of 5-Oxo-5, 6, 7, 8-tetrahydro-4H benze-[b]-pyran derivatives in room temperature ionic liquids[J]. Chinese Journal of Chemistry, 2005, 23: 1085–1089. DOI:10.1002/(ISSN)1614-7065 |
| [17] | Mitsunobu O, Matsumoto S, Wada M, Masuda H. Photooxidation of 1, 4-dihydropyridine[J]. Bulletin of the Chemical Society of Japan, 1972, 45: 1453–1457. DOI:10.1246/bcsj.45.1453 |
| [18] | Memarian H R, Sadeghi M M, Momeni A R, D pp D. Synthesis and photo-chemistry of novel 3, 5-diacetyl-1, 4-dihydropyridines[J]. Monatshefte Für Chemie, 2002, 133: 661–667. DOI:10.1007/s007060200038 |
| [19] | Fang X Q, Liu Y C, Li C Z. 9-Phenyl-10-methylacridi-nium:a highly efficient and reusable organocatalyst for mild aromatization of 1, 4-dihydro-pyridines by molecular oxygen[J]. The Journal of Organic Chemistry, 2007, 72: 8608–8610. DOI:10.1021/jo701796n |
| [20] | Wang D H, Liu Q, Cheng B, Zhang L P, Tung C H, Wu L Z. Photooxidation of Hantzsch 1, 4-dihydropyridines by molecular oxygen[J]. Chinese Science Bulletin, 2010, 55: 2855–2858. DOI:10.1007/s11434-010-3143-2 |
| [21] | Liu Q, Li Y N, Zhang H H, Chen B, Tung C H, Wu L Z. Reactivity and mechanistic insight into visible-light-induced aerobic cross-dehydrogenative coupling reaction by organophotocatalysts[J]. Chemistry-A European Journal, 2012, 18: 620–627. DOI:10.1002/chem.v18.2 |
| [22] | Wei X J, Wang L, Jia W L, Du S F, Wu L Z, Liu Q. Metal-free-mediated oxidation aromatization of 1, 4-dihydropyridines to pyridines using visible light and air[J]. Chinese Journal of Chemistry, 2014, 32: 1245–1250. DOI:10.1002/cjoc.v32.12 |
| [23] | Wang L, Ma Z G, Wei X J, Meng Q Y, Yang D T, Du S F, Chen Z F, Wu L Z, Liu Q. Synthesis of 2-substituted pyrimidines and benzoxazoles via a visible-light-driven organocatalytic aerobic oxidation:enhancement of the reaction rate and selectivity by a base[J]. Green Chemistry, 2014, 16: 3752–3757. DOI:10.1039/C4GC00337C |
| [24] | Griesbeck A G, Cho M. 9-Mesityl-10-methylacridinium:an efficient type Ⅱ and electron-transfer photooxygenation catalyst[J]. Organic Letters, 2007, 9: 611–613. DOI:10.1021/ol0628661 |
| [25] | Lechner R, Kümmel S, K nig B. Visible light flavin photo-oxidation of methyl-benzenes, styrenes and phenylacetic acids[J]. Photochemical & Photobiological Sciences, 2010, 9: 1367–1377. |
| [26] | Zhang P F, Wang Y, Yao J, Wang C M, Yan C, Anto-nietti M, Li H R. Visible-light-induced metal-free allylic oxidation utilizing a coupled photo-catalytic system of g-C3N4 and N-hydroxy compounds[J]. Advanced Synthesis & Catalysis, 2011, 353: 1447–1451. |
| [27] | Su Y J, Zhang L R, Jiao N. Utilization of natural sunlight and air in the aerobic oxidation of benzyl halides[J]. Organic Letters, 2011, 13: 2168–2171. DOI:10.1021/ol2002013 |
| [28] | Fukuzumi S, Kotani H, Ohkubo K, Ogo S, Tkachenko N V, Lemmetyinen H. Electron-transfer state of 9-mesityl-10-methylacridinium ion with a much longer lifetime and higher energy than that of the natural photosynthetic reaction center[J]. Journal of the American Chemical Society, 2004, 126: 1600–1601. DOI:10.1021/ja038656q |
| [29] | Perkowski A J, Nicewicz D A. Direct catalytic anti-Mar-kovnikov addition of carboxylic acids to alkenes[J]. Journal of the American Chemical Society, 2013, 135: 10334–10337. DOI:10.1021/ja4057294 |
| [30] | Zeng T T, Xuan J, Ding W, Wang K, Lu L Q, Xiao W J. [3+2] Cycloaddition/oxidative aromatization sequence via photoredox catalysis:one-pot synthesis of oxazoles from 2H-azirines and aldehydes[J]. Organic Letters, 2015, 17: 4070–4073. DOI:10.1021/acs.orglett.5b01994 |
| [31] | Ramirez N P, Bosque I, Gonzalez-Gomez J C. Photocatalytic dehydrogenative lactonization of 2-arylbenzoic acids[J]. Organic Letters, 2015, 17: 4550–4553. DOI:10.1021/acs.orglett.5b02269 |
| [32] | Hering T, Slanina T, Hancock A, Wille U, K nig B. Visible light photooxidation of nitrate:the dawn of a nocturnal radical[J]. Chemical Communications, 2015, 51: 6568–6571. DOI:10.1039/C5CC01580D |
| [33] | Yi H, Bian C L, Hu X, Niu L B, Lei A W. Visible light mediated efficient oxidative benzylic sp3 C-H to ketone derivatives obtained under mild conditions using O2[J]. Chemical Communications, 2015, 51: 14046–14049. DOI:10.1039/C5CC06015J |
| [34] | Wang K, Meng L G, Zhang Q, Wang L. Direct construction of 4-aryl tetralones via visible-light-induced cyclization of styrenes with molecular oxygen[J]. Green Chemistry, 2016, 18: 2864–2870. DOI:10.1039/C5GC02550H |
| [35] | Kotani H, Ohkubo K, Fukuzumi S. Photocatalytic oxygenation of anthracens and olefins with dioxygen via selective radical coupling using 9-mesityl-10-methylacridinium ion as an effective electron-transfer photocatalyst[J]. Journal of the American Chemical Society, 2004, 126: 15999–16006. DOI:10.1021/ja048353b |
| [36] | Zhang Q B, Ban Y L, Zhou D G, Zhou P P, Wu L Z, Liu Q. Preparation of α-acyloxy ketones via visible-light-driven aerobic oxo-acyloxylation of olefins with carboxylic acids[J]. Organic Letters, 2016, 18: 5256–5259. DOI:10.1021/acs.orglett.6b02560 |
| [37] | Badary O A, Taha R A, El-Din A M G, Abdel-Wahab M H. Thymoquinone is a potent superoxide anion scavenger[J]. Drug and Chemical Toxicology, 2003, 26: 87–98. DOI:10.1081/DCT-120020404 |




