3-吲哚乙酸(IAA)是一种植物体内普遍存在的内源生长素,属于吲哚类化合物,又称茁长素、生长素、异生长素。IAA可以调节植物的生长,对植物的生长和分化起着重要的调控作用,广泛应用于农作物生长调节。但需注意,IAA低浓度时可以促进植物生长,而高浓度时则会抑制生长,甚至使植物死亡,这一特性已引起人们极大的关注。
目前已经建立的检测IAA的方法主要有化学发光法[1, 2]、离子色谱法[3-5]和高效液相色谱法[6-8]。化学发光法容易受外界干扰因素的影响,重复性差;离子色谱法的特异性差;高效液相色谱法的检测可以取得较好的效果,但是样品前处理繁琐、耗时长、步骤复杂。为此,需要建立灵敏简便的检测方法和手段来检测IAA。
表面等离子体共振(SPR)[9-12]生物传感器是20世纪80年代兴起的光学生物传感器,发展迅速,具有灵敏度高、免标记、用量小,且能够实现实时、快速、在线检测等优点,现已成为一种成熟的检测生物分子间相互作用的方法。SPR生物传感器广泛应用于食品工业[13]、生命科学[14]、医药[15-17]等领域,但SPR对吲哚乙酸的检测未见相关报道。
金属纳米材料具有不同于传统固体材料的表面效应、小尺寸效应和宏观量子隧道效应,因而产生了许多独特的光、电、磁、力、化学和生物学特性。将金属纳米材料作为增敏材料引入SPR生物传感器来提高检测灵敏度已取得了一定的成果,并展现出了良好的发展前景和应用价值。金纳米粒子具有易于制备、化学稳定性高、生物相容性好的优点被引入SPR生物传感器[18, 19]。银纳米粒子比金纳米粒子具有一个更加尖锐的SPR共振峰,并表现出更高的折射率灵敏度响应,因此银纳米粒子的应用也较为普遍[20]。Au/Ag合金纳米粒子同时具有金和银纳米粒子的优点,也被引入SPR生物传感器[21, 22]。
本实验将Au/Ag合金纳米粒子引入到SPR生物传感器的制备中,提高了检测的灵敏度,吲哚乙酸标准溶液的检出限为2.2 μg/L,采用铁氰化钾发光体系检测吲哚乙酸的检出限为3.0×10-8 mol/L[2],即5.3 μg/L,与文献相比,本方法降低了检出限,取得了较好的结果,实现了对IAA的快速、简便、灵敏的检测。
1 实验部分 1.1 仪器与试剂仪器:FT-SPR型表面等离子体共振仪(美国Thermo公司),传感芯片1.8 cm×1.8 cm×0.14 mm,芯片表面金的厚度为50 nm,芯片的传感层为金;SZ-93自动双重纯水蒸馏水器,上海象华化工有限公司;KQ-200KD高功率数控超声清洗器,昆山市超声仪器有限公司;BS210S电子天平,北京赛多利斯天平有限公司;PHS-3D型pH计,上海精密科学仪器有限公司;100~1000 μL移液枪,大龙兴创实验仪器有限公司。
试剂:1, 6-己二硫醇(HDT, 98%)、3-巯基丙酸(MPA, 98%)、1-乙基-(3-二甲基氨基丙基)碳二亚胺盐酸盐(EDC, 98.5%)、N-羟基琥珀酰亚胺(NHS,98%),均购自上海晶纯试剂有限公司;盐酸乙醇胺(>99.0%),东京华成工业株式会社;蛋白A,美国Sigma-Aldrich;吲哚乙酸(IAA)、吲哚乙醛(IAAID)、吲哚乙酸抗体,均购自山东普天试剂公司。所用试剂均为分析纯。
1.2 Au/Ag合金纳米粒子的制备根据文献方法[23-25],取氯金酸(0.5 mL, 1%)加入盛有97 mL二次蒸馏水的三口蒸馏烧瓶中,用电热套加热至沸后,边搅拌边加入硝酸银(2.5 mL, 0.25%),待再次沸腾后,用医用注射器快速加入1.5 mL 1%的柠檬酸钠,保持微沸状态并不断搅拌,回流15 min后停止加热,发现混合物颜色逐渐由无色变成浅黄色,在搅拌下冷却至室温,转移至棕色玻璃瓶中密封4 ℃保存。
1.3 吲哚乙酸SPR生物传感器的制备本文制备了两种吲哚乙酸SPR生物传感器,传感器1为传统方法制备,传感器2为引入Au/Ag合金纳米粒子增敏的方法制备。
传感器1的制备:将裸金芯片1放入新制备的洗液(H2SO4:30%H2O2=7:3) 中浸泡5 min,在浸泡过程中要充分振荡3次,用镊子取出芯片1用大量的二次蒸馏水冲洗,用氮气吹干。然后将芯片1放入0.01 mol/L的MPA溶液中,室温下浸泡12 h,形成一层密集的自组装单分子层(SAM)后取出芯片1,用二次蒸馏水清洗芯片,用氮气吹干。再把芯片1浸入到EDC/NHS混合溶液(0.2 mol/L EDC:0.05 mol/L NHS=1:1) 中静置1 h,活化MPA末端的羧基。取出芯片1后,用二次蒸馏水冲洗芯片,用氮气吹干;再将芯片1浸泡于0.1 mg/L的蛋白A溶液中2 h, 取出芯片1后用磷酸盐缓冲液(PBS)冲洗芯片,用氮气吹干;再将芯片1转入乙醇胺溶液(5 g/L, pH=8.5) 中,浸泡1 h,使其与已活化的羧基反应,封闭芯片表面的共价反应位点。取出芯片1后用PBS冲洗芯片1,用氮气吹干。
传感器2的制备:先用洗液清洗裸金芯片2,然后将芯片2浸泡到新配制的HDT(0.01 mol/L)的乙醇/水(体积比2:1) 溶液中24 h,获得一层密集的自组装单分子层(SAM),取出芯片2后先用无水乙醇清洗,再用二次蒸馏水清洗,用氮气吹干后置于Au/Ag纳米粒子溶胶中12 h, 取出芯片2,用二次蒸馏水冲洗,接下来在芯片2上依次结合MPA、NHS、蛋白A、乙醇胺,方法同传感器1。两种制备方法的不同之处在于传感器2引入了Au/Ag合金纳米粒子,是通过与HDT形成Au—S键从而固定到芯片上的。
1.4 抗体在传感器上的固定将传感器1或2装入SPR仪器,整个实验过程保持160 μL/min的流速,设定仪器参数,通入PBS溶液至信号稳定,采集背景。通入10 μg/mL的抗体溶液至信号稳定后,再通入PBS溶液冲洗掉未结合到传感器芯片上的抗体至信号稳定。
1.5 IAA的检测抗体固定到传感器1或2上后,向流通池中依次通入浓度为17.5 μg/L、175 μg/L、350 μg/L、700 μg/L的IAA标准溶液,溶液中的抗原能和固定在传感器芯片上的抗体发生特异性反应。两个浓度溶液间隔要通PBS以冲洗掉未与抗体结合的IAA,为使检测结果可靠,每次实验平行3次。
1.6 传感器芯片的再生检测结束后,将芯片放入新配制的洗液中浸泡15 min,浸泡时充分振荡3次以除去芯片表面的试剂,取出芯片用大量的二次蒸馏水冲洗,用氮气吹干备用。
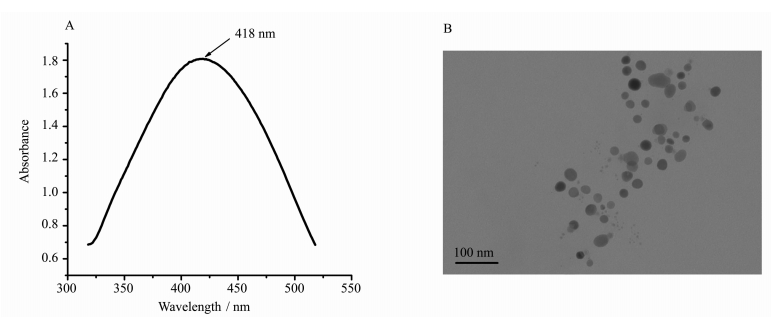
2 结果与讨论 2.1 Au/Ag复合纳米粒子的表征图 1A显示了Au/Ag复合纳米粒子的紫外可见吸收图谱,由图可知Au/Ag复合纳米粒子在418 nm处有一个特征吸收峰,该峰介于金纳米吸收峰和银纳米吸收峰之间,证明Au/Ag复合纳米粒子已生成。适度增加银元素的含量可以使传感器的灵敏度进一步提高[26],所以本实验中Au/Ag复合纳米粒子的摩尔比为0.25:0.75 (Au:Ag)。
|
图 1 Au/Ag复合纳米粒子的吸收光谱(A)和TEM图(B) Fig.1 UV-Vis absorbance spectrum (A) and TEM photograph (B) of Au/Ag alloy nanoparticles |
图 1B为Au/Ag复合纳米粒子的透射电子显微镜(TEM)图,平均粒径为35 nm。
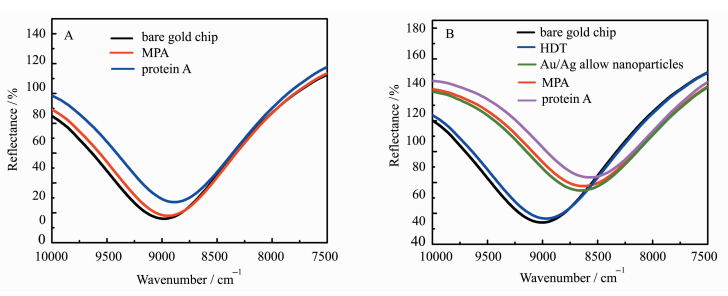
2.2 传感器在线下修饰不同物质的SPR光谱表征当试剂修饰到传感器芯片上时,其表面质量会发生变化,使谱线的波数发生位移,因此,可通过检测芯片的谱线波数的变化来观察不同物质是否已修饰到芯片上。图 2A是传感器1的芯片修饰不同物质的SPR光谱,其中曲线1是裸芯片的SPR光谱,最大吸收波数为8940 cm-1;曲线2是芯片修饰了MPA的SPR光谱,MPA可与Au-S键结合,最大吸收波数变为8921 cm-1,移动了19 cm-1;曲线3是芯片修饰了蛋白A的SPR光谱,蛋白A上的氨基可与MPA活化后的羧基结合,最大吸收波数变为8870 cm-1,移动了51 cm-1。说明MPA和蛋白A都成功的修饰到了芯片上。
|
图 2 A.传感器1在线下修饰不同物质的SPR图谱;B.传感器2在线下修饰不同物质的SPR图谱 Fig.2 A. SPR spectra of various reagent modified on sensor 1; B. SPR spectra of various reagent modified on sensor 2 |
图 2B是传感器2的芯片修饰不同物质的SPR光谱,其中曲线1是裸芯片的SPR光谱,最大吸收波数是8970 cm-1;曲线2是芯片修饰了HDT的SPR光谱,HDT通过Au—S键结合,最大吸收波数变为8945 cm-1,移动了25 cm-1;曲线3是芯片修饰了Au/Ag复合纳米粒子的SPR光谱,纳米粒子通过Au—S键、Ag—S键与HDT结合,最大吸收波数变为8605 cm-1,移动了340 cm-1;曲线4和5是芯片分别修饰了MPA和蛋白A的SPR光谱,最大吸收波数分别为8595 cm-1和8530 cm-1,分别移动了10 cm-1和65 cm-1。说明不同的物质已经成功的修饰到了芯片上。
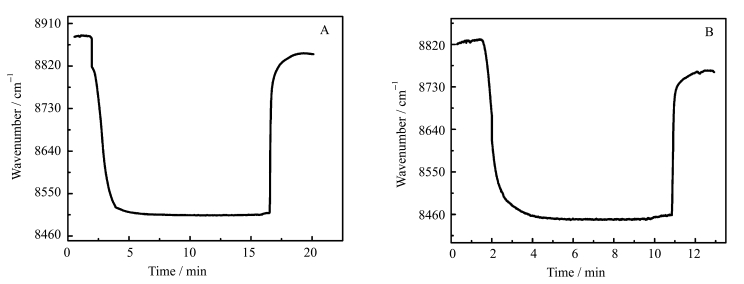
2.3 抗体在传感器芯片上的固定抗体与蛋白A能在其非抗原结合位点结合,使其修饰到芯片上。图 3A是抗体在传感器1的芯片上的修饰图谱,由图可知,当浓度为10 μg/mL的抗体溶液通过SPR芯片时,由于表面吸附,导致最大吸收波数由8880 cm-1降至8505 cm-1并保持稳定,随后用PBS清洗,去除非特异性吸附的抗体,最终波数变为8845 cm-1,下降约35 cm-1,说明抗体已经成功的修饰到了芯片上。
|
图 3 A.抗体在传感器1的芯片上的修饰SPR图谱;B.抗体在传感器2的芯片上的修饰SPR图谱 Fig.3 A. SPR spectra of IAA antibody modified on sensor chip 1;B. SPR spectra of IAA antibody modified on sensor chip 2 |
图 3B为抗体在传感器2的芯片上修饰的SPR图谱,由图可知,当浓度为10 μg/mL的抗体通过SPR芯片时,由于表面吸附,致使最大吸收波数由8825 cm-1降至8450 cm-1左右并保持稳定,随后用PBS清洗,去除非特异性吸附的抗体,最终波数变为8760 cm-1左右,下降约65 cm-1,说明抗体已成功修饰到芯片上。
由图 3A和B的对比可知,当传感器2的芯片上修饰了Au/Ag复合纳米粒子后,抗体修饰时的波数位移值明显增大了30 cm-1。
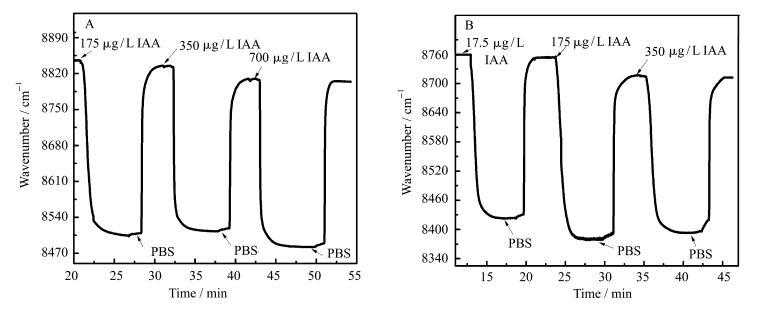
2.4 SPR生物传感器对IAA的检测图 4A为传感器1在检测浓度为175、350、700 μg/L IAA标液时的图谱。由图可知,浓度为175 μg/L的IAA通过SPR芯片时,由于IAA抗体与IAA的特异性结合,使最大吸收波数由8845 cm-1降至8500 cm-1并保持稳定,随后用PBS冲洗,去除未与IAA抗体特异性结合的IAA,最终吸收波数变为8839 cm-1,下降约6 cm-1;接着通入浓度为350 μg/L的IAA,最大吸收波数由8839 cm-1降至8510 cm-1并保持稳定,用PBS冲洗掉未与IAA抗体特异性结合的IAA,最终吸收波数变为8819 cm-1, 下降约20 cm-1;再通入更高浓度的700 μg/L的IAA时, 最大吸收波数几乎无变化,说明IAA与IAA抗体的结合已达饱和。
|
图 4 A.传感器1检测IAA(175、350、700 μg/L)的SPR图谱;B.传感器2检测IAA(17.5、175、350 μg/L)的SPR图谱 Fig.4 A. SPR spectra of 175, 350, 700 μg/L IAA detection by sensor 1; B. SPR spectra of 17.5, 175, 350 μg/L IAA detection by sensor 2 |
图 4B为传感器2在检测浓度为17.5、175、350 μg/L的IAA标液时的图谱。由图可知,17.5 μg/L的IAA通过SPR芯片时,最大吸收波数由8775 cm-1降至8430 cm-1并保持稳定,随后用PBS冲洗掉未与IAA抗体结合的IAA,最终吸收波数变为8768 cm-1,下降约7 cm-1;接着通入175 μg/L的IAA,最大吸收波数由8768 cm-1降至8370 cm-1并保持稳定,用PBS冲洗掉未与IAA抗体结合的IAA,最终吸收波数变为8745 cm-1,下降约23 cm-1;通入浓度更高的350 μg/L IAA时,最大吸收波数几乎无变化,说明IAA与IAA抗体的结合已达饱和。
通过图 4A和4B的对比可知,当传感器上修饰了Au/Ag复合纳米粒子后,最低IAA检测浓度由175 μg/L下降至17.5 μg/L,降为原浓度的1/10,显示出明显的优势。
2.5 IAA的浓度与其SPR波数位移值的关系图 5A为传感器1的IAA标液的浓度与其SPR波数位移值的关系图,经过3次平行测定,在浓度范围为175~350 μg/L时,两者呈良好的线性关系,R2=0.994,线性方程为y=-6.58+0.103x,检出限为25 μg/L(S/N=3)。图 5B为传感器2的IAA标液的浓度与其SPR波数位移值的关系图,经过3次平行测定,在浓度范围为17.5~250 μg/L时,两者呈良好的线性关系,R2=0.999,线性方程为y=4.27+0.104x,检出限为2.2 μg/L(S/N=3)。二者对比可知,传感器2的检出限只有传感器1的约1/12,这说明Au/Ag合金纳米粒子确实可以提高检测的灵敏度,降低检出限,同时亦说明本实验制备的SPR生物传感器可以定量检测IAA。
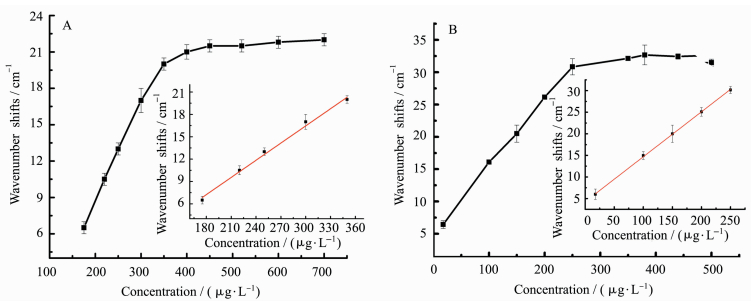
|
图 5 A.传感器1的IAA的浓度与其SPR波数位移值的关系图;B.传感器2的IAA的浓度与其SPR波数位移值的关系图 Fig.5 A. Relationship between concentrations of IAA and SPR wavenumber shifts of sensor 1;B. Relationship between concentrations of IAA and SPR wavenumber shifts of sensor 2 |
综上所述,传感器2上修饰了Au/Ag复合纳米粒子后比传感器1的灵敏度高。原因是当入射光照射到金、银等金属离子上时会激发出表面等离子体,使入射光在表面产生较强的电磁场强度,因而极大地增强了吸附在芯片表面的物质产生的拉曼散射强度,从而提高了检测灵敏度。因此,以下实验均只采用传感器2进行检测。
2.6 SPR生物传感器的特异性用吲哚乙醛(IAAID)、脱落酸(ABA)、细胞分裂素(CTK)来探究实验所构建的SPR生物传感器检测IAA的特异性。图 6为传感器分别检测IAA、IAAID、ABA、CTK标液(浓度均为175 μg/L)时最大吸收波数变化情况。由图可知,当检测IAA时,最大吸收波数变化值为23 cm-1,而当检测IAAID、ABA、CTK时,最大吸收波数变化值几乎无变化。这一结果验证了实验所构建的SPR生物传感器对IAA具有较好的特异性。
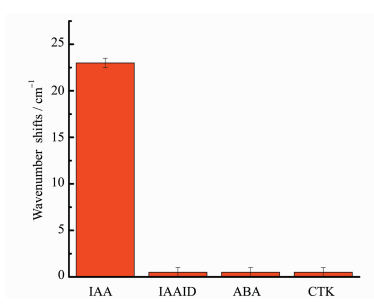
|
图 6 SPR生物传感器的特异性 Fig.6 Specificity of SPR biosensor |
准确移取浓度为25 μg/L的IAA标液5份,进行平行测定,结果见表 1,RSD=0.75%,说明SPR生物传感器具有较好的精密度。
| 表 1 SPR生物传感器的精密度 Table 1 Precision of SPR biosensor |
准确移取浓度为175 μg/L的IAA标液5份,分别于0、2、4、6、8 h进行测定,结果见表 2,RSD=1.1%,说明SPR生物传感器具有较好的稳定性。
| 表 2 SPR生物传感器的稳定性 Table 2 Stability of SPR biosensor |
采用5个与传感器2制备方法相同的传感器,分别检测同一浓度的IAA标液(100 μg/L),结果见表 3,RSD=0.52%,说明SPR生物传感器有较好的重现性。
| 表 3 SPR生物传感器的重现性 Table 3 Reproducibility of SPR biosensor |
对IAA的标液进行加标回收实验:准确移取浓度为150、200、250 μg/L的IAA标液各3份,每份5 mL,向每份标液中分别加入5 mL的100 μg/L IAA标液,每份混匀后分别测定,每个浓度水平的标液平行测定3次,测定结果取平均值。测定结果见表 4,加标回收率范围是96%~100.2%,平均值为98.4%。
| 表 4 加标回收实验结果 Table 4 Standard addition recovery experiment results |
本实验制备的两种吲哚乙酸SPR生物传感器均可成功检测到IAA,检出限分别为25 μg/L和2.2 μg/L,对比可知,Au/Ag合金纳米粒子的引入可将传感器检出限降至约1/12,说明引入Au/Ag合金纳米粒子可以提高检测的灵敏度,降低检出限。因此,Au/Ag合金纳米粒子作为SPR生物传感器的增敏材料具有广阔的发展前景和实用价值,本实验的结果也可以为利用SPR生物传感器检测其他物质的增敏提供借鉴。此外,制备的SPR生物传感器还具有较好的精密度、稳定性和重现性,能为实验提供可靠的数据。
| [1] |
刘丽珍, 韩素琴. 鲁米诺-铁氰化钾化学发光体系测定吲哚乙酸[J]. 山西师范大学学报(自然科学版), 2009, 23(2): 74–77.
Liu L Z, Han S Q. Determination of indole acetic acid by chemiluminescence with Luminol -potassium ferricyanide system[J]. Journal of Shanxi Normal University (Natural Science Edition), 2009, 23(2): 74–77. |
| [2] |
马桂贤, 赵守苗, 王会丽, 赵盼, 韩素琴. 铁氰化钾化学发光体系测定吲哚-3-乙酸[J]. 山西师范大学学报(自然科学版), 2009, 23(4): 63–65.
Ma G X, Zhao S M, Wang H L, Zhao P, Han S Q. Determination of indole-3-acetic acid by chemiluminescence with potassium ferricyanide system[J]. Journal of Shanxi Normal University (Natural Science Edition), 2009, 23(4): 63–65. |
| [3] |
吴东亮, 徐茂生, 张培志, 张培敏, 孙素敏, 徐育, 朱岩. 离子色谱法电导检测测定土壤中的吲哚-3-乙酸[J]. 仪器仪表学报, 2001, 22(4): 376–377.
Wu D L, Xu M S, Zhang P Z, Zhang P M, Sun S M, Xu Y, Zhu Y. Determination of indol-3-acetic with ion chromatography and suppressed conductance detector[J]. Chinese Journal of Scientific Instrument, 2001, 22(4): 376–377. |
| [4] |
颜金良, 俞明飞. 离子色谱法测定饮水中吲哚乙酸、吲哚丙酸和吲哚丁酸含量[J]. 中国卫生检验杂志, 2013, 23(7): 1723–1724.
Yan J L, Yu M F. Determination of indole acetic acid, 3-indole propionic acid, indole butyric acid, in drinking water by ion chromatography[J]. Chinese Journal of Health Laboratory Technology, 2013, 23(7): 1723–1724. |
| [5] |
颜金良, 王立. 离子色谱法快速测定蔬菜中吲哚乙酸[J]. 中国卫生检验杂志, 2009, 19(8): 1796–1797.
Yan J L, Wang L. Determination of indol-3-acetic acid in vegetable by ion chromatography[J]. Chinese Journal of Health Laboratory Technology, 2009, 19(8): 1796–1797. |
| [6] |
王佳祥, 王珊珊, 赵平. 高效液相色谱法同时测定蔬菜及水果中的吲哚丁酸和萘乙酸[J]. 化学工程师, 2013, 212(5): 23–25.
Wang J X, Wang S S, Zhao P. Determination of in IBA and NAA in vegetables and fruits by HPLC[J]. Chemical Engineer, 2013, 212(5): 23–25. |
| [7] |
王明月. 高效液相色谱法测定发酵液中的吲哚乙酸含量[J]. 热带农业工程, 2009, 33(5): 1–3.
Wang M Y. Determination of indole acetic acid content in the fermentation broth using HPLC[J]. Tropical Agricultural Engineering, 2009, 33(5): 1–3. |
| [8] |
马振宇, 吕志华, 姜廷福, 王远红. 高效液相色谱法测定菌肥中赤霉素和吲哚乙酸含量方法研究[J]. 分析测试技术与仪器, 2005, 11(3): 174–177.
Ma Z Y, Lü Z H, Jiang T F, Wang Y H. Determination of the content of gibberellin A3 and indole acetic acid from fertilizer by HPLC[J]. Analysis and Testing Technology and Instruments, 2005, 11(3): 174–177. |
| [9] |
陈执中. 表面等离子共振检测系统的研究进展[J]. 化学传感器, 2002, 22(1): 1–6.
Chen Z H. Progress in the studies of surface plasmon resonance detection system[J]. Chemical Sensors, 2002, 22(1): 1–6. |
| [10] |
程慧, 黄朝峰, 段子渊. SPR生物传感器及其应用进展[J]. 中国生物工程杂志, 2003, 23(5): 46–49.
Cheng H, Huang C F, Duan Z Y. Advances in the application of SPR biosensors[J]. China Biotechnology, 2003, 23(5): 46–49. |
| [11] |
段媛媛, 刘德立. SPR生物传感器的特点及其在生物特异性相互作用分析中的应用[J]. 生物技术通讯, 2002, 13(1): 72–75.
Duan Y Y, Liu D L. The advantages of SPR biosensor and its application in biospecific interaction analysis[J]. Letters in Biotechnology, 2002, 13(1): 72–75. |
| [12] |
吴世康, 汪鹏飞. 表面等离子体共振(SPR)——一种新型化学检测方法的原理[J]. 影像科学与光化学, 2008, 26(2): 157–168.
Wu S K, Wang P F. Surface plasmon resonance (SPR)-the principle of a new method for chemical detection[J]. Imaging Science and Photochemistry, 2008, 26(2): 157–168. DOI:10.7517/j.issn.1674-0475.2008.02.157 |
| [13] |
苏二辉, 耿国强, 赵向阳, 李伟, 江敏, 胡建东. 表面等离子共振生物传感器技术在食品安全快速检测中的应用研究进展[J]. 河南农业大学学报, 2007, 41(1): 113–116.
Su E H, Geng G Q, Zhao X Y, Li W, Jiang M, Hu J D. Study advancement of a surface plasmon resonance biosensor technology for rapid food safety testing[J]. Journal of Henan Agricultural University, 2007, 41(1): 113–116. |
| [14] |
王春艳, 李莹辉, 熊江辉, 谭映军, 聂捷琳, 刘学勇. SPR生物传感器在生命科学及在航天医学中的应用[J]. 空间科学学报, 2005, 25(3): 208–211.
Wang C Y, Li Y H, Xiong J H, Tan Y J, Nie J L, Liu X Y. Applications of surface plasmon resonance biosensor in life science and space medicine[J]. Chinese Journal of Space Science, 2005, 25(3): 208–211. DOI:10.11728/cjss2005.03.208 |
| [15] |
刘萍, 辛现良, 耿美玉. SPR技术在免疫学研究中的应用[J]. 现代生物医学进展, 2009, 9(9): 1749–1752.
Liu P, Xin X L, Geng M Y. Application of surface plasmon resonance technology on immunology territory[J]. Progress in Modern Biomedicine, 2009, 9(9): 1749–1752. |
| [16] |
翁璇, 郑小林, 杨军. SPR生物传感器及其在生物医学中的应用[J]. 中国医疗器械杂志, 2006, 30(5): 383–387.
Weng X, Zheng X L, Yang J. Surface plasmon resonance biosensor technology and its application in biomedicine[J]. Chinese Journal of Medical Instrumentation, 2006, 30(5): 383–387. |
| [17] |
路萍萍, 孟志云, 王敏伟, 刘婷, 王欣, 毕学智, 田慧芳, 王慧, 窦桂芳. 表面等离子共振技术测定药物与人血清白蛋白的相互作用[J]. 中国药理学与毒理学杂志, 2007, 21(2): 147–151.
Lu P P, Meng Z Y, Wang M W, Liu T, Wang X, Bi X Z, Tian H F, Wang H, Dou G F. Interactions between drug and human serum album in investigated using surface plasmon resonance technology[J]. Chinese Journal of Pharmacology Toxicology, 2007, 21(2): 147–151. |
| [18] | Bedford E E, Spadavecchia J, Pradier C M, Gu F X. Surface plasmon resonance biosensors incorporating gold nanoparticles[J]. Macromolecular Bioscience, 2012, 12(6): 724–139. DOI:10.1002/mabi.v12.6 |
| [19] | Gnedenko O V, Mezentsev Y V, Molnar A A, Lisitsa A V, Ivanov A S, Archakov A I. Highly sensitive detection of human cardiac myoglobin using a reverse sandwich immunoassay with a gold nanoparticle-enhanced surface plasmon resonance biosensor[J]. Analytical Chimica Acta, 2012, 759: 105–109. |
| [20] | Peng T C, Lin W C, Chen C W, Tsai D, Chiang H P. Enhanced sensitivity of surface plasmon resonance phase-interrogation biosensor by using silver nanoparticles[J]. Plasmonics, 2011, 6(1): 29–34. DOI:10.1007/s11468-010-9165-4 |
| [21] | Tu H, Sun T, Grattan K. SPR-based optical fibre sensors using gold-silver alloy particles as the active sensing material[J]. Sensors Journal IEEE, 2013, 13(6): 2192–2199. DOI:10.1109/JSEN.2013.2250953 |
| [22] | Wang J, Song D Q, Wang L Y, Zhang H, Zhang H Q, Sun Y. Design and performances of immunoassay based on SPR biosensor with Au/Ag alloy nanocomposites[J]. Sensors and Actuators B, 2011, 157(2): 547–553. DOI:10.1016/j.snb.2011.05.020 |
| [23] |
王文星, 黄玉萍, 陈启凡, 徐淑坤, 杨冬芝. 没食子酸还原法制备金银合金纳米粒子及其吸收光谱研究[J]. 光谱学与光谱分析, 2008, 28(8): 1726–1729.
Wang W X, Huang Y P, Chen Q F, Xu S K, Yang D Z. Synthesis and absorption spectra proper ties of Au-Ag alloy nanoparticles using gallic acid as reductant[J]. Spectroscopy and Spectral Analysis, 2008, 28(8): 1726–1729. |
| [24] |
王梅, 姚建林, 顾仁敖. Au-Ag合金纳米粒子制备及其表面增强拉曼光谱研究[J]. 高等学校化学学报, 2006, 27(8): 1518–1521.
Wang M, Yao J L, Gu R A. Preparation and surface enhanced raman spectroscopic studies on Au-Ag alloy nanoparticles[J]. Chemical Journal of Chinese Universities, 2006, 27(8): 1518–1521. |
| [25] |
金毅亮, 姚建林, 顾仁敖. 金银合金纳米粒子的合成及其SERS研究[J]. 光谱学与光谱分析, 2008, 28(6): 1309–1311.
Jin Y L, Yao J L, Gu R A. Preparation and surface enhanced raman spectroscopic studies on Au-Ag alloy nanoparticles[J]. Spectroscopy and Spectral Analysis, 2008, 28(6): 1309–1311. |
| [26] | Tu H, Sun T, Grattan K T. SPR-based optical fiber sensors using gold-silver alloy particles as the active sensing material[J]. Sensors Journal, IEEE, 2013, 13(6): 2192–2199. DOI:10.1109/JSEN.2013.2250953 |




