2. 东南大学 生物科学与医学工程学院 生物电子学国家重点实验室, 江苏 南京 210096;
3. 贵州省中国科学院天然产物化学重点实验室, 贵州 贵阳 550002
2. State Key Laboratory of Bioelectronics, School of Biological Science and Medical Engineering, Southeast University, Nanjing 210096, Jiangsu, P. R. China;
3. The Key Laboratory of Chemistry for Natural Products of Guizhou Province and Chinese Academy of Sciences, Guiyang 550002, Guizhou, P. R. China
量子点(quantum dots, QDs)作为当前纳米生物医学领域中普遍研究的一种纳米荧光材料,具有高的荧光产率、宽的激发光谱、窄的荧光光谱,以及表面易功能化修饰等诸多优点[1-4],是一种很有发展潜力的荧光探针,已被广泛应用于多个领域:分析领域,如离子、小分子,以及生物分子等检测[5-7];生物领域,如细胞成像、动物活体成像[8, 9];能源及光电器件[10, 11]领域等。
α, β, γ, δ-四(1-甲基吡啶嗡-4-基)卟吩对甲苯磺酸盐(TMPyP)是一种水溶性高效光敏剂,为四价阳离子的卟啉类衍生物,能选择性地进入癌细胞的细胞核中,而对正常的上皮细胞几乎没有毒性作用,与核酸具有很好的亲和性,可应用于核酸检测[12]、光动力治疗(PDT)[13]、癌症诊断[14]等方面。由于其荧光特性欠佳,TMPyP本身不能用作DNA荧光探针。目前,在溶液中,基于QDs与TMPyP组装而成的纳米荧光探针已用于DNA检测[15]。在此基础上,我们合成了高量子产率的CdTe量子点,制备出水溶性CdTe-TMPyP复合物荧光探针,对HeLa癌细胞标记成像。结果表明,CdTe量子点具有较好的荧光强度和光稳定性,可用于生物细胞的标记成像,为进一步可视化靶向药物输送及光动力治疗打下基础。
1 实验部分 1.1 试剂及设备碲粉(Te,99.999%,Alfa Aesar)、巯基乙酸(TGA,优级纯,阿拉丁公司)、硼氢化钠(NaBH4,分析纯,南京化学试剂有限公司)、氯化镉(CdCl2,99.99%,Sigma-Aldrich)、TMPyP(分析纯,百灵威科技公司)、鲑鱼精DNA(Sigma-Aldrich公司)、胎牛血清(杭州四季青生物工程材料有限公司,批号121112)、RPMI-1640培养基(Invitrogen公司,批号785914)、四氮唑蓝(MTT) (FLUCA公司)、乙腈(HPLC)、四丁基六氟磷酸胺(99%,J&K公司)。
量子点的荧光和紫外吸收光谱分别在Hitachi F-7000和Hitachi U-4100光谱仪上测量;量子点形貌在JEM-2100透射电子显微镜上观察;细胞荧光成像采用激光共聚焦显微镜(Leica TCS SP8) 成像系统;CO2培养箱(上海力申公司);酶标仪(Perkin Elmer, En Vision)用于细胞毒性试验;用扫描电子显微镜(SEM)(日本日立公司S-3000N型)观察细胞形态。
1.2 CdTe量子点的合成水溶性TGA包裹的CdTe量子点参照文献[16]方法合成。将摩尔比为3:1的硼氢化钠和碲粉在冰水浴中反应制得碲氢化纳(NaHTe)溶液。1.2 mmol CdCl2和1.56 mmol TGA溶解在100 mL超纯水中作为前驱液,将pH调为11.3,通入氮气除氧30 min。在搅拌条件下,迅速加入0.6 mmol除氧的NaHTe溶液,并加热至100 ℃回流,反应1.5 h,制备CdTe量子点。
1.3 CdTe QDs-TMPyP体系制备过程及DNA检测CdTe QDs浓度按照文献[17]计算得到,将不同浓度的TMPyP溶液加入到量子点溶液中,量子点的终浓度为0.1 μmol/L,两者充分混合,检测荧光猝灭实验;在荧光恢复实验中,将不同浓度的DNA加入到CdTe QDs-TMPyP体系中,检测荧光强度变化。所有荧光测量实验均在室温条件下进行,激发波长为400 nm,光电倍增管(PMT)电压为700 V,狭缝宽度为5 nm。
1.4 CdTe QDs-TMPyP对HeLa细胞毒性实验HeLa细胞在含10%小牛血清的RPMI-1640培养液中常规培养,将HeLa细胞以每孔1×104个细胞接种于96孔板,每孔体积200 μL,培养24 h后,加入不同浓度的CdTe量子点和CdTe QDs-TMPyP进行MTT试验,培养24 h后,加入MTT,继续培养4 h,小心弃上清,加入200 μL DMSO溶解。在酶标仪上测定细胞溶液在490 nm吸光度(A),按照下列公式计算肿瘤细胞存活率:

|
取对数生长期的HeLa细胞进行分组培养,加入CdTe QDs-TMPyP为200 nmol/L,培养24 h取样,胰酶消化,经4%多聚甲醛固定1 h,滴加在硅片上,烘干,扫描电镜观察与摄片及能谱分析,加速电压为10 kV。
1.6 CdTe QDs-TMPyP的细胞成像实验将HeLa细胞培养在24孔板中,细胞浓度为1×104个/mL,分别加入200 nmol/L CdTe和CdTe QDs-TMPyP(摩尔比1:1),培养1 h以及4 h后,吸去培养液,用PBS洗去3次,固定,封片,采用共聚焦荧光显微镜成像。
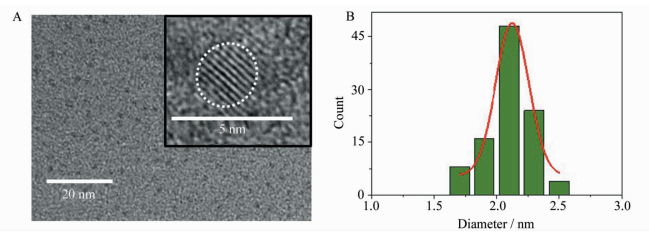
2 结果与讨论 2.1 CdTe量子点的合成当NaHTe前驱液注入Cd前驱液中,随着反应时间延长,可制备出不同尺寸TGA包覆的CdTe量子点。当反应1.5 h时,可制备出绿色CdTe量子点,透射电子显微镜(TEM)显示其具有很好的单分散性,如图 1A所示,可用于分析检测。通过对量子点的粒径分布进行统计,其粒径约为2.3 nm,如图 1B所示。
|
图 1 A. CdTe量子点TEM图,插图:HRTEM;B.量子点粒径分布图 Fig.1 A. TEM image of CdTe QDs, inset: HRTEM image; B. The particle size distribution of CdTe QDs |
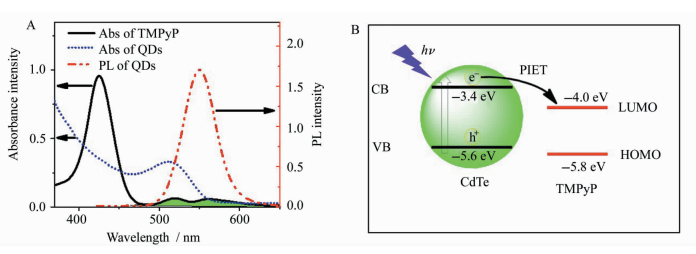
从图 2A可以看出,粒径为2.3 nm的CdTe量子点,其第一吸收峰为510 nm, 发射波长的最大发射峰为551 nm,半峰宽约为41 nm,具有较窄的半峰宽,使用罗丹明6G作为参考标准[18],量子产率为32%,具有较高的量子产率,可用于荧光可视化检测和成像。TMPyP作为卟啉家族的光敏剂之一,带有较强的正电荷,与带负电的巯基乙酸包覆的CdTe量子点静电组装,形成CdTe QDs-TMPyP复合物,当400 nm激发时,量子点荧光猝灭,由于TMPyP的吸收和量子点的发射具有较小的重叠,并且由于TMPyP的最高占据分子轨道(highest occupied molecular orbital, HOMO)和最低未占分子轨道(lowest unoccupied molecular orbital, LUMO)的能级分别为-5.8 eV和-4.0 eV,量子点的价带(valence band, VB)和导带(conduction band, CB)分别为-5.6 eV和-3.4 eV,TMPyP的HOMO和LUMO能级比CdTe QDs的VB和CB分别低0.2 eV和0.6 eV,如图 2B所示。因此可知,量子点和TMPyP之间主要产生光致电子转移[15],导致QDs/TMPyP复合物的荧光被高效猝灭。
|
图 2 A. TMPyP吸收以及量子点的吸收和发射光谱;B. CdTe QDs和TMPyP能级以及两者之间的PIET过程示意图 Fig.2 A. UV-Abs and PL spectra of TMPyP and CdTe QDs; B. PIET mechanism based on energy levels of green CdTe QDs versus TMPyP |
当在0.2 μmol/L CdTe量子点中加入等体积不同浓度的TMPyP时,带正电荷的TMPyP与带负电的CdTe量子点静电组装,形成CdTe QDs-TMPyP复合物,量子点的荧光逐渐减弱,如图 3A所示。当加入0.2 μmol/L TMPyP,即CdTe量子点/TMPyP摩尔比为1:1时,形成CdTe QDs-TMPyP复合物,量子点荧光猝灭到原来的10%,如图 3B所示,并且呈现良好的线性猝灭,R2=0.994,因此,选用CdTe QDs与TMPyP的摩尔比为1:1时组装的CdTe QDs-TMPyP纳米复合物用于DNA检测。当TMPyP浓度大于0.2 μmol/L时,猝灭量子点效率减弱。此外,CdTe QDs-TMPyP复合物在含10%小牛血清的RPMI-1640培养液中表现出良好的时间稳定性,如图 3C所示,为细胞呈现打下良好的基础。当双链DNA存在时,TMPyP与DNA结合,从量子点表面脱附,打断了CdTe QDs和TMPyP之间的PIET过程,量子点荧光恢复,如图 3D所示,在CdTe QDs-TMPyP复合物溶液中加入2.0 nmol/L DNA时,量子点恢复能到原来的90%。图 3D插图所示为在紫外灯下CdTe QDs-TMPyP复合物检测DNA的荧光变化。

|
图 3 A. CdTe量子点溶液中加入不同浓度TMPyP后的荧光光谱; B.加入不同浓度TMPyP后相对荧光强度的变化;C.在10%小牛血清的RPMI-1640培养液中CdTe QDs-TMPyP复合物时间稳定性变化;D. CdTe QDs-TMPyP复合物胞外检测DNA的荧光光谱图 插图:在紫外灯下的CdTe QDs-TMPyP复合物检测DNA荧光图片I和I0分别为量子点在TMPyP存在和不存在时的荧光强度 Fig.3 A. Evolution of PL intensity of CdTe QDs by added TMPyP; B. The relationship between the relative PL intensity (I/I0) of CdTe QDs and the TMPyP concentration; C. Stability measurement of CdTe QDs-TMPyP nano-complex with different time in 10% calf serum RPMI-1640 culture medium; D. The PL spectra of CdTe QDs-TMPyP nano-complex for DNA detection Inset: CdTe QDs-TMPyP photographs for DNA detection under UV lamp I and I0 are the PL intensity of CdTe QDs in the presence/absence of TMPyP, respectively |
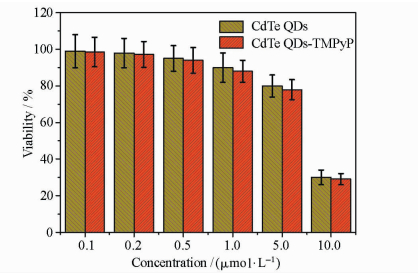
利用CdTe QDs-TMPyP复合物用于肿瘤细胞成像之前,采用MTT方法,探讨了CdTe QDs和CdTe QDs-TMPyP体系(摩尔比为1:1) 对HeLa细胞毒性研究。如图 4所示,当不同浓度的CdTe QDs和CdTe QDs-TMPyP作用于HeLa细胞24 h后,发现当CdTe QDs和CdTe QDs-TMPyP浓度低于1.0 μmol/L,细胞存活率为92%以上,表现出低的细胞毒性,而当CdTe QDs和CdTe QDs-TMPyP浓度达到10 μmol/L时,细胞存活率只有30%。当低浓度0.2 μmol/L CdTe QDs和CdTe QDs-TMPyP培养24 h后,HeLa细胞存活率在96%,这一结果与Zhou等的研究结果相似[19],可以进一步对肿瘤细胞成像。
|
图 4 不同浓度的CdTe QDs和CdTe QDs-TMPyP复合物对HeLa细胞作用的细胞毒性实验 Fig.4 Cell viability assays of the HeLa cells treated with different concentrations of CdTe QDs and CdTe QDs-TMPyP for 24 h |
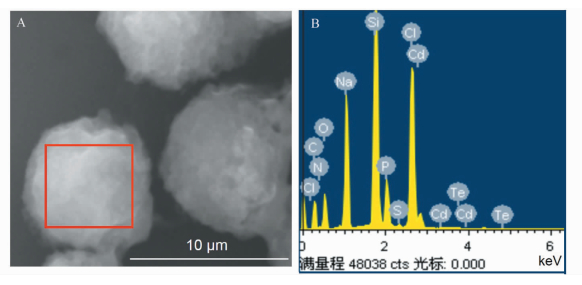
当0.2 μmol/L CdTe QDs-TMPyP作用于HeLa细胞24 h后,HeLa肿瘤细胞用扫描电镜观察细胞发现呈圆形,表面不光滑,有丰富的微绒毛及小泡状突起,如图 5A所示,说明细胞生长状态较好,进一步说明0.2 μmol/L CdTe QDs-TMPyP作用于肿瘤细胞对细胞影响较小。以图 5A红色方框为扫描范围,进行细胞内能谱分析,结果如图 5B所示,发现细胞内含有Cd和Te原子,说明CdTe QDs已经进入细胞,进一步说明可以细胞内成像。
|
图 5 CdTe QDs-TMPyP作用于HeLa细胞的SEM图(A)和细胞内能谱分析(B) Fig.5 SEM image (A) and EDS analysis (B) of HeLa cancer cells treated with CdTe QDs-TMPyP |
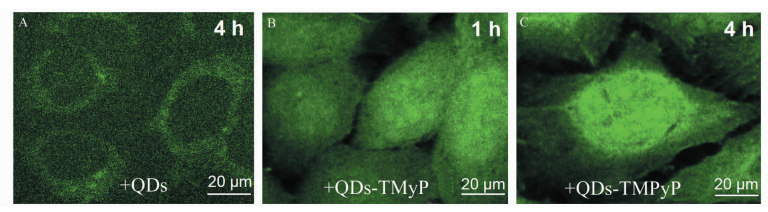
图 6为HeLa细胞对CdTe QDs和CdTe QDs-TMPyP纳米颗粒摄取情况的共聚焦成像图。0.2 μmol/L CdTe QDs培养HeLa细胞4 h后,发现绿色量子点进入细胞并主要分布在细胞质,细胞成像亮度较暗(图 6A)。当0.2 μmol/L CdTe QDs-TMPyP复合物与HeLa细胞共培养1 h后,发现量子点荧光在细胞质和细胞核分布较均匀,说明QDs-TMPyP复合物进入细胞,如图 6B所示。随着QDs-TMPyP复合物与HeLa细胞共培养时间延长至4 h时,发现细胞成像主要在细胞核,且亮度增强,说明QDs-TMPyP复合物进入细胞核,TMPyP插入到细胞核内的DNA,量子点荧光恢复。与单独的CdTe QDs培养4 h相比,细胞成像亮度明显增强,说明QDs-TMPyP复合物比单独的CdTe QDs更有利于进入细胞,更有利于QDs-TMPyP复合物的细胞药物输送和细胞成像,为可视化诊疗奠定基础。
|
图 6 CdTe QDs和CdTe QDs-TMPyP纳米颗粒对HeLa细胞共聚焦成像 A. CdTe QDs与HeLa细胞共培养4 h;B、C. CdTe QDs-TMPyP复合物物与HeLa细胞共培养1 h、4 h Fig.6 Confocal images of HeLa cancer cells after incubation with CdTe QDs for 4 h (A), with CdTe QDs-TMPyP for 1 h (B) and 4 h (C) |
本研究制备的巯基乙酸包覆的水溶性绿色CdTe量子点具有高荧光量子产率,并且单分散性好。与TMPyP组装成QDs-TMPyP复合物,通过光致电子转移机制检测DNA,发现QDs-TMPyP复合物更易被HeLa细胞摄取,利用量子点荧光,实现了在细胞核内成像,为宫颈癌细胞药物输送和细胞成像的深入研究奠定基础,为未来实现可视化光动力诊疗一体化提供了巨大的可能。
| [1] |
石星波, 温超, 符招弟, 邓放明, 郑舒, 刘秋云. 单个量子点的光学性质与应用[J]. 化学进展, 2014, 26(11): 1781–1792.
Shi X B, Wen C, Fu Z D, Deng F M, Shu Z, Liu Q Y. Photo properties and applications of single quantum dots[J]. Progress in Chemistry, 2014, 26(11): 1781–1792. |
| [2] | Biju V, Itoh T, Ishikawa M. Delivering quantum dots to cells:bioconjugated quantum dots for targeted and nonspecific extracellular and intracellular imaging[J]. Chemical Society Reviews, 2010, 39(8): 3031–3056. DOI:10.1039/b926512k |
| [3] |
李满秀, 张强, 赵三虎, 吴霞, 张蔚, 王聪聪. 基于CdTe量子点荧光猝灭-恢复方法测定依诺沙星的研究[J]. 发光学报, 2016, 37(4): 468–472.
Li M X, Zhang Q, Zhao S H, Wu X, Zhang W, Wang C C. Enoxacin detection based on CdTe quantum-dot-based OFF-ON fluorescent probe[J]. Chinese Journal of Luminescence, 2016, 37(4): 468–472. |
| [4] | Peng X G, Manna L, Yang W D, Wickham J, Scher E, Kadavanich A, Alivisatos A P. Shape control of CdSe nanocrystals[J]. Nature, 2000, 404(6773): 59–61. DOI:10.1038/35003535 |
| [5] |
郭瑜桉, 张直峰, 申晨凡, 闫桂琴. 基于CdSe/ZnS量子点构建丝裂霉素荧光检测体系的研究[J]. 影像科学与光化学, 2016, 34(4): 346–354.
Guo Y A, Zhang Z F, Shen C F, Yan G Q. A simple fluorescent method for detection of mitomycin based on CdSe/ZnS quantum dots[J]. Imaging Science and Photochemistry, 2016, 34(4): 346–354. DOI:10.7517/j.issn.1674-0475.2016.04.346 |
| [6] | Sing M N, Masilamany K, Ramaier N. A review on fluorescent inorganic nanoparticles for optical sensing applications[J]. RSC Advances, 2016, 6(26): 21624–21661. DOI:10.1039/C5RA24987B |
| [7] | Dong H F, Gao W C, Yan F, Ji H X, Ju H X. Fluorescence resonance energy transfer between quantum dots and graphene oxide for sensing biomolecules[J]. Analytical Chemistry, 2010, 82(13): 5511–5517. DOI:10.1021/ac100852z |
| [8] |
丁兆强, 权静, 聂华丽, 朱利民. L-Cys/MPA共修饰CdTe量子点:制备、表征及其在细胞标记中的应用[J]. 影像科学与光化学, 2015, 33(2): 126–135.
Ding Z Q, Quan J, Nie H L, Zhu L M. CdTe quantum dots using L-Cys/MPA as mixed-ligands:preparation, characterization and application in cell labeling[J]. Imaging Science and Photochemistry, 2015, 33(2): 126–135. DOI:10.7517/j.issn.1674-0475.2015.02.126 |
| [9] | Gao X, Cui Y, Levenson R, Chung L, Nie S. In vivo cancer targeting and imaging with semiconductor quantum dots[J]. Nature Biotechnology, 2004, 22(8): 969–976. DOI:10.1038/nbt994 |
| [10] | Sun Q J, Guru S, Dai L M, Michael C, Angela C, Rajesh N, James G, Wang Y Q. Highly efficient quantum-dot light-emitting diodes with DNA-CTMA as a combined hole-transporting and electron-blocking layer[J]. ACS Nano, 2009, 3(3): 737–743. DOI:10.1021/nn8009079 |
| [11] | Carey G H, Abdelhady A L, Ning Z, Thon S M, Bakr O M, Sargent E H. Colloidal quantum dot solar cells[J]. Chemical Reviews, 2015, 115(23): 12732–12763. DOI:10.1021/acs.chemrev.5b00063 |
| [12] | Fiel R J. Porphyrin-nucleic acid interactions:a review[J]. Journal of Biomolecular Structure and Dynamics, 1989, 6(6): 1259–1274. DOI:10.1080/07391102.1989.10506549 |
| [13] | Bristow C A, Hudson R, Paget T A, Boyle R W. Potential of cationic porphyrins for photodynamic treatment of cutaneous Leishmaniasis[J]. Photodiagnosis and Photodyna-mic Therapy, 2006, 3(3): 162–167. DOI:10.1016/j.pdpdt.2006.04.004 |
| [14] | Han F X, Wheelhouse R T, Hurley L H. Interactions of TMPyP4 and TMPyP2 with quadruplex DNA. Structural basis for the differential effects on telomerase inhibition[J]. Journal of the American Chemical Society, 1999, 121(15): 3561–3570. DOI:10.1021/ja984153m |
| [15] | Zhu K, Hu X Y, Ge Q, Sun Q J. Fluorescent recognition of deoxyribonucleic acids by a quantum dotimeso-tetrakis(N-methylpyridinium-4-yl)porphyrin complex based on a photo induced electron-transfer mechanism[J]. Analytica Chimica Acta, 2014, 812(812): 199–205. |
| [16] |
梁佳然, 钟文英, 于俊生. 高质量CdTe量子点的水相快速合成[J]. 高等学校化学学报, 2009, 30(1): 14–18.
Liang J R, Zhong W Y, Yu J S. Rapid aqueous synthesis of high-quality CdTe colloidal quantum dots[J]. Chemical Journal of Chinese Universities, 2009, 30(1): 14–18. |
| [17] | Yu W W, Qu L, Guo W, Peng X G. Experimental determination of the extinction coefficient of CdTe, CdSe, and CdS nanocrystals[J]. Chemistry of Materials, 2003, 15(14): 2854–2860. DOI:10.1021/cm034081k |
| [18] |
王益林, 黄武, 王荣芳, 周立亚. 颜色可调的高荧光CdTe量子点的水相合成[J]. 高等学校化学学报, 2011, 32(12): 2727–2732.
Sun Y L, Huang W, Wang S F, Zhou L Y. Synthesis of highly emissive, color-tunable CdTe quantum dots in aqueous solution[J]. Chemical Journal of Chinese Universities, 2011, 32(12): 2727–2732. |
| [19] | Zhou Y, Shi L, Li Q, Jiang H, Lv G, Zhao J, Wu C, Selke M, Wang X. Imaging and inhibition of multi-drug resistance in cancer cells via specific association with negatively charged CdTe quantum dots[J]. Biomaterials, 2010, 31(18): 4958–4963. DOI:10.1016/j.biomaterials.2010.02.053 |




