2. 徐州医科大学 新药研究与临床药学重点实验室, 江苏 徐州 221004
2. Jiangsu Key Laboratory of New Drug Research and Clinical Pharmacy, Xuzhou Medical University, Xuzhou 221004, Jiangsu, P. R. China
仿生合成是模仿或利用生物体内的反应和天然物结构进行合成的过程[1]。仿生合成条件温和、绿色无污染、环境友好,因此在纳米材料的制备领域引起众多研究者的关注[2-5]。仿生合成最初采用细菌或真菌为模板,在进行复杂的生物技术改造过程后完成纳米材料的合成[6-8]。2013年,首次出现利用蚯蚓活体进行CdTe量子点(quantum dots, QDs)合成的报道[9],利用仿生化方法进行纳米量子点的研究尚处于起步阶段[10, 11]。
细胞是生物体的基本结构和功能单位,生物体内的各种代谢活动之所以有条不紊地进行都依赖于细胞内部严密而精细的调控。文献报道,细胞内部的动态生命过程对于纳米粒子的合成[12]、细胞自身解毒以及细胞内金属离子还原[13, 14]都具有重要意义。几乎所有细胞中均含有谷胱甘肽,且肿瘤细胞中的谷胱甘肽含量(2~8 mmol/L)远高于正常细胞[15-17]。在量子点的生成过程中,谷胱甘肽是一种优良的稳定剂和保护剂,可以促进量子点的合成,因此,利用肿瘤细胞的内源性物质谷胱甘肽的作用可以完成量子点的合成[18-20]。
本工作利用宫颈癌上皮细胞HeLa细胞为载体,镉离子通过细胞膜进入细胞,与细胞内源性谷胱甘肽键合,形成稳定的镉-谷胱甘肽复合物,在细胞内部代谢活动的驱动力下,硫离子与镉-谷胱甘肽复合物反应生成量子点。肿瘤细胞易于培养,且可以持续大量分裂繁殖。利用肿瘤细胞进行CdS QDs的合成,具有方法简单、环境友好的特点,本工作的开展将为纳米量子点的合成提供新方法和新思路。
1 实验部分 1.1 仪器与试剂FD-1C-50真空冷冻干燥机,北京博艺康实验仪器有限公司;超声波细胞破碎仪(JY92-IIDN),宁波新芝生物科技股份有限公司;FL4600型荧光分光光度计,日本岛津制作所;MIKR0200R高速冷冻离心机,德国Hetlich科学仪器公司;G2 T12透射电镜(TEM),美国FEI有限责任公司;D8 ADVANCE X-射线衍射仪(XRD),德国布鲁克BRUKE公司。
人宫颈癌细胞(HeLa细胞),徐州医科大学附属医院惠赠;CCK-8试剂盒,日本同仁化学研究所;氯化镉(分析纯),上海展云化工有限公司;硫化钠,上海阿拉丁生化科技股份有限公司;罗丹明6G,上海精科化学科技有限公司;RIPA细胞裂解液,徐州博立达生物科技有限公司;其他化学试剂均为分析纯,购自国药集团化学试剂有限公司;实验用水为双蒸水。
1.2 实验方法 1.2.1 细胞培养HeLa细胞采用常规37 ℃和5%CO2恒温培养箱培养,使用DMEM高糖完全培养液(含10%胎牛血清、100 U/mL青霉素、100 μg/mL链霉素),取生长状态良好的对数生长期细胞进行CdS QDs的合成。
1.2.2 HeLa细胞中CdS QDs的合成镉源及硫源的配制:用细胞完全培养基配制浓度均为1 mmol/L的氯化镉及硫化钠溶液,溶液先后经0.45 μm、0.22 μm滤膜过滤,4 ℃保存备用。
取生长状态良好,培养密度为80%~85%的HeLa细胞进行量子点的合成,具体方法如下:HeLa细胞经PBS清洗2次,加入适量培养基配制的氯化镉溶液,置培养箱内孵育6 h。弃去培养基,更换为培养基配制的硫化钠溶液适量,置培养箱内继续孵育16 h。用细胞刮板收集细胞,经PBS洗涤2次后,在细胞中加入200 μL RIPA细胞裂解液,使用细胞破碎机超声破碎,14000 rpm离心5 min,上清液即为CdS QDs溶液。将CdS QDs用双蒸水稀释,加入2倍体积的异丙醇,暗处静置约12 h即出现CdS QDs黄色沉淀,14000 rpm离心5 min,重复离心-洗涤3次,经冷冻干燥后,得到纯化后的CdS QDs。
1.2.3 CdS QDs的光学及结构性能表征利用荧光光谱仪对制得的CdS QDs的光学性能进行表征。利用TEM、XRD对其结构、粒径、单分散性及均匀度等进行表征。
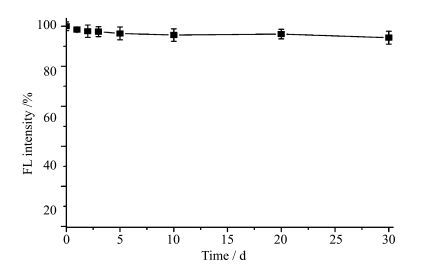
按照文献方法测定CdS QDs的荧光产率φx[21]。该方法是采用待测样品与标准样品吸光度和量子产率相比较的方法获得。本实验选用的标准样品为罗丹明6G,激发波长为350 nm。计算公式如下:
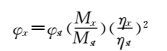
|
式中,罗丹明6G的量子产率φst=95%,ηx、ηst分别为被测样品和罗丹明6G所用溶剂的折光率(水的折光率=1.0,乙醇的折光率=1.359),Mx和Mst分别为被测样品和罗丹明6G的5种浓度所测得的荧光强度的积分面积对吸光度作图所得直线的斜率。
1.2.4 CdS QDs荧光稳定性实验研究称取1 mg量子点粉末,加水制成3 mL溶液,分别于第1、2、3、5、10、20、30天进行荧光光谱的测定,用以研究本方法制备CdS量子点荧光性质的稳定性。
2 结果与讨论当镉离子与细胞孵育后,细胞内源性的谷胱甘肽在细胞内部生命代谢活动的驱动下与镉离子发生键合作用,从而保证在与硫离子发生反应时,生成分散均匀的纳米颗粒。本实验研究了镉离子浓度、镉离子和硫离子分别与细胞共孵育的时间,对量子点荧光性质的影响。
2.1 镉离子浓度对CdS QDs荧光性质的影响固定硫离子浓度为1 mmol/L,考察不同镉离子浓度对CdS QDs荧光性质的影响(Ex=370 nm), 如图 1所示。结果显示,未加入镉离子或硫离子时,细胞破碎提取量子点后,溶液未表现出荧光发射峰,而加入镉离子和硫离子的细胞在波长450 nm处有明显的荧光发射峰。当镉离子的浓度为0.5 mmol/L时,CdS QDs的荧光强度较弱。随着镉离子浓度的升高,合成的量子点的荧光也增强;镉离子浓度为1 mmol/L时,提取的CdS QDs荧光强度最强;但当镉离子的浓度增加至1.3 mmol/L时荧光强度反而下降,这种现象的出现可能是镉为重金属元素,较高浓度的镉离子对细胞损害较大,相关研究表明其对细胞有显著的毒性作用[22],因而细胞活力变弱。因此,本实验最终选择的氯化镉溶液的浓度为1 mmol/L。

|
图 1 镉离子浓度对HeLa细胞(a. 0 mmol/L;b. 0.5 mmol/L;c. 1 mmol/L;d. 2 mmol/L)及CdS QDs荧光光谱性能(e)的影响 Fig.1 Effect of cadmium concentration on HeLa cells (a. 0 mmol/L; b. 0.5 mmol/L; c. 1 mmol/L; d. 2 mmol/L) and the fluorescence spectra of CdS QDs (e) |
量子点的荧光性质与细胞形态密切相关。除镉离子浓度外,镉离子与细胞共孵育的时间对HeLa细胞的形态也有明显影响,如图 2所示。在0~24 h范围内,对孵育0、3、6、10、24 h后HeLa细胞的形态进行考察,结果显示,随孵育时间延长,细胞形态逐渐发生变化,当孵育时间增加至10 h时,细胞形态变圆,间隙变大,继续增加至24 h,细胞已出现破碎现象。因此,选择合适的孵育时间对实验结果影响较大。最终本实验选择的最佳孵育时间为6 h。

|
图 2 镉源与细胞孵育时间对HeLa细胞形态的影响 (a-e: 0,3,6,10,24 h) Fig.2 Effect of incubation time of cadmium with cells on the morphology of HeLa cells |
本实验在4~32 h范围内,在镉离子浓度为1 mmol/L,与细胞孵育时间为6 h,硫离子浓度为1 mmol/L条件下,考察了硫离子与细胞孵育时间分别为4、8、12、16、20、24、28和32 h对CdS量子点荧光性质的影响。其荧光光谱见图 3a,荧光强度见图 3b。在4~16 h范围内随着硫离子与细胞共孵育时间的延长,量子点荧光强度也随之增强,16 h时荧光强度达到最大值,而当孵育时间继续延长,量子点荧光强度逐渐下降。
|
图 3 硫化钠与细胞共孵育时间对CdS QDs的荧光光谱(a)及荧光强度(b)的影响 Fig.3 Effect of incubation time on the fluorescence spectra (a) and intensity (b) of CdS QDs |
观察细胞状态可以得出相同结论,导致这一结果的原因可能是,镉离子进入到细胞后,游离的重金属镉离子对细胞可能产生损害,而加入硫源后,随着孵育时间的不断延长,16 h后细胞生命代谢活动已逐渐减弱,因此继续增加孵育时间,荧光强度并未显著增长。
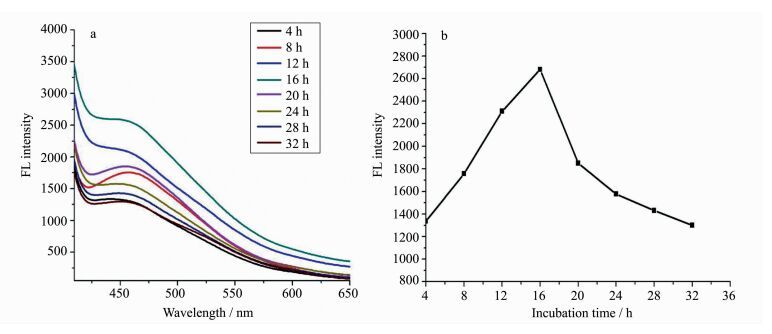
2.4 宫颈癌HeLa细胞中合成CdS QDs的结构性质在镉离子浓度为1 mmol/L,与细胞孵育时间6 h,硫离子浓度为1 mmol/L,与细胞孵育时间16 h条件下,CdS QDs合成后细胞的TEM图像如图 4a所示。从图中可以看出量子点出现在细胞中,说明本实验通过细胞本身的正常代谢活动完成了CdS QDs的制备。实验通过延长裂解时间使量子点完全从细胞器中释放出来,制得CdS QDs。图 4b的TEM图像显示,该方法合成的CdS QDs粒径约为3.0 nm,且在水溶液中分散性良好,粒径均一。
|
图 4 CdS QDs在细胞内(a)的合成及其TEM图(b) Fig.4 Location of the prepared CdS QDs in cancer cells(a) and its TEM image (b) |
图 5为本工作制备的CdS QDs的XRD图谱,可以看出,在25.36°、43.71°、51.91°有3个明显的衍射峰,分别与标准卡片中的(111)、(220)、(311)对应,证明所合成的CdS QDs为立方晶型结构。

|
图 5 CdS QDs的XRD图 Fig.5 The XRD spectrum of the prepared CdS QDs |
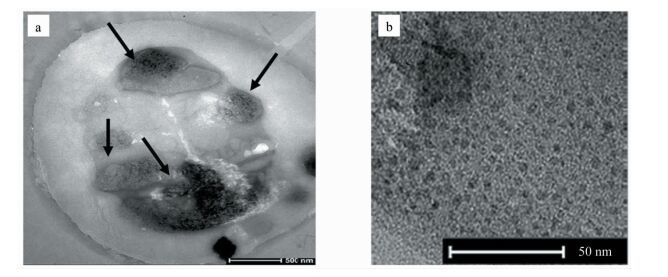
经细胞裂解提取CdS QDs并经水复溶后,置于室温暗处保存不同时间,通过监测其荧光性质考察其稳定性。如图 6所示,将CdS QDs溶液暗处放置时间一个月后,荧光强度基本保持不变,为原荧光效率的94.3%,说明所合成的CdS QDs具有良好的荧光稳定性,可以满足后期应用需要。
|
图 6 CdS QDs荧光稳定性 Fig.6 The fluorescence stability of the prepared CdS QDs |
本工作建立了肿瘤细胞内制备性能优良的量子点的方法。利用肿瘤细胞中谷胱甘肽作为稳定剂和保护剂,以细胞自身代谢活动为驱动力制备水溶性CdS QDs,实验最佳优化条件为镉源浓度为1 mmol/L,与细胞孵育时间为6 h,硫源浓度为1 mmol/L,与细胞孵育时间为16 h。该方法操作简单,实验条件温和,且制备的CdS量子点光学性质优良,水溶液中分散均匀,可以满足后期生物领域的进一步应用。本工作的开展将量子点的合成从化学方法拓宽至仿生方法,为纳米材料的制备提供了新思路。
| [1] | Nam K T, Kim D W, Yoo P J, Chiang C Y, Meethong N, Hammond P T, Chiang Y M, Belcher A M. Virus-enabled synthesis and assembly of nanowires for lithium ion battery electrodes[J]. Science, 2006, 312(5775): 885–888. DOI:10.1126/science.1122716 |
| [2] | Sweeney RY, Mao C, Gao X, Burt J L, Belcher A M, Georgiou G, Iverson B L. Bacterial biosynthesis of cadmium sulfide nanocrystals[J]. Chemistry & Biology, 2004, 11(11): 1553–1559. |
| [3] | Williams P, Keshavarz-Moore E, Dunnill P. Efficient production of microbially synthesized cadmium sulfide quantum semiconductor crystallites[J]. Enzyme And Microbial Technology, 1996, 19(3): 208–213. DOI:10.1016/0141-0229(95)00233-2 |
| [4] | Tan L, Wan A, Li H. Synthesis of near-infrared quantum dots in cultured cancer cells[J]. ACS Applied Materials & Interfaces, 2014, 6(1): 18–23. |
| [5] | Anshup A, Venkataraman J S, Subramaniam C, Kumar R R, Priya S, Kumar T R, Omkumar R V, John A, Pradeep T. Growth of gold nanoparticles in human cells[J]. Langmuir, 2005, 21(25): 11562–11567. DOI:10.1021/la0519249 |
| [6] | Li Y, Cui R, Zhang P, Chen B B, Tian Z Q, Li L, Hu B, Pang D W, Xie Z X. Mechanism-oriented controllability of intracellular quantum dots formation:the role of glutathione metabolic pathway[J]. ACS Nano, 2013, 7(3): 2240–2248. DOI:10.1021/nn305346a |
| [7] | Perez-Donoso J M, Monras J P, Bravo D, Aguirre A, Quest A F, Osorio-Román I O, Aroca R F, Chasteen T G, Vásquez C C. Biomimetic, mild chemical synthesis of CdTe-GSH quantum dots with improved biocompatibility[J]. Plos One, 2012, 7(1): e30741. DOI:10.1371/journal.pone.0030741 |
| [8] | Monras J P, Diaz V, Bravo D, Montes R A, Chasteen T G, Osorio-Román I O, Vásquez C C, Pérez-Donoso J M. Enhanced glutathione content allows the in vivo synthesis of fluorescent CdTe nanoparticles by escherichia coli[J]. Plos One, 2012, 7(11): e48657. DOI:10.1371/journal.pone.0048657 |
| [9] | Sturzenbaum S R, Hockner M, Pannerselvam A, Levitt J, Bouillard J S, Taniguchi S, Dailey L A, Ahmad Khanbeigi R, Rosca E V, Thanou M, Suhling K, Zayats A V, Green M. Biosynthesis of luminescent quantum dots in an earthworm[J]. Nature Nanotechnology, 2013, 8(1): 57–60. DOI:10.1038/nnano.2012.232 |
| [10] | Qian J, Cao Y, Chen Z, Liu C, Lu X. Biomimetic synthesis of cerium oxide nanosquares on RGO and their enhanced photocatalytic activities[J]. Dalton Transactions, 2017, 46(2): 547–553. DOI:10.1039/C6DT03375J |
| [11] | He X, Ma N. Biomimetic synthesis of fluorogenic quantum dots for ultrasensitive label-free detection of protease activities[J]. Small, 2013, 9(15): 2527–2531. DOI:10.1002/smll.v9.15 |
| [12] | Stroh M, Zimmer J P, Dudad G, Levchenko T S, Cohen K S, Brown E B, Scadden D T, Torchilin V P, Bawendi M G, Fukumura D, Jain R K. Quantum dots spectrally distinguish multiple species within the tumor milieu in vivo[J]. Nature Medicine, 2005, 11(6): 678–682. DOI:10.1038/nm1247 |
| [13] | Murray C B, Norris D J, Bawendi M G. Synthesis and characterization of nearly monodisperse CdE (E=sulfur, selenium, tellurium) semiconductor nanocrystallites[J]. Journal of the American Chemical Society, 1993, 115(19): 8706–8715. DOI:10.1021/ja00072a025 |
| [14] | Peng Z A, Peng X G. Formation of high-quality CdTe, CdSe, and CdS nanocrystals using CdO as precursor[J]. Journal of the American Chemical Society, 2001, 123(1): 183–184. DOI:10.1021/ja003633m |
| [15] | Xianyu Y, Xie Y, Wang N, Wang Z, Jiang X. A dispersion-dominated chromogenic strategy for colorimetric sensing of glutathione at the nanomolar level using gold nanoparticles[J]. Small, 2015, 11(41): 5510–5514. DOI:10.1002/smll.v11.41 |
| [16] | Gu oY, Wang H, Sun Y S, Qu B. A disulfide bound-molecular beacon as a fluorescent probe for the detection of reduced glutathione and its application in cells[J]. Chemical Communications, 2012, 48: 3221–3223. DOI:10.1039/c2cc17552e |
| [17] | Liu Z, Zhou X, Miao Y, Hu Y, Kwon N, Wu X, Yoon J. A reversible fluorescent probe for real-time quantitative monitoring of cellular glutathione[J]. Angewandte Chemie-International Edition, 2017. DOI:10.1002/anie.201702114 |
| [18] | DeGroot M W, Taylor N J, Corrigan J F. Molecular nanocluster analogues of CdSe/ZnSe and CdTe/ZnTe core/shellnanoparticles[J]. Journal of Materials Chemistry, 2004, 14: 654–660. DOI:10.1039/b312297b |
| [19] | Liu F C, Cheng T L, Shen C C, Tseng W L, Chiang M Y. Synthesis of cysteine-capped ZnxCd1-xSe alloyed quantum dots emitting in the blue-green spectral range[J]. Langmuir, 2008, 24(5): 2162–2167. DOI:10.1021/la702972d |
| [20] | Deng Z T, Lie F L, Shen S Y, Ghosh I, Mansuripur M, Muscat A J. Water-based route to ligand-selective synthesis of ZnSe and Cd-doped ZnSe quantum dots with tunable ultraviolet A to blue photoluminescence[J]. Langmuir, 2009, 25(1): 434–442. DOI:10.1021/la802294e |
| [21] | Demas J N, Crosby G A. The measurement of photoluminescence quantum yields[J]. Journal of Physical Chemistry, 1971, 75(8): 991–1024. DOI:10.1021/j100678a001 |
| [22] | Rosenthal S J. Bar-coding biomolecules with fluorescent nanocrystals[J]. Nature Biotechnology, 2001, 19(7): 621–622. DOI:10.1038/90213 |




