2. 中国科学院大学, 北京 100049;
3. 北京大学 药学院, 北京 100191
2. University of Chinese Academy of Sciences, Beijing 100049, P. R. China;
3. School of Pharmaceutical Sciences, Peking University, Beijing 100191, P. R. China
随着纳米技术的兴起,纳米金刚石(nanodiamonds,NDs)以其具备稳定的物理、化学性质、良好的生物兼容性、易于修饰的表面性能和较高的商业普及度等独特优势[1-3],在生物医学领域备受瞩目[4-8]。其中值得关注的一个方向是基于NDs的稳定荧光信号,可将其作为荧光标记物或生物探针而广泛应用于生物成像[9, 10], 如Weng等[11]通过将转铁蛋白修饰到纳米金刚石上,利用NDs的荧光信号作为标记,实现了对癌细胞表面转铁蛋白受体与转铁蛋白间识别过程的观察。虽然关于NDs荧光探针的研究众多[12-16],而且荧光成像技术已相对成熟,但是这种方法依然存在一些缺陷,比如样品的染色固定较复杂、生物体系存在自发荧光及背景干扰,这些问题影响了纳米金刚石荧光探针的应用[17]。为了避免上述因素对荧光成像的困扰,基于生物体自发信号的拉曼扫描技术开始被关注,并且由于具备非侵入性和无损伤性,拉曼成像在医学和生物领域的应用潜力被不断开发。由于纳米金刚石具备自发且稳定的拉曼信号,NDs拉曼探针体系的构建及应用也开始被讨论和研究[18]。纳米金刚石的拉曼光谱在1332 cm-1处有一清晰而锐利的特征峰,这一特征峰来源于碳结构中的sp3声子振动[19],而且该信号不会被生物体的自发拉曼信号干扰,这为纳米金刚石拉曼探针在生物成像领域的应用提供了极大的便利[20]。
通常情况下,纳米金刚石作为标记物和探针时,其表面需要功能化并修饰特定的生物分子,以实现对这些分子与生命体中一些结构的相互作用过程的研究。这些生物分子可以通过物理吸附[21-24]、共价或非共价键合[25-27]以及静电吸附的方式负载到纳米金刚石表面。这些功能化或被修饰后的纳米金刚石拉曼探针一般是在细胞体系内实现对生命活动的观察[17, 20, 28-30],如Cheng等[29]以负载了生长素的NDs为拉曼生物探针,成功观察到A549细胞表面的生长素受体及其与生长素之间的相互作用。但将纳米金刚石拉曼生物探针应用于微生物体内的研究较少,而微生物的许多生命活动也需要进一步研究与阐明,尤其是在备受关注的抗菌领域。
众所周知,由于抗生素的滥用,细菌耐药性已愈演愈烈。全球科学家们正在通过各种研究尝试力图解决这一全世界共同面对的公共卫生问题。目前大家在极力寻找和研发新型抗菌物质,以取代原有的抗生素。在这些新型抗菌物质中,溶菌酶和抗菌肽是具有显著抗菌效果的非抗生素类天然抗菌物质[31-33],但是由于发展时间较短,目前对这些新型抗菌物质的研究普遍停留在新品种研发及其抗菌效果的定性分析上,对其抗菌机理的研究较薄弱,观察分析还不够深入。而借助拉曼成像技术的纳米金刚石生物探针,能实现对细菌生命活动的可视化观察,恰好能满足上述的研究需求,这为新型抗菌物质的抗菌机理分析提供了重要支持。
本工作介绍一种纳米金刚石生物探针,用于观察细菌体系内的生命活动。其中,非抗生素类抗菌肽——死亡素被成功修饰在100 nm的纳米金刚石上,构建了纳米金刚石拉曼生物探针。基于纳米金刚石的特征拉曼信号(1332 cm-1),本文借助拉曼成像技术可视化了纳米金刚石-死亡素的复合物与枯草芽孢杆菌间的相互作用,并结合扫描电子显微镜分析了死亡素的抗菌过程。这些实验结果将对非抗生素类抗菌物质的研究及整个抗菌领域有一定的借鉴意义。
1 实验部分 1.1 纳米金刚石的表面均一化100nm左右的纳米金刚石粉末(NDs)购于广州克斯曼有限公司(中国),由高温高压法合成制得。为了清除材料表面的化学基团及制备需要的官能团,纳米金刚石粉末通过强酸氧化以实现表面羧基化和均一化。羧基化过程按照之前文献报道的经典方法[34, 35],流程如下:用浓硫酸和浓硝酸(体积比3:1)的混合液,在70 ℃下对纳米金刚石粉末处理24 h,然后用0.1 mol/L的NaOH溶液在70 ℃下中和反应1 h,再用HCl溶液处理过量的NaOH溶液至中性,之后经过多次离心清洗,最终在空气中干燥,获得均一的羧基化后纳米金刚石。
1.2 死亡素在纳米金刚石表面的吸附实验中使用的抗菌肽死亡素(thanatin),购于上海强耀生物科技有限公司(中国)。首先,将10 mg/mL的纳米金刚石分散液与500 μmol/L死亡素溶液等体积混合,在37 ℃下振荡反应1 h,之后经过多次离心清洗,以除去未吸附在NDs上的死亡素,得到纳米金刚石-死亡素复合物的分散液。然后将沉淀分散在磷酸缓冲液中,得到浓度为1~5 mg/mL的纳米金刚石-死亡素复合物的分散液。利用紫外-可见分光光度计(Cary 5000,Varian,美国),通过测试反应前死亡素溶液和混合后上清液在280 nm处的紫外吸收差异,确定了纳米金刚石-死亡素(NDs-thanatin)复合物中死亡素的量。此外,用红外测试(Excalibur 3100, Varian,美国)验证和分析了纳米金刚石对死亡素的成功吸附,而复合物的粒径分布及表面电位通过动态光散射仪(Malvern Instruments,英国)测试得到。
1.3 纳米金刚石-死亡素复合物对枯草芽孢杆菌的抗菌效果枯草芽孢杆菌(Bacillus subtilis)购自中国科学院微生物所,在Luria-Bertani(LB)液体培养基中,37 ℃下培养24 h。然后将菌体多次离心清洗,重新分散在PBS中。为了测试纳米金刚石-死亡素复合物对枯草芽孢杆菌的抗菌效果,实验中采用菌落计数法的方式进行研究和评价。首先,将枯草芽孢杆菌菌液与上述纳米金刚石-死亡素分散液(1 mg/mL)等体积混合,在25 ℃下静置2 h。之后,将反应后样品在超净台内稀释103倍,然后取100 μL加入LB固体培养皿中,在37 ℃恒温箱内培养48 h后,取出计算培养皿内菌落数。同时,实验中也测试和评价了对照组(菌液中加入等体积PBS)、NDs组(菌液中加入等体积NDs的PBS分散液,浓度为1 mg/mL)和死亡素组(菌液中加入等体积的死亡素溶液,浓度为50~80 μmol/L,与纳米金刚石-死亡素复合物中死亡素含量一致)的抗菌效果。每个样品进行3次重复实验。
1.4 扫描电子显微镜下对NDs-thanatin与枯草芽孢杆菌间相互作用过程的观察将枯草芽孢杆菌菌液分别与NDs分散液(5 mg/mL)、NDs-thanatin复合物分散液(5 mg/mL)和thanatin溶液(400 μmol·L-1)等体积混合,振荡反应30~500 s,将反应后的溶液离心清洗3次,获得沉淀。为了观察枯草芽孢杆菌的状态,需要对菌体进行固定:先分别将上述沉淀用质量分数为2%的戊二醛处理过夜,然后用20%、40%、60%、80%和100%的乙醇溶液梯度脱水,得到最终菌体样品,滴涂在硅片上干燥,用扫描电子显微镜(SEM, S-4800, Hitachi,日本)进行观察。
1.5 共聚焦拉曼显微镜下对NDs-thanatin与枯草芽孢杆菌间相互作用过程的观察将枯草芽孢杆菌菌液分别与NDs分散液(5 mg/mL)、NDs-thanatin复合物分散液(5 mg/mL)和thanatin溶液(400 μmol/L)等体积混合,振荡反应30~500 s后离心清洗3次,然后滴涂在硅片上,迅速干燥。将样品直接进行拉曼扫描,拉曼成像通过双通道共聚焦拉曼显微镜(Raman-11,Nanophoton,Osaka,日本)实现,观察时采用60X/1.2的水镜(UPLSAPO 60XW, Olympus),激发波长为532 nm,激光功率为0.7 mW/μm2,扫描方式为线扫描,获得一张拉曼图像需要5~8 min,光谱分辨率为3 cm-1,空间分辨率为423.5 nm(平面像素大小)。每个实验重复3次,每次选取5~8个细菌进行成像分析。
1.6 NDs-thanatin与枯草芽孢杆菌间相互作用过程中细菌表面电位变化的表征为了进一步分析NDs-thanatin与枯草芽孢杆菌间的相互作用,研究死亡素对枯草芽孢杆菌的杀灭过程,实验中将枯草芽孢杆菌菌液分别与NDs分散液(5 mg/mL)、NDs-thanatin复合物分散液(5 mg/mL)和thanatin溶液(400 μmol/L)等体积混合,分别振荡反应30~500 s,采用动态光散射仪(Malvern Instruments,英国)对枯草芽孢杆菌的表面电位进行表征。每个样品进行3次重复实验。
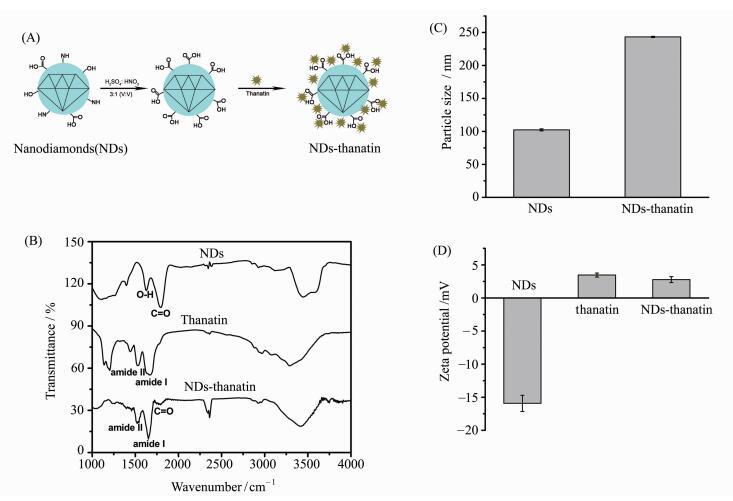
2 结果与讨论 2.1 纳米金刚石拉曼生物探针的制备和表征如图 1A所示,为了获得纳米金刚石拉曼生物探针,对直接购买获得的100 nm的纳米金刚石进行羧基化,以除去其表面的多种杂乱基团,得到表面均一的NDs,并将非抗生素类多肽死亡素负载在NDs表面。为了验证死亡素在NDs上的成功吸附,采用红外(图 1B)、粒径分布(图 1C)和电位测试(图 1D)进行对比分析。图 1B中分别给出纳米金刚石(NDs)、死亡素(thanatin)和纳米金刚石-死亡素复合物(NDs-thanatin)的红外光谱,相比于单独NDs以及thanatin,NDs-thanatin的光谱中出现了来自于thanatin多肽中的两个酰胺峰(amide Ⅰ和amide Ⅱ),以及保留的NDs位于2300 cm-1的吸收峰,由此可以证明死亡素已经成功负载到纳米金刚石上。图 1C中粒径分析表明,NDs-thanatin的平均尺寸为268 nm左右,明显大于NDs的100 nm。而图 1D中表面电位分析表明,NDs-thanatin的表面电位为2.8 mV左右,而NDs表面电位为-15.6 mV左右,出现了表面电位的显著改变。上述NDs-thanatin复合物红外光谱的变化,以及增大的粒径和表面电位的由负到正,验证了死亡素在纳米金刚石上的成功负载。此外,如图 2所示,利用紫外-可见分光光度计测试,确定了纳米金刚石-死亡素复合物中死亡素的量,通过计算得到,浓度为1 mg/mL的NDs-thanatin复合物分散液中thanatin含量为50~80 μmol/L。
|
图 1 纳米金刚石-死亡素复合物的制备和表征 Fig.1 Preparation and characterizations of NDs-thanatin compound |

|
图 2 样品制备前后溶液的紫外-可见光谱图 (A)与NDs反应前的死亡素溶液;(B)反应后上清液 Fig.2 UV-Vis spectra of samples (A) thanatin solution before interaction with NDs, (B) after interaction with NDs |
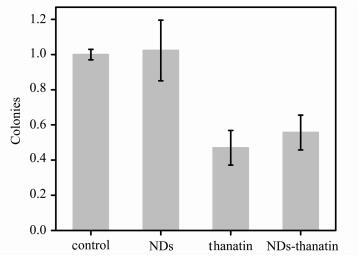
NDs拉曼生物探针的成功构建,不仅需要对其制备过程进行评价,更需要检测其抗菌效果,以确保其在细菌体系应用的可行性,即将thanatin负载到NDs上,其本身的抗菌活性也不应被改变。为了对比吸附在纳米金刚石上的死亡素与溶液中同浓度死亡素的抗菌活性差异,本文采用菌落计数法的方式进行分析,操作流程参见实验部分。图 3给出了NDs、thanatin和NDs-thanatin复合物对枯草芽孢杆菌的抗菌效果。首先,单纯的NDs并不会对枯草芽孢杆菌活性产生影响,这表明NDs本身作为拉曼探针有良好的生物兼容性。其次,图 3显示thanatin和NDs-thanatin复合物都有很强的抗菌活性,对枯草芽孢杆菌的杀灭效果分别为52.8%±9.8%和44.3%±9.9%,两者的差异不大。因此可以得出结论,将死亡素负载在纳米金刚石上,不会影响死亡素本身的抗菌性能,这为纳米金刚石拉曼探针在抗菌领域的应用提供了基础。
|
图 3 对NDs、thanatin和NDs-thanatin复合物的抗菌效果评价 Fig.3 Antibacterial activity evaluation of NDs, thanatin and NDs-thanatin |
为了观察NDs-thanatin与枯草芽孢杆菌间的相互作用,进而实现以纳米金刚石为探针分析死亡素的抗菌过程,我们首先采用常规扫描电子显微镜进行观察(图 4)。
|
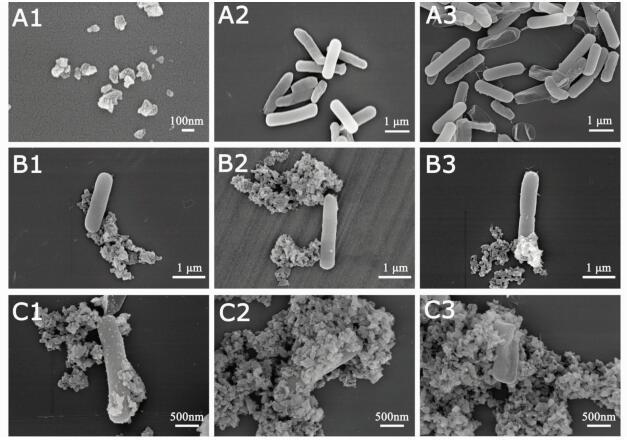
图 4 NDs-thanatin与枯草芽孢杆菌间相互作用过程的SEM图像 第一行中,A1为100nm的NDs,A2为PBS处理3 min枯草芽孢杆菌,A3为thanatin处理3 min的枯草芽孢杆菌。第二行中枯草芽孢杆菌分别由NDs处理(B1)1 min,(B2)3 min和(B3)5 min。第三行中枯草芽孢杆菌分别由NDs-thanatin处理(C1)1 min,(C2)3 min和(C3)5 min Fig.4 SEM images of the interaction between NDs-thanatin and Bacillus subtilis In the first row, A1 is 100 nm NDs, A2 is Bacillus subtilis treated with PBS for 3 min, and A3 is Bacillus subtilis treated with thanatin for 3 min. In the second row, Bacillus subtilis was treated with NDs (B1) for 1 min, (B2) for 3 min and (B3) for 5 min, respectively. In the third row, Bacillus subtilis was treated with NDs-thanatin (C1) for 1 min, (C2) for 3 min and (C3) for 5 min, respectively |
A1图为100 nm的纳米金刚石;A2图为PBS处理3 min的枯草芽孢杆菌菌体,作为对照组;A3图为thanatin处理3 min后的枯草芽孢杆菌,部分菌体开始出现坍塌死亡的现象,从图中可以看到与正常菌体有显著差异,死亡菌体呈现“魅影”形态(ghost morphology),这种状况下死亡的枯草芽孢杆菌内部像是被掏空,细胞质流出,整个细菌看起来像由细胞壁构成的空腔,形貌出现巨大改变[36]。
B1图为单纯纳米金刚石处理1 min的枯草芽孢杆菌,菌体几乎不吸附纳米金刚石;B2图为纯NDs处理3 min的枯草芽孢杆菌,菌体上依然很少粘附纳米金刚石;B3图为纯NDs处理5 min的枯草芽孢杆菌,菌体上仅吸附了少量纳米金刚石,但是可以看到,菌体上芽孢明显,依然保持其生命活性,表明纯NDs基本不会吸附在枯草芽孢杆菌上,且不影响其生命活性。
C1图为NDs-thanatin处理1 min的枯草芽孢杆菌,菌体表面开始吸附NDs-thanatin;C2图为NDs-thanatin处理3 min的枯草芽孢杆菌,菌体上大量粘附NDs-thanatin,几乎被其全部覆盖;C3图为NDs-thanatin处理5 min的枯草芽孢杆菌,菌体上依然存在大量NDs-thanatin,而且明显观察到细菌形貌同样出现坍塌,同图 4A3中一致,呈现“魅影”形态。
本实验验证非抗生素多肽死亡素对枯草芽孢杆菌具有良好的杀灭效果,与细菌作用一段时间后,会对细菌的形态产生巨大影响,出现“魅影”现象,而且这种杀灭效果是通过NDs-thanatin以静电吸附方式附着在菌体表面,进而引发菌体内部电荷紊乱而实现的[36],不同于传统非抗生素类药物或溶菌酶直接溶解破坏菌体表面结构的方式[18]。之后我们将结合其他实验,以更好地验证和说明该结论。
2.4 共聚焦拉曼显微镜下观察NDs探针与枯草芽孢杆菌间相互作用过程相比于扫描电镜对NDs-thanatin与枯草芽孢杆菌间相互作用过程的观察,共聚焦拉曼成像技术在生物观测时操作更简单和即时,且不需对样品进行固定等前处理,使其成为原位监测生物体相互作用的一个新选择。在进行拉曼观察之前,首先确定了NDs-thanatin复合物中的NDs是否可以依然保持其特征的拉曼信号,以验证作为生物探针的可行性。图 5分别给出NDs(A)、thanatin(B)和NDs-thanatin(C)3个样品的拉曼光谱,可以看到:thanatin在1400~1700 cm-1范围内有特征拉曼峰,但是未与NDs位于1332 cm-1处锐利清晰的拉曼峰相互干扰,而且thanatin在NDs上的成功负载并不会影响NDs的拉曼信号。这个结论为NDs用作探针,及用共聚焦拉曼显微镜可视化观察NDs-thanatin与枯草芽孢杆菌间的相互作用奠定了基础。

|
图 5 (A) NDs,(B)thanatin和(C) NDs-thanatin复合物的拉曼光谱 Fig.5 Raman spectra of (A) NDs, (B) thanatin and (C) NDs-thanatin |
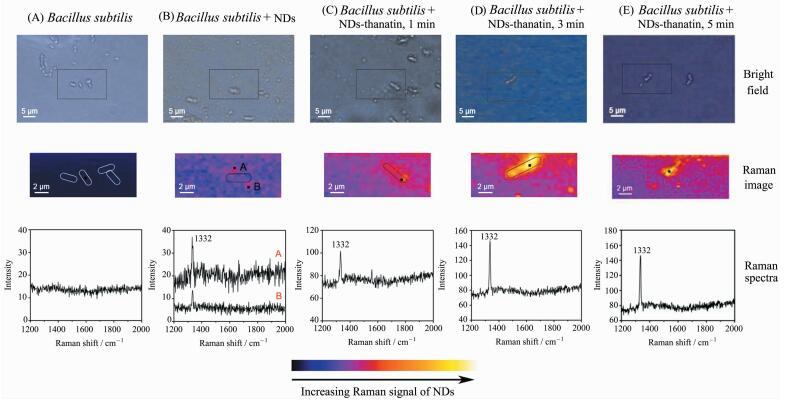
拉曼成像的操作流程如实验部分论述,其结果展示在图 6中。其中,第一行是细菌菌体在普通显微镜下的观察结果,第二行是菌体的共聚焦拉曼成像图,第三行是拉曼成像图中黑点对应的拉曼光谱图。图 6中,A图为未作处理的枯草芽孢杆菌菌体的对照组,在本实验条件下,未观测到拉曼信号;B图为单纯NDs处理3 min的枯草芽孢杆菌,菌体上未检测到金刚石拉曼信号,NDs仅散落在菌体周围,表明NDs与枯草芽孢杆菌之间的相互作用微弱;C图为NDs-thanatin处理1 min的枯草芽孢杆菌,菌体上吸附了NDs-thanatin,出现一定强度的NDs拉曼信号,但是信号限于局部;D图为NDs-thanatin处理3 min的枯草芽孢杆菌,出现高强度的NDs拉曼信号,而且这些信号的出现与细菌位置对应,菌体上大量附着了NDs-thanatin,而拉曼信号强度分布描绘出了单个细菌的形貌,表明NDs-thanatin与枯草芽孢杆菌之间存在强烈的相互作用;E图为NDs-thanatin处理5 min的枯草芽孢杆菌,菌体表面的NDs拉曼信号减弱,菌体上大量附着的NDs-thanatin减少,明显弱于D图,这表明随着作用时间增长,NDs-thanatin逐渐改变了枯草芽孢杆菌的表面状态,进而抑制菌体活性,实现了对细菌的杀灭。以NDs为探针进行拉曼成像实验,观察到NDs-thanatin可大量吸附在枯草芽孢杆菌菌体上,而且随着作用时间延长,吸附量先增多后减少,从而验证了死亡素与细菌之间首先通过相互吸附作用结合在一起,然后改变菌体状态,进而杀死细菌。以上拉曼成像的实验结论,与之前扫描电镜的结果对应一致。但是,以纳米金刚石为探针的拉曼成像手段,实验操作简单,不需要像扫描电镜观察那样繁复的样品前处理过程,极大地缩短了实验时间,提高了效率。而且,拉曼扫描可以在对菌体直接成像,实现活体原位观测。这些优势极大地扩充了拉曼成像的潜在应用领域。
|
图 6 NDs-thanatin复合物与枯草芽孢杆菌间相互作用过程的拉曼图像 Fig.6 Raman images of the interaction between NDs-thanatin and Bacillus subtilis |
SEM和Raman成像已成功实现对NDs-thanatin与枯草芽孢杆菌之间相互作用的观察,结果表明,NDs-thanatin首先吸附在细菌表面,推测应是通过破坏细菌内部稳定性达到杀灭细菌的作用,而不是直接溶解细菌表面结构。为了验证该想法,实验对NDs-thanatin与枯草芽孢杆菌作用过程中菌体表面的Zeta电位进行测试并观察分析其变化(图 7),以进一步明确thanatin对枯草芽孢杆菌的灭菌过程和步骤。实验中枯草芽孢杆菌菌液分别与NDs分散液(5 mg/mL)、NDs-thanatin分散液(5 mg/mL)和thanatin溶液(400 μmol/L)等体积混合,反应30~600 s。然后分别取反应0 min、1 min、3 min和5 min的枯草芽孢杆菌菌液,离心清洗3次后,测试Zeta电位。
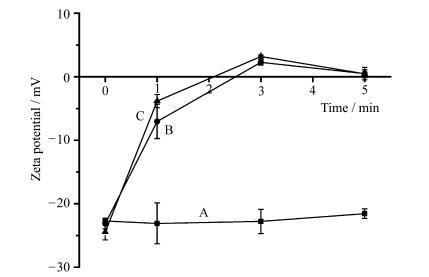
|
图 7 枯草芽孢杆菌表面Zeta电位变化,菌体分别由(A)NDs、(B)NDs-thanatin和(C)thanatin处理 Fig.7 The Zeta potential change of bacteria surface during the interaction of Bacillus subtilis with (A) NDs, (B) NDs-thanatin and (C) thanatin |
图 7中,NDs处理后的曲线A,在不同时间段,枯草芽孢杆菌菌体表面电位几乎没有变化,与初始值一致,一直都在-22.6 mV左右,这表明NDs不会对细菌表面造成影响,这一结果与上述扫描电镜和拉曼成像结果一致。而对于NDs-thanatin复合物分散液(曲线B)和thanatin溶液(曲线C)处理过的枯草芽孢杆菌,其表面电位随着时间变化均有明显改变,出现先变正又变负的现象。这与NDs-thanatin和thanatin与枯草芽孢杆菌间相互作用有关,结合扫描电镜和拉曼成像中对该过程的观察结果,以及前人对死亡素灭菌机理的分析[37, 38],推测NDs-thanatin/thanatin与枯草芽孢杆菌之间的相互作用包含以下几步:
(1) 首先,thanatin(表面电位约为3.4 mV)和NDs-thanatin(表面电位约为2.8 mV)通过静电吸附作用结合到枯草芽孢杆菌表面(表面电位约为-22.6 mV),富集在细菌表面类脂膜的亲水层,形成“地毯式”(carpet)覆盖。这个过程发生在反应前3 min内,细菌表面出现大量NDs-thanatin/thanatin(图 4和图 6),菌体Zeta电位开始变正(图 7)。
(2) 由于NDs-thanatin和thanatin的作用,枯草芽孢杆菌杆菌表面结构稳定性改变,这个扰动引起细菌细胞质膜的机能及呼吸受损,菌体内外电势差被消耗,细胞膜经历去极化过程(3~5 min)。
(3) 失稳的枯草芽孢杆菌细菌膜结构通透性增强,菌体内胞质外泄,细菌死亡(5 min)。这样,死亡后的菌体因膜结构的变化和去极化作用,电位由负回归平衡态附近(图 7),其表面吸附的NDs-thanatin和thanatin逐渐变少脱落(图 6E)。
综上,通过扫描电镜和拉曼成像观察、Zeta电位变化分析,成功实现了对NDs-thanatin与枯草芽孢杆菌间相互作用过程及抗菌步骤的研究。
3 结论以表面修饰了抗菌多肽死亡素的纳米金刚石作为拉曼生物探针,成功实现了对纳米金刚石-死亡素的复合物与枯草芽孢杆菌间的相互作用的可视化。本工作不仅对非抗生素类抗菌物质的抗菌过程研究有一定借鉴意义,更为纳米金刚石拉曼生物探针在生物成像领域的应用提供了更广阔的视野。
致谢 感谢国家自然科学基金项目(21375137)和东南大学生物电子国家重点实验室开放基金的支持。| [1] | Vairakkannu V, Tzeng Y K, Chang H C, Li C L. The biocompatibility of fluorescent nanodiamonds and their mechanism of cellular uptake[J]. Nanotechnology, 2009, 20: 425103. DOI:10.1088/0957-4484/20/42/425103 |
| [2] | Schrand A M, Huang H J, Carlson C, Schlager J J, Osawa E, Hussain S M, Dai L M. Are diamond-nanoparticles cytotoxic?[J]. The Journal of Physical Chemistry B, 2007, 111(1): 2–7. DOI:10.1021/jp066387v |
| [3] | Schrand A M, Hens S A C, Shenderova O A. Nanodiamondparticles:properties and perspectives for bioapplications[J]. Critical Reviews in Solid State and Materials Sciences, 2009, 34(1-2): 18–74. |
| [4] | Guan B, Zou F, Zhi J F. Nanodiamond as the pH-responsive vehicle for an anticancer drug[J]. Small, 2010, 6(14): 1514–1519. DOI:10.1002/smll.v6:14 |
| [5] | Huang H J, Pierstorff E, Osawa E, Ho D. Active nanodiamond hydrogels for chemotherapeuticdelivery[J]. Nano Letters, 2007, 7(11): 3305–3314. DOI:10.1021/nl071521o |
| [6] | Li L, Tian L, Wang Y L, Zhao W J, Cheng F Q, Li Y Q, Yang B S. Smart pH-responsive and high doxorubicin loading nanodiamond for in vivo selective targeting, imaging, and enhancement of anticancer therapy[J]. Journal of Materials Chemistry B, 2016, 4: 5046–5058. DOI:10.1039/C6TB00266H |
| [7] | Li L, Tian L, Zhao W J, Li Y Q, Yang B S. Acetate ions enhance load and stability of doxorubcin onto PEGylated nanodiamond for selective tumor intracellular controlled release and therapy[J]. Integrative Biology, 2016, 8: 956–967. DOI:10.1039/C6IB00068A |
| [8] | Cui Z F, Zhang Y, Zhang J C, Kong H T, Tang X X, Pan L, Xia K, AldalbahA, Li A G, Tai R Z, Fan C H, Zhu Y. Sodium alginate-functionalized nanodiamonds as sustained chemotherapeutic drug-release vectors[J]. Carbon, 2016, 97: 78–86. DOI:10.1016/j.carbon.2015.07.066 |
| [9] | Chow E K H, Ho D. Cancer nanomedicine:from drug delivery to imaging[J]. Science Translational Medicine, 2013, 5(216): 214–216. |
| [10] | Wang Z Q, Tian Z M, Dong Y, Li L, Tian L, Li Y Q, Yang B S. Nanodiamond-conjugated transferrin as chemotherapeutic drug delivery[J]. Diamond and Related Materials, 2015, 58: 84–93. DOI:10.1016/j.diamond.2015.06.008 |
| [11] | Weng M F, Chiang S Y, Wang N S, Niu H. Fluorescent nanodiamonds for specifically targeted bioimaging:application to the interaction of transferrin with transferrin receptor[J]. Diamond and Related Materials, 2009, 18(2): 587–591. |
| [12] | Yu S J, Kang M W, Chang H C, Chen K M, Yu Y C. Bright fluorescence nanodiamond:no photo bleaching and low cytotoxicity[J]. Journal of the American Chemical Society, 2005, 127(50): 17604–17605. DOI:10.1021/ja0567081 |
| [13] | Hui Y Y, Cheng C L, Chang H C. Nanodiamonds for optical bioimaging[J]. Journal of Physics D:Applied Physics, 2010, 43: 374021. DOI:10.1088/0022-3727/43/37/374021 |
| [14] | Fu C C, Lee H Y, Chen K, Lim T S, Wu H Y, Lin P K, Wei P K, Tsao P H, Chang H C, Fann W. Characterization and application of single fluorescent nanodiamonds as cellular biomarkers[J]. Proceedings of the National Academy of Sciences of USA, 2007, 104(3): 727–732. DOI:10.1073/pnas.0605409104 |
| [15] | Faklaris O, Garrot D, Treussart F, Joshi V, Curmi P, Boudou J P, Sauvage T. Comparison of the photoluminescence properties of semiconductor quantum dots and nonblinking diamond nanoparticles. Observation of the diffusion of diamond nanoparticles in living cells[J]. Journal of the European Optical Society Rapid Publications, 2009, 4: 09035. DOI:10.2971/jeos.2009.09035 |
| [16] | Lien Z Y, Hsu T C, Liu K K, Liao WS, Hwang K C, Chao J I. Cancer cell labeling and tracking using fluorescent and magnetic nano diamond[J]. Biomaterials, 2012, 33: 6172–6185. DOI:10.1016/j.biomaterials.2012.05.009 |
| [17] | ChaoJ I, Perevedentseva E, Chung P H, Liu K K, Cheng C Y, Chang C C, Cheng C L. Nanometer-sized diamond particle as a probe for biolabeling[J]. Biophysical Journal, 2007, 93(6): 2199–2208. DOI:10.1529/biophysj.107.108134 |
| [18] | Perevedentseva E, Cheng C Y, Chung P H, Tu J S, Hsieh Y H, Cheng C L. The interaction of the protein lysozyme with bacteria E. coli observed using nanodiamond labelling[J]. Nanotechnology, 2007, 18(31): 31502. |
| [19] | Knight D S, White W B. Characterization of diamond films by Raman spectroscopy[J]. Journal of Materials Research, 1989, 4(2): 385–393. DOI:10.1557/JMR.1989.0385 |
| [20] | Perevedentseva E, Hong S F, Huang K J, Chiang I T, Lee C Y, Tseng Y T, Cheng C L. Nanodiamond internalization in cells and the cell uptake mechanism[J]. Journal of Nanoparticle Research, 2013, 15(8): 1–12. |
| [21] | Zhu Y W, Shen X Q, Wang B C, Xu X Y, Feng Z J. Chemical mechanical modification of nanodiamond in an aqueous system[J]. Physics of the Solid State, 2004, 46(4): 681–684. DOI:10.1134/1.1711451 |
| [22] | Puzyr A P, Pozdniakova I O, Bondar V S. Design of a luminescent biochip with nanodiamonds and bacterial luci-ferase[J]. Physics of the Solid State, 2004, 46(4): 761–763. DOI:10.1134/1.1711469 |
| [23] | Tsubota T, Hirabayashi O, Ida S, Nagaoka S, Nagata M, Matsumoto Y. Chemical modification of hydrogenated diamond surface using benzoyl peroxides[J]. Physical Che-mistry Chemical Physics, 2002, 4(5): 806–811. DOI:10.1039/b107349b |
| [24] | Huang T S, Tzeng Y, Liu Y K, Chen Y C, Walker K R, Guntupalli R, Liu C. Immobilization of antibodies and bacterial binding on nanodiamond and carbon nanotubes for biosensor applications[J]. Diamond and Related Mate-rials, 2004, 13(4-8): 1098–1102. DOI:10.1016/j.diamond.2003.11.047 |
| [25] | Ushizawa K, SatoY, Mitsumory T, Machinami T, UedaT, Ando T. Covalent immobilization of DNA on diamond and its verification by diffuse reflectance infrared spectroscopy[J]. Chemical Physics Letters, 2002, 351(1-2): 105–108. DOI:10.1016/S0009-2614(01)01362-8 |
| [26] | Huang L C L, Chang H C. Adsorption and immobilization of cytochrome c on nanodiamonds[J]. Langmuir, 2004, 20(14): 5879–5884. DOI:10.1021/la0495736 |
| [27] | Kossovsky N, GelmanA, Hnatyszyn H J, RajguruS, Garrell R L, Torbati S, Freitas S S F, Chow G M. Surface-modified diamond nanoparticles as antigen delivery vehicles[J]. Bioconjugate Chemistry, 1995, 6(5): 507. DOI:10.1021/bc00035a001 |
| [28] | Perevedentseva E, Lin Y C, Jani M, Cheng C L. Biome-dical applications of nanodiamonds in imaging and therapy[J]. Nanomedicine, 2015, 8(12): 2041–2060. |
| [29] | Cheng C Y, Perevedentseva E, Tu J S, Chung P H, Cheng C L, Liu K K, Chao J I, Chen P H, Chang C C. Direct and in vitro observation of growth hormone receptor molecules in A549 human lung epithelial cells by nanodiamond labeling[J]. Applied Physics Letters, 2007, 90(16): 163903. DOI:10.1063/1.2727557 |
| [30] | Lin Y C, Perevedentseva E, Tsai L W, Wu K T, Cheng C L. Nanodiamond for intracellular imaging in the microorganisms in vivo[J]. Journal of Biophotonics, 2012, 5(11-12): 838–847. DOI:10.1002/jbio.201200088 |
| [31] | Martins R M, Sforca M L, Amino R, Juliano M A, Oyama J S, Juliano L, Pertinhez T A, Spisni A, Schenkman S. Lytic activity and structural differences of amphipathic peptides derived from trialysin[J]. Biochemistry, 2006, 45(6): 1765–1774. DOI:10.1021/bi0514515 |
| [32] | Marr A K, Gooderham W J, Hancock R E. Antibacterial peptides for therapeutic use:obstacles and realistic outlook[J]. Current Opinion in Pharmacology, 2006, 6(5): 468–472. DOI:10.1016/j.coph.2006.04.006 |
| [33] | Nicolas P, Vanhoye D, Amiche M. Molecular strategies in biological evolution of antimicrobial peptides[J]. Peptides, 2003, 24(11): 1669–1680. DOI:10.1016/j.peptides.2003.08.017 |
| [34] | Chen X, Wang H, Li D D, Yu Y, Zhi J F. The effect of carboxylated nanodiamond (cNDs) on the migration of HepG2 cells[J]. Physica Status Solidi, 2016, 213(8): 2131–2137. DOI:10.1002/pssa.v213.8 |
| [35] | Chen X, Li D D, Wang H, Jiao Y Y, Wang H, Yu Y, Zhi J F. Fabrication of an EGF modified nanodiamonds-based anti-cancer drug targeted delivery system and drug carrier uptake visualization by 3D Raman microscopy[J]. RSC Advances, 2016, 6(50): 44543–44551. DOI:10.1039/C6RA04753J |
| [36] | Hou Z, Lu J, Fang C, Zhou Y, Bai H, Zhang X G, Xue X Y, Chen Y Y, Luo X X. Underlying mechanism of in vivo and in vitro activity of C-terminal-amidated thanatin against clinical isolates of extended-spectrum β-lactamase-producing Esherichia coli[J]. The Journal of Infectious Diseases, 2011, 203(2): 273–282. DOI:10.1093/infdis/jiq029 |
| [37] | Wu G Q, Wu H B, Li L X, Fan X B, Ding J X, Li X F, Xi Tao, Shen Z L. Membrane aggregation and perturbation induced by anticrobial peptide of S-thanatin[J]. Biochemical and Biophysical Research Communications, 2010, 395: 31–35. DOI:10.1016/j.bbrc.2010.03.107 |
| [38] | Chapple D S, Mason D J, Joannou C L, Odell E W, Gant V, Evans R W. Structure-function relationship of antibacterial synthetic peptides homologous to a helical surface region on human lactoferrin against Escherichia coli serotype O111[J]. Infection and Immunity, 1998, 66: 2434–2440. |




