2. 陕西师范大学 化学化工学院, 陕西 西安 710127
2. College of Chemistry and Chemical Engineering, Shaanxi Normal University, Xi'an 710127, Shaanxi, P. R. China
利用太阳光分解水制备氢气是目前科技领域研究的前沿,然而,因缺少储量丰富、可用于捕光光化学器件的有效催化剂,使光解水产氢的研究受到了阻碍[1]。近年来,光化学和电化学已充分应用于水分解领域,结合光化学和电化学,实现光电化学水分解备受关注[2-4]。目前,这一领域的研究主要集中于有机无机杂化材料[5],分子催化剂的报道非常少。分子催化剂在光化学和电化学领域研究相对比较透彻,且在机理方面已相对成熟,这为后期在光电化学领域的研究提供了基础。而有机无机杂化材料组成相对比较复杂,组分不单一,对后期结构改进及机理等研究造成一定的困难。分子催化剂在光电化学领域的研究面临以下两个难题[1-4, 6]:①在光电化学器件中催化剂的研究对象主要采用贵金属钌配合物,研究成本高;②分子催化剂催化效率低,光电流密度小。因此,实现廉价金属分子催化剂在光电化学领域的应用,提高其催化活性是研究者共同努力的目标。
2016年,我们报道了廉价易合成的分子催化剂Cu(F3TPA)(ClO4)2[F3TPA =三(6-氟吡啶-2-甲基)胺]。在pH为8.5,0.1 mol/L的硼酸缓冲溶液中,其在电化学和光化学水氧化方面均具有优良的性能,过电势为610 mV,光催化水氧化的TOF值可达(1.58 ± 0.03) × 10-1 s-1,最大的TON值可达11.61 ± 0.23[7]。那么,我们想能不能将光化学和电化学相结合拓展其在光电化学水分解方面的应用呢?如果能将催化剂Cu(F3TPA)(ClO4)2组装到电极上,利用可见光照射产生电流,将会突破只有贵金属分子催化剂用于光电催化水分解研究的局限。基于这样的想法,我们选用TiO2/FTO电极为工作电极,铂丝为辅助电极,Ag/AgCl为参比电极,通过浸泡将光敏剂[Ru(bpy)2(H2dcbpy)](PF6)2键合在TiO2/FTO电极表面,用Nafion将催化剂Cu(F3TPA)-(ClO4)2负载至吸附有光敏剂的TiO2/FTO电极上,成功构筑了光电化学器件。经过初步的尝试,在pH为8.5,0.1 mol/L的硼酸缓冲溶液中,用LEDs [λ= (470 ± 10) nm, 820 μE·cm-2·s-1]灯照射,光电流密度可达20 μA/cm2。
1 实验部分 1.1 试剂与仪器甲醇、N, N′-二甲基甲酰胺、丙酮、乙醇、氨水、二氯甲烷、醋酸购自天津市富宇精细化工有限公司; 乙腈、乙醚、碳酸氢钠、硼酸、硼砂、氢化钙、锌粉、盐酸、碳酸钠、碘、硫酸、氢氧化钾、氯化锂购自国药集团化学试剂有限公司; 2, 2-联吡啶、六水合氯化镍、2-溴-4-甲基吡啶、三氧化铬、六氟磷酸钾等购自安耐吉; 水合三氯化钌、四-(三苯基膦)钯、二苯甲酮购自萨恩化学技术(上海)有限公司。
采用Bruker公司400 Hz核磁共振仪、Apex IV FTMS高分辨质谱仪对合成化合物进行表征;采用日立U-3900H紫外可见吸收光谱仪对催化剂和光敏剂的吸附量进行测试;采用上海辰华CHI660E电化学工作站对催化产氧活性进行测试。
1.2 实验过程 1.2.1 实验准备工作DMF除水处理:所用反应容器均烘干备用,适量的分子筛在120 ℃下活化3 h备用。取分析纯DMF溶剂于250 mL的圆底烧瓶中,向其中加入氢化钙,80 ℃下加热回流8 h,在60 ℃下减压蒸馏,分子筛干燥备用。
锌粉的活化:取适量的锌粉于烧杯中,向其中加入1 mol/L的稀盐酸,搅拌,有大量的气泡冒出,反应0.5 h,反应期间适量补加稀盐酸以彻底除去锌粉表面的氧化物,然后迅速抽滤,并用水、乙醇、丙酮快速反复的冲洗;无水乙醚冲洗2~3次。将抽滤得到的粉末迅速转移至圆底烧瓶中,用油泵干燥1~2 h,直到锌粉彻底变干,密封干燥保存,备用。
1.2.2 合成步骤4, 4′-二甲基-2, 2′-联吡啶的合成[8]:取六水合氯化镍59.4 mg(0.25 mmol)溶于10 mL无水DMF中,搅拌下加热到40 ℃,溶液变为绿色。然后向其中加入2-溴-4-甲基吡啶0.86 g(5 mmol)、无水氯化锂212.5 mg(5 mmol)、活化的锌粉390 mg(6 mmol),溶液变为蓝色。将温度逐渐升高到50 ℃,向其中加入米粒大小的碘粒及两滴醋酸,然后升高温度,溶液逐渐变黑,且瓶子内壁有雾气。温度达到65 ℃,搅拌2~3 h,直至反应完全,一段时间后发现溶液逐渐为黄色。冷却,加入7.5 mL 1 mol/L的稀盐酸除去多余的锌粉,溶液变为橙红色。加氨水调节溶液pH到碱性,然后用二氯甲烷萃取,收集有机相,加无水碳酸钠干燥处理。抽滤,旋干得米黄色粗产品。将粗产品利用硅胶柱进行分离提纯,展开剂为CH2Cl2:CH3OH=20:1(体积比)。得米黄偏白的粉末230 mg,产率为50%。1HNMR (400 MHz, CDCl3, 25 ℃):8.55 (d, J = 5.2 Hz, 2H), 8.25 (s, 2H), 7.15 (d, J = 4.8 Hz, 2H), 2.46 (s, 6H, CH3)。
4, 4′-二羧基-2, 2′-联吡啶的合成[9-11]:称取4, 4′-二甲基-2, 2′-联吡啶125 mg(0.678 mmol),溶于4 mL浓硫酸中,冷却到0 ℃。向反应体系中分批加入407 mg的三氧化铬,1 h内加完。混合物加热到75 ℃,反应4 h,然后常温反应10 h。向反应体系中加入冰水混合物,抽滤,蒸馏水洗涤,绿色固体逐渐变白,再用甲醇和乙醚洗涤,干燥,得白色固体粉末。1HNMR(400 MHz, CDCl3, 25 ℃):13.6(s, 2H), 8.93(d, J = 5.2 Hz, 2H), 8.85(s, 2H), 7.91(dd, J = 4.8, 1.6 Hz, 2H)。
化合物二氯化二-2-2′-联吡啶钌[Ru(bpy)2Cl2]的合成[12]:称取1.142 g 2, 2′-联吡啶、1 g水合三氯化钌,溶于10 mL DMF中,除气30 min。加入10.8 mg的无水氯化锂溶于上述溶液中。在175 ℃下避光反应24 h,最后溶液变为黑紫色。冷却到室温,加入过量的丙酮,放置在冰箱中过夜,抽滤得黑色固体。
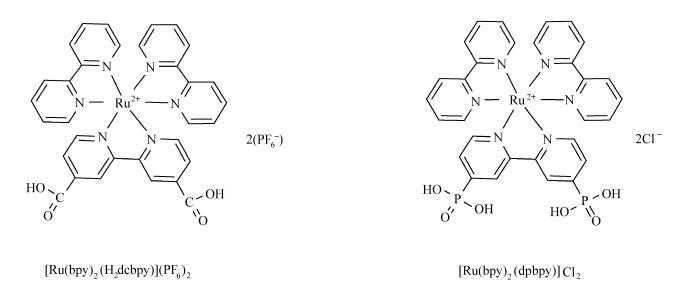
化合物[Ru(bpy)2(H2dcbpy)](PF6)2的结构见图 1, 合成过程[13]:配置溶剂20 mL甲醇/水(4/1),除气30 min,称取200 mg Ru(bpy)2Cl2、151.3 mg化合物2、142.2 mg碳酸氢钠于反应瓶中,搅拌。75 ℃下避光反应过夜,溶液由深紫色变为透明的橙红色。冷冻过夜,滤除沉淀。加浓硫酸调节pH至4,滤去沉淀,滤液用六氟磷酸钾处理,进行阴离子交换,得橘红色沉淀328 mg,产率为90%。质谱分析M: C32H24F12N6O4P2Ru,ESI-MS (m/z): calcd for: [M-2(PF6)]2+/2: 329.0454; found: 329.0450。
|
图 1 光敏剂[Ru(bpy)2(H2dcbpy)](PF6)2和[Ru(bpy)2(dpbpy)]Cl2的结构 Fig.1 Structures of the photosensitizers [Ru(bpy)2(H2dcbpy)](PF6)2 and [Ru(bpy)2(dpbpy)]Cl2 |
配置5 ×10-4 mol/L[Ru(bpy)2(H2dcbpy)](PF6)2的乙醇溶液,然后将TiO2/FTO电极浸泡在乙醇溶液中,FTO电极上负载的TiO2的厚度为10 μm左右,黑暗密封条件下浸泡过夜,吸附完成后将电极取出,用乙醇反复冲洗,黑暗条件下晾干,完成光敏剂的负载。
在1 mL的乙醇溶液中加入1滴全氟磺酸(Nafion)溶液,然后将配置好的含有全氟磺酸的乙醇溶液滴到以上晾干的电极表面,待黑暗条件下晾干后,120 ℃下干燥20 min,对电极进行活化处理。处理结束后自然冷却到室温,黑暗保存备用。
配置5×10-4 mol/L的Cu(F3TPA)(ClO4)2,用微量注射器吸取20 μL滴加到活化好的TiO2/FTO的电极上,黑暗条件下自然晾干,备用。
1.2.4 光电化学实验条件本文所有电化学实验均用型号为CHI660E的电化学工作站进行测试,光电化学的测试条件:(0.6×0.6)cm2的TiO2/FTO为工作电极,铂丝为辅助电极,Ag/AgCl为参比电极,LEDs [λ= (470 ± 10) nm,820 μE·cm-2 · s-1]灯为光源,以pH为8.5,0.1 mol/L的硼酸缓冲溶液为电解液,扫速为100 mV/s。电化学中所用到的电压均采用公式ENHE = EAg/AgCl + 0.20 V进行计算。
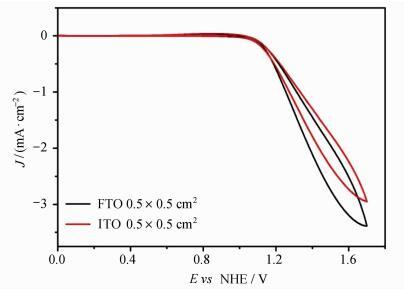
2 结果与讨论 2.1 实验条件的筛选近年来,分子催化剂在光电化学领域的研究工作中,人们均选用负载有TiO2的FTO为工作电极,而2016年我们报道的Cu(F3TPA)(ClO4)2催化剂电化学活性的测试是以ITO为工作电极,因此,在其它条件相同的情况下,我们用面积相同的ITO和FTO分别作工作电极,对比二者的差别。图 2所示为两种电极的循环伏安曲线图,从图中可以看出两种电极并无明显差别。因此,接下来的光电化学实验选用负载TiO2的FTO作为工作电极。
|
图 2 1 mmol/L的Cu(F3TPA)(ClO4)2在pH为8.5,0.1 mol/L硼酸缓冲溶液中的循环伏安曲线,分别以ITO (0.5×0.5) cm2和FTO(0.5×0.5) cm2为工作电极,扫速为100 mV·s-1 Fig.2 CVs of 1 mmol/L Cu(F3TPA)(ClO4)2 in a 0.1 mol/L borate buffer at pH 8.5 with ITO (0.5×0.5) cm2 and FTO (0.5×0.5) cm2 as the working electrode respectively at 100 mV·s-1 |
除羧酸基团外,磷酸基团也是良好的负载基团,于是我们合成了磷酸基取代的多吡啶钌光敏剂[Ru(bpy)2(dpbpy)]Cl2,结构如图 1所示。图 3显示了3种多吡啶钌光敏剂在pH为8.5,0.1 mol/L硼酸缓冲溶液中循环伏安曲线。实线代表[Ru(bpy)3](ClO4)2的循环伏安曲线,E1/2 = 1.106 V vs NHE处有一对可逆的氧化还原峰,代表Ru(Ⅲ)/Ru(Ⅱ)的氧化还原电对;虚线为[Ru(bpy)2(dpbpy)]Cl2的循环伏安曲线,表明Ru(Ⅲ)/Ru(Ⅱ)的氧化还原过程出现在E1/2 = 1.236 V vs NHE处;点线代表光敏剂[Ru(bpy)2(H2dcbpy)](PF6)2的循环伏安曲线,其在E1/2 = 1.339 V vs NHE显示Ru(Ⅲ)/Ru(Ⅱ)的氧化还原过程。3种光敏剂峰型非常相似,其中[Ru(bpy)2(H2dcbpy)](PF6)2对应的氧化还原峰电位较之其它两种光敏剂的峰位置相对偏正,说明其具有更强的氧化能力,与催化剂配位后,电子转移的驱动力最大。因此,后续研究选用[Ru(bpy)2(H2dcbpy)](PF6)2。

|
图 3 1mmol/L的[Ru(bpy)2(H2dcbpy)](PF6)2 (点线)、[Ru(bpy)2(dpbpy)]Cl2 (虚线)和[Ru(bpy)3](ClO4)2 (实线),在pH为8.5,0.1 mol/L硼酸缓冲溶液中的循环伏安曲线,0.07 cm2的玻碳电极为工作电极,Ag/AgCl为参比电极,铂丝为辅助电极 Fig.3 Cyclic voltammetry of 1 mmol/L [Ru(bpy)2(H2dcbpy)](PF6)2 (dot line), [Ru(bpy)2(dpbpy)]Cl2 (dash line) and [Ru(bpy)3](ClO4)2 (solid line) in pH 8.5, 0.1 mol/L borate buffer with glassy carbon (0.07 cm2) as working electrode, Ag/AgCl as reference electrode and platinum wire as counter electrode |
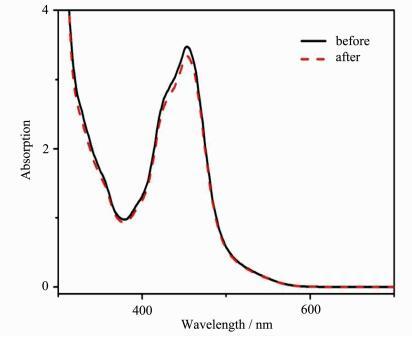
负载有TiO2的FTO为工作电极,浸泡在含有光敏剂[Ru(bpy)2(H2dcbpy)](PF6)2的乙醇溶液中过夜,通过紫外可见吸收光谱法检测光敏剂在电极上的吸附量。根据朗伯比尔定律:A = εbc,其中ε为吸光系数;b为比色皿的宽度;c为所测溶液的浓度, 在其它实验条件相同的情况下,吸光度值A与浓度c成正比。如图 4所示,实线代表新鲜配置的浓度为2.5×10-4 mol/L的[Ru(bpy)2(H2dcbpy)](PF6)2在乙醇溶液中对应的紫外可见吸收光谱图;虚线代表完全相同的3块负载有TiO2的FTO电极在新鲜配置的光敏剂溶液中同时浸泡后对应的紫外可见吸收光谱图。图 4显示,浸泡前后的紫外可见吸收光谱有明显的变化。取451 nm处对应的吸光度值进行计算,浸泡前对应A前值为3.4480,浸泡后对应的A后值为3.3089,计算得光敏剂的吸附量为2×10-8 mol。电极的有效面积为(0.6×0.6) cm2,因此,单位面积的吸附量为5.56×10-8 mol·cm-2。
|
图 4 光敏剂[Ru(bpy)2(H2dcbpy)](PF6)2在TiO2/FTO电极浸泡前(实线)和浸泡后(虚线)的紫外可见吸收光谱图 Fig.4 UV-Vis absorption spectra of [Ru(bpy)2(H2dcbpy)](PF6)2 before (2.5×10-4 mol/L) (solid line) and after soaking the TiO2/FTO electrodes (dash line) |
在1 mL的乙醇溶液中加入1滴全氟磺酸(Nafion)溶液,然后将配置好的含有全氟磺酸的乙醇溶液滴到以上晾干的电极表面,黑暗条件下晾干,120 ℃下干燥20 min,对电极进行活化处理。室温下黑暗保存备用。用微量注射器移取15 μL,2×10-3 mol/L的催化剂滴在制备好的电极表面,计算得催化剂的吸附量为3×10-8 mol,因此,单位面积的吸附量为8.3×10-8 mol·cm-2,约为光敏剂吸附量的1.5倍。
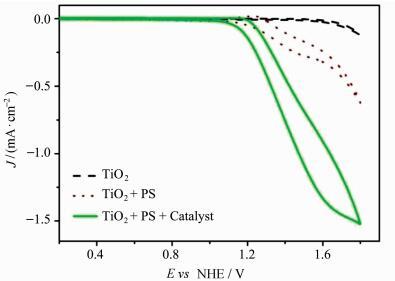
2.3 光电化学活性的测试为确定光敏剂和催化剂是否真正负载成功,测试其在pH为8.5,0.1 mol/L硼酸缓冲溶液中的循环伏安曲线。以Ag/AgCl为参比电极,铂丝为辅助电极,结果如图 5所示。虚线代表空白的TiO2/FTO电极在硼酸缓冲溶液中的循环伏安曲线,点线代表TiO2/FTO电极上负载了光敏剂所对应的循环伏安曲线,实线代表TiO2/FTO电极上负载了光敏剂和催化剂对应的循环伏安曲线。从图中可以看出, 空白的TiO2/FTO电极电流密度最小,负载有光敏剂后催化电流密度有显著提高,并且显示出Ru(Ⅲ)/Ru(Ⅱ)可逆的氧化还原峰。当将光敏剂和催化剂同时负载到TiO2/FTO电极上时,催化电流密度明显增大,且峰型与只有光敏剂时完全不同,Ru(Ⅲ)/Ru(Ⅱ)对应的氧化还原峰消失,转变为明显的催化峰,且对应的催化起峰过电势很低,为113 mV vs NHE。实验表明,催化剂成功负载到了TiO2/FTO电极上,且能实现较好的催化水氧化。
|
图 5 在pH为8.5,0.1 mol/L硼酸缓冲溶液中,Ag/AgCl为参比电极,铂丝为辅助电极,不同工作电极对应的循环伏安曲线 二氧化钛(虚线),二氧化钛+光敏剂(点线),二氧化钛+光敏剂+催化剂(实线) Fig.5 Cyclic voltammetry of the working electrode TiO2 (dash line), TiO2+PS (dot line), TiO2+Catalyst (solid line) in pH 8.5, 0.1 mol/L borate buffer, Ag/AgCl as reference electrode and platinum wire as counter electrode |
确定光敏剂和催化剂在电极上负载成功后,我们进一步研究了体系的光电流密度。如图 6所示,虚线和实线分别代表电极上只负载光敏剂和同时负载光敏剂和催化剂时对应的光电流密度。以LED[λ=(470 ± 10) nm, 820 μE ·cm-2·s-1]光源照射体系, 当外电压为0.2 V vs NHE,未光照时对应的电流密度值一直为0,开启光照后,电流密度迅速增大,关闭光照,电流密度又迅速回到0,这一现象表明体系电流密度的产生是光驱动的。同时发现,体系仅有光敏剂时最大的催化电流密度为10 μA/cm2,而催化剂与光敏剂同时存在时,电流密度可达约20 μA/cm2,且光电流密度下降平缓,说明光敏剂、催化剂形成了良好的光驱动催化水氧化体系。连续测试300 s,仍可维持10 μA/cm2的光电流密度,说明体系稳定性较高。值得一提的是,此体系优于2010年Spiccia小组报道的以锰簇为催化剂的光电水氧化体系[1]。

|
图 6 光控制的光电流密度测量 外电压为0.2 V vs NHE,以二氧化钛+光敏剂(虚线)和二氧化钛+光敏剂+催化剂(实线)为工作电极,在pH为8.5,0.1 mol/L硼酸缓冲溶液中进行测试,光源为LEDs [λ=(470 ± 10) nm, 820 μE ·cm-2·s-1] Fig.6 Light-control photocurrent measurements with a 0.2 V vs NHE external bias for working electrodes TiO2+PS (dash line) and TiO2+PS+Catalyst (solid line) in pH 8.5 borate buffer solution upon illumination with LEDs [λ=(470 ± 10) nm, 820 μE ·cm-2·s-1] |
本文将催化剂Cu(F3TPA)(ClO4)2和带有羧酸基团的光敏剂[Ru(bpy)2(H2dcbpy)](PF6)2负载到含有TiO2的FTO电极上,成功构筑了光电化学器件。光敏剂和催化剂的负载量分别达到5.56×10-8 mol·cm-2和8.3×10-8 mol·cm-2时,在pH为8.5,0.1 mol/L硼酸缓冲溶液中催化的起峰过电势为113 mV vs NHE。在光控制的光电流密度测量实验中,当外电压为0.2 V vs NHE时,光照条件下,电流密度值可达约20 μA/cm2,而且可持续光照长达300 s,具有较好的稳定性。
| [1] | Brimblecombe R, Koo A, Dismukes G C, Swiegers G F, Spiccia L. Solar driven water oxidation by a bioinspired manganese molecular catalyst[J]. Journal of the American Chemical Society, 2010, 132(9): 2892–2894. DOI:10.1021/ja910055a |
| [2] | Li L, Duan L, Xu Y, Gorlov M, Hagfeldt A, Sun L. A photoelectrochemical device for visible light driven water splitting by a molecular ruthenium catalyst assembled on dye-sensitized nanostructured TiO2[J]. Chemical Communications, 2010, 46(39): 7307–7309. DOI:10.1039/c0cc01828g |
| [3] | Ding X, Gao Y, Ye L, Zhang L, Sun L. Assembling supramolecular dye-sensitized photoelectrochemical cells for water splitting[J]. ChemSusChem, 2015, 8(23): 3992–3995. DOI:10.1002/cssc.201500313 |
| [4] | Yamamoto M, Wang L, Li F, Fukushima T, Tanaka K, Sun L, Imahori H. Visible light-driven water oxidation using a covalently-linked molecular catalyst-sensitizer dyad assembled on a TiO2 electrode[J]. Chemical Science, 2016, 7(2): 1430–1439. DOI:10.1039/C5SC03669K |
| [5] | Barroso M, Cowan A J, Pendlebury S R, Gr tzel M, Klug D R, Durrant J R. The role of cobalt phosphate in enhancing the photocatalytic activity of α-Fe2O3 toward water oxidation[J]. Journal of the American Chemical Society, 2011, 133(38): 14868–14871. DOI:10.1021/ja205325v |
| [6] | Gao Y, Ding X, Liu J, Wang L, Lu Z, Li L, Sun L. Visible light driven water splitting in a molecular device with unprecedentedly high photocurrent density[J]. Journal of the American Chemical Society, 2013, 135(11): 4219–4222. DOI:10.1021/ja400402d |
| [7] | Xiang R J, Wang H Y, Xin Z J, Li C B, Lu Y X, Gao X W, Sun H M, Cao R. A water-soluble copper-polypyridine complex as a homogeneous catalyst for both photo-induced and electrocatalytic O2 evolution[J]. Chemistry-A European Journal, 2016, 22(5): 1602–1607. DOI:10.1002/chem.201504066 |
| [8] | Liao L Y, Kong X R, Duan X F. Reductive couplings of 2-halopyridines without external ligand:phosphine-free nickel-catalyzed synthesis of symmetrical and unsymmetrical 2, 2'-bipyridines[J]. The Journal of Organic Chemistry, 2014, 79(2): 777–782. DOI:10.1021/jo402084m |
| [9] | Oh H, Kim J, Yun S H, Lee J, Park B, Tak J, Kim B H. Synthesis of heteroleptic Ru(Ⅱ) complexes ligated with 1, 3-dihydro-1, 1, 3, 3-tetramethyl-7, 8-diazacyclopenta[J]. Synthetic Metals, 2014, 198: 260–266. DOI:10.1016/j.synthmet.2014.10.029 |
| [10] | Oki A R, Morgan R J. An efficient preparation of 4, 4'-dicarboxy-2, 2'-bipyridine[J]. Synthetic Communications, 1995, 25(24): 4093–4097. DOI:10.1080/00397919508011487 |
| [11] | Garelli N, Vierling P. Synthesis of new amphiphilic perfluoroalkylated bipyridines[J]. The Journal of Organic Chemistry, 1992, 57(11): 3046–3051. DOI:10.1021/jo00037a019 |
| [12] | Al-Rawashdeh N A F, Chatterjee S, Krause J A, Connick W B. Ruthenium bis-diimine complexes with a chelating thioether ligand:delineating 1, 10-phenanthrolinyl and 2, 2'-bipyridyl ligand substituent effects[J]. Inorganic Chemistry, 2014, 53(1): 294–307. DOI:10.1021/ic4022454 |
| [13] | Pearson P, Bond A M, Deacon G B, Forsyth C, Spiccia L. Synthesis and characterisation of bis(2, 2'-bipyridine)(4-carboxy-4'-(pyrid-2-ylmethylamido)-2, 2'-bip-yridine)ruthenium(Ⅱ) di(hexafluorophosphate):comparison of spectroelectrochemical properties with related complexes[J]. Inorganica Chimica Acta, 2008, 361(3): 601–612. DOI:10.1016/j.ica.2007.03.031 |




